Мрт в онкологии реферат
Обновлено: 02.07.2024
В настоящее время невозможно представить медицину без лучевой диагностики. В первые десятилетия ее развития использовались только проекционные методы – рентгенография, ангиография, планарная сцинтиграфия. Технический прогресс и появление компьютеров привело к развитию томографических методов, которые сегодня занимают ведущее место в лучевой диагностике. В первую очередь, это относится к рентгеновской компьютерной томографии и магнитно-резонансной томографии (МРТ). Развитие и становление этих методов произошло на наших глазах.
Стартовой точкой развития методов лучевой диагностики стало появление компьютерной томографии (КТ) [3, 7]. Высказывается мнение, что создание КТ по своей значимости сопоставимо с открытием рентгеновских лучей. Первый экспериментальный КТ был, как известно, установлен в Лондоне в 1971 г. Он был создан инженером Годфри Хаунсфилдом (Godfrey Hounsfield), работавшем на звукозаписывающей компании ЭМИ (EMI).
Именно с этого периода началось триумфальное шествие томографических методов диагностики. Использование методов математического моделирования (метод обратных проекций и преобразование Фурье) стало доступно не только для рентгеновской томографии, но и для других видов томографий (радионуклидной, магнитно-резонансной, ультразвуковой). Эта особенность объединила современные методы лучевой диагностики, несмотря на то, что используются различные физические принципы и источники излучений.
С этого времени КТ стала применяться как универсальный метод диагностики. При СКТ появилась возможность быстро выполнять исследование в определенную фазу прохождения контрастного вещества через сосуды (артериальную, венозную), что привело к созданию новой методики - КТ-ангиографии.
С 1984 г., до появления МСКТ, электронно-лучевая компьютерная томография (ЭЛТ) была практически единственной методикой КТ, позволявшей выполнять исследования сердца и коронарных артерий [8]. ЭЛТ обладала высоким временным разрешением (до 33 мс на срез) благодаря использованию уникальной технологии получения срезов без использования вращающейся рентгеновской трубки. Однако, в настоящее время, возможности МСКТ в исследовании сердца превзошли таковые ЭЛТ, что привело к прекращению производства подобных томографов. Однако не исключено, что идея ЭЛТ будет использована при создании новых моделей томографов.
Объемный сбор данных и высокая скорость получения срезов при МСКТ значительно расширили области использования КТ [11, 12]. Так, КТ-ангиография стала распространенным методом визуализации практически всех сосудов, особенно коронарных [2]. Появилась возможность за одно исследование получить изображение всего сосудистого русла человеческого тела (рис.1).
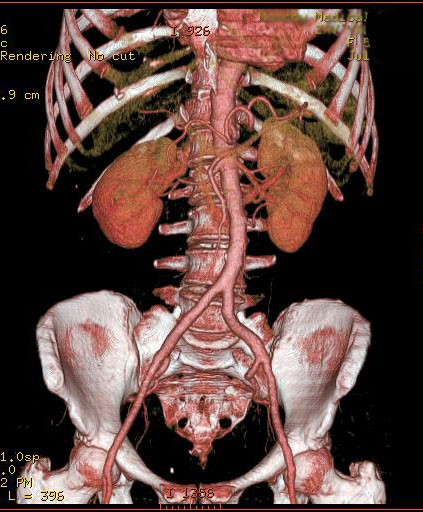
Рис. 1. Трехмерное изображение аорты, полученное с помощью КТ-ангиографии.
Достоинства МСКТ получили широкое признание в онкологии. Помимо детальной анатомической информации, объемная томография, выполняемая в различные фазы прохождения контрастного препарата через исследуемый орган, позволяет лучше выявлять и характеризовать патологические очаги.
КТ стала одним из основных методов изучения перфузии головного мозга, что имеет большое значение при обследовании пациентов с острыми нарушениями мозгового кровообращения (рис.2). МСКТ в сочетании со специальными методами трехмерной обработки изображений дает возможность получать изображения внутреннего просвета сосудов и состояния их и стенок как при эндоскопическом исследовании.
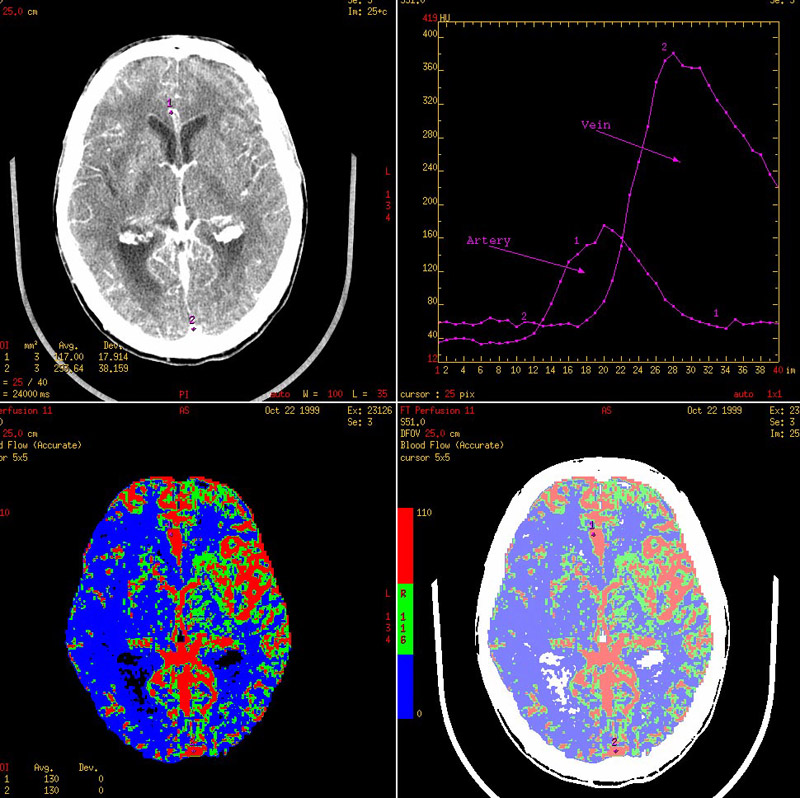
Рис. 2. Изучение перфузии головного мозга при нарушении мозгового кровообращения с помощью КТ.
Обширный дефект перфузии в правом полушарии.
Появились методики виртуальной КТ-ангиоскопии, колоноскопии, бронхоскопии, пельвио- уретероскопии, цистоскопии, ларингоскопии и подобные им методы (рис.3) [14]. Обсуждается целесообразность применения КТ-колоноскопии для скрининга рака толстой кишки, учитывая быстроту выполнения и необременительность этого исследования для пациентов.
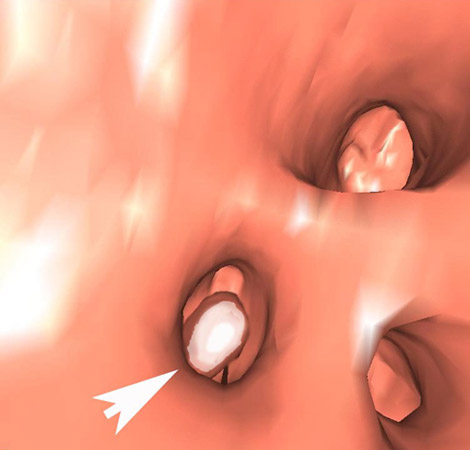
Рис. 3. Виртуальная КТ-пиелоскопия. Стрелкой указан камень в нижней чашечке.
В многочисленных клинических и лабораторных исследованиях было установлено, что микрокальцинаты в липидных бляшках можно обнаружить уже на ранних стадиях их развития. Используя опыт ЭЛТ, МСКТ стали использовать для скрининга коронарного атеросклероза [9]. Эта методика основывается на выявлении и стандартизованном количественном подсчете микрокальцинатов в атеросклеротических бляшках (рис.4). Анализ результатов исследований проведенных в Институте кардиологии РКНПК МЗСР РФ и в ряде зарубежных публикаций показали, что использование ЭЛТ и МСКТ имеют высокие показатели чувствительности и специфичности для диагностики атеросклероза и ИБС для предсказания риска наличия гемодинамически значимых стенозов и будущих сердечно-сосудистых осложнений.
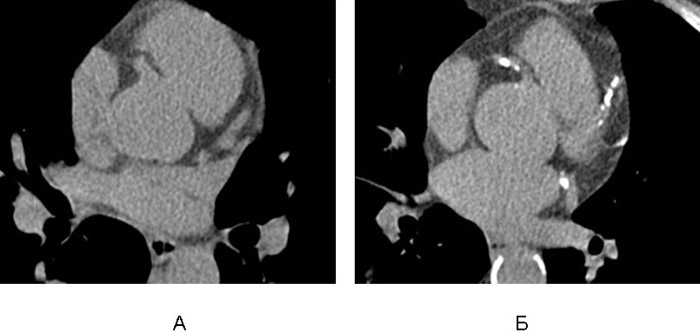
Рис. 4. Скрининг коронарного атеросклероза с помощью МСКТ. А – нормальные коронарные артерии,
Б – кальциноз правой и левой коронарных артерий в местах локализации атеросклеротических бляшек.
КТ существенно сокращает диагностический алгоритм, зачастую заменяя собой целую группу методов диагностики. Например, МСКТ стала незаменимым методом неотложной диагностики при травмах, переломах костей, нарушениях мозгового кровообращения, расслоениях аорты, тромбоэмболиях легочной артерии и других опасных для жизни состояний. Даже при неясном диагнозе МСКТ дает возможность за считанные минуты поставить правильный диагноз или определить направление диагностического поиска.
Так как МСКТ дает возможность за считанные секунды выполнить томографию всего тела, несколько лет назад появилось новое направление скрининга – так называемая томография всего тела. Единственным ограничением к широкому внедрению этой методики являются опасения избыточной лучевой нагрузки. Однако, при использовании современных моделей КТ с технологиями ограничения лучевой нагрузки на организм, ее величина относительно невелика и даже при КТ всего тела она эквивалентна воздействию естественного фона радиации за период 1-2 года.
С практической точки зрения основное следствие достигнутого технического прогресса в области КТ – это рост числа покупаемых и устанавливаемых систем и повышение потребности в них. КТ стала одним из наиболее используемых в современной медицине лучевых методов диагностики. В России имеется уже более 1000 установок КТ различных конструкций, из них более 80 – мультиспиральные системы.
МРТ – еще один томографический метод, вошедший в арсенал радиологов вскоре после КТ. В 1983 г в мире появились первые единичные МР-системы серийного производства. В бывшем СССР были созданы экспериментальные образцы МР-томографов, а в конце 1984 г в Кардиологическом научном центре АМН СССР был установлен первый серийный томограф (BRUKER), поэтому в 2004 г отмечалось 20-летие развития метода в России. Подробнее с историей развития отечественной МРТ можно ознакомиться в книге П. Ринка [5].
Существенно изменился технический парк МР-систем. Первые МР-системы были низкопольными – их магниты имели силу поля 0,02-0,35 Тесла (Тл). Потом, стараясь получить более сильный сигнал, производители сделали крен в сторону высокопольных (1,0-1,5 Тл) систем. В первую половину 90-х годов ХХ века качество изображений более экономичных низко - и среднепольных систем удалось существенно улучшить и их доля в числе установленных приборов стала увеличиваться. Анализ развития МРТ показывает, что в западных странах МРТ достигала трети от числа установленных систем, а в России превышала 90%.
Однако, со второй половины 90-х годов ХХ века стало очевидным, что полный спектр возможностей МРТ (МР-ангиография, исследования сердца, быстрая томография, исследования скорости кровотока, спектроскопия) в наибольшей степени могут быть реализованы только на высокопольных системах. Поэтому, в западных странах большинство новых МР-систем вновь стали составлять томографы с высоким полем (более 90% рынка). В России также в последние годы было установлено значительное количество высокопольных МР-систем. Существенно, что растет популярность систем с полем в 3 Тл (более 10% от числа новых систем), хотя их преимущества в клинической практике перед системами в 1,5 Тл пока не доказаны. Достоинства 3-тесловых МРТ (более дорогих, чем модели с меньшим полем) при исследованиях органов тела (сердца, печени, почек и других органов) пока не очевидны.
Существуют МР-системы и с более высоким полем – 7 Тл и 9 Тл, но они предназначены для выполнения специальных видов исследований и выпускаются в единичных экземплярах. Однако можно с уверенностью утверждать, что подобные приборы в обозримом будущем не будут использоваться для целей диагностики в клинических условиях.
В настоящее время стало возможным выполнение МРТ в реальном масштабе времени (МР-флюороскопия), внедрение в практику быстрых МР-исследований, не требующих задержки дыхания пациентом.
В наиболее совершенных моделях томографов может подключаться одновременно практически неограниченное количество радиочастотных катушек, охватывающих все тело человека, что дает возможность за короткое время выполнять МРТ всего тела или МР-ангиографию всей сосудистой системы (при непрерывном движении стола).
По аналогии с УЗИ, были созданы внутриполостные (эндоректальные, эндовагинальные МР-катушки), с помощью которых удалось значительно увеличить пространственное разрешение при исследованиях органов малого таза и прямой кишки. Разработаны модели миниатюрных внутрисосудистых радиочастотных катушек. Они дают возможность детально изучать сосудистую стенку с помощью МРТ и даже проводить интервенционные вмешательства на артериях.
Высокая скорость получения изображений при МРТ, сочетающаяся с отсутствием лучевой нагрузки, сделала ее важнейшим методом оценки перфузии внутренних органов. Наиболее широкое клиническое применение нашли методы оценки перфузии головного мозга и миокарда с помощью МРТ. Однако имеется целый ряд публикаций по использованию МРТ для изучения перфузии печени, почек, мышц, молочной железы, предстательной железы и других органов.
Соответственно новым возможностям МРТ, произошли огромные сдвиги в ее клиническом использовании. Утвердилась роль МРТ в основных сферах ее практического применения – исследованиях головного и спинного мозга, позвоночника и суставов [4]. На нее не повлияло даже появление мультиспиральной компьютерной томографии (МСКТ) или позитронно-эмиссионной томографии (ПЭТ). Например, сколько рядов детекторов – 4 или 256 – не имел бы компьютерный томограф, он никогда не сможет достичь такого же мягкотканого контрастного разрешения при исследованиях центральной нервной системы (ЦНС) как МРТ.
Но, помимо традиционных для МРТ показаний к использованию, метод прочно вошел и в новые для него области. МРТ сердца и сосудов сейчас стала одной из самых динамично развивающихся областей клинического применения метода, крайне интересующей как радиологов, так и кардиологов [1] (рис.5). МР-маммография (рис.6), как показали проведенные исследования, может быть высокоинформативным методом исследования молочных желез у определенных категорий женщин с имеющейся или предполагаемой патологией. Оказалось, что МРТ может успешно конкурировать с ПЭТ в выявлении метастатических поражений скелета. Клинический опыт показал, что МРТ существенно лучше, чем КТ при исследованиях внутренних и наружных половых органов у женщин и мужчин, в частности, при выявлении патологии предстательной железы и семенных пузырьков. Появились работы по применению МРТ для изучения паренхимы легких, тонкой и толстой кишки, желудка [10] – тех органов, в отношении которых еще 10-15 лет назад никто не мог предположить, что новый метод диагностики будет использоваться и для этих органов.
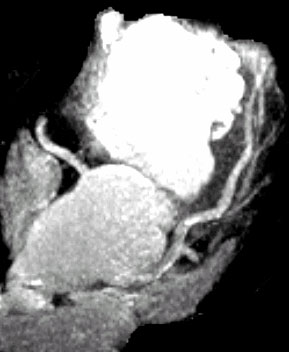
Рис. 5. МР-ангиография коронарных артерий.
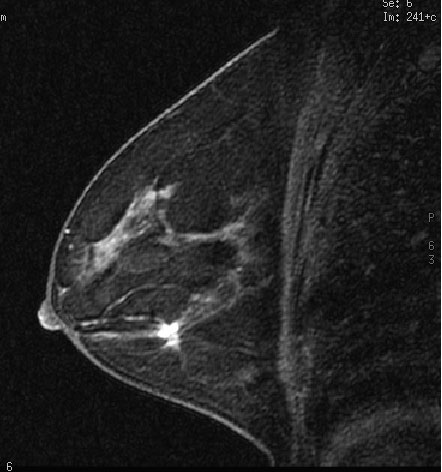
Рис. 6. МР-маммография. На фоне контрастирования гадолинием виден очаг накопления контрастного вещества в опухоли.
Произошли большие сдвиги в клиническом использовании МР-спектроскопии (МРС). Протонная МРС стала успешно применяться в нейрорадиологии для целей дифференциальной диагностики и характеризации воспалительных, метаболических и опухолевых поражений ЦНС. Успешным и оправданным с практической точки зрения оказалось использование МРС для диагностики рака предстательной железы в диагностически сложных случаях (рис.7). Ведутся активные исследования в области МРС сердца, печени, костного мозга и молочной железы.
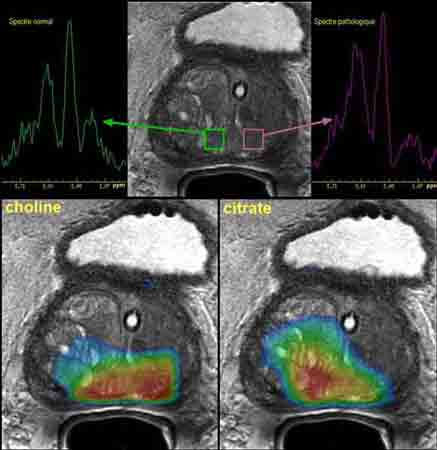
Рис. 7. Сочетание МРТ и МРС при исследовании предстательной железы. Карты распределения метаболитов.
Таким образом, к настоящему времени МРТ – конечно же, наряду с КТ, УЗИ и радионуклидной диагностикой – стала методом, без которого немыслима современная радиология [6]. МР-системы дороже, чем приборы УЗИ и КТ, их сложнее устанавливать и обслуживать, поэтому их меньше в количественном соотношении. В то же время, при правильно выбранных показаниях к исследованию, МРТ может служить методом диагностики не второй, а первой линии, то есть быть единственным методом, который позволяет ответить на все клинические вопросы.
В заключении следует отметить, что оба томографических метода – КТ и МРТ – находятся на новом витке своего развития. Именно они определяют развитие современной диагностической радиологии.
- Беленков Ю.Н., Терновой С.К., Синицын В.Е. Магнитно-резонансная томография сердца и сосудов // М., Видар, 1997.
- Дадвани С.А., Терновой С.К., Синицын В.Е., Артюхина Е.Г. Неинвазивные методы диагностики в хирургии брюшной аорты и артерий нижних конечностей // М., Видар. 2000.
- Календер В. Основы рентгеновской компьютерной и магнитно-резонансной томографии. М., Техносфера, 2006.
- Коновалов А.Н., Корниенко В.Н., Пронин И.Н. "Магнитно-резонансная томография в нейрохирургии". //М., Видар, 1998.
- Ринк П.А. Магнитный резонанс в медицине // М., Геотар-Мед, 2003.
- Синицын В.Е., Терновой С.К. Магнитно-резонансная томография в новом столетии. // Радиология-практика 2005; 4: 17-22.
- Терновой С.К., Синицын В.Е. Развитие компьютерной томографии и прогресс лучевой диагностики // Радиология-практика 2005; 4: 23-29.
- Терновой С.К., Синицын В.Е. Спиральная компьютерная и электронно-лучевая томография. // М., Видар,1998.
- Терновой С.К., Синицын В.Е., Гагарина Н.В. Неинвазивная диагностика атеросклероза коронарных артерий // М., Атмосфера, 2003.
- Gourtsoyiannis N.C., Rosn P.R. Radiologic-Pathologic Correlations from Head to Toe. Understanding the Manifestations of Disease // Springer, Berlin, 2005.
- Jeremic B. Advances in Radiation Oncology in Lung Cancer // Springer, Berlin, 2005.
- Margulis A. Modern Imaging of the Alimentary Tube // Springer, Berlin, 1998.
- Moonen, C.T.W., Bandettini, P.A. Functional MRI. // Springer, Berlin, 1999.
- Prokop M. Spiral and Multislice Computed Tomography of the Body // Thieme, Berlin, 2003.
Представлены данные об истории возникновения метода магнитно-резонансной томографии (МРТ), принципах формирования МРТ-изображений, устройстве МР-сканера, процессе МРТ-сканирования и используемых импульсных последовательностях, преимуществах и недостатках МРТ по сравнению с рентгеновской компьютерной томографией, о биологическом действии магнитных полей и противопоказаниях к проведению МРТ, использовании контрастных веществ, а также методике МРТ всего тела с диффузионно-взвешенным исследованием.
Явление ЯМР в жидкостях и твердых телах открыли в 1946 г. независимо друг от друга американские исследователи Ф. Блох и Э. Пурселл, получившие за это в 1952 г. Нобелевскую премию по физике. В 1972 г. американец П. Лаутербур получил первое в мире двухмерное МР-изображение двух стеклянных капилляров, заполненных жидкостью. На получение этого изображения ушло 4 ч 45 мин. Первое МРТ-изображение человека (пальцы кисти) было представлено П. Мэнсфилдом в Лондоне в 1976 г. На сканирование уходило уже от 15 до 23 мин.
За изобретение метода МРТ П. Лаутербуру и П. Мэнсфилду присуждена Нобелевская премия по медицине в 2003 г.
В настоящее время МРТ является одним из основных томографических методов лучевой диагностики в медицине, во многих случаях превосходящим рентгеновскую компьютерную томографию (КТ) по диагностической эффективности.
Принципы формирования МРТ-изображений
Метод МРТ основан на измерении отклика атомов водорода на возбуждение их определенной комбинацией электромагнитных волн (РЧ-импульсами) в постоянном магнитном поле [3]. Почему в клинической МРТ основную роль в формировании изображений играет водород? Для этого имеются две основные причины: I) большая распространенность водорода в организме человека — он входит в состав молекул воды (Н20), из которой на 2/3 состоит тело человека, а также в состав белков, жиров и углеводов (химические группы СН2 и др.); 2) большой магнитный момент, то есть способность выстраиваться вдоль внешнего магнитного поля. Ядро атома водорода состоит из заряженной частицы (протона) и нейтральной частицы (нейтрона). Положительно заряженный протон обусловливает наличие у водорода магнитных свойств.
Формирование МРТ-изображения включает следующие основные этапы.
1. Сканируемый объект помещается во внешнее постоянное магнитное поле, в котором протоны водорода приобретают продольную, то есть совпадающую по направлению с внешним магнитным полем, намагниченность.
2. В объект подаются кратковременные РЧ- импульсы, обусловливающие отклонение намагниченности в заданную плоскость. В типичном случае используют 90° РЧ-импульс, отклоняющий намагниченность в поперечную плоскость.
3. После прекращения воздействия РЧ-импульса намагниченность начинает возвращаться в исходное положение, что называют релаксацией. При этом сканируемым слоем испускается РЧ-сигнал, улавливаемый МР-сканером и преобразуемый в изображение.
Кроме постоянного и РЧ магнитного полей в МРТ используют еще одно магнитное поле — градиентное. 0но служит для выделения слоя — выбора плоскости сканирования и толщины среза. В отличие от КТ, при которой томограмму можно получить только в плоскости механически вращающихся вокруг пациента рентгеновской трубки и детектора излучения (в большинстве случаев это трансверсальная плоскость), при МРТ плоскость сканирования определяется направлением приложения градиентного магнитного поля и может быть любой — трансверсальной, сагиттальной, коронарной или наклоненной к ним (рис. I).
Основные компоненты МР-сканера
Основными компонентами МР-сканера являются магнит, радиочастотная и градиентная системы, стол пациента и компьютер для управления процессом сканирования и реконструкции изображений (рис. 2) [2].
Магнит создает внешнее постоянное магнитное поле, основной характеристикой которого является напряженность или сила, выражаемая в Теслах (Тл). По силе магнитного поля МР-томо- графы разделяют на низкопольные (менее 0,5 Тл), среднепольные (0,5—1,0 Тл), высоко- польные (1,0—2,0 Тл) и сверхвысокопольные (более 2,0 Тл). В клинической практике наиболее распространены томографы с напряженностью 1,5 Тл, которые в настоящее время считаются оптимальными по соотношению качества изображений, функциональных возможностей сканера и цены. Все более распространенными становятся сканеры с напряженностью 3 Тл. В последние годы началась клиническая эксплуатация аппаратов с напряженностью 7 Тл (рис. 3). Консорциум Европейских компаний и университетов проводит работы по созданию МР-томографа с напряженностью 11,7 Тл, которые должны быть завершены в 2016 г.
Преимуществом свервысокопольных сканеров является более высокая детализация изображений, что особенно важно для нейровизуализации. К недостаткам относится увеличение количества энергии, передаваемой сканируемому объекту, что требует соблюдения определенных предосторожностей. Кроме этого, сложнее создать полную однородность магнитного поля, что может снизить качество изображений при некоторых исследованиях (например, с подавлением сигнала от жира).
В зависимости от конструкции магниты разделяют на закрытые (см. рис. 2) и открытые. В первом случае томограф имеет туннель, в который помещается сканируемый объект в положении лежа. Преимуществом открытых магнитов является отсутствие туннеля, что делает условия сканирования более комфортными для пациента и позволяет проводить интервенционные вмешательства. Одна из разновидностей МР-сканеров с магнитом открытого типа позволяет проводить обследование пациента в положении сидя или стоя, то есть в условиях физиологической нагрузки на позвоночник. Недостаток открытых магнитов — меньшая напряженность магнитного поля (в настоящее время не более 1,2 Тл). С технической точки зрения магниты бывают постоянного, резистивного и сверхпроводящего типов. В высокопольных МР-сканерах используются магниты сверхпроводящего типа, предусматривающие охлаждение жидким гелием.
РЧ и градиентное магнитные поля создаются с помощью специальных приспособлений, называемых катушками. РЧ-катушки отвечают за передачу и прием из сканируемого объекта РЧ-сигналов (рис. 4). Для сканирования определенной анатомической зоны используют специально предназначенные для нее РЧ-катушки, которые могут быть съемными (например, для сканирования головного мозга, брюшной полости, коленного сустава) или встроенными в стол пациента (для сканирования позвоночника) или в обшивку магнита (для сканирования всего тела). Градиентные катушки встроены в обшивку магнита.
Контраст МР-изображений и основные импульсные последовательности
В отличие от КТ, при которой плотность тканей может быть измерена в единицах Хаунсфилда, при МРТ говорят об интенсивности сигнала, которую не принято оценивать количественно, так как она существенно варьирует в зависимости от большого количества факторов [2, 4]. Интенсивность сигнала (контраст тканей) в МРТ определяется в основном четырьмя параметрами:
1) протонной плотностью (количество протонов в исследуемой ткани);
2) временем продольной релаксации тканей (обозначается как время Т1);
3) временем поперечной релаксации тканей (время Т2);
4) движением или диффузией исследуемых структур.
В каждом МР-изображении присутствует контраст, обусловленный как протонной плотностью, так и Т1- и Т2-релаксацией. В зависимости от их соотношения говорят о Т1-взвешенных изображениях (Т1-ВИ), Т2-взвешенных (Т2-ВИ) или об изображениях протонной плотности (PD), которые также называют средневзвешенными.
Специально разработанные импульсные последовательности (ИП) определяют вклад того или иного параметра в интенсивность сигнала изображения для получения оптимального контраста между нормальными и патологическими тканями [5]. ИП — это набор радиочастотных и градиентных импульсов заданной формы, амплитуды и интервала между ними, многократно повторяемых во время сканирования и определяющих контраст МР-изображений. Другими словами, ИП — это компьютерная программа, управляющая МР-сканером в процессе сканирования.
Основными техническими параметрами ИП являются время повторения (TR), время эха (ТЕ), время инверсии (TI), угол отклонения.
Используемые в клинической практике ИП можно схематически разделить на следующие группы:
• спин-эхо;
• турбоспин-эхо — быстрое спин-эхо;
• градиентное эхо — еще более быстрые ИП;
• инверсия-восстановление:
FLAIR— подавление сигнала от свободной жидкости (темная жидкость); STIR — подавление сигнала от жира;
• МР-ангиография (МРА):
без внутривенного (в/в) введения контрастного вещества (КВ): время-пролетная МРА (ToF-МРА); фазово-контрастная МРА; с в/в введением КВ (контрастно-усиленная МРА);
• эхопланарная визуализация — сверхбыстрые ИП:
диффузионно-взвешенная МРТ (диффузи- онно-взвешенное исследование — ДВИ) и ее разновидность — диффузионная тензорная МРТ (трактография); перфузионная МРТ — с болюсным в/в контрастным усилением; функциональная МРТ (фМРТ);
• МР-спектроскопия (МРС):
одновоксельная; мультивоксельная.
Для того чтобы отличить Т2-ВИ от Т1-ВИ можно использовать следующие способы. Во-первых, на Т2-ВИ вода имеет повышенный сигнал (белая), а на Т1-ВИ — сниженный (темная) (рис. 5). Обычно оценивают интенсивность сигнала спинномозгового ликвора. Во-вторых, можно обращать внимание на значения параметров TR и ТЕ. Так, при использовании спинэховых и турбо-спинэховых ИП эти параметры обычно составляют для Т2-ВИ — TR более 1600 мс, TE более 60 мс; для Т1-ВИ — TR 300— 600 мс, TE 10—20 мс; для изображений протонной плотности — TR более 2000 мс, TE 20 мс.
Считается, что Т2-ВИ по своей контрастности наиболее информативны для выявления патологии — большинство опухолей имеют повышенное содержание воды и поэтому на Т2- ВИ характеризуются повышенным сигналом.
Т1-ВИ позволяют установить серозную (сниженный сигнал) или геморрагическую (в подостром периоде — повышенный сигнал) природу жидкостных образований, а также используются для оценки контрастного усиления после в/в введения содержащих гадолиний КВ. Изображения протонной плотности хорошо визуализируют суставной хрящ и наиболее широко используются при МРТ суставов [6].
МРТ-сканирование обычно включает получение Т2-ВИ и Т1-ВИ в одной или нескольких плоскостях, при необходимости — Т1-ВИ после в/в введения КВ и ряд дополнительных ИП. Получение каждой серии изображений занимает от 1 до 7 мин, в среднем — 2—3 мин. В итоге общая длительность МРТ-сканирования составляет в среднем 20—40 мин, а в некоторых случаях может достигать 1 ч и более. Необходимо отметить, что контрастная разрешающая способность, пространственная разрешающая способность (толщина среза) МР-изображений и длительность сканирования имеют обратную связь друг с другом — так называемый Бермудский треугольник. Это означает, что для получения более контрастных и трехмерных (тонкие срезы) изображений требуется больше времени. Поэтому до начала МРТ-исследования необходимо четко понять стоящие перед ним задачи, чтобы определить оптимальный с точки зрения качества изображений и длительности сканирования протокол исследования.
Преимущества и недостатки МРТ по сравнению с КТ
Как и КТ, МРТ является неинвазивным томографическим методом лучевой диагностики. К преимуществам МРТ относятся:
1) более высокая контрастная разрешающая способность. Например, при МРТ очаги в головном мозге нередко визуализируются лучше, чем при КТ; фибромиома матки при КТ не отличается по плотности от тканей матки, при МРТ— имеет сниженный сигнал на Т2-ВИ и четко визуализируется; суставной хрящ хорошо визуализируется на МРТ-изображениях в отличие от КТ;
2) отсутствие ионизирующего излучения, что позволяет проводить МРТ всего тела и повторять исследование в динамике, что особенно важно в онкологии для стадирования злокачественных опухолей и оценки эффективности лечения;
3) отсутствие артефактов от костной ткани — преимущество при оценке базальных отделов головного мозга;
4) естественный контраст от движущейся крови — исследование сосудов без в/в контрастирования;
5) исследование функции органов: измерение скорости кровотока, уровня диффузии в тканях с помощью ДВИ, метаболизма тканей с помощью МРС, визуализация активации коры головного мозга с помощью фМРТ.
Одним из преимуществ МРТ ранее считали возможность сканирования в любой плоскости, а не только в аксиальной, как при КТ. Однако с появлением многосрезовых КТ-сканеров стало возможным получение тонких аксиальных КТ- срезов с последующей реконструкцией изображений в любой плоскости.
К основным недостаткам МРТ по отношению к КТ относятся:
1) более длительное сканирование, что может стать причиной двигательных артефактов и снижает пропускную способность аппарата;
2) недостаточная визуализация легочной ткани — воздух не создает МР-сигнала, но визуализируется легочный интерстиций;
3) невозможность надежного выявления кальцификатов, некоторых видов патологии костных структур— кальций не дает МР-сигнала, визуализируется костный мозг, а не костная ткань;
4) подверженность МР-изображений артефактам, в том числе за счет неоднородности магнитного поля;
5) невозможность обследования пациентов с клаустрофобией, искусственными водителями сердечного ритма, наличие других противопоказаний;
6) высокая стоимость оборудования и его эксплуатации.
Учитывая сказанное, МРТ имеет преимущества перед КТ при визуализации головного и спинного мозга, органов таза, суставов [6, 7].
При патологии легких, для диагностики ряда заболеваний костных структур, а также у пациентов, которые не могут длительно и осознанно соблюдать неподвижность во время сканирования, предпочтительнее выполнять КТ. При МРТ брюшной полости может потребоваться многократная задержка дыхания, в случае неспособности пациента ее выполнять информативность исследования значительно снижается. При выборе метода обследования необходимо учитывать и другие факторы, такие как длительность сканирования и доступность соответствующего оборудования.
Биологическое действие магнитных полей и противопоказания к МРТ
Энергия, передаваемая объекту электромагнитным излучением, пропорциональна его частоте. Используемые в МРТ радиоволны имеют частоту порядка 107 Гц, в то время как рентгеновское излучение— 101W Гц. Из этого следует, что рентгеновские лучи передают тканям гораздо больше энергии, чем радиоволны, частота которых даже ниже, чем у видимого света. В этой связи метод МРТ считается безопасным для человека, однако имеет ряд ограничений. Магнитное поле сканера с напряженностью магнитного поля 1,5 Тл в 30 000 раз сильнее магнитного поля Земли. Поэтому МРТ противопоказана при наличии у пациента кардиостимулятора (его работа может нарушаться с потенциальной угрозой для жизни) и других электронных имплантированных устройств, ферромагнитных интракраниальных аневризмальных клипс, инородных металлических тел в орбитах (угроза смещения и повреждения тканей).
Не рекомендуется проводить МРТ в первые 3 мес беременности по причине неизученности возможного влияния на плод.
Несъемные металлические зубные коронки, протезы суставов, немагнитные (титановые, танталовые, из нержавеющей стали, биодеградабельные) стенты и аневризмальные клипсы не опасны для проведения МРТ спустя 2—4 нед после их установки. Вместе с тем металлические имплантаты, находящиеся в зоне сканирования, вызывают артефакты, создающие сложности для интерпретации результатов исследования. МРТ невозможно провести при наличии у пациента боязни замкнутого пространства (клаустрофобия), которая встречается не более чем у 4% населения. У маленьких детей (обычно в возрасте до 5 лет) исследование проводится в состоянии медикаментозного сна.
Перед началом исследования пациент заполняет анкету с вопросами о возможных противопоказаниях. Снимаются любые металлические украшения, предметы и элементы одежды. Другой специальной подготовки к МРТ обычно не требуется.
Использование контрастных веществ при МРТ
При МРТ используют КВ на основе редкоземельного элемента гадолиния (омнискан, магневист, оптимарк, гадовист и др.), которые вводят струйно в локтевую вену в дозе 0,2 мл/кг массы тела пациента (гадовист— 0,1 мл/кг). В ряде случаев, например при перфузионной МРТ и МРТ молочных желез, рекомендуется болюсное введение, то есть с помощью автоматического инжектора.
После в/в введения препарат проникает через поврежденный гематоэнцефалический барьер (при злокачественных опухолях, ишемии, инфекционно-воспалительных и демиелинизирующих заболеваниях головного мозга), а также накапливается в нормальных и патологических экстракраниальных тканях.
Для оценки контрастного усиления проводят сканирование с использованием Т1-ВИ, на которых патологические образования приобретают повышенный сигнал. В онкологии использование МР-КВ играет важную роль как при определении распространенности опухолевого процесса, так и при контроле эффективности лечения [6]. У беременных женщин использование содержащих гадолиний КВ допускается лишь в случае крайней необходимости, поскольку КВ проникает через плаценту и может накапливаться в амниотической жидкости. У кормящих грудью женщин ограничения для в/в контрастирования при МРТ не установлены [9].
Еще одной группой МР-КВ являются наночастицы железа оксида. Показана высокая эффективность их использования для диагностики метастазов в лимфатических узлах. В отличие от гадолиниевых препаратов частицы железа оксида вызывают снижение сигнала от нормальных тканей лимфоузла на Т2-ВИ. В настоящее время данные препараты не представлены на рынке.
Как отмечалось выше, МРТ является нерадиационным безопасным методом обследования пациентов, что с учетом высокой контрастной разрешающей способности делает его весьма подходящим для сканирования всего тела, особенно в онкологии.
Программа сканирования всего тела может отличаться в зависимости от технических возможностей МР-сканера, опыта и предпочтений врача-диагноста, но обычно включает Т2-ВИ и Т1-ВИ в коронарной плоскости, ДВИ в трансверсальной плоскости. Преимущество ДВИ особенно очевидно у онкологических пациентов — первичные и метастатические злокачественные опухоли имеют повышенный сигнал на фоне подавления сигнала от нормальных тканей, что делает ДВИ-изображения подобными на изображения позитронной эмиссионной томографии (рис. 6). При ДВИ не требуется в/в введение КВ, то есть методика является абсолютно неинвазивной.
Заключение
МРТ является высокоинформативным и безопасным томографическим методом лучевой диагностики. По сравнению с КТ метод имеет ряд существенных преимуществ, обусловливающих более широкое его использование в клинической практике. Грамотное применение МРТ требует учета показаний и противопоказаний, а также адаптации протокола сканирования в соответствии с конкретной клинической задачей. Достаточно новой высокоинформативной методикой МРТ является ДВИ. Высокая контрастная разрешающая способность и отсутствие ионизирующего излучения делают метод МРТ- ДВИ особенно подходящим для исследования всего тела, особенно у пациентов с онкологическими заболеваниями.
Контактная информация:
Хоружик Сергей Анатольевич — к. м. н., доцент.
РНПЦ онкологии и медицинской радиологии
им. Н. Н. Александрова.
223040, а/г Лесной, Минский район;
сл. тел.: (+37517) 26S-56-81.
Конфликт интересов отсутствует.
Ключевые слова: диффузионно-взвешенное исследование, компьютерная томография, магнитно-резонансная томография
Автор(ы): Хоружик С. А.
Медучреждение: РНПЦ онкологии и медицинской радиологии им. Н. Н. Александрова Минздрава Республика Беларусь
Магнитно-резонансная томография позволяет открыть множество новых деталей в получении изображений различных участков человеческого тела, особенно при исследованиях головного и спинного мозга и при диагностике сарком. При проведении обследований по данной методике пациент помещается в мощное магнитное поле, которое выстраивает магнитные моменты атомов человеческого тела вдоль своих силовых линий.
Затем на магнитное поле накладывается короткий импульс, изменяющий направление магнитных моментов атомов. Вслед за импульсом магнитные моменты атомов возвращаются к своей первоначальной ориентации в постоянном магнитном поле. Датчики регистрируют это время релаксации, длительность которого зависит от энергообмена между протонами атомов и окружающими их атомами и молекулами. Время релаксации протонов в нормальных и опухолевых тканях различно.
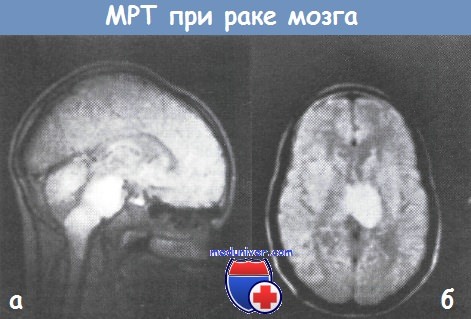
Эта методика доказала свою эффективность в диагностике опухолей мозга, когда глубоко залегающие опухоли не могут быть обнаружены другими способами. Магнитно-резонансная интроскопия способна обнаруживать опухоли в стволовых структурах мозга, в мозжечке и в других глубинных слоях, где КТ оказывается бессильной. Еще более повышает точность МРТ использование контрастирующих агентов.
В диагностике заболеваний позвоночника МРТ все более вытесняет миелографию, так как она позволяет выявлять вторичные очаги опухолей без проведения поясничной пункции. Точность диагностики значительно повышается с применением гадолиниевого контраста.
При диагностике сарком костных и мягких тканей МРТ демонстрирует непревзойденную точность в определении первичных очагов опухолей, что оказывает неоценимую помощь хирургам и радиологам в планировании дальнейшего лечения.
В диагностических обследованиях брюшного и тазового отделов МРТ также имеет ряд преимуществ перед КТ, например, в определении функциональной анатомии шейки матки и оценке состояния тазовых лимфатических узлов.
Использование современных контрастных веществ, включая лимфотропные парамагнитные наночастицы, значительно увеличивает чувствительность метода в диагностике пациентов с раком простаты.
Для обнаружения опухолей поджелудочной железы и желчных протоков в настоящее время все более широко используется магнитно-резонансная холангиопанкретография (МРХП) как противовес более инвазивной эндоскопической процедуре (ЭРХП — эндоскопическая ретроградная холангиопанкретография).
Преимущество этой методики, впервые опробованной в 1991 г., состоит в том, что она не требует введения в организм экзогенных контрастирующих веществ, что делает ее незаменимой для пациентов с аллергическими реакциями на соединения йода. Точность МРХП в большинстве случаев сопоставима с точностью ЭРХП, и она гораздо менее дорогостояща.
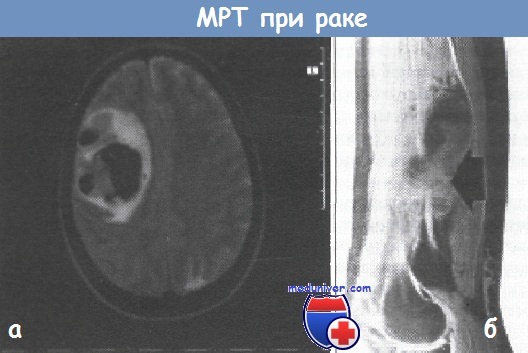
(а) МРТ-сканограмма саркомы мягких тканей нижней части бедра. Четко видна опухолевая масса (отмечена стрелкой) с пронизывающей ее бедренной артерией,
(б) МРТ-сканограмма мозга показывает наличие крупных метастазов.
Геморрагическая область видна как плотный черный участок центрального затемнения. Срединные структуры отчетливо смещены справа налево.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

МРТ является современным диагностическим методом, который основан на действии магнитного поля и радиоволны. Это отличает данный метод от компьютерной томографии и рентгенографии, где используется ионизированное излучение. Именно поэтому процедуры можно повторять столько, сколько необходимо, не боясь за последствия.
Данный метод отличается высокой информативностью, особенно при исследовании мягких тканей. С помощью него врач получает детальные срезовые изображения интересующей ткани либо органа.
Датой рождения метода считают 1973 год. Именно тогда в одном из научных журналов США появилась статья П.Лотербура, где автор описал суть метода.
В начале 1950-х оба ученых получили Нобелевскую премию. Исследования эффекта продолжались, и в 1972 году проведены были клинические испытания нового аппарата, работа которого была основана как воздействие рентгеновского излучения на организм. Безусловно, испытание КТ-аппарата стало значимой вехой в развитии МРТ-технологии.
В настоящее время МРТ-диагностика успешно используется в разных направлениях медицины, ее ценность не только в информативности, но и в отсутствии эффектов побочного рода, безболезненности, возможности использовать при диагностике контрастного вещества.
Точность и своевременность процедуры делают МРТ-диагностику эффективной, незаменимой в плане составления лечебной программы и быстрейшего выздоровления.
Принцип диагностики и устройство аппарата
Для проведения процедуры обследуемый помещается на специальный стол, который двигается сквозь магнит тоннелеобразной формы. Интересующая зона получает радиочастотные импульсы, и, как результат данного влияния – возникает резонанс атомов водорода в органических тканях.
Необходимо понимать: тело человека в большей части — это водная и жировая материя. В этих двух веществах содержится большое водородное скопление. В разных тканях присутствует разное его количество. И содержание его в поврежденных тканях будет разниться от водородного обогащения в здоровых тканях.
Результат атомного резонанса отражается на специальных датчиках, а затем его обрабатывает программа компьютера, которая преображает результат в картинку в виде среза интересующего органа.
Можно ли выявить онкологию с помощью исследования?
С помощью исследования можно выявить рак. На полученных в ходе процедуры снимках виден очаг новообразования злокачественной природы, причем на всех стадиях его развития. Помимо этого, снимки позволяют рассмотреть метастазы, где бы они ни локализовались.
Безусловный плюс метода в том, что онкологический процесс виден на самой ранней стадии, когда еще атипичные клетки зарождаются, когда еще не сформировалось новообразование. То есть метод позволяет выявить мутированные клетки величиной менее миллиметра.
Пытаясь определить характер процесса метастазировании, врачи с помощью МРТ-исследования применяют контрастные препараты для создания трехразмерной модели опухоли.
Это дает врачу важную информацию о:
- Размере и локализации новообразования;
- Его типе;
- Степень его развития;
- Изменениях патологического характера в кровоснабжении исследуемой области;
- Целесообразности хирургического вмешательства;
- Специфике взаимодействия новообразования с элементами нервной и сосудистой систем.
Возможность ошибочного заключения
С помощью МРТ-исследования сегодня с вероятностью до 95% можно выявить раковое заболевание. Данное обстоятельство говорит об исследовании как о самом совершенном инструменте аппаратной диагностики онкологических заболеваний.
Ошибочное заключение может случиться в нескольких случаях:
- Квалификация персонала недостаточная;
- Томограф низкого качества;
- При исследовании костей и легких, т.к. они являются проблемными для подобного исследования.
Раковое заболевание, диагностированное вовремя, нередко побеждают, применяя консервативный способ лечения. Именно МРТ-исследование помогает обнаружить рак на ранней его стадии.
Виды МРТ исследований
Сегодня целый ряд исследований МРТ очень широко применимы в медицине. К ним относятся:
- Исследование позвоночника. Проводя его, можно получить необходимую информацию о состоянии того либо иного отдела и элемента, из которых состоит позвоночник. Помимо этого, врач узнает о проблемах кровообращения, выявляет последствия, причиной которых явились травмы, выявляет отклонения от нормального развития и т.п.
- Исследование суставов. Можно исследовать конкретные суставы, изучить их структуру, выявить патологии в развитии, разного рода отклонения, заболевания околосуставных тканей.
- Исследование мозга. Процедура высоко чувствительна. С помощью нее обследуются все отделы и структуры органа. Данное исследование позволяет выявить разного рода аномалии.
- Исследование гипофиза. Оно позволяет увидеть, в каком состоянии находится сам орган и область, в которой он расположен, выявить повреждения органа.
- Ангиографическое исследование мозга. С его помощью оцениваются сосуды органа, при этом введение контраста не предусмотрено, т.к. врач может различить кровь и сосудистые стенки.
- Исследование холангиографическое. Его цель – охарактеризовать проходимость протоков желчи. С помощью исследования можно обнаружить полипы, новообразования, сужение путей прохода желчи, наличие камней.
- Исследование предстательной железы. С помощью данного исследования врач получает детальную информацию о структуре органа, способен обнаружить аденому простаты, воспалительные очаги, новообразования различной природы.
- Исследование малого таза. Диагностируются структурные изменения тканей, спайки, миомы, новообразования и т.п.
Процедура исследования безвредна
Процедура исследования безвредна, так как в ней не используется рентгеновское либо ионизирующее излучение. Электромагнитные импульсы не наносят вреда человеческому организму.
А можно ли применять ее при онкологических заболеваниях? Ответ однозначен - да, это широко практикуется.
Процедура безопасна при разных стадиях ракового заболевания, сколь бы раз ее не применяли. Она никак не воздействует на ускорение процесса клеточного деления, не может стать причиной перерождения опухоли доброкачественной в злокачественную.
Противопоказания к проведению процедуры
При всей эффективности процедуры к ней существуют некоторые противопоказания:
- Если в организме присутствуют электронные приборы;
- Если в организме присутствуют металлические конструкции либо их фрагменты;
- Наличие зубных имплантов, сосудистых стентов, зонтов, изготовленных свыше семи лет назад;
- Наличие кардиостимулятора;
- Боязнь замкнутого пространства.
Готовимся к процедуре
Перед процедурой специальная подготовка не предусмотрена. Исключением является обследование печени и желчного пузыря. Их выполняют утром натощак.
Врач должен объяснить обследуемому, что тот будет находиться в тоннеле аппарата некоторое время, минимум 15 минут. Время проведения процедуры исследования зависит от его вида и может длиться до 60 минут. При этом пациент слышит шум, который исходит из работающей установки.
На одежде обследуемого не должно быть никакого металла. Необходимо снять металлические аксессуары, оставить любые металлические носители, например, электронные магнитные карты, флешки, иначе они пострадают.

Результат исследования
После проведенного исследования врач должен определить существуют ли признаки злокачественного новообразования. При этом диагноз не ставится, так как для его постановки необходима биопсия с последующим лабораторным анализом биоптата.
Процедура показывает насколько исследуемый орган поражен, затронуты ли поражением близлежащие ткани, есть ли нарушения кровоснабжения, наличествуют ли метастазы, если да, то каковы их размеры и где локализуются.
Читайте также:

