Молекулярная структура мембран миелиновых оболочек нервных волокон реферат
Обновлено: 02.07.2024
С детства мы слышим, что нервные клетки не восстанавливаются. И хотя вопрос о возможности образования новых нейронов во взрослом мозге до сих пор открыт, уже есть данные, что процесс нейрогенеза у человека продолжается до глубокой старости. Любые нарушения в развитии нервных клеток могут приводить к серьезным, иногда необратимым патологиям. Одним из таких нарушений являются дефекты в защитной изоляционной оболочке (миелине) отростков нервных клеток, которые могут формироваться у человека еще до его рождения. Их практически невозможно диагностировать с помощью традиционных методов визуализации.
Об авторах
Яна Олеговна Исаева — студентка Института медицины и психологии им. В. Зельмана Новосибирского государственного университета.
Василий Леонидович Ярных — кандидат химических наук, заведующий лабораторией отделения радиологии, профессор университета Вашингтона (Сиэтл, США) и Томского государственного университета. Автор и соавтор более 70 научных работ, в том числе 5 патентов.
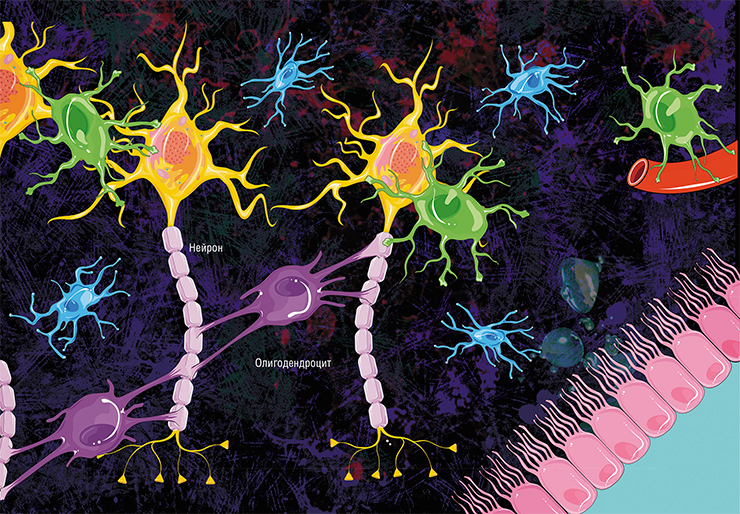
В мозге человека в среднем содержится около 100 млрд нейронов, которые принимают, хранят, обрабатывают и передают информацию с помощью электрических и химических сигналов. Взаимодействие между нейроном и другими нервными клетками и органами происходит с помощью коротких (дендриты) и длинного (аксон) отростков.
Все повреждения миелиновой оболочки или дефекты, возникшие в период ее формирования, приводят к серьезным, иногда неизлечимым заболеваниям. Среди них наиболее известен рассеянный склероз — хроническое аутоиммунное заболевание, поражающее преимущественно молодых людей.
Развитие мозга плода — сложный процесс, при котором происходят быстрые перестройки морфологии и микроструктуры нервной ткани. В некоторых зонах мозга процесс формирования миелина начинается уже с 18–20-й недели беременности, а продолжается приблизительно до десятилетнего возраста.
Но как выявить дефекты миелина в период внутриутробного развития? В настоящее время акушеры-гинекологи пользуются только биометрическими показателями (например, размером мозга), однако они обладают высокой изменчивостью и не дают полной картины. В педиатрии даже при наличии явных функциональных отклонений в мозговой деятельности ребенка традиционные изображения МРТ или нейросонографии (ультразвукового исследования головного мозга новорожденных) часто не показывают структурные отклонения.
Поэтому поиск точных количественных критериев оценки формирования миелина во время беременности является актуальной задачей, которую к тому же нужно решить с помощью неинзвазивных диагностических методов, уже апробированных в акушерстве. Специалисты из новосибирского Международного томографического центра СО РАН предложили использовать для этих целей новый метод количественной нейровизуализации, уже адаптированный для дородовых (пренатальных) исследований.
На обычном томографе
Любая патология головного мозга плода, которую подозревают врачи во время ультразвукового обследования беременной, обычно является показанием к проведению МРТ; подобные исследования проводятся в МТЦ СО РАН уже более десяти лет. Результаты МРТ могут подтвердить, уточнить, опровергнуть либо вообще изменить предварительный диагноз и, соответственно, тактику ведения беременности.
Дело в том, что количество миелина и размеры отдельных структур головного мозга у эмбриона настолько малы, что любые измерения очень сложны и трудоемки. К тому же плод постоянно шевелится, что очень затрудняет получение качественных изображений и достоверных количественных данных. Поэтому нужна технология, позволяющая получать изображения быстро и с высокой разрешающей способностью даже на маленьких объектах.
Именно таким оказался метод быстрого картирования макромолекулярной протонной фракции (МПФ) — биофизического параметра, который описывает долю протонов в макромолекулах тканей, вовлеченных в формирование МРТ-сигнала, тогда как обычно источником сигнала являются протоны, содержащиеся в воде (Yarnykh, 2012; Yarnykh et al., 2015).
В основе метода лежит специализированная процедура математической обработки МРТ-изображений, которая позволяет вычленить компоненты сигнала, связанные с МПФ клеточных мембран. А в головном мозге человека и животных основная их часть содержится именно в миелине. Реконструируются карты МПФ на основе исходных данных, которые могут быть получены практически на любом клиническом томографе.
Для реконструкции карт МПФ используются четыре исходных изображения, полученные различными традиционными методами МРТ. Правильность такого подхода подтвердили результаты его апробации на лабораторных животных в Томском государственном университете: у мышей, которым вводили раствор, вызывающий разрушение миелина, результаты МПФ-картирования совпали с данными гистологического исследования тканей (Khodanovich et al., 2017).
Миелин — в норме и патологии
Пилотные исследования, выполненные в рамках клинических диагностических МРТ-обследований эмбрионов возрастом от 20 недель и старше, показали, что новая технология позволяет за небольшое (менее 5 мин.) время сканирования выявить очень малые количества миелина.
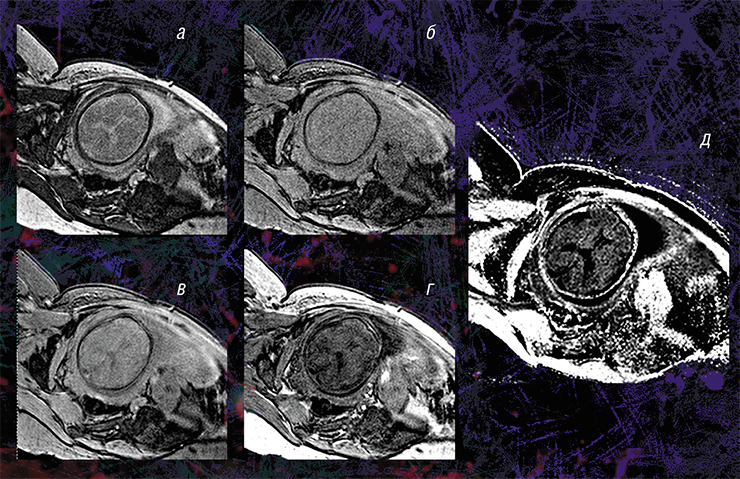
Карта МПФ (д) реконструируется с помощью специальной математической программы из четырех видов исходных изображений: в режиме переноса намагниченности (а) и протонной плотности (б), референсного (в) и анатомического (г), которые можно получить на обычном томографе
Кроме того, оказалось, что изображения, полученные с помощью новой технологии, являются наиболее информативными для внутриутробной диагностики одного из видов медуллобластомы — врожденной злокачественной опухоли мозжечка. У плода опухоль не удалось отчетливо выявить с помощью традиционного МРТ-обследования, однако она хорошо прослеживалась с использованием количественного метода МПФ.
Дело в том, что у плода показатель МПФ для ткани медуллобластомы вдвое выше значений для окружающей здоровой ткани из-за более высокого содержания в опухоли фибриллярного белка коллагена соединительной ткани, которая широко представлена в этом виде опухоли. После рождения и до полутора лет эти различия сглаживались из-за нарастающей миелинизации мозжечка, в то время как значения МПФ в опухоли оставались практически неизменными.
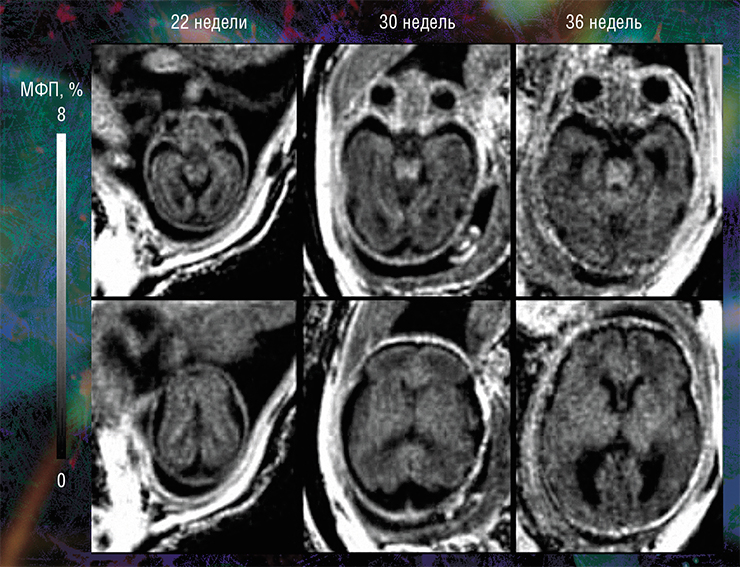
Наиболее высокие значения МФП и, соответственно, степени миелинизации выявлены в стволовых структурах головного мозга плода. Меньшие значения МПФ обнаружены в таламусе и мозжечке, а минимальные — в полушариях головного мозга. При этом количество миелина в центральных мозговых структурах стабильно увеличивается с эмбриональным возрастом
Эти результаты говорят о том, что диагностическая значимость метода МПФ наиболее высока именно во внутриутробном периоде. И это очень важно, так как после рождения ребенка арсенал МРТ (в том числе с использованием контрастирующих средств), который позволяет визуализировать все детали злокачественного поражения, значительно расширяется (Korostyshevskaya, Savelov, Papusha et al., 2018).
В течение последнего десятилетия для изучения внутриутробного периода созревания мозга использовались различные количественные методы МРТ. Но оказалось, что среди всех известных на сегодня методов наиболее чувствительным к содержанию миелина в мозге взрослого человека и плода оказался метод картирования МПФ.
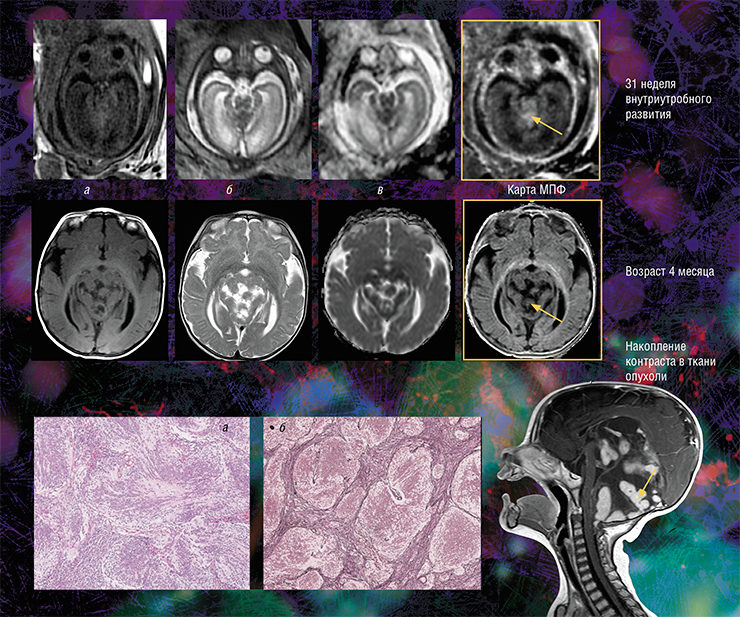
Медуллобластома — злокачественная опухоль центральной нервной системы, развивающаяся из эмбриональных клеток и локализующаяся преимущественно в мозжечке. Она составляет пятую часть всех опухолей головного мозга у детей. Формирование у ребенка врожденной медуллобластомы удалось проследить с внутриутробного периода. На традиционных МРТ-изображениях головного мозга (карте коэффициента диффузии воды — а и анатомических изображениях с различным контрастом — б, в) опухоль можно диагностировать после рождения: например, она хорошо видна в возрасте 4 месяцев. Однако в последнем семестре беременности опухоль не выделяется на фоне окружающей ткани, но ее можно увидеть на МПФ-карте, потому что медуллобластома содержит большое количество коллагена, влияющего на величину детектируемого сигнала МРТ. Справа — МРТ-изображение нервной системы больного в возрасте 4 месяцев, полученное при обычном сканировании с контрастным усилением. В возрасте 5,5 месяцев ребенку была сделана оперативная резекция опухоли. Внизу — гистологические срезы опухолевых фрагментов, окрашенных гематоксилин-эозином (а) и импрегнированных серебром (б), на которых видны множественные слившиеся опухолевые узлы, окруженные фиброзными волокнами, в состав которых входит коллаген. Фото из архива НМИЦ детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева (Москва)
С его помощью новосибирским специалистам впервые удалось разработать количественные критерии нормальной внутриутробной миелинизации, на основании которых можно оценить своевременность формирования внутренней структуры мозга от второго триместра до рождения ребенка. Эти критерии в дальнейшем можно использовать в клинической практике. Кроме того, в некоторых случаях новый метод помогает диагностировать врожденный порок развития головного мозга еще до рождения, что бывает затруднительно с использованием только традиционных методов МРТ.
Исследование поддержано Министерством образования и науки Российской Федерации (госзадание 18.2583.2017/4.6.), Российским научным фондом (проект № 19-75-20142) и Национальными институтами здравоохранения США (National Institutes of Health, NIH).
ОСНОВНОЙ БЕЛОК МИЕЛИНА. СТРОЕНИЕ, СВОЙСТВА, ФУНКЦИИ, РОЛЬ В ДИАГНОСТИКЕ ДЕМИЕЛИНИЗИРУЮЩИХ ЗАБОЛЕВАНИЙ
Ключевые слова: основной белок миелина, онтогенез, рассеянный склероз, гидроцефалия, опухоли головного мозга, демиелинизирующие заболевания.
ВВЕДЕНИЕ. Молекулярная организация миелина. Основная информация о структуре миелина получена с помощью рентгено-структурного анализа и электронной микроскопии [1–10]. Уникальной морфологической особенностью миелина является то, что он формируется в результате спирального обвития отростков олигодендроглиоцитов в центральной нервной системе и шванновских клеток на периферии, вокруг аксонов нейронов [2, 7, 10–13]. Таким образом, миелин представляет собой своеобразную мембрану, состоящую из липидного бислоя и белков, связанных с ним. В образовании миелиновой оболочки и структуре миелина ЦНС и периферической нервной системы (ПНС) имеются отличия. При формировании миелина ЦНС один олигодендроглиоцит имеет связи с несколькими сегментами миелина нескольких аксонов; при этом к аксону примыкает отросток олигодендроглиоцита, расположенного на некотором расстоянии от аксона, а внешняя поверхность миелина соприкасается с внеклеточным пространством. Шванновская клетка при образовании миелина ПНС формирует спиральные пластинки миелина и отвечает лишь за отдельный участок миелиновой оболочки между перехватами Ранвье. Цитоплазма шванновской клетки вытесняется из пространства между спиральными витками и остается только на внутренней и наружной поверхностях миелиновой оболочки [2, 12].
Среди белков миелина выделяют так называемые внутренние (intrinsic) и внешние (extrinsic) белки [14]. Первые прочно связаны с мембраной, проходя сквозь нее, в то время как другие, расположенные поверхностно, связаны слабее. Подобная мембрана является асимметричной по химическому составу и электрическому заряду. Ее экстрацеллюлярная поверхность богата углеводными остатками гликопротеинов и гликолипидов, при этом С-конец гликопротеинов находится на цитоплазматической стороне мембраны, тогда как полисахаридный остаток экспонирован на экстрацеллюлярной поверхности. Расстояние между разнонаправленными гидрофильными группировками липидов в мембране миелина составляет 4,5-5,0 нм, в то время как расстояние между соседними витками спирали - 3,0-5,0 нм. Толщина мультиламеллярного образования, сформированного исключительно липидами, составляет 1,5-3,0 нм [2, 14–16].
Процесс формирования миелина отростками глиальных клеток сопровож-дается вытеснением цитоплазмы таким образом, что цитоплазматические поверх-ности мембраны плотно соприкасаются друг с другом, образуя так называемую главную плотную линию (major dense line). Плотный контакт наружных поверхностей мембран, образующихся при спиралевидном обвитии отростков миелинобразующих клеток вокруг аксонов нейронов, способствует формирова-нию, так называемой межпромежуточной линии (interperiod line) [2, 12]
Одной из биохимических характеристик, которая отличает миелин от других биологических мембран, является высокое соотношение липид/белок. Белки составляют от 25 до 30% массы сухого вещества миелиновой оболочки. На долю липидов приходится приблизительно 70-75% от сухой массы белого вещества ЦНС млекопитающих; в миелине спинного мозга соотношение липиды:белки выше [12, 15]. Из общего количества липидов на долю холестерола приходится около 28%, 43% – на фосфолипиды и 29% составляют галактолипиды. Известно, что липиды оказывают существенное влияние на конформационные характеристики белков, входящих в состав мембраны миелина; последние в свою очередь влияют на свойства липидов [2, 12].
Основной функцией миелина является быстрое проведение нервного импульса по аксонам, которые он окружает. Мембраны клеток, формирующих миелин, плотно соприкасаются, что обеспечивает высокое сопротивление и малую емкость, обеспечивая, таким образом, аксону эффективную изоляцию и предотвращая продольное распространение импульса. Миелин прерывается только в области перехватов Ранвье, которые встречаются через правильные промежутки длинной примерно 1 мм. В связи с тем, что ионные токи не могут проходить сквозь миелин, вход и выход ионов осуществляется лишь в области перехватов. Это ведет к увеличению скорости проведения нервного импульса. Таким образом, по миелинизированным волокнам импульс проводится приблизительно в 5-10 раз быстрее, чем по немиелинизированным [2, 12].
Помимо передачи нервного импульса, миелин участвует в питании нервного волокна, а также выполняет структурную и защитную функции
Основной белок миелина
С детства мы слышим, что нервные клетки не восстанавливаются. И хотя вопрос о возможности образования новых нейронов во взрослом мозге до сих пор открыт, уже есть данные, что процесс нейрогенеза у человека продолжается до глубокой старости. Любые нарушения в развитии нервных клеток могут приводить к серьезным, иногда необратимым патологиям. Одним из таких нарушений являются дефекты в защитной изоляционной оболочке (миелине) отростков нервных клеток, которые могут формироваться у человека еще до его рождения. Их практически невозможно диагностировать с помощью традиционных методов визуализации
В мозге человека в среднем содержится около 100 млрд нейронов, которые принимают, хранят, обрабатывают и передают информацию с помощью электрических и химических сигналов. Взаимодействие между нейроном и другими нервными клетками и органами происходит с помощью коротких (дендриты) и длинного (аксон) отростков.
Все повреждения миелиновой оболочки или дефекты, возникшие в период ее формирования, приводят к серьезным, иногда неизлечимым заболеваниям. Среди них наиболее известен рассеянный склероз – хроническое аутоиммунное заболевание, поражающее преимущественно молодых людей.
Развитие мозга плода – сложный процесс, при котором происходят быстрые перестройки морфологии и микроструктуры нервной ткани. В некоторых зонах мозга процесс формирования миелина начинается уже с 18—20-й недели беременности, а продолжается приблизительно до десятилетнего возраста.
Но как выявить дефекты миелина в период внутриутробного развития? В настоящее время акушеры-гинекологи пользуются только биометрическими показателями (например, размером мозга), однако они обладают высокой изменчивостью и не дают полной картины. В педиатрии даже при наличии явных функциональных отклонений в мозговой деятельности ребенка традиционные изображения МРТ или нейросонографии (ультразвукового исследования головного мозга новорожденных) часто не показывают структурные отклонения.
Поэтому поиск точных количественных критериев оценки формирования миелина во время беременности является актуальной задачей, которую к тому же нужно решить с помощью неинзвазивных диагностических методов, уже апробированных в акушерстве. Специалисты из новосибирского Международного томографического центра СО РАН предложили использовать для этих целей новый метод количественной нейровизуализации, уже адаптированный для дородовых (пренатальных) исследований.
На обычном томографе
Любая патология головного мозга плода, которую подозревают врачи во время ультразвукового обследования беременной, обычно является показанием к проведению МРТ; подобные исследования проводятся в МТЦ СО РАН уже более десяти лет. Результаты МРТ могут подтвердить, уточнить, опровергнуть либо вообще изменить предварительный диагноз и, соответственно, тактику ведения беременности.
Именно таким оказался метод быстрого картирования макромолекулярной протонной фракции (МПФ) – биофизического параметра, который описывает долю протонов в макромолекулах тканей, вовлеченных в формирование МРТ-сигнала, тогда как обычно источником сигнала являются протоны, содержащиеся в воде (Yarnykh, 2012; Yarnykh et al., 2015).
В основе метода лежит специализированная процедура математической обработки МРТ-изображений, которая позволяет вычленить компоненты сигнала, связанные с МПФ клеточных мембран. А в головном мозге человека и животных основная их часть содержится именно в миелине. Реконструируются карты МПФ на основе исходных данных, которые могут быть получены практически на любом клиническом томографе.
Для реконструкции карт МПФ используются четыре исходных изображения, полученные различными традиционными методами МРТ. Правильность такого подхода подтвердили результаты его апробации на лабораторных животных в Томском государственном университете: у мышей, которым вводили раствор, вызывающий разрушение миелина, результаты МПФ-картирования совпали с данными гистологического исследования тканей (Khodanovich et al., 2017).
Миелин – в норме и патологии
Пилотные исследования, выполненные в рамках клинических диагностических МРТ-обследований эмбрионов возрастом от 20 недель и старше, показали, что новая технология позволяет за небольшое (менее 5 мин.) время сканирования выявить очень малые количества миелина.
Кроме того, оказалось, что изображения, полученные с помощью новой технологии, являются наиболее информативными для внутриутробной диагностики одного из видов медуллобластомы – врожденной злокачественной опухоли мозжечка. У плода опухоль не удалось отчетливо выявить с помощью традиционного МРТ-обследования, однако она хорошо прослеживалась с использованием количественного метода МПФ.
Дело в том, что у плода показатель МПФ для ткани медуллобластомы вдвое выше значений для окружающей здоровой ткани из-за более высокого содержания в опухоли фибриллярного белка коллагена соединительной ткани, которая широко представлена в этом виде опухоли. После рождения и до полутора лет эти различия сглаживались из-за нарастающей миелинизации мозжечка, в то время как значения МПФ в опухоли оставались практически неизменными.
Эти результаты говорят о том, что диагностическая значимость метода МПФ наиболее высока именно во внутриутробном периоде. И это очень важно, так как после рождения ребенка арсенал МРТ (в том числе с использованием контрастирующих средств), который позволяет визуализировать все детали злокачественного поражения, значительно расширяется (Korostyshevskaya, Savelov, Papusha et al., 2018).
В течение последнего десятилетия для изучения внутриутробного периода созревания мозга использовались различные количественные методы МРТ. Но оказалось, что среди всех известных на сегодня методов наиболее чувствительным к содержанию миелина в мозге взрослого человека и плода оказался метод картирования МПФ.
С его помощью новосибирским специалистам впервые удалось разработать количественные критерии нормальной внутриутробной миелинизации, на основании которых можно оценить своевременность формирования внутренней структуры мозга от второго триместра до рождения ребенка. Эти критерии в дальнейшем можно использовать в клинической практике. Кроме того, в некоторых случаях новый метод помогает диагностировать врожденный порок развития головного мозга еще до рождения, что бывает затруднительно с использованием только традиционных методов МРТ.
Коростышевская А. М., Савелов А. А., Цыденова Д. В и др. Количественный анализ структурной зрелости головного мозга плода по данным диффузионно-взвешенной МРТ // Вест. Новосиб. гос. ун-та. Серия: Биология, клиническая медицина. 2015. Т. 13. № 4. С. 27–32.
Korostyshevskaya A. M., Prihod’ko I. Y., Savelov A. A. et al. Direct comparison between apparent diffusion coefficient and macromolecular proton fraction as quantitative biomarkers of the human fetal brain maturation // J. Magn. Reson. Imaging. 2019. N. 50. P. 52–61. DOI: 10.1002/jmri.26635
Korostyshevskaya A. M., Savelov A. A., Papusha L. I. et al. Congenital medulloblastoma: fetal and postnatal longitudinal observation with quantitative MRI // Clinical imaging. 2018. N. 52. P. 172–176.
Yarnykh V., Korostyshevskaya A. Implementation of fast macromolecular proton fraction mapping on 1.5 and 3 Tesla clinical MRI scanners: preliminary experience // J. Phys.: Conf. Ser. 2017. V. 886. P. 1–5.
Yarnykh V. L., Savelov A., Prihod’ko I. Y. et al. Quantitative assessment of normal fetal brain myelination using fast macromolecular proton fraction mapping // Am. J. of Neuroradiology. 2018. V. 39(7). P. 1341–1348.
Исследование поддержано Министерством образования и науки Российской Федерации (госзадание 18.2583.2017/4.6.), Российским научным фондом (проект № 19-75-20142) и Национальными институтами здравоохранения США (National Institutes of Health, NIH)

Статья
Миелинизация в норме
Функция и структура миелина
Перед обсуждением процессов нормальной миелинизации в головном мозге человека необходимо понимать строение миелина и его функции в центральной нервной системе. Миелин имеется и в центральной, и в периферической нервных системах. В ЦНС он находится преимущественно в белом веществе (хотя некоторые его количества имеются и в сером), как раз придавая ему такой цвет. Миелин работает по типу электрического изолятора: скорость проведения потенциала действия возрастает в 10-100 раз по сравнению с немиелинизированными волокнами. Юлия Эдгар и Джессика Гарберн (2004) показали, что отсутствие главного белка миелина (PLP/DM20) в олигодендроцитах приводит к серьезным нарушениям аксонального транспорта у мышей с моделью наследственной спастической параплегией. Также было выяснено, что миелин, вероятно, играет роль в регуляции как состава ионов, так и объема жидкости вокруг аксона.
Миелинизация – процесс образования билипидного миелинового слоя вокруг аксона. Данный процесс обеспечивает в дальнейшем быструю передачу информации, необходимую для когнитивной, поведенческой, эмоциональной функций. Миелинизация начинается во время эмбрионального периода и продолжается после рождения.
Миелин является модифицированным расширением отростков олигодендроглиальных клеток. Олигодендроцит является ключевой клеткой в миелинизации ЦНС и является преобладающим типом нейроглии в белом веществе. Миелиновая оболочка состоит из множественных сегментов миелина, которые обвиваются вокруг аксона. Данная оболочка способна проводить потенциал действия с его увеличением по аксону благодаря перехватам Ранвье, которые представляют собой немиелинизированные участки, содержащие натриевые ионные каналы – они и ответственны за ускорение проведения ПД по аксону. Миелин также находится в некотором симбиозе с аксоном. Миелин участвует в метаболических превращениях своих компонентов и содержит большое количество миелиновых ферментов. Миелин также играет роль в переносе ионов, что способствует буферизации ионов вокруг аксона.
Один олигодендроцит может обеспечивать миелиновой оболочкой до 40 волокон. Миелин примерно на 70% состоит из липидного компонента и на 30% – из белкового. Основной белок миелина (MBP) составляет 30% от всей белковой фракции, протеолипидный белок (PLP) – 50%, а фосфодиэстеразы циклических нуклеотидов – 4%. Липиды миелина в своем составе содержат холестерол, фосфолипиды, гликосфинголипиды.
Миелин и МРТ
Не существует МРТ методики или технологии, которая могла бы визуализировать напрямую миелиновый бислой. Миелин оценивается качественно на основании Т1- и Т2-ВИ, МР-спектроскопии, диффузно-тензорной визуализации (DTI). В клинической практике традиционная анатомическая визуализация является основой из-за своей легкости выполнения. Количественная оценка миелина может быть получена в многокомпонентном релаксационном (MCR или multicomponent relaxation) анализе. MCR-анализ – это объемно-взвешенное суммирование микроскопических компартментов воды. С помощью этого метода определяются два домена воды: медленно-релаксирующий домен, включающий свободную внутри- и внеклеточную воду, и быстро-релаксирующий домен, включающий в себя воду, заключенную в липидном бислое миелина.
На данный момент стандартные МРТ-последовательности не способны специфично подсчитывать количество миелина. Они позволяют оценить изменения в плотности и размерах аксонов, изменения в мембранной структуре, а именно содержание белков, липидов и воды. DTI – ненадежный показатель общего количества миелина, но все же дает информацию о его возможных изменениях.
Джеймс Баркович выделяет две отдельные популяции молекул воды, которые играют главную роль в формировании сигнала от миелина на МРТ – это те молекулы, которые находятся в миелиновой оболочке, и молекулы, находящиеся вне ее. На анатомических изображениях миелин имеет гиперинтенсивный сигнал по отношению к серому веществу на Т1- и гипоинтенсивный на Т2-ВИ. На Т1-ВИ гиперинтенсивность относительно коры определяется вероятнее всего наличием большого количества гликолипидов (особенно галактоцереброзидов) и холестерола в миелиновой оболочке. На Т2-ВИ гипоинтенсивность обусловлена уменьшенным содержанием воды.
Читайте также:

