Молекулы карлики и молекулы гиганты реферат
Обновлено: 02.07.2024
Металл, дерево, камень и стекло — вот материалы, из которых еще недавно было сделано подавляющее большинство предметов, окружавших человека. Сейчас к этим материалам прибавился еще один—пластмасса. Из пластмассы делают посуду, изготовляют паркет, облицовывают стены; из пластмассы выполняют детали машин, делают кузова автомобилей. Пластмасса ведет решительное наступление на старые материалы, успешно вытесняя их из самых различных областей жизни и техники.
Не меньшие изменения происходят в отношении материалов, идущих на изготовление одежды. До последнего времени одежда изготовлялась исключительно из естественных материалов — кожи и шерсти животных, а также из растений. Сейчас мы видим, как появляются все новые и новые изделия из искусственного волокна, знакомые всем под названиями— капрон, нейлон, перлон. Вслед за дамскими чулками последовало белье, появились костюмы, пальто, шубы…
Из искусственных материалов изготовляется и значительная часть обуви. Процесс вытеснения старых материалов новыми только начался. Но уже для всех бесспорно, что будущее принадлежит искусственному волокну.
Пластмассы и волокна построены из молекул-гигантов, содержащих сотни тысяч атомов. Размеры таких молекул весьма велики, и их можно видеть с помощью электронного микроскопа. Волокна построены из молекул, атомы которых вытянуты в цепочки.
Большей частью молекула состоит из регулярно повторяющихся групп атомов. Если вытянуть такую молекулу в линию — обнаружится строгий порядок следования групп атомов. Порядок этот такого же типа, как в ряду атомов, образующих кристалл. Длина такой молекулы может достигать огромной (для атомного мира) величины — десятков и сотен тысяч ангстрем (т. е. доходить до сотых долей миллиметра).
Волокно состоит, из пачек таких длинных молекул. Пачки расположены в основном вдоль оси волокна, они переплетены между собой наподобие ниточек веревки. Молекулы, составляющие пачку, могут выстроиться в весьма строгом порядке. Но обычно этот порядок не поддерживается вдоль всей длины пачки.
Область строгой боковой укладки сменяется областью, в которой молекулы хотя и располагаются параллельно, но повернуты беспорядочно по отношению друг к другу. Области беспорядка и порядка могут многократно сменять друг друга. Многие пластмассы построены не из линейных, а из разветвленных молекул.
Каждая молекула — это сложное дерево, состоящее из огромного числа ветвей. Молекулы перепутаны между собой, как деревья в сваленном лесу. По своему строению пластмассы представляют типичный пример беспорядка в расположении атомов.
Sorry, this entry is only available in
Російська
На жаль, цей запис доступний тільки на
Російська.
К сожалению, эта запись доступна только на
Російська.
Оказалось, что не всякое химическое соединение может быть связующей основой для получения пластмасс. Эту роль могут выполнять вещества только одного определённого типа. Характерным для этих веществ являются огромные размеры их молекул. Поэтому их называют высокомолекулярными веществами. Таковы органические соединения: клетчатка, или целлюлоза (основная составная часть древесины) и многие её эфиры, получаемые при химической переработке клетчатки; таковы белковые вещества, природный и синтетический (искусственный) каучук, различные природные и синтетические смолы.
Молекулы большинства органических соединений — сахара, красителей, спиртов, кислот и т. д.— имеют очень малые размеры и содержат небольшое число атомов. Это — молекулы-карлики. В большинстве случаев такие соединения легко растворяются в соответствующих растворителях. Если такое низкомолекулярное соединение жидкое, то при нагревании оно превращается в пар; твёрдое при нагревании расплавляется, а при охлаждении горячих и насыщенных растворов эти вещества выпадают в виде кристаликов определённой формы. Так, мы знаем, что такие жидкости, как винный спирт, скипидар, уксусная кислота, керосин, бензин легко превращаются в пар при нагревании. Сахар, стеариновая кислота, уротропин и другие твёрдые вещества при нагревании расплавляются. Если растворить сахар или поваренную соль в воде при нагревании до полного насыщения, то при охлаждении полученного раствора выпадают кристалики сахара или соли.
Все эти свойства твёрдых и жидких низкомолекулярных органических соединений обусловлены малыми размерами их молекул, благодаря чему сила сцепления между отдельными молекулами очень слаба. При повышении температуры движение молекул жидкости усиливается и они легко отделяются друг от друга, образуя пар. В подходящем растворителе молекулы жидкого или твёрдого низкомолекулярного вещества также легко отделяются друг от друга и равномерно распределяются между молекулами растворителя.
Благодаря слабой связи между отдельными молекулами низкомолекулярные органические вещества не могут служить связующей основой при изготовлении пластмасс.
Иную природу имеют молекулы высокомолекулярных веществ — клетчатки, белков, синтетических смол и др. Они состоят, как правило, из тысяч, а иногда и десятков тысяч атомов, прочно связанных между собой. Это — молекулы-гиганты.
На рисунке 3 схематически представлена картина распределения маленьких и больших молекул в растворе. На левом рисунке мы видим, что большое число маленьких молекул совершенно свободно размещается в растворителе. Поэтому растворы низкомолекулярных веществ (например, раствор сахара в воде) обладают почти такой же подвижностью, как и чистый растворитель. Из правого же рисунка видно, что сравнительно небольшое число больших, длинных молекул (раствор желатины в воде или раствор каучука в бензине) при своём движении могут легко зацепиться друг за друга. Поэтому резиновый или столярный клей обладают очень малой подвижностью или, как принято говорить,— высокой вязкостью.

Распределение молекул низкомолекулярных и высокомолекулярных веществ в растворах
При упаривании растворов высокомолекулярных веществ на дне чашки остаётся твёрдый остаток в виде плотной смолы (например, при упаривании столярного клея или киселя). При охлаждении горячих насыщенных растворов высокомолекулярных веществ кристаллического осадка не получается: выпавший осадок представляет собой или студнеобразную массу или мелкий некристаллический порошок.
При нагревании твёрдые высокомолекулярные соединения размягчаются постепенно и лишь некоторые из них превращаются в жидкость.
Все эти свойства высокомолекулярных веществ являются следствием больших размеров их молекул.
Сила сцепления между большими молекулами очень велика, они прочно связаны между собой. Поэтому большинство высокомолекулярных веществ является хорошей связующей основой при изготовлении пластмасс.
Конечно, свойства того или иного материала зависят не только от величины молекулы, но также и от формы молекул и от химической природы самого вещества. Поэтому разные высокомолекулярные вещества обладают различными механическими свойствами, и не всякое высокомолекулярное соединение имеет одинаковую ценность в качестве связующей основы при изготовлении пластмасс.
Современная наука имеет достаточно ясное представление о химическом составе, строении и форме молекул различных высокомолекулярных веществ, а также о влиянии химического состава и строения молекулы на механические свойства вещества.
Установлено, что молекулы большинства высокомолекулярных веществ (клетчатка, каучук, хлорвиниловая смола и др.) имеют цепеобразное строение. Такие молекулы называют линейными молекулами. Если молекулу низкомолекулярного органического соединения сравнить с одним звеном цепи, то линейную молекулу высокомолекулярного вещества можно сравнить с длинной цепочкой, состоящей из сотен звеньев.
Для наглядности на рисунке 4 показан принцип построения низкомолекулярных веществ (а) и высокомолекулярного соединения линейного строения (б).

Схема строения низкомолекулярного и высокомолекулярного вещества цепеобразного строения
Длина таких цепеобразных молекул может достигать очень большой величины — до 1/1000 доли миллиметра. Однако эти молекулы имеют очень малые размеры в поперечном сечении (порядка 1/1 000 000 доли миллиметра), поэтому их не удаётся разглядеть даже под самым сильным микроскопом.
Многие наблюдали, как буксирный пароход тянет за собой баржу. Несмотря на большое расстояние между пароходом и баржей, буксирного каната издали не видно. Он невидим из-за малого поперечного сечения. Подобную картину мы наблюдаем и для больших цепеобразных молекул.
Если взять кусок какого-нибудь вещества, состоящего из длинных цепевидных молекул (например, кусок каучука), то в нём цепеобразные молекулы различной формы переплетены между собой и имеют очень много точек соприкосновения. Вследствие этого между молекулами существует очень большая взаимная связь, и требуется значительное усилие, чтобы отделить их друг от друга. Такой кусок каучука можно сравнить с войлоком, где отдельные волокна шерсти переплетены, и, вследствие силы трения между ними в точках их соприкосновения, превратить войлок в шерсть трудно.
Могут быть и такие случаи, когда отдельные линейные молекулы не переплетены, а расположены параллельно друг другу и плотно соприкасаются друг с другом. Такое строение имеют, например, волокна льна и других волокнистых материалов (рис. 5).

Схема строения волокнистого материала
Между параллельно расположенными длинными молекулами волокнистых материалов существует огромная сила сцепления, так как они плотно соприкасаются друг с другом по всей длине молекулы. Поэтому волокнистые материалы обладают высокой прочностью. Например, для разрыва волокна льна необходимо приложить силу свыше 100 килограммов на квадратный миллиметр его сечения (напомним, что для разрыва стальной проволоки необходимо приложить силу от 80-ти до 160-ти килограммов на квадратный миллиметр сечения).
На рисунке 6 показана схема построения трёхмерной молекулы, на которой пунктирными звеньями изображены мостики между отдельными цепеобразными молекулами. Разделение такой громадной трёхмерной молекулы на отдельные цепочки без разрыва химических связей невозможно. Поэтому такие вещества при нагревании не плавятся, а подвергаются разложению; не растворяются в растворителях, а только набухают.

Строение трехмерной молекулы
Из природных продуктов примером такого вещества может служить кожа.
Механические свойства веществ, состоящих из больших цепеобразных молекул, при превращении их в вещества с трёхмерными молекулами, сильно изменяются: повышается прочность, стойкость к высоким и низким температурам и т. п.
При вулканизации смеси каучука, содержащей около 1—2% серы, получается мягкий эластичный продукт — резина. При вулканизации с 30—35% серы образуется твёрдая упругая пластмасса — эбонит. Как известно, резина и эбонит имеют совершенно другие свойства, чем сырой каучук.
Изменение свойств при переходе линейных молекул в трёхмерные можно проследить на многих других примерах, которые часто встречаются в практике приготовления пластмасс. Так, при взаимодействии фенола с формальдегидом вначале получаются смолы, имеющие цепеобразноестроение молекул. Они нестойки к действию воды, отличаются плавкостью и хорошей растворимостью во многих растворителях (их растворы известны под названием бакелитовых лаков). Но при дальнейшем нагревании этих смол происходит химическое взаимодействие между отдельными линейными молекулами и образуется нерастворимый и неплавкий продукт, стойкий к действию воды и других растворителей.
Способностью многих высокомолекулярных соединений образовывать трёхмерные молекулы широко пользуются в промышленности пластмасс. Процесс получения пластмасс делится на две стадии. Первую ступень процесса ведут до образования высокомолекулярных веществ цепеобразного типа, которые ещё сохраняют способность растворяться и плавиться при нагревании. В дальнейшем к полученному соединению (смоле) прибавляют соответствующие пластификаторы, наполнители, и в некоторых случаях и химические вещества, способные связывать отдельные цепи между собой. При быстром нагревании такой смеси под высоким давлением в специальных прессформах образуется готовое изделие из пластмассы; последняя уже является нерастворимой, неплавкой и обладает высокой прочностью.
Имеется ещё один тип высокомолекулярных веществ, которые отличаются тем, что молекулы их имеют вид сильно разветвлённого кустика (рис. 7). К веществам такого типа относится крахмал, который, как известно, содержится в клубнях картофеля, а также в корнях, плодах и зёрнах многих растений. Вещества такого строения являются плохими связующими материалами при получении пластмасс, так как между отдельными кустообразными молекулами сравнительно мало точек соприкосновения, и связь между ними получается слабой.

Строение кустообразной разветвленной молекулы
Необходимо указать, что резкой грани между низкомолекулярными и высокомолекулярными соединениями нет. Имеются соединения и промежуточного типа, которые можно отнести как к тому, так и к другому типу. С другой стороны, эти две группы соединений могут переходить друг в друга. При расщеплении или разложении высокомолекулярных веществ образуются низкомолекулярные. Например, при сухой перегонке каучука образуются низкомолекулярные соединения (изопрен, дипентон и другие). Установлено также, что при нагревании многих синтетических смол без доступа воздуха они превращаются в низкомолекулярные вещества, из которых они были получены.
Некоторые виды высокомолекулярных веществ расщепляются при нагревании их с водными растворами кислот и щелочей. Этот процесс носит название гидролиза.
Академик Н. Д. Зелинский показал, что при гидролизе природных белковых веществ в присутствии кислот под высоким давлением и при высокой температуре образуются различные простейшие соединения (например, аминокислоты). Таким образом сложнейшее высокомолекулярное соединение, каким является белковое вещество живой клетки, состоит из сотен и тысяч аминокислот и их продуктов превращения, соединённых между собой в большие молекулы.
Такие высокомолекулярные природные продукты, как крахмал и клетчатка, при действии на них водных растворов кислот, также подвергаются гидролизу; при этом образуется простейшее вещество, называемое глюкозой, или виноградным сахаром, способное превращаться при брожении в спирт. Этой реакцией теперь широко пользуются в промышленности для получения винного спирта из древесины.
В противоположность реакциям расщепления имеются также реакции, приводящие к искусственному получению высокомолекулярных веществ из простейших низкомолекулярных соединений. Об этих реакциях, имеющих большое значение для промышленности пластмасс, о путях превращения простейших соединений в более сложные, а также об источниках сырья для получения молекул-гигантов, будет рассказано в следующих разделах нашей книжки.
Одним из основополагающих понятий современной науки является понятие молекулы. Его введение европейскими учеными в 1860 г. дало толчок к развитию не только химии и физики, но и других естественных наук.

Молекулой, в наиболее общем определении, называется частица, образованная из нескольких (двух или более) атомов, объединенных между собой ковалентными связями. Она не имеет электрического заряда, все электроны в её составе имеют пару.
Молекулы, несущие заряд, называются ионами, неспаренные электроны – радикалами. Качественный и количественный состав их стабилен. Количество ядер атомов, электронов и их взаимное расположение позволяют отличать молекулы разных веществ друг от друга.
Что такое молекула в физике
В физике этим понятием оперируют при изучении свойств разных сред (газы, жидкости) и твердых тел.

Также их свойствами объясняются явления диффузии, теплопроводности и вязкость веществ.
Что такое молекула в химии
Учение о молекулах для химической науки является одним из самых главных. Именно химические исследования дали важнейшие сведения о составе и свойствах этой мельчайшей единицы вещества.
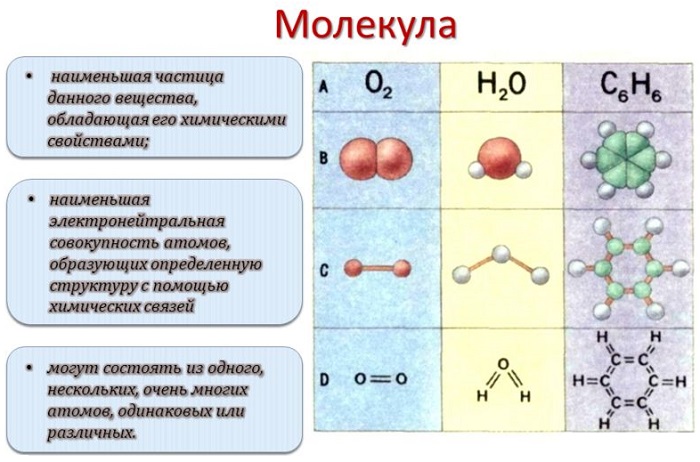
При прохождении химического превращения молекулы обмениваются атомами, распадаются. Поэтому знания о строении и состоянии этих частиц лежат в основе изучения химии веществ и их превращений.
На основании знаний о проходящей химической реакции можно предсказать строение молекул веществ, в ней участвующих. Противоположное заключение тоже будет верным: на основании сведений о строении молекулы вещества реально предсказать его поведение во время химической реакции.
Строение молекулы
Понятие о строении включает геометрическую структуру и распределение электронной плотности.
В качестве примера рассмотрим строение наименьшей частицы воды.
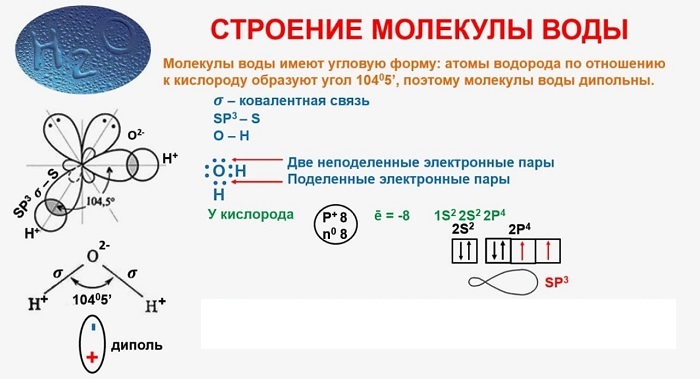
Существует несколько способов взаимодействия атомов. Основным способом являются химические связи, благодаря им поддерживается стабильное существование молекул. Прочие (неосновные) взаимодействия происходят между теми атомами, которые не связаны непосредственно.
Виды химической связи:
Металлическая - ядра атомов металлов, расположенные в узлах кристаллических решёток, объединены общим облаком электронов.
Водородная - основана на способности атома водорода образовывать дополнительную связь при смещении от него электронной плотности.
Ионная - имеет электрическую природу. Сильно поляризована. Возникает при притяжении ионов, несущих противоположный заряд.
Ковалентная - может быть полярной и неполярной. Образуется за счет пары электронов, совместно принадлежащей двум атомам. Отличается наибольшей устойчивостью и энергетической емкостью.
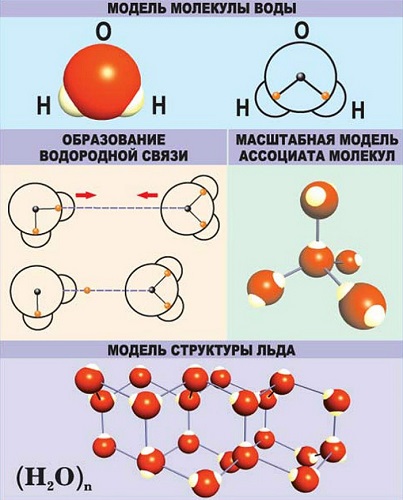
Связи характеризуются следующими показателями:
длина – степень удаления друг от друга ядер атомов, образовавших связь;
энергия – сила, прилагаемая для разрушения связи;
полярность – смещение электронного облака к одному из атомов;
порядок или кратность – количество пар электронов, образовавших связь.
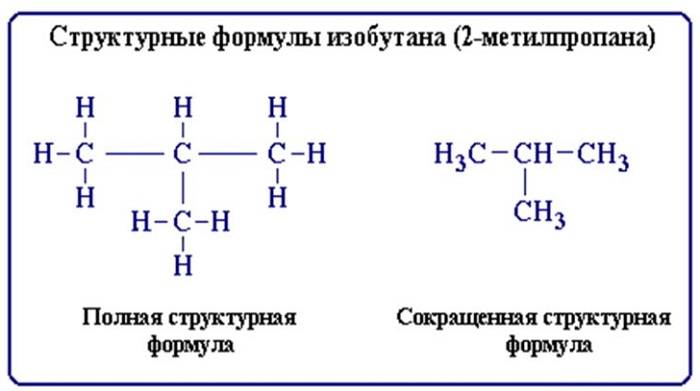
Строение молекул условно отражается структурными формулами. Основные взаимодействия атомов, при составлении таких формул, отображается черточками. В таких формулах связи образуют неразрывную цепь и иллюстрируют валентности образовавших их элементов (атомов).
Структурные формулы также отражают то, как выглядит молекула (линейная, циклическая, наличие радикалов и т. д.).
Строение частицы вещества активно изучается. Для этого используют различные экспериментальные и теоретические методы. К экспериментальным относят рентгеновский структурный анализ, спектроскопия, массспектрометрия и др. К теоретическим - расчётные методы квантовой химии.
Масса (размер) молекулы
В зависимости о количества ядер атомов, входящих в их состав, можно выделить молекулы двухатомные, трехатомные и т. д.

В том случае, если количество атомов велико, молекула носит название макромолекулы.
Путем сложения масс атомов, входящих в состав частицы, можно определить молекулярную массу. В зависимости от её величины, все вещества делят на высоко- и низкомолекулярные.
Свойства молекулы

Современная наука выделяет следующие свойства молекул:
Электрические - этими свойствами определяется то, как ведет себя вещество в электрическом поле. Атомы, входящие в состав молекулы, состоят, в свою очередь, из положительно заряженного ядра и электронов, несущих отрицательный заряд. Эти заряды внутри самой молекулы располагаются неравномерно, в связи с этим возникает так называемый дипольный момент и смещение электронной плотности в сторону одного из атомов.
Оптические - дают характеристику того, как ведет себя вещество в поле световой волны. К оптическим свойствам относят способность поляризовать свет, преломлять его и рассеивать.
Магнитные - объясняются распределением электронов в атомах.
диамагнитные - парных электронов нет;
парамагнитные - имеются непарные электроны.
Знания о свойствах и строении молекул являются основополагающими для развития теоретических и прикладных наук и играют важную роль в жизни человека.
Читайте также:

