Методы получения мембран липосомы реферат
Обновлено: 05.07.2024
Разработан универсальный липосомальный контейнер для инкапсулирования различных фармацевтических внутривенных препаратов на основе нанофосфолипидной системы. Результаты представленных исследований могут быть использованы как в научных экспериментах, так и при освоении технологии получения новых липосомальных форм лекарств.
Ключевые слова: фосфолипиды сои, липосомы, наночастицы, альфа-токоферол.
Как известно, мембраны играют главную роль в системе биологической коммуникации, благодаря специфическим рецепторам, воспринимающим внешние стимулы. Фосфолипиды – основной класс мембранных липидов. Фосфатидилхолин (ФХ), максимально представленный в мембранах различных клеток тканей (35-50% от всех ФЛ), фосфатидилинозит (ФИ), относящийся к минорным метаболически значимым ФЛ, и мажорный, структурирующий мембраны фосфатидилэтаноламин (ФЭА), участвуют во многих процессах жизнедеятельности клетки. Природные ФЛ обычно отличаются высокой физиологической толерантностью и легко метаболизируются. Чтобы проследить путь экзогенных ФЛ, введенных в организм, проведены исследования с использованием радиоактивных изотопов. Для этой цели чаще всего использовали высокоочищенные ФХ и ФИ, выделенные из фосфолипидной смеси соевых бобов. Установлено, что у крыс, собак и человека из кишечника в течение суток всасывается 90% поступившего ФХ. Максимальная концентрация его в крови обнаруживается уже через 6 часов после поступления в организм. Аналогично метаболизируется и ФИ [1]. При применении препаратов из природных, высококонцентрированных фосфолипидов, полученных из генетически немодифицированных бобов сои, содержащих более 75% ненасыщенных жирных кислот, было установлено снижение активности ферментов крови (АлАТ, АсАТ) и величины показателей пигментного обмена, улучшение УЗИ-структуры паренхимы печени. Пациенты отмечали исчезновение дискомфорта в правом подреберье, улучшение переносимости жирной пищи [2].
В основе дезинтоксикационного и антирадиационного эффектов препаратов такого механизма действия лежит свойство полиненасыщенных жирных кислот, входящих в состав фосфолипидов, связывать токсины и активные химические радикалы. Фосфолипиды являются важным компонентом неферментативной антиоксидантной защиты природных липидов.
В настоящее время в отечественной и зарубежной литературе большое внимание уделяется разработке фосфолипидных транспортных систем. Фосфолипидные наночастицы (мицеллы/липосомы) имеют ряд преимуществ перед другими, например, полимерными наночастицами. Они нетоксичны, биодеградируемы, не вызывают аллергических реакций, благодаря своему строению и составу, имеют высокое сродство к мембранам клеток, что позволяет доставлять лекарство внутрь клетки. В настоящее время в мире существует 10-15 сертифицированных наносис- тем, используемых в качестве переносчиков лекарств, а на фармацевтическом рынке – несколько десятков, в основном, противоопухолевых препаратов, снабженных фосфолипидной системой транспорта (липосомы). Большинство препаратов находятся на последних стадиях клинических испытаний.
Одним из многообещающих направлений в развитии фармакологии являются нанотехнологии. На смену технологическим процессам с применением микрочастиц (препараты жировых эмульсий) пришли технологии, позволяющие работать с нано- частицами. Свойства таких частиц дают возможность создать нанокомпозиции, способные коренным образом изменить диагностику и лечение многих заболеваний [3].
В практическом аспекте нанотехнологии – это технологии, которые манипулируют единичными объектами размером не более 100 нм и используют их уникальные свойства, возникающие вследствие того, что в наночастицах, благодаря их малым размерам, существенно изменяются физико-химические свойства вещества. В области медицины возможности нанотехнологий нацелены на управление с помощью наноматериалов и наночастиц физическими, химическими и биологическими процессами, протекающими в живых организмах на молекулярном уровне [4].
Основное фармакологическое применение существующих в настоящее время наночастиц состоит в использовании их как носителей лекарственных веществ (ЛВ). Такие частицы могут облегчать всасывание и прохождение их через биологические мембраны, защищать от метаболизма, улучшать профиль тканевого распределения и усиливать проницаемость в клетку. Вследствие этого существенно повышается безопасность применения лекарств, уменьшаются их токсичность и риск развития побочных эффектов [5].
Несмотря на общее название, наночастицы существенно различаются по размеру, форме и составу входящих в них веществ. По форме они могут иметь вид шара, сферы, трубки, мицеллы и др. Преимущественно наночастицы – это сложные много- компонентные структуры, порой имеющие несколько слоев, различных по физико-химическим свойствам.
Наиболее изученными, с нашей точки зрения, наночастицами являются липосомы – наносферы водной субстанции, заключенные в фосфолипидную оболочку, размер их может варьироваться от нескольких десятков нанометров до десятка микрометров. Толщина липидного бислоя определяется, прежде всего, длиной углеводородных цепей и равна приблизительно 4–5 нм. Расстояние между бислоями 2–3 нм и может возрастать до 20 нм в зависимости от величины заряда бислоя. Липосомы являются уникальными носителями лекарств, поскольку обеспечивают не только направленную доставку, но и регуляцию скорости высвобождения лекарства в месте патологического процесса. Искусственные мембраны, построенные на основе липидного бислоя, позволяют воспроизвести в модельных системах (липосомах) многие функции и характеристики биологических мембран. Способность липосом включать в себя вещества различной химической природы без каких-либо ограничений даёт поистине уникальные возможности для решения некоторых медицинских проблем. Включение лекарственных веществ (ЛВ) в липосомы может значительно повысить их терапевтическую эффективность, поскольку, с одной стороны, препарат, находящийся в липосоме, защищен её мембраной от действия неблагоприятных факторов, а с другой – та же мембрана не позволяет токсичному препарату превысить допустимую концентрацию в биологических жидкостях организма. Липосома в данном случае выполняет роль хранилища, из которого ЛВ высвобождается постепенно, в нужных дозах в течение требуемого промежутка времени [6, 7, 8].
Свойства липосом в большой степени определяются химическим составом липидного бислоя. Рядом авторов было показано, что включение в состав липидного бислоя липосом анионных ФЛ (фосфатидилэтаноламина, инозит-фосфатида) увеличивает стабильность липосомальной везикулы. Введение отрицательно заряженного компонента придаёт мембране отрицательный заряд, предотвращающий агрегирование везикул и их прилипание к стенкам сосудов.
Так, в работе М.В. Жуковой с соавторами [9, 10], посвященной инкапсулированию доксорубицина в липосомы, для формирования липосомальных везикул использовался отрицательно заряженный фосфатидилэтаноламин (ФЭА) в сочетании с антиоксидантной составляющей – α-токоферолом. Липидный бислой содержит ФХ, ФЭА и α-токоферол в высоком соотношении 60:40:1. Применение такого состава является примером того, что фосфолипиды являясь благоприятным субстратом окисления, в то же время участвуют в синергическом увеличении эффективности действия токоферола. Таким образом, профилактика повреждения мембран и дезактивация процесса свободнорадикального окисления может быть обеспечена с помощью композиции фосфолипидов и полифенолов (α-токоферол).
Показано, что степень синергизма зависит не только от соотношения ФЛ и полифенолов, но и от относительной доли ФХ и ФЭА в ФЛ-комплексе. Хотелось бы отметить, что ФХ получали из лецитина соевых бобов Epikuron 200 (Lucas Meyer, США), содержащего 92% ФХ. Этими же авторами показано, как измерение состава бислоя липосом влияет на их свойства.
Многие авторы предпочитают в качестве составляющей бислоя использовать не соевый, а яичный ФХ. Так, в работе сотрудников института биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН [11], в составе бислоя ЛС используется яичный ФХ и ФИ в соотношении (8:1) моль. Показана большая эффективность липосомальной формы диглицеридного производного метотрексата по сравнению с исходным лекарством, в том числе пониженная системная токсичность, а также преодоление явления множественной лекарственной устойчивости. Следует отметить, что в последние годы предпочтение всё же отдается ФЛ, выделенным из соевого сырья. Вышеприведенные немногочисленные примеры свидетельствуют о том, что важным условием сохранения стабильности липосомальной субстанции является наличие в составе липосом антиоксиданта α-токоферола (α-ТФ). Способность α-токоферола растворяться только в жирах и органических растворителях затрудняет его доступ в клетку. Решающим фактором доставки α-ТФ в клетку через её мембрану является включение его в бислои липосом. В литературе [12] описан способ получения липосомальной формы α-ТФ, который позволяет получать липосомы с высокой биологической активностью и стабильностью при хранении. Проведение циклической гомогенизации обеспечивает получение липосомального размера 50-400 нм. Заданное значение размера липосом достигается путём выбора давления и количества циклов гомогенизации. Соотношение α-ТФ и фосфолипидов составляет 1:6 по массе соответственно. Полученный препарат может быть использован в медицинской промышленности, в ветеринарии в качестве кормовых добавок и инъекций животным, а также в косметической промышленности. Применение нескольких антиоксидантов в составе одного препарата имеет важные преимущества, но не лишено недостатков. Преимущества заключаются в том, что некоторые антиоксиданты, например, токоферол-аскорбиновая кислота могут усиливать действие друг друга. В то же время в зависимости от соотношения между ними возможно взаимное ослабление действия. Это было показано напримере пары токоферол-каротиноиды в модельных системах [13].
Мембранопротекторный эффект витамина Е связан с проявлением антиоксидантных свойств и с его участием в организации структуры мембран за счет прямого взаимодействия его боковой изодентальной цепи с полиненасыщенными жирными кислотами фосфолипидных мембран. Такое взаимодействие приводит к более плотной упаковке мембран митохондрий. Вследствие этого у них появляется повышенная устойчивость к действию процессов ПОЛ.
Дефицит α-ТФ сопровождается интенсификацией процессов ПОЛ, заключающейся в повышении концентрации малонового диальдегида и снижении активности ферментативного звена антиоксидантной защиты (супероксиддисмутазы и каталазы). Данные последних лет свидетельствуют, что реакции свободнорадикального окисления играют важную роль в патогенезе последствий экстремальных состояний. Использование антиоксидантных лекарственных средств в этих случаях представляется вполне оправданным.
В литературе большое количество работ посвящено α-ТФ, как важнейшему витамину и антиоксиданту [14]. Широко обсуждаются вопросы биологической роли, метаболизма, дефицита витамина Е (клиническое проявление гиповитаминоза Е), его потребность для организма. Подчеркивается широкий спектр действия этого активного вещества и необходимость применения его при различных патологиях. Особо хочется отметить, что витамин Е обладает онкопрофилактическими свойствами, поглощает радикалы, обезвреживает канцерогены, повышает защитную способность Т-лимфоцитов, смягчает внутреннее воспаление и не дает перейти в хроническое, а главное, подавляет рост опухоли. Однако работы посвященные созданию липосомальной формы α-ТФ, встречаются редко и до настоящего времени препараты с α-ТФ для внутривенного введения отсутствуют.
В результате проведённых исследований в Российском НИИ гематологии и трансфузиологии в лаборатории жировых эмульсий создан универсальный для инкапсулирования различных фармацевтических препаратов липосомальный контейнер для внутривенного введения, липидные компоненты которого выделяются из отечественного сырья – фосфолипидов сои. Нами получены липосомы на основе фосфолипидов сои, содержащие α-токоферол.
В опытах на крысах изучалось терапевтическое действие α-ТФ и липосом с α-ТФ при синдроме длительного сдавливания [15]. Изучение содержания малонового диальдегида, активности каталазы и супероксиддисмутазы в тканях печени, почек, миокарда и мозга позволило судить о степени перекисного окисления липидов. Результаты исследований показали выраженное антиоксидантное действие липосом с α-ТФ, терапевтическая эффективность которых в 1,5–2 раза превышала эффективность обычной формы α-ТФ. Разработан способ получения ли- посом с цитохромом С для внутривенного введения. Оболочка липосом состояла из соевого лецитина, холестерина и компонента, содержащего отрицательно заряженные фосфолипиды.
Проведена работа по изучению противоишемической защиты миокарда с помощью липосом, содержащих цитохром С [16]. Изучение терапевтической эффективности проводили на модели ишемии у крыс. Установлено, что введение животным после острой ишемии миокарда липосом с цитохромом С препятствовало развитию тяжёлых нарушений энергетического обмена в сердце и тормозило активацию перекисного окисления липидов. У животных, которым вводили липосомы с цитохромом С, содержание в сердце фосфокреатина и АТФ было значительно выше, чем у крыс, которым вводили его обычную форму, а структурные повреждении миокарда менее выражены. Более высокие противоишемические свойства липосом с цитохромом С, очевидно, связаны с пролонгацией его терапевтического действия. Наличие липосомальной оболочки у цитохрома С способствует его удержанию в деструктивных участках. Результаты исследований позволяют рекомендовать липосомы с цитохромом С для экспериментального изучения как кардиопротекторного средства.
Также были проведены исследования по включению в липосомальный контейнер гемоглобина [17]. Из литературы известно, что гемоглобин и другие гемсодержащие белки катализируют перекисное окисление ненасыщенных жирных кислот, входящих в состав фосфолипидов, продукты окисления которых в свою очередь окисляют гемоглобин. Везикулы же, состоящие из лецитина, содержащего фосфатидилхолин с насыщенными жирнокислотными остатками, оказывают стабилизирующее влияние на гемоглобин. Кроме того, они более инертны в отношении процессов свёртывания крови. Нами получены образцы соевого лецитина различной степени гидрогенизации (40, 50 и 60%) . В качестве катализатора использовали Ni-Ренея. На основе образцов гидрированного соевого лецитина были получены 9 серий липосом, изучение физико-химических характеристик которых показало возможность получения мелкодисперсного, нетоксичного, апирогенного липосомального препарата не влияющего на осмотическую резистентность эритроцитов. При разработке метода получения гемосом мы использовали два состава бислоя липосомальных везикул. Первый состав в качестве основного компонента содержал лецитинобогащённую фракцию соевых фосфолипидов, второй – гидрированный на 50% соевый лецитин с иодным числом 63.0. Оба состава дополнительно содержали холестерин, кислые фосфолипиды и α-токоферол. Отделение неинкапсулированного гемоглобина осуществляли центрифугированием при 3500 об/мин при 4°С. Средний размер везикул составлял 1,0–1,1 мкм, рН = 7,1–7,3. Концентрация гемоглобина составляла 120 мг/мл. Показано преимущество состава бислоя на основе гидрированного соевого лецитина в процессе инкапсулирования легкоокисляемого гемоглобина. Значения малонового диальдегида и коэффициента окисленности были в два раза ниже, чем у гемосом на основе соевого лецитина. Та же закономерность наблюдалась и в содержании метформы в гемосомах.
Совместно с сотрудниками лаборатории консервирования крови института проведено изучение влияния липосом на такие свойства эритроцитов крови как электрофоретическая подвижность, СОЭ, число осмотически неустойчивых эритроцитов, гемолиз, вязкость, деформируемость и другие [18].
Было установлено, что инкубирование консервированной крови доноров с липосомами в дозе моделирующей терапевтическую (2:6 мг фосфолипидов на 1 мл крови доноров) приводит к увеличению отрицательного значения дзета-потенциала эритроцитов. Дальнейшее изучение взаимодействия липосом с эритроцитами крови доноров выявило увеличение суспензионной стабильности крови при хранении в присутствии липосом в течение 14 суток. Наблюдалось снижение СОЭ, уменьшение процесса накопления микросгустков и числа осмотически неустойчивых эритроцитов по сравнению с контролем.
При изучении лечебной эффективности липосомального препарата с α-ТФ Липоферол на модели повреждения печени у животных при острой интоксикации четырёххлористым углеродом было установлено, что препарат обладает более высоким гепатопротекторным эффектом и оказывает выраженный лечебный эффект, по сравнению с α-ТФ per se. Эффективность Липоферола была показана и при инфузионной терапии ожогового шока. Отмечали значительное улучшение системой гемодинамики и кислородного режима организма, снижение явления токсемии в крови обожжённых животных. О повышении лечебной эффективности свидетельствует и большая, по сравнению с контролем, выживаемость животных.
Многофункциональность липосом, выявленная при разной экспериментальной патологии, позволяет рассчитывать на их успешное включение в схемы медикаментозного лечения, применяемого при инфузионной терапии в клинике. Отсутствие промышленного выпуска липосомальных препаратов, особенно для внутривенного введения, вызвано особенностями и сложностями технологии их получения. Создание липосомальных лекарственных препаратов для внутривенного введения для широкого клинического применения – актуальная задача отечественной медицины.
Липосомы, или фосфолипидные везикулы (пузырьки), получают обычно при набухании сухих фосфолипидов в воде или при добавлении раствора липида в воду. При этом происходит самосборка бимолекулярной липидной мембраны. Минимальному значению энергии Гиббса соответствует замкнутая сферическая одноламеллярная форма мембраны. При этом все неполярные гидрофобные хвосты находятся внутри мембраны и ни один из них не соприкасается с полярными молекулами воды (рис.4.7, А).
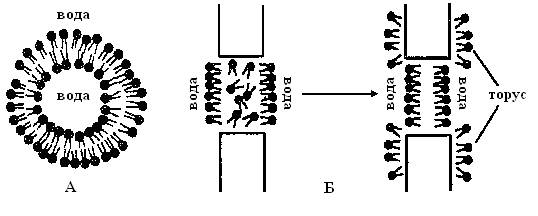
Рис.4.7.Схема строения однослойной липосомы (А); образование плоской бислойной липидной мембраны (Б).
Каждый бимолекулярный слой многослойной липосомы отделен от другого слоя водной средой. Толщина липидных слоев составляет, в зависимости от природы липидов, 6,5 – 7,5 нм, а расстояние между ними 1,5 – 2,0 нм. Диаметр многослойных липосом колеблется в пределах 60,0 – 400,0 нм.
Однослойные липосомы можно получить различными методами, например - из суспензии многослойных липосом, если обработать их ультразвуком. Диаметр однослойных липосом, полученных таким методом, составляет 25,0 – 30,0 нм.
Липосомы представляют собой в некотором роде прообраз клетки. Они служат моделью для исследования различных свойств клеточных мембран. Липосомы нашли непосредственное применение в медицине. Например, можно заключить внутрь липосом лекарственный препарат и использовать как фосфолипидную микрокапсулу для доставки лекарства в определенные органы и ткани. Например, инсулин, заключенный в липосому, защищен от действия пищеварительных ферментов, поэтому этот препарат можно вводить больным диабетом перорально.
Плоские бислойные липидные мембраны (БЛМ) – другой тип модельных мембран. Такие мембраны получают на маленьких отверстиях диаметром около 1 мм в пластине из пластика, погруженной в водную среду. На отверстие наносят каплю раствора липида (в спирте, хлороформе или другом растворителе). Растворитель диффундирует из раствора в воду, и на отверстии остается пленка липида. Эта пленка спонтанно утончается до тех пор, пока не образуется бимолекулярный слой толщиной около 6, 0 нм. Лишний липид собирается в виде ободка – торуса у краев отверстия (рис.4.7, Б).
Плоские липидные мембраны, наряду с липосомами, широко используются в качестве моделей для изучения электрических свойств мембраны и их проницаемости. С помощью модельных мембран изучают их барьерную функцию или моделируют транспорт веществ.
Искусственные мембраны получают с помощью специально разработанных методик. Такие мембранные системы обычно состоят из одного фосфолипида (природного или синтетического) или их смеси. В соответствующих условиях (например, при мягкой обработке ультразвуком) эти фосфолипиды образуют сферические бислойные везикулы. Везикулы, ограниченные липидным бислоем, называются липосомами.
Рассмотрим несколько примеров использования
Рис. 42.8. При самосборке мембраны сохраняется ее принципиальная структура, но не асимметрия. Мембраны разрушаются при обработке их детергентами в высокой концентрации; амфифильные молекулы детергента образуют маленькие капельки, называемые мицеллами. Детергент растворяет компоненты мембраны, обволакивая гидрофобные участки липидов и белков и заключая их в мицеллы, где они защищены от воды. После удаления детергента липиды спонтанно образуют новый бислой с интегрированными в него белками. Однако последние включаются в основном в случайной ориентации. Эксперименты, подобные описанному здесь, показали, что все клеточные мембраны не способны к правильной самосборке; по крайней мере некоторые интегральные белки должны встраиваться в уже готовую мембрану, имеющую определенную ориентацию. (Из работы Lodish Н. F., Rothman J. Е.: The assembly of cell membranes. Sci. Am. [Jan] 1979,240, 43, с любезного разрешения.)
искусственных мембранных систем и укажем их преимущества перед природными мембранами.
1. Содержание разных липидов в искусственных мембранах можно варьировать; это позволяет проводить систематическое исследование влияния липидного состава мембран на ту или иную функцию. Например, можно получить везикулы исключительно из фосфатидилхолина или, наоборот, из смеси фосфолипидов известного состава с включением гликолипидов и холестерола. Можно строить мембраны из липидов с разными остатками жирных кислот. Это позволяет провести ситематические исследования влияния жирнокислотного состава на определенные функции мембран (например, на транспорт).
2. В везикулы можно встраивать очищенные мембранные белки или ферменты. Это позволяет выявить, какие молекулы (например, специфические липиды или вспомогательные белки) необходимы для реконструкции функции очищенных белков. Исследования очищенных белков, например Са2+-АТРазы саркоплазматического ретикулума, показывает, что в некоторых случаях для реконструкции ионного насоса достаточно одного белка и одного липида.
3. Микроокружение искусственных систем можно жестко контролировать и целенаправленно варьировать (например, изменять концентрацию ионов). Их можно подвергать действию лигандов, специфичных к определенным белковым рецепторам, содержащимся в липосоме.
4. При формировании липосом ими могут захватываться те или иные компоненты, например лекарственные вещества или изолированные гены. Весьма перспективным представляется использование липосом для доставки лекарств к конкретным тканям. Для этого в мембраны липосом необходимо включить компоненты (например, антитела к определенным молекулам клеточной поверхности), позволяющие адресовать их конкретным тканям или опухолям. Терапевтический эффект такого способа доставки лекарства должен быть весьма значительным. ДНК, заключенная внутри липосом, по-видимому, менее чувствительна к нуклеазам; это следует учитывать при генной терапии.

Липосомы как современный способ доставки лекарственный средств
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке "Файлы работы" в формате PDF
Липосомы, известные как искусственно создаваемые липидные везикулы, состоят из одного или нескольких фосфолипидных бислоев, разделенных водным пространством. Диаметр их варьирует от 25 до 1000нм, визуально напоминают попавшие в воду капли жира. Но это, разумеется, лишь внешнее сходство, так как липидные пузырьки, о которых пойдет речь, имеют сравнительно малые размеры, а также содержат липиды, входящие в состав всех клеток организма.
На протяжении долгого времени проводились поиски идеальных систем доставки лекарственных средств. В большинстве случаев заболевания носят локальный характер, то есть, поражают отдельные органы и ткани. Очевидно, что ход лечения окажется более быстрым и успешным при условии действия лекарства непосредственно в очаге поражения. Особенно важным это является в случаях работы с токсичными препаратами, оказывающими сильное влияние не только на очаг болезни, но и на весь организм в целом. Многие лекарственные препараты имеют низкий терапевтический индекс. Это означает, что концентрация, в которой они оказывают лечебное действие, практически не отличается от концентрации, при которой препарат становится токсичным. Также, возможна быстрая потеря активности препарата при введении в организм. Причиной этого является воздействие инактивирующих агентов. Но включение таких препаратов в липосомы может повысить их эффективность, так как с одной стороны, препарат, находящийся в липосомах, защищен ее мембраной от воздействия неблагоприятных факторов, с другой – та же самая мембрана ограничивает превышение токсичным препаратом допустимой концентрации в биологических жидкостях в организме [2].
Существует несколько свойств, позволяющих им быть в преимуществе перед другими носителями лекарств:
-Биологическая совместимость – липосомы создаются из природных липидов и поэтому не являются токсичными, следовательно, не вызывают нежелательных иммунных реакций.
-Универсальность – возможность создания широкой вариации размеров, характеристик и состава поверхности.
-Сравнительно легкое разрушение в организме с последующим высвобождением доставленных веществ.
Липосомы вводят в организм внутривенно, подкожно, перорально, внутрибрюшинно, внутрисуставно, накожно. Существует как минимум два пути проникновения липосом в клетку. Первый заключается в том, что вследствие эндоцитоза происходит захват липосом клеткой, в результате чего образуется вакуоль, которая сливается с лизосомой. Далее при помощи фермента фосфолипазы происходит гидролиз фосфолипидов мембраны лизосом, чем и обуславливается выход препарата в цитоплазму клетки. Второй путь заключается в непосредственном слиянии липосом с клеточной мембраной. При этом происходит встраивание липидного компонента липосом в мембрану клетки, а водорастворимый препарат проникает в цитоплазму.
Липосомы нашли свое применение в самых различных сферах, но как носители лекарств наиболее широкое применение получили в экспериментальной онкологии [1]. Имеется ряд препаратов, которые способны к весьма эффективному разрушению злокачественных клеток. Несмотря на это, применение их в терапевтических целях не всегда представляется возможным из-за большой токсичности или слабой растворимости в воде. Именно с помощью липосом возможно преодоление подобных трудностей. Липосомы также применяются в борьбе с инфекционными заболеваниями. Так, лечение лейшманиоза с помощью липидных везикул позволяет не только снизить токсичность принимаемых лекарственных веществ, но и способствовать инокуляции этих веществ, тем самым подавлять активность паразитов примерно в 290 раз [3].
Список литературы
Шляхто, Е.В. Нанотехнологии в биологии и медицине /Е.В. Шляхто. - СПб: Санкт-Петербург, 2009. — 320 с.

Липосомы как современный способ доставки лекарственный средств
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке "Файлы работы" в формате PDF
Липосомы, известные как искусственно создаваемые липидные везикулы, состоят из одного или нескольких фосфолипидных бислоев, разделенных водным пространством. Диаметр их варьирует от 25 до 1000нм, визуально напоминают попавшие в воду капли жира. Но это, разумеется, лишь внешнее сходство, так как липидные пузырьки, о которых пойдет речь, имеют сравнительно малые размеры, а также содержат липиды, входящие в состав всех клеток организма.
На протяжении долгого времени проводились поиски идеальных систем доставки лекарственных средств. В большинстве случаев заболевания носят локальный характер, то есть, поражают отдельные органы и ткани. Очевидно, что ход лечения окажется более быстрым и успешным при условии действия лекарства непосредственно в очаге поражения. Особенно важным это является в случаях работы с токсичными препаратами, оказывающими сильное влияние не только на очаг болезни, но и на весь организм в целом. Многие лекарственные препараты имеют низкий терапевтический индекс. Это означает, что концентрация, в которой они оказывают лечебное действие, практически не отличается от концентрации, при которой препарат становится токсичным. Также, возможна быстрая потеря активности препарата при введении в организм. Причиной этого является воздействие инактивирующих агентов. Но включение таких препаратов в липосомы может повысить их эффективность, так как с одной стороны, препарат, находящийся в липосомах, защищен ее мембраной от воздействия неблагоприятных факторов, с другой – та же самая мембрана ограничивает превышение токсичным препаратом допустимой концентрации в биологических жидкостях в организме [2].
Существует несколько свойств, позволяющих им быть в преимуществе перед другими носителями лекарств:
-Биологическая совместимость – липосомы создаются из природных липидов и поэтому не являются токсичными, следовательно, не вызывают нежелательных иммунных реакций.
-Универсальность – возможность создания широкой вариации размеров, характеристик и состава поверхности.
-Сравнительно легкое разрушение в организме с последующим высвобождением доставленных веществ.
Липосомы вводят в организм внутривенно, подкожно, перорально, внутрибрюшинно, внутрисуставно, накожно. Существует как минимум два пути проникновения липосом в клетку. Первый заключается в том, что вследствие эндоцитоза происходит захват липосом клеткой, в результате чего образуется вакуоль, которая сливается с лизосомой. Далее при помощи фермента фосфолипазы происходит гидролиз фосфолипидов мембраны лизосом, чем и обуславливается выход препарата в цитоплазму клетки. Второй путь заключается в непосредственном слиянии липосом с клеточной мембраной. При этом происходит встраивание липидного компонента липосом в мембрану клетки, а водорастворимый препарат проникает в цитоплазму.
Липосомы нашли свое применение в самых различных сферах, но как носители лекарств наиболее широкое применение получили в экспериментальной онкологии [1]. Имеется ряд препаратов, которые способны к весьма эффективному разрушению злокачественных клеток. Несмотря на это, применение их в терапевтических целях не всегда представляется возможным из-за большой токсичности или слабой растворимости в воде. Именно с помощью липосом возможно преодоление подобных трудностей. Липосомы также применяются в борьбе с инфекционными заболеваниями. Так, лечение лейшманиоза с помощью липидных везикул позволяет не только снизить токсичность принимаемых лекарственных веществ, но и способствовать инокуляции этих веществ, тем самым подавлять активность паразитов примерно в 290 раз [3].
Список литературы
Шляхто, Е.В. Нанотехнологии в биологии и медицине /Е.В. Шляхто. - СПб: Санкт-Петербург, 2009. — 320 с.
Читайте также:

