Компенсаторные возможности почек реферат
Обновлено: 08.07.2024
Хроническая почечная недостаточность (ХПН) – это постепенное ухудшение функции почек в течение длительного времени. В современной литературе встречается термин "хроническая болезнь почек", который имеет несколько более широкое значение и подразумевает снижение функции почек в течение трех месяцев и более.
Функция почек – сохранять нормальный баланс жидкости и солей в организме, а также выводить из организма продукты обмена белков (азотистые шлаки), образуя мочу. При ХПН очищение крови не происходит в достаточной степени, что со временем может приводить к тяжелым осложнениям.
На ранних стадиях хронической почечной недостаточности может не возникать никаких симптомов. Заболевание часто обнаруживается, когда функция почек значительно ухудшается.
Очень важно как можно раньше установить диагноз "ХПН", чтобы своевременно начать лечение, которое позволяет замедлить скорость снижения функции почек, так как длительное повреждение почек является необратимым. Без лечения функция почек может критически ухудшаться, что может потребовать проведения процедуры гемодиализа (искусственного очищения крови с помощью аппарата "искусственная почка").
В ряде случаев единственным методом лечения пациента с ХПН может быть только трансплантация почки.
Синонимы русские
Хроническая болезнь почек, ХПН, ХБП, сморщивание почки, нефросклероз, уремия.
Синонимы английские
Chronic Renal Failure, Chronic Kidney Disease, Chronic Kidney Failure, Chronic Renal Disease, CRF, CKF, CKD, CRD, Uremia.
Симптомы
Признаки и симптомы почечной недостаточности в течение длительного времени могут не появляться. Симптомы могут быть разнообразными и включать:
- тошноту, рвоту, потерю аппетита;
- частые ночные мочеиспускания;
- усталость, быструю утомляемость;
- сухость, бледность кожи, стойкий кожный зуд;
- высокое кровяное давление (гипертония);
- мышечные подергивания, покалывания в разных частях дела, судороги;
- кровотечения из желудочно-кишечного тракта, из десен, носа;
- извращение вкуса;
- снижение либидо, аменорею (отсутствие менструаций);
- отеки стоп, лодыжек;
- снижение интеллектуальной активности.
Признаки и симптомы хронической почечной недостаточности неспецифичны, то есть могут встречаться и при других заболеваниях.
Общая информация о заболевании
Хроническая почечная недостаточность – это состояние, характеризующееся постепенным ухудшением функции почек в течение нескольких месяцев или лет.
ХПН является важной медицинской проблемой. Миллионы людей во всем мире страдают этим заболеванием, и количество заболевших с каждым годом неуклонно растет. На миллион взрослого населения приходится 300-500 больных ХПН.
Почки являются главным органом выделительной системы человека. В норме они поддерживают соотношение воды, активных веществ в организме, регулируют объем и состав плазмы крови. Кроме того, они вырабатывают ряд гормонов – биологически активных молекул.
Фильтрация крови в почках осуществляется за счет функционирования почечных клубочков. В каждой почке находится по миллиону клубочков. Каждый почечный клубочек представляет собой сплетение капилляров, в виде клубочка, окруженного капсулой. Проходя через клубочки, жидкая часть крови фильтруется, после чего образуется первичная моча. Клубочки в норме пропускают только жидкую часть крови – белки и другие крупные молекулы через почки не проходят.
Далее первичная моча поступает в почечные канальцы – тонкие трубочки в почках. В почечных канальцах большая часть этой жидкости всасывается обратно (этот процесс называется реабсорбцией), а небольшая часть в виде мочи поступает в почечную лоханку, а затем в мочеточник и в мочевой пузырь. Когда в мочевом пузыре накапливается достаточное количество мочи, она выводится из организма во время мочеиспускания.
За день через почки проходит около 150 литров жидкости, из которых образуется 1,5-2 литра мочи. Так осуществляется регуляция состава и объема плазмы.
При хронической почечной недостаточности из-за разных причин происходит замещение почечной ткани рубцовой, структура почек меняется, площадь здоровой ткани сокращается, в результате чего объем фильтруемой крови постепенно снижается. При этом оставшиеся клубочки и канальцы гипертрофируются, усиливая свою функцию для компенсации этого состояния. Потеря 75 % ткани почек приводит лишь к 50 % снижения объема фильтрации крови.
Как следствие, снижается объем фильтрации крови, в организме нарушается соотношение воды и солей (электролитов), что проявляется тошнотой, рвотой, мышечными подергиваниями, в тканях накапливается жидкость, что проявляется отеками, одышкой (из-за накопления жидкости в легких). Плотность мочи уменьшается, она становится более светлой, пациента начинают беспокоить частые ночные мочеиспускания.
Со временем концентрация в крови азотистых шлаков (мочевины и креатинина) – основных конечных продуктов обмена белков – значительно возрастает, что служит только признаком ухудшения работы почек, но не проявляется никакими симптомами. Повышение мочевины приводит к возникновению тошноты, боли в животе, головной боли. Другие азотистые шлаки приводят к возникновению стойкого кожного зуда.
Симптомы при ХПН появляются не сразу по причине больших компенсаторных возможностей почек. Даже при умеренной степени почечной недостаточности симптомов может не быть.
Почечная недостаточность может развиться после множества заболеваний, приводящих к поражению почек. Наиболее часто к ней приводят:
- сахарный диабет 1 или 2 типа;
- высокое кровяное давление (артериальная гипертензия);
- атеросклероз – отложение холестерола в стенках почечных артерий, препятствующее нормальному кровотоку в них;
- гломерулонефрит – группа заболеваний, имеющих разные причины, общим для которых является воспаление на уровне почечных клубочков;
- мочекаменная болезнь – появление в почках камней;
- хронический пиелонефрит – хроническое воспаление почечной ткани;
- туберкулез;
- поликистоз почек – наследственное заболевание, проявляющееся образованием полостей в ткани почек (кист);
- длительная закупорка мочевыводящих путей, которая может возникать при аденоме или раке простаты.
В последние годы вместо термина "хроническая почечная недостаточность" всё чаще используют термин "хроническая болезнь почек", который подразумевает снижение функции почек в течение трех месяцев и более. Хроническая болезнь почек классифицируется по пяти стадиям в зависимости от степени нарушения клубочковой фильтрации. Первые 2 стадии указывают на легкое нарушение функции почек. Третья, четвертая и пятая стадия соответствуют уже непосредственно самой почечной недостаточности. Последняя стадия называется терминальной (конечной) стадией. Конечная стадия ХПН, когда критически снижается функция почек и пациента беспокоит множество жалоб, называется уремией.
Хроническая почечная недостаточность может приводить к развитию широкого спектра различных осложнений:
- Анемия. В норме почки вырабатывают гормон эритропоэтин, стимулирующий образование эритроцитов (основных клеток крови, переносящих кислород от легких к органам и тканям) в костном мозге. При уменьшении площади здоровой ткани почек выработка эритропоэтина и эритроцитов снижается, возникает анемия (снижение уровня эритроцитов и гемоглобина в крови), которая проявляется слабостью и усталостью.
- Перикардит – накопление жидкости в оболочке, окружающей сердце (перикарде). Это состояние может угрожать нормальным сокращениям сердца и привести к смерти больного.
- Энцефалопатия. Термином энцефалопатия обозначают состояние, связанное с токсическим воздействием на головной мозг азотистых шлаков. В тяжелых случаях это может привести к коме.
- Язвы желудочно-кишечного тракта, которые могут приводить к спонтанным кровотечениям.
- Поражение костей. Почти у всех пациентов с ХПН наблюдается нарушение обмена кальция и фосфора, что приводит к размягчению костей и повышенному риску переломов.
- Сердечная или легочная недостаточность. Задержка жидкости в организме при ХПН может приводить к развитию или усугублять недостаточность сердца или легких, проявляясь одышкой и отеками.
- Инфаркт миокарда, инсульт. ХПН ускоряет прогрессирование атеросклероза – состояния, при котором в стенках артерий откладываются холестероловые бляшки, которые могут ограничивать кровоток по сосуду. Если это происходит в сердечных артериях, возникает повреждение мышцы сердца (инфаркт миокарда), закупоривание сосудов мозга приводит к инсульту – острому нарушению кровообращения в мозге.
- Повышение уровня калия в крови (гиперкалиемия) может приводить к аритмии – нарушению сердечного ритма, что угрожает жизни пациента.
- Снижение иммунного ответа делает больного более уязвимым к инфекциям и другим заболеваниям.
- Синдром беспокойных ног. Состояние, связанное с неприятными ощущениями в ногах, которые заставляют человека постоянно ими шевелить.
- Осложнения беременности, опасные для плода и матери.
В большинстве случаев хроническая почечная недостаточность неуклонно и необратимо прогрессирует вплоть до терминальной стадии. Скорость этого прогрессирования отличается у разных пациентов. Быстрее заболевание прогрессирует у лиц с очень низким уровнем клубочковой фильтрации, у молодых мужчин, а также у тех, у кого с мочой выделяется много белка.
Своевременно установленный диагноз и адекватное лечение позволяют значительно продлить жизнь пациентам с хронической почечной недостаточностью.
Кто в группе риска?
- Страдающие сахарным диабетом.
- Страдающие артериальной гипертензией – повышенным кровяным давлением.
- Пожилые.
- Страдающие любыми хроническими заболеваниями почек.
- Лица с повышенным уровнем холестерола.
- Люди с ожирением.
- Курящие.
- Имеющие родственников, страдающих хронической почечной недостаточностью.
Диагностика
Диагноз устанавливают на основании повышенного уровня азотистых шлаков – креатинина и мочевины. Также требуется выполнение ультразвукового исследования почек. Для уточнения состояния организма и степени повреждения органов и систем организма выполняется широкий спектр лабораторных исследований.
- Мочевина и креатинин в сыворотке крови. Это азотистые шлаки (продукты распада белков), которые могут выводиться организмом только с мочой. Прогрессирующее повышение креатинина является основным диагностическим признаком хронической почечной недостаточности. Уровень мочевины, в отличие от креатинина, не всегда соответствует тяжести нарушения функции почек. В последнее время для более точной оценки степени нарушения функции почек используется специальный показатель – скорость клубочковой фильтрации. Она определяется по разным формулам с учетом роста, веса и пола пациента.
- Общий анализ крови.
- Гемоглобин и эритроциты. Уровень гемоглобина и эритроцитов при ХПН как правило снижен, характеризуя развитие анемии.
- Гематокрит. Гематокрит – это показатель, характеризующий вязкость крови и представляет собой отношение объема клеток крови к общему объему крови. При ХПН гематокрит обычно значительно снижен.
- Тромбоциты. Количество тромбоцитов (кровяных пластинок) часто снижено при ХПН, отражая повышенную наклонность к кровоточивости.
- Плотность мочи. Для почечной недостаточности характерно значительное снижение плотности мочи.
- Эритроциты. Повышение уровня эритроцитов в моче может указывать на гломерулонефрит как причину ХПН.
- Лейкоциты. Значительное количество лейкоцитов в моче – признак инфекции мочевыводящих путей.
- Белок. Чем больше белка выводится с мочой при ХПН, тем быстрее прогрессирует заболевание.
- Цилиндры. Слепки фрагментов, образующихся в просвете почечных канальцев. Характерным признаком хронической почечной недостаточности являются восковидные цилиндры.
- Триглицериды. У пациентов с ХПН особенно часто повышается уровень триглицедиров – одного из видов жиров, находящихся в крови.
- Холестерол. Общий холестерол может быть в норме, но часто снижено содержание "полезного" холестерола – холестерола липопротеинов высокой плотности (ЛПВП) – и повышено содержание "вредного" холестерола – холестерола липопротеинов низкой плотности (ЛПНП).
- Кальций и фосфор в сыворотке. Для хронической почечной недостаточности характерно снижение кальция в сыворотке крови, в то время как уровень фосфора обычно повышен.
- Щелочная фосфатаза. Щелочная фосфатаза – фермент, который в большом количестве содержится в желчных ходах и в костной ткани. При ХПН костная ткань разрушается, поэтому в крови увеличивается количество щелочной фосфатазы за счет ее костной фракции
- Биопсия почек. В диагностически сложных случаях может потребоваться проведение биопсии почек – забор небольшого кусочка почечной ткани, который подвергается исследованию под микроскопом, что позволяет выявить характерные признаки ХПН – замещение клубочков почек рубцовой тканью.
Другие методы исследования
- Ультразвуковое исследование (УЗИ) почек. При ХПН отмечается уменьшение почек (сморщивание) вместе с истончением их наружного слоя. Также УЗИ может использоваться для выявления опухолей, камней или кист почек.
- Компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) брюшной полости. Исследования обладают большей чувствительностью по сравнению с УЗИ. Они позволяют выявлять опухоли, кисты и камни размером до 5 мм.
Лечение
Вылечить хроническую почечную недостаточность невозможно, однако можно замедлить или даже остановить ее прогрессирование. Лечение проводится для облегчения симптомов и профилактики осложнений.
Всем больным с ХПН показан строгий контроль кровяного давления, пациентам с сахарным диабетом необходимо поддерживать уровень глюкозы крови в пределах нормы. Обычно требуется снижение уровня холестерола с помощью лекарственных препаратов из группы статинов.
Рекомендуется ограничение приема соли и белков, продуктов, богатых калием.
Для лечения анемии назначается препарат эритропоэтина – искусственный аналог гормона, стимулирующего образование эритроцитов, иногда вместе с препаратами железа. Редко требуется переливание эритроцитов.
Обычно необходимо назначение витамина D для улучшения костного обмена, а также солей кальция, которые связывают избыток фосфатов в крови.
Обычно большинство пациентов также получают мочегонные препараты.
Доза лекарственных препаратов, выводящихся через почки с мочой, требует коррекции при хронической почечной недостаточности.
При выраженном снижении функции почек проводится гемодиализ – механическая фильтрация крови пациента с помощью аппарата "искусственная почка".
Большинству из нас знакома лишь одна важная функция почек — выделительная, которая позволяет организму избавляться от ненужных соединений, поступивших с пищей, или продуктов обмена. Второй не менее важной функцией является регуляция объема и состава жидких сред организма. Баланс воды и практически всех электролитов, включая поступление (в результате пищеварительных или обменных процессов) и выведение (путем выделения или метаболической переработки), в основном поддерживается почками. Для осуществления клетками разнообразной деятельности необходимо постоянство окружающей их среды. Оно поддерживается с помощью регуляторной функции почек.
• выделение продуктов обмена и чужеродных веществ;
• регуляция водного и электролитного баланса;
• регуляция осмолярности жидких сред и концентрации электролитов;
• регуляция артериального давления;
• регуляция кислотно-щелочного равновесия;
• секреция, переработка и выделение гормонов;
а) Выделение продуктов обмена, чужеродных веществ, лекарственных препаратов и продуктов переработки гормонов. Почки играют ведущую роль в выведении продуктов обмена, в которых организм более не нуждается. Такими продуктами являются следующие метаболиты: мочевина (обмен аминокислот), креатинин (источник — креатин мышечной ткани), мочевая кислота (источник — нуклеиновые кислоты), конечные продукты расщепления гемоглобина (например, билирубин) и различные продукты метаболизма гормонов. Эти вещества необходимо вывести из организма сразу после их образования. Почки также выводят большинство токсинов и других чужеродных веществ, которые либо образуются в организме, либо попадают в него через пищеварительный тракт (например, пестициды, лекарственные препараты, пищевые добавки).
![физиология почек]()
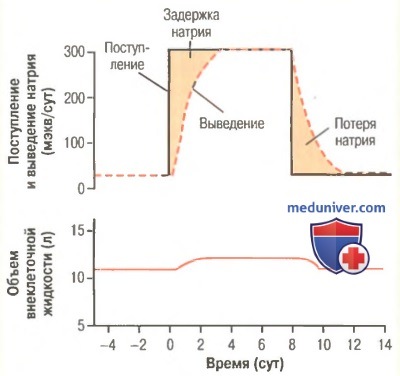
Влияние десятикратного (с 30 до 300 мэкв/л) увеличения поступления натрия в организм на выделение натрия с мочой и объем внеклеточной жидкости. Закрашенные области под кривой представляют суммарную задержку или потерю натрия, определяемую разницей между поступившим и выведенным натрием
б) Регуляция водного и электролитного баланса. Для поддержания гомеостаза выделение воды и электролитов должно в точности соответствовать их поступлению. Если поступление превышает выделение, количество данного вещества в организме будет возрастать. Если же вещества поступает меньше, чем выводится, то его количество уменьшится.
Поступление воды и многих электролитов определяется в основном индивидуальными особенностями питьевого и пищевого поведения субъекта. Почки приводят в соответствие скорость выведения различных веществ скорости их поступления в организм. На рисунке показана реакция почек на резкое десятикратное возрастание поступления натрия: от низкого уровня в 30 мэкв/сут до высшего значения в 300 мэкв/сут. В течение 2-3 сут после повышения потребления натрия выделение его почками также возрастает до 300 мэкв/сут. Таким образом, между поступлением и выведением натрия вновь установится равновесие. Однако во время 2-3-дневной адаптации к высокому потреблению натрия наблюдается его незначительное накопление, которое приводит к небольшому увеличению объема внеклеточной жидкости, активирует гормональные реакции и другие компенсаторные ответы, оповещая почки о необходимости вывести натрий.
Способность почек изменять выделение натрия велика. В эксперименте показано, что у многих лиц его поступление может быть увеличено до 1500 мэкв/сут (в 10 раз выше нормы) или уменьшено до 10 мэкв/сут (менее 1/10 от нормы). При этом объем внеклеточной жидкости или концентрация ионов Na+ в плазме изменяется незначительно. Это также справедливо для воды и большинства таких электролитов, как хлориды, калий, кальций, протоны, магний, фосфат-ион. В следующих главах мы рассмотрим особые механизмы, которые позволяют почкам проявлять поистине удивительные способности поддерживать гомеостаз.
в) Регуляция артериального давления. Почкам принадлежит ведущая роль в долговременной регуляции артериального давления, осуществляемая с помощью изменения выделения натрия и воды. Почки также вносят вклад в систему быстрой регуляции артериального давления путем секреции факторов или веществ, влияющих на сосуды, например ренина, приводящего к образованию ангиотензина II.
г) Регуляция кислотно-щелочного равновесия. Путем выделения кислых продуктов и регуляции буферной емкости жидких сред почки совместно с дыхательной системой принимают участие в регуляции кислотно-щелочного равновесия. Почки являются единственными органами, выделяющими определенные виды кислот, например серную и фосфорную, образовавшихся в результате обмена белков.
д) Регуляция образования эритроцитов. Почки вырабатывают эритропоэтин, который стимулирует образование эритроцитов. Одним из главных стимулов выработки эритропоэтина служит гипоксия. Практически весь выделяемый в кровоток эритропоэтин приходится на долю почек, поэтому у лиц с тяжелыми урологическими заболеваниями или с удаленными почками и проходящими процедуру гемодиализа в результате недостатка эритропоэтина развивается тяжелая анемия.
е) Участие в образовании витамина D3. Почками синтезируется активная форма витамина D: 1,25-дигидроксивитамин D3 (кальцитриол). Он образуется вследствие гидроксилирования молекулы данного витамина в первом положении. Кальцитриол необходим для процесса депонирования кальция в костях и его реабсорбции в пищеварительном тракте. Кальцитриол играет важную роль в регуляции содержания кальция и фосфатов (все это подробно расписано в отдельной статье на сайте - просим вас пользоваться формой поиска выше).
ж) Синтез глюкозы. При продолжительном воздержании от пищи почки вырабатывают глюкозу из аминокислот и других веществ. Данный процесс относится к глюконеогенезу. При длительном голодании способность почек к выработке глюкозы соперничает с печенью.
При хронической почечной патологии эти гомеостатические функции нарушаются, при этом быстро возникают тяжелые нарушения объема и состава жидких сред организма. В терминальной стадии почечной недостаточности калий, кислоты, жидкость и другие вещества в большом количестве накапливаются в организме в течение нескольких дней, пока с помощью гемодиализа хотя бы частично не будет восстановлен баланс жидкости и электролитов.
Видео физиология водно-солевого баланса - профессор, д.м.н. П.Е. Умрюхин
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
![]()
Почки. Известно, что интенсивность кровообращения в почках в 6–7 раз превышает кровоснабжение мозга. Сохранение нормального уровня внутрипочечной циркуляции обеспечивает определенную скорость клубочковой фильтрации и сохранение осмотического градиента в интерстиции.
В условиях кровопотери, гипоксемии возникает активация симпатоадреналовой системы и развитие рефлекторно-сосудистой компенсации, характеризующейся спазмом периферических сосудов, а также сосудов различных внутренних органов, в частности, почек. В условиях ишемии почек активизируется ренин-ангиотензиновая система,то есть усиливается продукция ренина, ангиотензина II, возникают вторичный гиперальдостеронизм, избыточная задержка натрия и потеря калия.
По мере развития геморрагического шока, по данным рентгенокинематографических исследований, объемная скорость почечного кровотока снижается до 15 % от исходного уровня, а линейная скорость движения крови в почечной артерии падает почти в три раза.
Недостаточность внутрипочечной циркуляции является определяющим фактором развития преренальной формы острой почечной недостаточности. Прекращение фильтрационной способности почек в связи с резким падением эффективного фильтрационного давления отмечается при снижении максимального артериального давления до 70 мм рт. ст. и ниже. При этом возникают прогрессирующая азотемия, расстройства электролитного баланса, свойственные острой почечной недостаточности. В начальном периоде развития шока эти изменения обратимы, в дальнейшем формируются необратимые органические изменения в почках, в частности, развивается канальцевый некроз, так называемая шоковая почка, что свидетельствует о развитии ренальной формы почечной недостаточности. В этих случаях ликвидируемая с помощью различных плазмозаменителей гиповолемия не устраняет анурии. В связи с этим хирурги и реаниматологи в первую очередь должны стремиться восполнить потерянный объем циркулирующей крови, ликвидировать преренальную форму недостаточности, обусловленную компенсаторным спазмом сосудов, и тем самым воспрепятствовать развитию необратимых дегенеративных сдвигов в почках и формированию ренальной формы острой почечной недостаточности. Одновременно необходимо регулировать кислотно-основное состояние организма, устранить ацидоз, являющийся следствием гемической гипоксии, вазоконстрикции и острой почечной недостаточности.
Возникновение циркуляторной гипоксии в процессе рефлекторно-сосудистой компенсации, спазма сосудов различных органов и тканей сопровождается образованием активных форм кислорода, активацией свободнорадикального окисления, дестабилизацией биологических мембран, повреждением сосудистой стенки. Последнее свидетельствует о целесообразности использования при геморрагическом шоке антиоксидантов, антигипоксантов, мембранопротекторов.
Печень. Кровоснабжение печени, в отличие от кожи, скелетных мышц, брыжейки кишечника, при шоке снижается в значительно меньшей степени и длительное время поддерживается на достаточном уровне, приемлемом для жизнедеятельности органа за счет рефлекторно-сосудистой компенсации. Однако следует отметить, что возникающая в ответ на кровопотерю вазоконстрикция в раннем периоде шока приводит к развитию циркуляторной гипоксии, активации гликолиза, развитию метаболического ацидоза, набуханию митохондрий, дефициту макроэргов, подавлению всех энергозависимых реакций в гепатоцитах [22, 35]. Последнее проявляется нарушением белоксинтетической функции, процессов дезаминирования и переаминирования аминокислот, дезинтоксикационной и других функций, то есть формируются метаболические признаки печеночной недостаточности.
Длительный спазм сосудов печени и избыточное накопление свободных радикалов, кислых продуктов приводят, как и в других органах, к повышению проницаемости микроциркуляторного русла, плазмопотере, сгущению крови, нарушению ее реологических свойств. Если гиповолемия и гипоксия печени при геморрагическом шоке своевременно не ликвидируются, в печени формируются очаги некроза, усугубляются клинические проявления печеночной недостаточности, резко ухудшается прогноз.
Как известно, печеночная недостаточность при шоке проявляется комплексом клинико-биохимических синдромов, в частности, гипопротеинемией, гипоальбуминемией, диспротеинемией, снижением синтеза К-зависимых (II, VII, IX, X) и К-независимых факторов свертывания крови (I, V, VIII) , развитием геморрагического синдрома. Протромбиновый индекс обычно ниже 70 %.
Признаками недостаточности печени являются также нарушение глюкостатической функции, нарушения билирубинового и холестеринового обмена, избыточное накопление небелкового азота крови в основном за счет азота аминокислот. Характерным является синдром цитолиза, проявляющийся повышением активности трансаминаз и других внутриклеточных ферментов в сыворотке крови, являющихся маркерами состояния проницаемости цитоплазматических мембран.
Следует отметить, что в соответствии с данными пункционной биопсии уже в первые часы профузного кровотечения возможно развитие белковой дистрофии и жировой дегенерации печени, сопровожающееся возникновением некробиотических и некротических изменений гепатоцитов, увеличением количества и размеров очагов некроза.
Выраженность деструктивных процессов в печени определяется длительностью периода некомпенсированной гиповолемии.
Сердечно-сосудистая система. При геморрагическом шоке, как и при травматическом шоке, не осложненном кровопотерей, возникают типовые изменения сердечно-сосудистой системы, характеризующиеся спазмом периферических сосудов и централизацией кровотока, развитием патологического депонирования крови, резким уменьшением венозного возврата, плазмопотерей в микроциркуляторном русле различных внутренних органов и тканей, сгущением крови. Гиповолемия, возникающая в связи с кровопотерей и усугубляемая на фоне патологического депонирования крови, циркуляторная гипоксия индуцируют активацию симпотоадреналовой системы, что приводит к прогрессирующей тахикардии. Следует отметить, что при шоке любой этиологии, в том числе и геморрагическом, образуется масса токсических соединений, подавляющих сократительную способность миокарда, в частности, миокардиальный депрессорный фактор. Последний является низкомолекулярным пептидом, накапливается в плазме крови, печени, поджелудочной железе, кишечнике пропорционально тяжести ишемии.
Таким образом, в раннем периоде шока в связи с централизацией кровотока деятельность сердца поддерживается на достаточно высоком уровне. Однако по мере развития шока возникают нарушения энергообеспечения и интенсивности коронарного кровотока в связи с прогрессирующей тахикардией, избыточным накоплением в миокарде свободных радикалов, продуктов липопероксидации, ионов кальция, водородных ионов, укорочением времени диастолического расслабления миокарда. В то же время присоединяется цитопатогенное действие миокардиального депрессорного фактора.
Поджелудочная железа. В связи с чрезмерной активацией симпатоадреналовой системы после кровопотери возникают выраженный спазм сосудов поджелудочной железы, гипоксия, ишемия органа, образование активных форм кислорода, приводящие к лабилизации мембран лизосом и выходу лизосомальных ферментов в плазму крови, во внеклеточную среду, к развитию явлений дистрофии, аутолиза.
Поджелудочная железа, как известно, при развитии в ней выраженных метаболических и функциональных расстройств является важнейшим источником калликреинов-кининогеназ, обеспечивающих активацию образования кининов и развитие вазодилатирующего эффекта, а также миокардиального депрессорного фактора.
Характерным проявлением недостаточности инсулярного аппарата поджелудочной железы, обусловленной выраженной гиперкатехоламинемией и развитием дистрофических, аутолитических процессов в ней, может быть резкое повышение уровня сахара в крови.
Легкие. Морфологические и функциональные изменения в легких при геморрагическом шоке носят неспецифический характер и соответствуют аналогичным изменениям в легких при травматическом шоке.
Различают три периода изменений в системе внешнего дыхания в динамике геморрагического шока:
I период, величина артериального давления в пределах 100 мм рт. ст., преобладают реакции адаптации, характеризующиеся увеличением частоты и минутного объема дыхания;
II период – при снижении АД до 60 мм рт. ст., характеризуется относительной стабилизацией дыхания;
III период – АД ниже 50 мм рт. ст., ограничивается легочный газообмен.
Ранним диагностическим признаком развития респираторной недостаточности является снижение РО2 крови, возникающее еще до клинических и рентгенологических проявлений патологии. Развитие дыхательной гипоксии закономерно инициирует образование свободных радикалов, вызывающих дальнейшую структурную и функциональную дезорганизацию системы внешнего дыхания.
Важнейшим фактором усугубления гипоксического состояния при шоке является развитие ДВС-синдрома, расстройства микроциркуляции, сладжирования эритроцитов.
Кожа. Кровопотеря сопровождается активацией симпатоадреналовой системы, резким спазмом сосудов кожи, благодаря чему корригируется потеря до 1 л крови. Кровоток сохраняется лишь на уровне артериовенозных анастомозов подкожной клетчатки.
Резюмируя вышеизложенное, следует заключить, что основными патогенетическими факторами геморрагического шока являются следующие:
1. Кровопотеря, снижение объема циркулирующей крови, артериальная гипотензия.
2. Активация симпатоадреналовой системы, спазм периферических сосудов кожи, подкожной клетчатки, мышц, печени, почек, брыжейки кишечника, централизация кровотока за счет расширения сосудов сердца, мозга.
3. В связи с длительным спазмом сосудов периферических органов и тканей возникают избыточное образование активных форм кислорода, активация липопероксидации, развитие метаболического ацидоза, патологического депонирования крови, повышение проницаемости сосудов, экстравазация плазмы, сгущение крови, прогрессирующее снижение объема циркулирующей крови.
4. Развитие диссеминированного внутрисосудистого свертывания крови, выраженные расстройства микроциркуляции, усугубление гипоксического синдрома.
5. Активация лизосомальных гидролаз, калликреин-кининовой системы, развитие процессов дистрофии и аутолиза в различных внутренних органах.
6. Образование токсических продуктов метаболизма, свободных радикалов, продуктов липопероксидации.
7. Полиорганная недостаточность как следствие длительной гиповолемии, спазма периферических сосудов, циркуляторной гипоксии.
8. Прогрессирующие нарушения кислотно-основного состояния. Шоковое состояние при кровопотере усугубляется развитием острой постгеморрагической анемии, которая развивается и по мере выхода из шокового состояния.
Знание основных фаз развития постгеморрагической анемии и их гематологической характеристики дает возможность правильной оценки тяжести кровопотери и выраженности компенсаторных реакций.
Как указывалось выше, одним из наиболее мобильных звеньев адаптации при кровопотере является активация симпатоадреналовой системы, что приводит к развитию комплекса защитно-приспособительных реакций. Прежде всего возникает рефлекторный спазм периферических сосудов или рефлекторно-сосудистая компенсация постгеморрагической анемии, направленная на адаптацию емкости сосудистого русла. Изучение гематологических показателей в период рефлекторно-сосудистой компенсации может выявить лишь незначительное снижение уровня гемоглобина и эритроцитов, отсутствие выраженных изменений гематокрита, даже при значительной кровопотере.
Спустя 1–3 суток после кровопотери развивается так называемая гидремическая компенсация, в механизмах развития которой важное место отводится активации ренин-ангиотензиновой системы, усилению освобождения минералокортикоидов. Последние вызывают усиление реабсорбции натрия в почках и желудочно-кишечном тракте, повышение осмотического давления в крови и тканях, сопровождающееся стимуляцией выброса антидиуретического гормона и усилением факультативной реабсорбции воды в дистальных почечных канальцах. Жидкость поступает в кровеносные капилляры по градиенту осмотического давления.
Для этого периода характерно уменьшение количества эритроцитов и гемоглобина в единице объема крови и во всем объеме крови. Анемия носит нормохромный характер.
Касаясь сроков восстановления объема жидкой части крови в период гидремической компенсации, следует отметить, что при кровопотере около 25 % объема циркулирующей крови возможна нормализация его уже в течение первых суток, а на третьи сутки объем циркулирующей плазмы может превосходить исходный уровень на 30 %. К этому времени концентрация белка составляет 85–90 % от исходного уровня, причем преобладают глобулиновые фракции. В то же время уместно отметить, что эритроцитарная масса восстанавливается через более длительные сроки. Так, после потери 500 мл крови необходимо 40–50 дней, чтобы гемоглобин и гематокрит достигли исходного уровня.
Спустя 4–5 дней после кровопотери возникает фаза костномозговой компенсации. Касаясь механизмов ее развития, следует отметить, что под влиянием гипоксии, активации симпатоадреналовой системы и других гормональных и гуморальных факторов стимулируется продукция эритропоэтина в различных клетках нефрона, в печени, селезенке, макрофагах. В натуральном виде эритропоэтин представляет собой димер с ММ от 46 000 Д до 60 000 Д; содержание белка в нем составляет около 30 %. Под влиянием эритропоэтина эритропоэтинчувствительные клетки костного мозга дифференцируются в эритробласты и далее до зрелых эритроцитов, которые выходят в сосудистое русло и обеспечивают компенсацию кровопотери. При этом в периферической крови появляются молодые, недонасыщенные гемоглобином формы эритроцитов – ретикулоциты, оксифильные, полихроматофильные, базофильные нормоциты, характеризующие регенераторную активность костного мозга. Анемия приобретает гипохромный характер. Признаком регенераторной активности костного мозга является возникновение нейтрофильного лейкоцитоза со сдвигом влево.
Вначале лейкоцитоз носит перераспределительный характер. Однако лейкоцитозу может предшествовать лейкопения с относительным лимфоцитозом.
Обращает на себя внимание тот факт, что сыворотка крови животных, перенесших кровопотерю, обладает выраженными гемолизирующими свойствами в течение 5–7 дней после кровопотери, в связи с чем и в постгеморрагическом периоде возможно дальнейшее уменьшение количества эритроцитов крови. Механизмы гемолизирующего воздействия сыворотки остаются не изученными до конца, тем не менее подобный факт прогрессирования анемии в постгеморрагическом периоде, несмотря на включение компенсаторных механизмов, может иметь место и у людей.
В эксперименте установлено, что потеря плазмы переносится тяжелее, чем потеря эритроцитов. Выживание возможно при сохранении 35 % от первоначального количества эритроцитов, в то время как потеря 30 % объема плазмы представляет смертельную опасность.
Параллельно с указанными фазами компенсации развертывается и так называемая белковая компенсация. Восстановление белков идет в две фазы: первая, более быстрая,- в течение 2–3 дней за счет мобилизации тканевых ресурсов, и вторая, более медленная,- в результате усиленного синтеза белков в печени, в частности, белковых плазменных факторов свертывания крови. Следует отметить, что активация протеосинтеза наблюдается уже через несколько часов после кровотечения и регистрируется в течение последующих нескольких недель и более.
![хроническая почечная недостаточность (ХПН)]()
Хроническая почечная недостаточность (ХПН) является обычно исходом заболеваний, приводящих к прогрессирующей потере нефронов:
- нефритов при системных патологиях (сахарном диабете, красной волчанке, склеродермии, онкологической патологии) и хронических интоксикациях;
- нефролитиаза (камни в почках);
- хронических гломерулонефритов или пиелонефритов;
- гломерулосклероза на фоне диабета;
- поликистоза или амилоидоза почек;
- нефроангиосклероза (поражения артерий почек).
Причины ХПН
Дисфункции мочевыделительной системы могут провоцировать другие острые и хронические патологии:
- Гломерулонефрит – воспаление клубочковых элементов почек аутоиммунной природы.
- Поликистоз – множественные доброкачественные опухоли, которые поражают почечную ткань.
- Сахарный диабет – эндокринное заболевание, оказывающее влияние на мочевыделительную систему.
- Высокое артериальное давление – выступает предпосылкой хронической почечной недостаточности из-за повышенной нагрузки на органы выделения.
- Закупорка почечных протоков, вызванная патологическими состояниями – увеличением простаты, опухолями в соседних тканях, мочекаменной болезнью.
Хроническая почечная недостаточность также развивается по таким причинам:
- тяжелые степени ожирения;
- нарушения липидного обмена;
- аутоиммунные заболевания;
- хронические инфекции мочеполовых путей у женщин и мужчин;
- неправильное питание;
- злоупотребление нестероидными препаратами;
- аномалии внутриутробного развития.
Стадии хронической почечной недостаточности
В своем развитии почечная недостаточность проходит 4 стадии:
- Скрытая. Протекает без выраженных симптомов как у женщин, так и у мужчин. Диагностировать заболевание удается только по результатам комплексных лабораторных исследований. О патологии может свидетельствовать протеинурия – повышение концентрации белка в моче.
- Компенсированная. Организм пациента пока справляется с нарушением метаболизма, но первые проявления патологии уже дают о себе знать. На этой стадии хроническая почечная недостаточность проявляется сухостью во рту, повышенной утомляемостью в течение дня, увеличением суточного объема мочи. В анализах наблюдается высокая концентрация мочевины и креатинина.
- Периодическая. Симптомы поражения почек становятся более выраженными. К ощущению сухости во рту присоединяется острая жажда, горький привкус и тошнота. Нарушается рН-баланс в сторону повышения кислотности. Наблюдаются расстройства сна и ухудшение памяти.
- Терминальная. Это стадия опасных осложнений хронической почечной недостаточности, среди которых отечность, нарушения в работе сердца, дистрофия печени, застойные явления в легочной ткани.
Симптомы и признаки ХПН
Клинические проявления хронической почечной недостаточности многообразны:
- проблемы с кожей – сухость, шелушение, снижение эластичности;
- ломкость ногтей и выпадение волос;
- общая слабость и снижение работоспособности;
- повышенная тревожность и раздражительность;
- трудности с длительным удержанием внимания;
- проблемы со слухом, зрением, памятью и засыпанием.
Прогрессирование хронической почечной недостаточности влечет за собой развитие следующих симптомов:
- кожа у мужчин и у женщин становится бледной, приобретает сероватый или желтоватый оттенок;
- из-за нарушения свертываемости крови на теле появляются гематомы и кровоподтеки;
- возникают спонтанные кровотечения – из носа, заднего прохода, слизистой оболочки ротовой полости и желудка;
- нарушение усвоения витамина D становится причиной болезненности в костях и суставах;
- развивается тугоподвижность из-за отложения солей мочевой кислоты;
- появляются проблемы с пищеварением – ухудшение аппетита, развитие анорексии, неприятные вкусовые ощущения, рвота, тошнота, частые диареи.
Хроническая почечная недостаточность на последней стадии сопровождается такими симптомами, как одышка, частое сердцебиение, отеки, глубокое шумное дыхание, судороги в конечностях. Ярким признаком прогрессирования заболевания считается уменьшение суточного объема мочи до 200 мл. Стул становится зловонным, изо рта появляется неприятный запах.
Вероятные осложнения при ХПН
При отсутствии своевременной диагностики и грамотной терапии хроническая почечная недостаточность провоцирует полиорганные нарушения со стороны:
- органов кроветворения – снижение уровня гемоглобина и показателей свертываемости (симптомы внутренних кровотечений);
- сердечно-легочной системы – стойкое повышение артериального давления, миокардит, перикардит, поражение легочной ткани, сердечная недостаточность, развитие ишемической болезни;
- нервной системы – спутанность сознания, симптомы полинейропатии (поражение периферических нервов).
Без соответствующего лечения хроническая почечная недостаточность может закончиться летальным исходом из-за уремической комы или сердечно-сосудистых нарушений у женщин и у мужчин.
Диагностика хронической почечной недостаточности
Ключевую роль в диагностике хронической почечной недостаточности играют лабораторные исследования. Уже при первых признаках заболевания могут наблюдаться изменения в составе крови – повышение уровня креатинина, мочевой кислоты и щелочной фосфатазы. При этом снижается уровень гемоглобина, тромбоцитов, альбумина и калия, уменьшаются показатели вязкости крови (гематокрита). Важный симптом хронической почечной недостаточности – существенное снижение плотности мочи, повышение уровня эритроцитов, лейкоцитов, белка и цилиндров.
Комплексная диагностика включает также липидограмму – исследование всего спектра жировых соединений в составе крови. Особое внимание уделяется показателям триглицеридов и холестерола.
- биопсия почечной ткани;
- ультразвуковое исследование почек;
- КТ и МРТ брюшной полости.
Лечение хронической почечной недостаточности
Лечение хронической почечной недостаточности направлено на достижение стойкой ремиссии, поскольку добиться абсолютного выздоровления современная медицина не способна. Но благодаря своевременной терапии удается сгладить симптоматику, отсрочить появление осложнений и существенно улучшить качество жизни пациента.
Лечение хронической почечной недостаточности должно начинаться с устранения основной причины патологии. Усилия врачей направлены на компенсацию признаков сахарного диабета, гломерулонефрита, поликистоза и других аутоиммунных нарушений. В приоритете – комплексный подход к лечению, который включает:
Большая роль отводится симптоматическому лечению, которое позволяет облегчить протекание болезни и улучшить самочувствие пациента. Больным назначают препараты, которые восполняют дефицит витамина D, контролируют артериальное давление, корректируют кислотно-щелочной баланс, борются с олигурией.
В некоторых случаях для лечения хронической почечной недостаточности показаны дробные переливания эритроцитной массы. Методика позволяет повысить уровень гемоглобина в крови, уменьшить проявления анемии, устранить последствия внутренних кровотечений. По достижении ремиссии пациентам с хронической почечной недостаточностью показано санаторно-курортное лечение.
Если консервативные методы терапии не дают ожидаемых результатов, пациенту может быть назначена трансплантация почки. Это физиологический метод заместительного лечения с использованием донорского органа. После пересадки почки проводится комбинированная иммуносупрессивная терапия, препятствующая отторжению донорской почки.
Основными способами лечения ТХПН повсеместно признаны диализ и трансплантация почки.
Наиболее полное замещение почечной функции происходит в результате успешной трансплантации почки, а диализ замещает ее лишь частично.
Гемодиализ (ГД)
— метод внепочечного очищения крови при острой и хронической болезни почек. Во время гемодиализа происходит удаление из организма токсических продуктов обмена веществ, для уменьшения биохимических аномалий, нормализация нарушений водного, электролитного балансов и кислотно-щелочного равновесий. Очищение крови производится путем снижения концентрации в ней вредных веществ. В зависимости от метода гемодиализа, это достигается различными путями. Под гемодиализом понимают процедуру фильтрации плазмы крови с помощью полупроницаемой мембраны, через поры которой проходят молекулы с небольшой молекулярной массой, а крупные молекулы белков остаются в плазме, которая затем возвращается в кровоток пациента.
Назначение:
1.Обеспечение компенсаторной функции почек, фильтрация крови от токсических соединений и конечных продуктов метаболизма. Гемодиализ при хронической недостаточности проводят трижды за неделю, но нарастание интоксикации – основание для более частого проведения процедуры. При крайне тяжести, диализ выполняют до конца жизни, или пока не трансплантируют здоровую почку. 2. Почечная недостаточность, как осложнение острого гломерулонефрита, пиелонефрита. Цель назначения процедуры – вывести излишек жидкости из организма, устранить отеки, эвакуировать продукты токсического свойства. 3. Дисбаланс электролитов в крови. Указанное состояние происходит вследствие массивных ожогов, перитонита, обезвоживания, лихорадочных явлений. Гемодиализ позволяет вывести чрезмерную концентрацию ионов одного вида, заместив их другими. Также показанием для рассматриваемой процедуры выступает избыток жидкости в организме, что приводит к отеку оболочек головного мозга, сердца, легких. Диализ помогает сократить отечность и снизить уровень артериального давления. Процедура гемодиализа проводится на АИП с помощью одноразовых расходных материалов, к которым относятся диализаторы, кровопроводящие магистрали, фистульные иглы, катетеры, диализные концентраты.
Аппарат для гемодиализа представляет автоматизированное высокопоточное устройство, с помощью которого достигается максимально качественная очистка жидкостей. Многочисленные датчики следят за процессом и контролируют все его показатели. Организм, подключенный к диализатору, получает необходимую качественную очищенную кровь. Диализ позволяет лишь частично заменить работу почек, так как не способен обеспечить ее эндокринные функции. Но и этого бывает достаточно, чтобы улучшить состояние больного.
Показания к началу Заместительной почечной терапии – гемодиализу:
- гиперкалиемия выше 6 ммоль/л, метаболичиский ацидоз, который не поддается коррекции;
- скорость клубочковой фильтрации (СКФ) 10 мл/мин и 36ммоль/л;
- уремический перикардит;
- жизнеопасная гипергидратация, отек легких рефрактерный к терапии мочегонными;
- наличие олигоанурии – выделения в сутки не более 0,5 л мочи даже при форсированном диурезе
- прогрессирующая уремическая энцефалопатия и/или нейропатия;
В дневном стационаре – отделении гемодиализа вам помогут:
- Определить причины возникновения почечной дисфункции;
- Определить патологические изменения: острая или хроническая недостаточность;
- Провести качественный медицинский осмотр;
- Назначить диагностику почечной недостаточности;
- Произвести лечение почечной недостаточности;
- Составить прогноз по окончанию лечения;
- Назначить профилактику почечной недостаточности.
Процедура проводится 3 раза в неделю. Длительность ее составляет от 240 мин до 270 мин.
В дневном стационаре проводятся:
Все услуги и медицинская помощь оказывается пациентам абсолютно бесплатно в рамках ОМС.
Отделение, в котором лечат почечную недостаточность
Жители города Москвы для получения направления и прикрепления к гемодиализному центру должны пройти консультацию у главного внештатного специалиста – нефролога Департамента здравоохранения г. Москвы в консультативно-диагностическом отделении Городской клинической больницы №52.
Жители субъектов РФ могут поступить на лечение в Дневной стационар НИИ урологии и интервенционной радиологии имения Н.А. Лопаткина по направлению формы 057/у.
Платные медицинские услуги предоставляются в виде комплексной программы медицинской помощи, по желанию пациента, или гражданам, обеспечение которых бесплатными медицинскими услугами не предусмотрено законодательством Российской Федерации (гражданам иностранных государств, лицам без гражданства).
Читайте также: