Конденсация водяного пара реферат
Обновлено: 05.07.2024
Испарение - процесс перехода вещества из жидкого состояния в газообразное. Обратный ему процесс, при котором происходит переход вещества из газообразного состояния в жидкое, называется конденсацией. Испарению подвержены все жидкости, но при разных температурах и с разной скоростью. Возможен также переход из твердого состояния в газообразное, минуя жидкость. Такой процесс называется сублимацией или возгонкой. Повседневный опыт показывает, что испарение идет быстрее, если образующиеся пары удаляются от жидкости.
Файлы: 1 файл
Испарение и конденсация.doc
Испарение и конденсация
Испарение - процесс перехода вещества из жидкого состояния в газообразное. Обратный ему процесс, при котором происходит переход вещества из газообразного состояния в жидкое, называется конденсацией. Испарению подвержены все жидкости, но при разных температурах и с разной скоростью. Возможен также переход из твердого состояния в газообразное, минуя жидкость. Такой процесс называется сублимацией или возгонкой. Повседневный опыт показывает, что испарение идет быстрее, если образующиеся пары удаляются от жидкости. И наоборот, если исключить удаление паров (например, закрыть бутылку с водой), то со временем жидкость и пар приходят в равновесие - жидкость больше не испаряется, но и пар не сгущается в жидкость. Пар, находящийся в равновесии со своей жидкостью, называют насыщенным. Как следует из названия, в данном объеме при данных условиях не может быть помещено большее количество пара.
Плотность и давление насыщенного пара при неизменной температуре являются постоянными величинами, хотя и разными для разных жидкостей. Температура оказывает очень большое влияние на давление насыщенного пара. Так, при 0 ° С давление паров воды равно приблизительно 4,6 мм рт. ст., а при 100 ° С уже 760 мм рт. ст.
С точки зрания молекулярного строения жидкости, испарение объясняется следующим образом: молекулы жидкости движутся с самыми разнообразными скоростями. Поскольку для того, чтобы молекула с поверхностного слоя жидкости могла вылететь за ее пределы необходимо совершить работу против сил сцепления, то испаряются только молекулы, имеющие достаточную скорость и кинетическую энергию. Вылетевшие молекулы сталкиваются с другими и могут вернуться обратно в жидкость. Если вылетает больше молекул, чем возвращается - жидкость испаряется. В противном случае происходит конденсация.
Если же число вылетевших и вернувшихся молекул в среднем одинаково в единицу времени, наступает динамическое (подвижное) равновесие между жидкостью и ее паром, пар становится насыщенным.
Рассмотрим процесс кипения жидкости на примере воды.
По мере нагревания сосуда с водой дно и стенки сосуда будут покрываться пузырьками, в которых находятся воздух и пары воды. С увеличением температуры объем пузырьков увеличивается в такой мере, что сумма давления воздуха и пара внутри пузырька всегда равна внешнему давлению. При дальшенйшем увеличении объема пузырька выталкивающая сила заставляет его подниматься вверх.
Если верхние слои воды недостаточно прогреты, часть водяных паров из пузырька конденсируется в воду и он опять уменьшается в размерах. Это попеременное увеличение и уменьшение объема и создает специфический шум закипающей воды. Если же весь объем воды прогрет в достаточной степени, пузырьки не уменьшаются в размерах, а лопаются на поверхности, выпуская пар во внешнее пространство. Все время, пока кипит вода, термометр показывает одну и ту же температуру - 100 ° С.
Итак, кипение происходит при такой температуре, когда давление насыщающих паров жидкости равно наружному давлению. Температура кипения определяется давлением пара и его температурой.
Температура пара кипящей жидкости называется точкой кипения. Точка кипения жидкости зависит от внешнего давления - чем больше давление, тем выше температура кипения. При давлении в 15 атмосфер температура кипения воды близка к 200 ° С.
Давление водяных паров в воздухе принято выражать в барах и миллибарах. Давление в 1 бар равно давлению 750 мм рт. ст.
Абсолютная влажность воздуха - количество водяного пара в 1 м3 воздуха, выраженное в граммах.
Относительная влажность воздуха - отношение давления пара, содержащегося в воздухе, к давлению насыщенного пара при той же температуре, выраженное в процентах.
При понижении температуры воздуха и при постоянном содержании водяного пара относительная влажность возрастает, так как чем ниже температура воздуха, тем ближе водяной пар подходит к состоянию насыщения. При какой-то температуре относительная влажность становится равной 100% и дальнейшее понижение температуры приводит к конденсации водяного пара. Температура, при которой пар данного давления становится насыщенным (и относительная влажность становится равной 100%), называется точкой росы.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Лекция № 7
Испарение и конденсация. Насыщенный пар и его свойства. Влажность воздуха
Взаимные превращения жидкостей и газов - это процессы перехода вещества из одного состояния в другое.
Испарение – это процесс перехода жидкости в пар (газообразное состояние).
Испарение происходит при любой температуре жидкости.
Пар - это газообразное состояние вещества, в которое переходят жидкости при испарении.
Молекулы жидкости при тепловом движении движутся с разными скоростями. Самые быстрые молекулы способны преодолеть притяжение остальных молекул и выскочить из жидкости.
Эти молекулы образуют пары в воздухе.
Скорость испарения жидкости зависит от:
- температуры (чем выше температура жидкости, тем большей скоростью обладают ее молекулы)
- от площади поверхности испаряющейся жидкости (чем больше площадь поверхности, тем большее число быстрых молекул покидает жидкость)
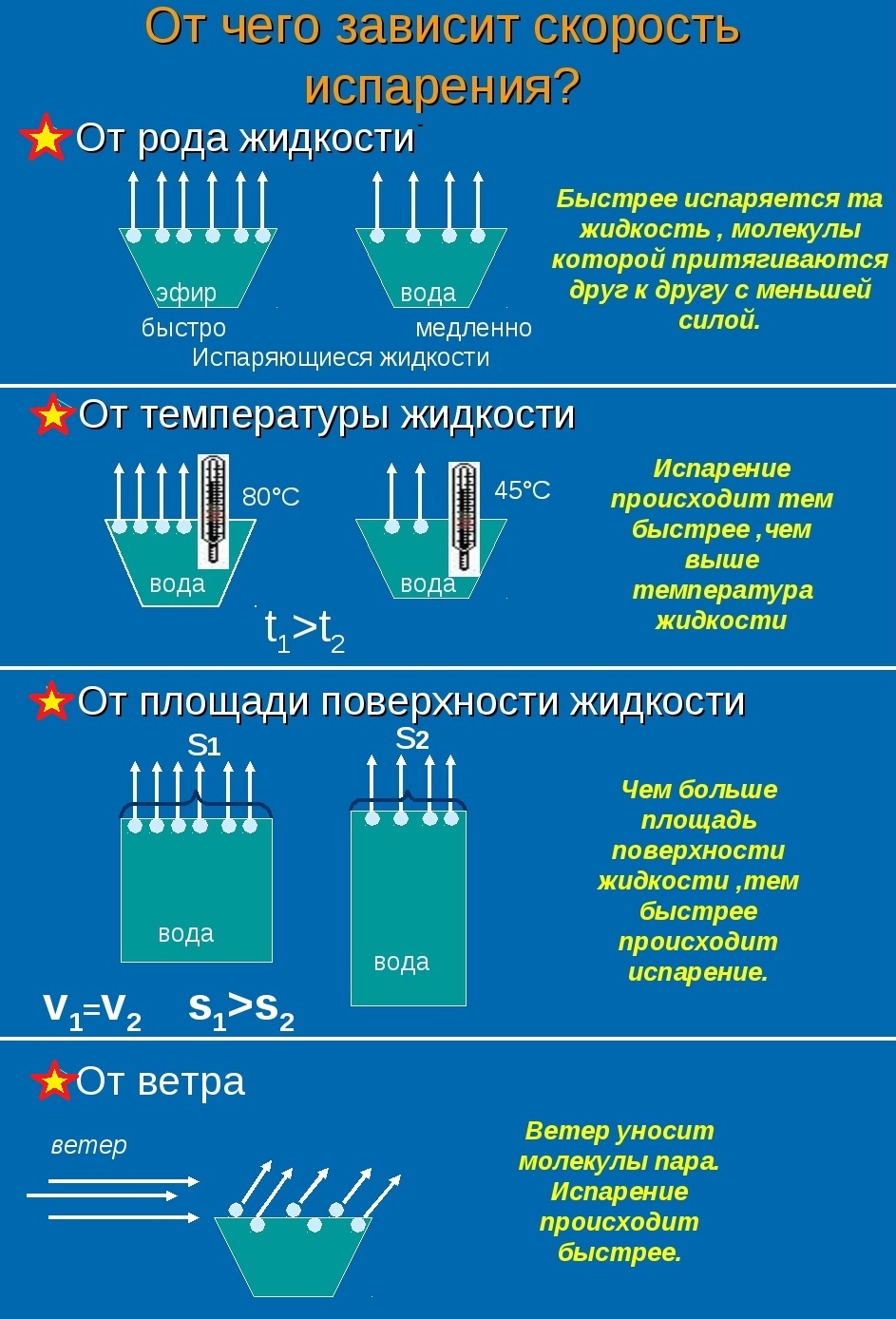
- от наличия ветра над поверхностью жидкости
Так как при испарении жидкость покидают наиболее быстрые молекулы, обладающие соответственно большей кинетической энергией, средняя кинетическая энергия молекул жидкости уменьшается, значит температура жидкости при испарении понижается.
Насыщенный пар
Рассмотрим процесс образования насыщенного пара:
В сосуд наливаем жидкость и закрываем его. Жидкость в сосуде начинает испаряться, и плотность пара над жидкостью в сосуде увеличивается.
В результате теплового движения часть молекул водяного пара возвращается в жидкость. Чем больше плотность водяных паров в сосуде, тем большее число молекул пара возвращается в жидкость.
Через некоторое время в сосуде устанавливается динамическое равновесие между жидкостью и паром:
число молекул, покинувших жидкость за какой-то отрезок времени, становится равным числу молекул, возвращающихся в жидкость за такой же отрезок времени.
В сосуде образовался насыщенный пар.
Насыщенный пар – это пар, находящийся в динамическом равновесии со своей жидкостью.
Давление насыщенного пара
Давление насыщенного пара это давление пара, при котором жидкость находится в равновесии со своим паром.
где
n - концентрация молекул пара
k - постоянная Больцмана
Т - температура
Давление и концентрация молекул (плотность) насыщенного пара при постоянной температуре не зависят от занимаемого паром объема.
Давление насыщенного пара зависит только от его температуры .
Давление насыщенного пара растет как вследствие повышения температуры жидкости, так и вследствие увеличения концентрации молекул пара.
Ненасыщенный пар
Пар называется ненасыщенным , если его давление меньше давления насыщенного пара при данной температуре.
Давление ненасыщенного пара зависит от его объема:
при уменьшении объема давление увеличивается, а при увеличении объема - уменьшается.
Влажность воздуха
Влажность воздуха – это содержание водяного пара в воздухе.
Атмосферный воздух состоит из смеси газов и водяных паров.
Влажность воздуха характеризуется следующими величинами:
1. Абсолютная влажность воздуха – это масса водяных паров, содержащихся в 1 куб. метре воздуха при данных условиях.
Абсолютная влажность воздуха может оцениваться:
а) через плотность водяного пара в воздухе, тогда единицы измерения – г/м3.
б) в метеорологии - через парциальное давление водяного пара, тогда единицы измерения - мм рт. ст. или Па.
Парциальное давление водяного пара – это давление, которое производил бы водяной пар, если бы остальные газы воздуха отсутствовали.
2. Относительная влажность воздуха - это отношение парциального давления водяного пара, содержащегося в воздухе при данной температуре, к давлению насыщенного водяного пара при той же температуре.
Единицы измерения относительной влажности - %.
Ф = *100%
где
р – парциальное давление водяного пара в воздухе при температуре t
р 0 - давление насыщенного водяного пара при той же температуре
В прогнозе погоды указывается величина относительной влажности воздуха в процентах!
Относительная влажность воздуха показывает как близко содержание водяных паров в воздухе к насыщению.
При относительной влажности 100% - в воздухе насыщенный водяной пар.
Прибор для измерения относительной влажности воздуха называется психрометром .
Явление превращения вещества из жидкого состояния в газообразное называется парообразованием. Парообразование может осуществляться в виде двух процессов: испарение и кипение.
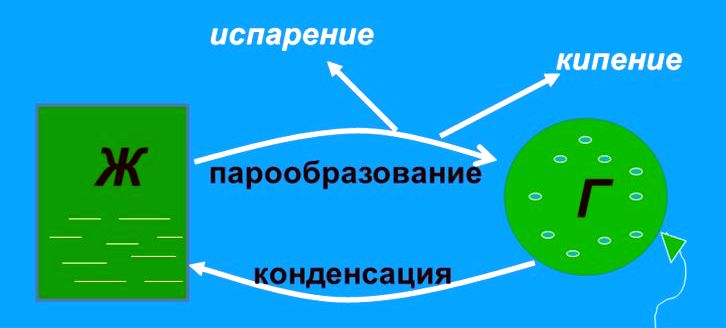
Испарение
Испарение происходит с поверхности жидкости при любой температуре. Так, лужи высыхают и при 10 °С, и при 20 °С, и при 30 °С. Таким образом, испарением называется процесс превращения вещества из жидкого состояния в газообразное, происходящий с поверхности жидкости при любой температуре.
С точки зрения молекулярно-кинетической теории строения вещества испарение жидкости объясняется следующим образом. Молекулы жидкости, участвуя в непрерывном движении, имеют разные скорости. Наиболее быстрые молекулы, находящиеся на границе поверхности воды и воздуха и имеющие сравнительно большую энергию, преодолевают притяжение соседних молекул и покидают жидкость. Таким образом, над жидкостью образуется пар.
Поскольку из жидкости при испарении вылетают молекулы, обладающие большей внутренней энергией по сравнению с энергией молекул, остающихся в жидкости, то средняя скорость и средняя кинетическая энергия молекул жидкости уменьшаются и, следовательно, температура жидкости уменьшается.
Скорость испарения жидкости зависит от рода жидкости. Так, скорость испарения эфира больше, чем скорость испарения воды и растительного масла. Кроме того, скорость испарения зависит от движения воздуха над поверхностью жидкости. Доказательством может служить то, что бельё сохнет быстрее на ветру, чем в безветренном месте при тех же внешних условиях.
Скорость испарения зависит от температуры жидкости. Например, вода при температуре 30 °С испаряется быстрее, чем вода при 10 °С.
Хорошо известно, что вода, налитая в блюдце, испариться быстрее, чем вода такой же массы, налитая в стакан. Следовательно, скорость испарения зависит от площади поверхности жидкости.
Конденсация
Процесс превращения вещества из газообразного состояния в жидкое называется конденсацией.
Процесс конденсации происходит одновременно с процессом испарения. Молекулы, вылетевшие из жидкости и находящиеся над её поверхностью, участвуют в хаотическом движении. Они сталкиваются с другими молекулами, и в какой-то момент времени их скорости могут быть направлены к поверхности жидкости, и молекулы вернутся в неё.
Если сосуд открыт, то процесс испарения происходит быстрее, чем конденсация, и масса жидкости в сосуде уменьшается. Пар, образующийся над жидкостью, называется ненасыщенным.
Если жидкость находится в закрытом сосуде, то вначале число молекул, вылетающих из жидкости, будет больше, чем число молекул, возвращающихся в неё, но с течением времени плотность пара над жидкостью возрастет настолько, что число молекул, покидающих жидкость, станет равным числу молекул, возвращающихся в неё. В этом случае наступает динамическое равновесие жидкости с её паром.

Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называется насыщенным паром.
Если сосуд с жидкостью, в котором находится насыщенный пар, нагреть, то вначале число молекул, вылетающих из жидкости, увеличится и будет больше, чем число молекул, возвращающихся в неё. С течением времени равновесие восстановится, но плотность пара над жидкостью и соответственно его давление увеличатся.
У всех веществ есть три агрегатных состояния – твердое, жидкое и газообразное, которые проявляются при особых условиях.
Фазовый переход – это переход вещества от одного состояния к другому.
Примерами такого процесса являются конденсация и испарение.
Если создать определенные условия, можно превратить любой реальный газ (например, азот, водород, кислород) в жидкость. Для этого необходимо понижение температуры ниже некоторого минимума, называемого критической температурой. Она обозначается T к р . Так, для азота значение этого параметра равно 126 К , для воды – 647 , 3 К , для кислорода – 154 , 3 К . При поддержании комнатной температуры вода может сохранять как газообразное, так и жидкое состояние, а азот и кислород – только газообразное.
Испарение – это фазовый переход вещества в газообразное состояние из жидкого.
Молекулярно-кинетическая теория объясняет этот процесс постепенным перемещением с поверхности жидкости тех молекул, чья кинетическая энергия больше, чем энергия их связи с остальными молекулами жидкого вещества. Вследствие испарения средняя кинетическая энергия оставшихся молекул уменьшается, что, в свою очередь, приводит к снижению температуры жидкости, если к ней не подведен дополнительный источник внешней энергии.
Конденсация – это фазовый переход вещества из газообразного состояния в жидкое (процесс, обратный испарению).
Во время конденсации молекулы пара возвращаются обратно в жидкое состояние.

Рисунок 3 . 4 . 1 . Модель испарения и конденсации.
Динамическое равновесие
Если сосуд, в котором находится жидкость или газ, закупорен, то в таком случае его содержимое может находиться в динамическом равновесии, т.е. скорость процессов конденсации и испарения будет одинаковой (из жидкости будет испаряться столько молекул, сколько возвращается обратно из пара). Такая система получила название двухфазной.
Насыщенный пар – это пар, который находится со своей жидкостью в состоянии динамического равновесия.
Существует зависимость между количеством молекул, испаряющихся с поверхности жидкости в течение одной секунды, и температурой этой жидкости. Скорость процесса конденсации зависит от концентрации молекул пара и скорости их теплового движения, которая, в свою очередь, также находится в прямой зависимости от температуры. Следовательно, можно сделать вывод, что при равновесии жидкости и ее пара концентрация молекул будет определяться равновесной температурой. При повышении температуры необходима высокая концентрация молекул пара, чтобы испарение и конденсация стали одинаковыми по скорости.
Поскольку, как мы уже выяснили, концентрация и температура будут определять давление пара (газа), мы можем сформулировать следующее утверждение:
Давление насыщенного пара p 0 определенного вещества не зависит от объема, но находится в прямой зависимости от температуры.
Именно по этой причине изотермы реальных газов на плоскости включают в себя горизонтальные фрагменты, которые соответствуют двухфазной системе.
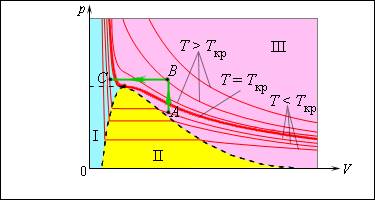
Если температура будет расти, увеличатся и давление насыщенного пара, и его плотность, а вот плотность жидкости, наоборот, будет снижаться из-за теплового расширения. При достижении критической для данного вещества температуры плотность жидкости и газа уравниваются, после прохождения этой точки физические различия между насыщенным паром и жидкостью исчезают.
Возьмем насыщенный пар и будем сжимать его изотермически при T T к р . Его давление будет постепенно возрастать, пока не сравняется с давлением насыщенного пара. Постепенно на дне сосуда появится жидкость, и между ней и ее насыщенным паром возникнет динамическое равновесие. По мере уменьшения объема будет происходить конденсация все большей части пара при неизменном давлении (на изотерме это состояние соответствует горизонтальному участку). После того, как весь пар перейдет в жидкое состояние, давление начнет резко увеличиваться при дальнейшем уменьшении объема, поскольку жидкость сжимается слабо.
Необязательно проходить двухфазную область, чтобы совершить переход от газа к жидкости. Процесс можно провести и в обход критической точки. На изображении такой вариант показан при помощи ломаной линии A B C .

Рисунок 3 . 4 . 3 . Модель изотермы реального газа.
Воздух, которым мы дышим, при некотором давлении всегда включает в себя водяные пары. Это давление, как правило, меньше, чем давление насыщенного пара.
Относительная влажность воздуха – это отношение парциального давления к давлению насыщенного водяного пара.
В виде формулы это можно записать так:
Для описания ненасыщенного пара допустимо использовать и уравнение состояния идеального газа с учетом обычных для реального газа ограничений: не слишком большого давления пара ( p ≤ ( 10 6 – 10 7 ) П а ) и температуры выше значения, определенного для каждого конкретного вещества.
Для описания насыщенного пара применимы законы идеального газа. Однако при этом давление для каждой температуры должно быть определено по кривой равновесия для данного вещества.
Чем выше температура, тем выше давление насыщенного пара. Эту зависимость из законов идеального газа вывести нельзя. При условии постоянной концентрации молекул давление газа будет постоянно возрастать прямо пропорционально температуре. Если пар является насыщенным, то с ростом температуры будет расти не только концентрация, но и средняя кинетическая энергия молекул. Из этого следует, что чем выше температура, тем быстрее растет давление насыщенного пара. Этот процесс происходит быстрее, чем рост давления идеального газа при условии постоянной концентрации молекул в нем.
Что такое кипение
Выше мы указывали, что испарение идет в основном с поверхности, но оно также может происходить и из основного объема жидкости. Любое жидкое вещество включает в себя мелкие газовые пузырьки. Если внешнее давление (т.е. давление газа в них) уравнять с давлением насыщенного пара, то произойдет испарение жидкости внутри пузырьков, и они начнут наполняться паром, расширяться и всплывать на поверхность. Этот процесс называется кипением. Таким образом, температура кипения зависит от внешнего давления.
Жидкость начинает кипеть при такой температуре, при которой внешнее давление и давление ее насыщенных паров будут равны.
Если атмосферное давление нормальное, то для кипения воды нужна температура 100 ° С . При ней давление насыщенных водяных паров будет равно 1 а т м . Если мы будем кипятить воду в горах, то из-за уменьшения атмосферного давления температура кипения снизится до 70 ° С .
Жидкость может кипеть только в открытом сосуде. Если его герметично закрыть, то нарушится равновесие между жидкостью и ее насыщенным паром. Узнать температуру кипения при различных значениях давления можно с помощью кривой равновесия.
Кривые равновесия состояний вещества
На изображении выше с помощью изотерма реального газа показаны процессы фазовых переходов – конденсации и испарения. Эта схема является неполной, поскольку вещество может принимать также и твердое состояние. Достижение термодинамического равновесия между фазами вещества при заданной температуре возможно лишь при определенном давлении в системе.
Кривая фазового равновесия – это зависимость между равновесным давлением и температурой.
Примером такой зависимости может быть кривая равновесия жидкости и насыщенного пара. Если мы построим кривые, отображающие равновесие между фазами одного вещества, на плоскости, то мы увидим определенные области, которые соответствуют разным агрегатным состояниям вещества – жидкому, твердому, газообразному. Кривые, построенные в системе координат, называются фазовыми диаграммами.

Рисунок 3 . 4 . 4 . Типичная фазовая диаграмма вещества. K – критическая точка, T – тройная точка. Область I – твердое тело, область I I – жидкость, область I I I – газообразное вещество.
Равновесие между газообразной и твердой фазой вещества отображает так называемая кривая сублимации (на рисунке она обозначена как 0 T ), между паром и жидкостью – кривая испарения, которая заканчивается в критической точке. Кривая равновесия между жидкостью и твердым телом называется кривой плавления.
Тройная точка – это точка, в которой сходятся все кривые равновесия, т.е. возможны все фазы вещества.
Многие вещества достигают тройной точки при давлении меньше 1 а т м ≈ 10 5 П а . Они плавятся при нагревании в атмосферном давлении. Так, у воды тройная точка имеет координаты T т р = 273 , 16 К , p т р = 6 , 02 · 10 2 П а . Именно на ней основана абсолютная температурная шкала Кельвина.
У некоторых веществ достижение тройной точки происходит и при давлении выше 1 а т м .
Например, для углекислоты нужно давление в 5 , 11 а т м и температура T т р = 216 , 5 К . Если давление равно атмосферному, то для поддержания ее в твердом состоянии нужна низкая температура, а переход в жидкое состояние становится невозможен. Углекислота в равновесии со своим паром при атмосферном давлении называется сухим льдом. Это вещество не способно плавиться, а может только испаряться (сублимировать).
Читайте также:

