Коллаген и эластин реферат
Обновлено: 07.07.2024
Что такое коллаген?
Коллаген — основной структурный белок межклеточного матрикса. Он составляет от 25 до 33% общего количества белка в организме, или, иначе говоря, 6% массы тела.
Какова его роль?
Коллаген в дерме — это каркас кожи. Представьте себе ортопедический матрас. Коллаген выполняет ровно ту же опорную функцию, что его пружины, и считается основой 3D-матрикса. Кроме того, именно этот белок обеспечивает прочность, пластичность тканей, является главным строительным материалом не только дермы, но и связок на лице и теле, суставов, межпозвоночных дисков
Как усилить синтез коллагена?
Здесь можно говорить и об инъекционных препаратах, и об аппаратных методиках, и о приеме определенных ингредиентов внутрь. Каких именно? Список более чем обширен. Скажем, при нехватке аминокислот синтез коллагена будет неизбежно затрудняться. И в таком случае нужно добавлять либо аминокислотные комплексы, либо гидролизат коллагена, который помогает уменьшить этот дефицит. Кроме того, в синтезе коллагена участвует витамин С. Так что, дорогие курильщики, каждая сигарета вредит не только вашим легким!
Почему так эффективны именно инъекции коллагена?
Какие ритуалы нужно включать в свою бьюти-рутину, чтобы поддерживать должный уровень коллагена?
Во-первых, не забывайте о правильном питании и ни в коем случае не исключайте из рациона белок. Откажитесь от сахара: он разрушает коллаген и эластин. И обязательно пейте жидкость с pH выше 7.0 рекомендуемого объема на массу тела. Ни чай, ни кофе абсолютно всех видов в эту категорию не попадают.
Ну, а во-вторых, скорректируйте свою бьюти-рутину. Сделайте ставку на кремы, содержащие регуляторные пептиды: они как раз и способствуют синтезу коллагена. Очень многие ошибочно считают, что одной сыворотки для повседневного ухода достаточно. Это не совсем так, потому что сверху должны использоваться базовый и солнцезащитный кремы. И да, последний необходимо наносить на кожу круглый год.
А как вы относитесь к питьевому коллагену?
Это интересный продукт, но выбирайте зарекомендованных производителей и хорошую дозировку. Получив необходимый гидролизат коллагена, организм сам решает, куда его потратить: в первую очередь он пойдет на восстановление наиболее важных участков. Вы можете пить биодобавку, однако внешний вид, скорее всего, сразу не улучшится — к этому надо быть готовым.
Как влияет стресс на выработку коллагена?
Если мы говорим о хроническом стрессе, конечно, питательная активность тканей будет снижаться. Организм сначала отправляет в топку глюкозу, затем аминокислоты (особенно быстро человек начинает терять альбумин в крови). В итоге неизбежно начинает страдать общий уровень белка в тканях. Так что спокойствие, спокойствие и еще раз спокойствие!
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Министерство образования и науки Российской Федерации
федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
Институт Естествознания и Экономики
ПО ДИСЦИПЛИНЕ
БИОЛОГИЧЕСКАЯ ХИМИЯ
Коллаген – главный белок соединительной ткани
Направление подготовки: 050100 Педагогическое образование
Профиль подготовки: Биология
Форма обучения: очная
Доцент кафедры химия
Коллаге́н — фибриллярный белок, составляющий основу соединительной ткани организма (сухожилие, кость, хрящ, дерма и т. п.) и обеспечивающий её прочность и эластичность. Коллаген обнаружен у многоклеточных животных; отсутствует у растений, бактерий, вирусов, простейших и грибов. Коллаген - основной компонент соединительной ткани и самый распространённый белок у млекопитающих, составляющий от 25 % до 35 % белков во всём теле, т.е. 6% массы тела. Название "коллаген" объединяет семейство близкородственных фибриллярных белков, которые являются основным белковым элементом кожи, костей, сухожилий, хряща, кровеносных сосудов, зубов. В разных тканях преобладают разные типы коллагена, а это, в свою очередь, определяется той ролью, которую коллаген играет в конкретном органе или ткани.
Молекула коллагена (тропоколлагена) построена из трех пептидных цепей, каждая из которых содержит около 1000 аминокислотных остатков. Необычен аминокислотный состав коллагена: каждая третья аминокислота – это глицин, 20 % составляют остатки пролина и гидроксипролина, 10 % - аланина, остальные 40 % представлены всеми другими аминокислотами. Коллаген – единственный белок, в котором содержится гидроксипролин. Эта аминокислота получается путем гидроксилирования части остатков пролина уже после образования пептидных цепей.
Коллаген – сложный белок, гликопротеин: содержит моносахаридные (галактозильные) и дисахаридные (галактозилглюкозильные) остатки, соединенные с гидроксильными группами некоторых остатков оксилизина.
Учёные десятилетиями не могли понять молекулярное строение коллагена. Первое доказательство того, что коллаген имеет постоянную структуру на молекулярном уровне, было представлено в середине 30-х годов прошлого века. С того времени много выдающихся учёных, включая Нобелевских лауреатов, таких как Фрэнсис Крик, Лайнус Полинг, Александр Рич, Ада Йонат, Хелен Берман, Вилеайнур Рамачандран работали над строением мономера коллагена.
Коллаген синтезируют и поставляют в межклеточный матрикс почти все клетки (фибробласты, хондробласты, остеобласты, одонтобласты, цементобласты, кератобласты и др.). Синтез и созревание коллагена является сложным многоэтапным процессом, который начинается в клетке и заканчивается в межклеточном матриксе. Нарушения синтеза коллагена, обусловленные мутацией в генах, а также в процессе трансляции и пост- трансляционной модификации сопровождаются появлением дефектных коллагенов. Поскольку около 50% всех коллагеновых белков содержатся в тканях скелета, а остальные 40% в дерме и 10% в строме внутренних органов, то нарушения синтеза коллагена сопровождаются патологией как костно-суставной системы, так и внутренних органов.
Синтез коллагена включает два этапа. На внутриклеточном этапе происходит трансляция и посттрансляционная модификация полипептидных цепей, и на внеклеточном - модификации белка, завершающаяся образованием коллагеновых волокон (рис.1).
Внутриклеточный этап синтеза коллагена. Пептидные α-цепи коллагена синтезируются на полирибосомах, связанных с мембранами эндоплазматической сети. Её синтезированные пептидные цепи в цистернах подвергаются посттрансляционной модификации, которая включает:
• удаление сигнального пептида проколлагеновой цепи при участии специфической протеиназы;
• гидроксилирование остатков пролина и лизина, которое начинается в период трансляции полипептидной цепи вплоть до её отделения от рибосом.
Реакции гидроксилирования катализируют оксигеназы. В реакции гидроксилирования используются О2 и 2-оксоглутарат, а в качестве кофактора участвует аскорбиновая кислота. Гидроксилазы пролина и лизина в активном центре содержат Fе2+, а аскорбиновая кислота, которая легко окисляется в дегидроаскорбиновую кислоту, необходима для сохранения атома железа в ферроформе (рис.2). В реакциях гидроксилирования один атом кислорода присоединяется к четвёртому атому углерода в остатке пролина, а второй атом кислорода включается в янтарную кислоту, которая образуется при декарбоксилировании 2-оксоглутарата (рис.3).
Наряду с гидроксилированием пролина происходит гидроксилирование остатков лизина с образованием 5-гидроксилизина. В дальнейшем гидроксилированные остатки лизина подвергаются гликозилированию(рис.4).
При участии гликозилтрансфераз образуются ковалентные О-гликозидные связи между 5-ОН группой гидроксилизина и остатком галактозы или дисахаридом галактозилглюкозой. К амидной группе аспарагина присоединяются молекулы N-ацетилглюкозамина или маннозы. Одновременно с гидроксилированием пролина формируется стабильная трёхспиральная структура коллагена. Из эндоплазматической сети молекулы проколлагена перемещаются в аппарат Гольджи, где они включаются в секреторные пузырьки и в их составе секретируются во внеклеточное пространство (рис.5).
Внеклеточный этап - модификация молекул проколлагена. В межклеточном пространстве при участии протеолитических ферментов от молекулы проколлагена отщепляются N- и С-концевые пептиды и освобождается тройная спираль коллагена (тропоколлагена). Далее происходит процесс самосборки коллагеновых фибрилл, фиксированных межмолекулярными ковалентными связями (сшивками). В формировании этих связей участвуют остатки лизина и 5-гидроксилизина и их альдегидные производные, которые образуются вследствие окислительного дезаминирования. Окислительное дезаминирование лизина и 5-гидроксилизина происходит с участием лизилоксидазы. Особенностью этого фермента является присутствие Cu2+ в активном центре. Молекулы лизилоксидазы синтезируются в клетке в виде проферментов и после связывания с ионами Cu2+ упаковываются в везикулы, которые покидают клетку. На клеточной поверхности молекула пролизилоксидазы подвергается ограниченному протеолизу и в сфор- мировавшемся активном центре при участии ионов Cu2+ происходит окисление остатка тирозина до тирозинхинона. Образовавшаяся в активном центре хиноидная структура связывает остатки лизина в молекуле проколлагена с образованием фермент-субстратного комплекса (рис.6).
На следующем этапе аллизин и 5-гидроксиаллизин конденсируются вместе с лизиловыми и гидроксилизиловыми остатками; формируются внутри- и межмолекулярные поперечные связи. В реакции конденсации аллизина с остатком лизина другой цепи образуется основание Шиффа. В случае альдольной конденсации двух остатков аллизина образуются альдольные межмолекулярные связи (лизиннорлейцин) (рис.7).
Альдольная конденсация характерна для коллагена костной ткани и дентина, а основания Шиффа наиболее часто встречаются в коллагенах сухожилий.
Около 25% молекул тропоколлагена распадается, не образуя фибрилл. Получившиеся фрагменты выполняют сигнальные функции и стимулируют коллагеногенез. Пространственная организация фибрилл завершается при участии фибронектина, протеогликанов и коллагенов, ассоциированных с фибриллами.
Коллаген - ярко выраженный полиморфный белок. В настоящее время известно 19 типов коллагена, которые отличаются друг от друга по первичной структуре пептидных цепей, функциям и локализации в организме. Вариантов α-цепей, образующих тройную спираль, гораздо больше 19 (около 30). Для обозначения каждого вида коллагена пользуются определённой формулой, в которой тип коллагена записывается римской цифрой в скобках, а для обозначения α-цепей используют арабские цифры: например коллагены II и III типа образованы идентичными α-цепями, их формулы, соответственно [α1(II)]3 и [α1(III)]3; коллагены I и IV типов являются гетеротримерами и образуются обычно двумя разными типами α-цепей, их формулы, соответственно [α1(I)]2α2(I) и [α1(IV)]2α2(IV). Индекс за скобкой обозначает количество идентичных α-цепей (табл. 1).
Гены коллагена называются соответственно типам коллагена и записываются арабскими цифрами, например COL1 - ген коллагена I типа, COL2 - ген коллагена II типа, COL7 - ген коллагена VII типа и т.д. К этому символу приписываются буква А (обозначает α-цепь) и арабская цифра (обозначает вид a-цепи). Например, COL1A1 и COL1A2 кодируют, соответственно, α1 и α2-цепи коллагена I типа.
Молекула коллагена представляет собой правозакрученную спираль из трёх α-цепей. Такое образование известно под названием тропоколлаген. Один виток спирали α-цепи содержит три аминокислотных остатка. Молекулярная масса коллагена около 300 кДа, длина 300 нм, толщина 1,5 нм.
Коллаген относится к тем немногим белкам животного происхождения, которые содержат остатки нестандартных аминокислот: около 21 % от общего числа остатков приходится на 3-гидроксипролин, 4-гидроксипролин и 5-гидроксилизин. Каждая из α-цепей состоит из триад аминокислот. В триадах третья аминокислота всегда глицин, вторая — пролин или лизин, первая — любая другая аминокислота, кроме трёх перечисленных.
Выделяют 19 типов коллагена, которые подразделяют на несколько классов в зависимости от того, какие структуры они могут образовывать.
95% всего коллагена в организме человека составляют коллагены I, II и III типов, которые образуют очень прочные фибриллы. Значительное содержание именно этих типов коллагена объясняется тем, что они являются основными структурными компонентами органов и тканей, которые испытывают постоянную или периодическую механическую нагрузку (кости, сухожилия, хрящи, межпозвоночные диски, кровеносные сосуды), а также участвуют в образовании стромы паренхиматозных органов. Поэтому коллагены I, II и III типов часто называют интерстициальными. К классу фибриллообразующих относят также минорные коллагены V и XI типов (рис.8).
Этот класс объединяет коллагены, которые выполняют очень важную функцию: они ограничивают размер фибрилл, образуемых интерстициальными коллагенами (прежде всего, I и II типов), и участвуют в организации межклеточного матрикса в костях, коже, хрящах, сухожилиях. К этим коллагенам относят коллагены IX, XII, XIV и XVI типов. Коллагены этого класса сами фибрилл не формируют, но непосредственно связаны с фибриллами, которые образуют интерстициальные коллагены.
К этому классу относят коллагены IV, VIII, X типов. Особенности строения и функционирования таких белков можно рассмотреть на примере наиболее изученных к настоящему времени коллагенов IV и VIII типов.
Коллаген IV типа является ключевым структурным компонентом базальных мембран, которые представляют собой особую форму межклеточного матрикса. Его секретируют различные типы клеток: эпителиальные, эндотелиальные, мышечные, нервные, жировые. Особенностью коллагена IV типа является то, что повторяющиеся спирализованные участки с последовательностью (Гли-х-у)nчасто прерываются короткими неспиральными сегментами. Это, вероятно, увеличивает гибкость коллагена IV типа и способствует образованию на его основе сетчатых структур (рис.9).
К этому классу относят коллаген VI типа, который является короткоцепочечным белком. Он образует микрофибриллы, которые располагаются между крупными фибриллами интерстициальных коллагенов. Этот коллаген широко представлен в хрящевом матриксе, но больше всего его содержится в межпозвоночных дисках: в nucleus pulposus он составляет -20% общего коллагена. Две молекулы этого коллагена соединяются антипараллельно с образованием димера. Из димеров образуются тетрамеры, которые секретируются из клетки, и вне клетки связываются "конец в конец" с образованием микрофибрилл.
Функции коллагена VI типа пока полностью не ясны, хотя известно, что его микрофибриллы могут связываться со многими компонентами межклеточного матрикса: фибриллами интерстициальных коллагенов, гиалуроновой кислотой, протеогликанами. Молекула этого коллагена содержит многочисленные последовательности Арг-Гли-Асп (RGD), поэтому возможно его участие в клеточной адгезии через присоединение к мембранным адгезивным молекулам, например интегринам α1β1 и α2β1 (рис.10).
К этому классу относят коллагены VII и XVII типов, которые называют также коллагенами, связанными с эпителием, так как они обычно находятся в местах соединения эпителия с субэпителиальными слоями.
Коллаген VII типа - основной структурный компонент "заякоренных" фибрилл. Каждая молекула этого белка содержит два неколлагеновых домена (НК1 - у С-конца, НК2 - у N-конца) и один коллагеновый домен между ними. Из мономеров образуются димеры, при этом молекулы соединяются в области НК2-доменов антипараллельно по отношению друг к другу. Затем НК2домены отщепляются, и димеры соединяются между собой "бок о бок" с образованием фибрилл (рис.11).
Эти фибриллы играют важную роль в присоединении эпидермиса к дерме, так как одним концом они могут присоединяться к lamina densa, на которой лежит кожный эпителий, а другой их конец проникает в более глубокие субэпидермальные слои кожи и связывается там со структурами, называемыми "якорные диски".
Коллаген XVII типа представляет собой трансмембранный белок и обычно находится в гемидесмосомах эпидермиса. Предполагают, что этот коллаген взаимодействует с другими молекулами гемидесмосом и таким образом участвует в процессе присоединения эпидермиса к дерме.
Как и любой белок, коллаген функционирует в организме определённое время. Его относят к медленно обменивающимся белкам; Т1/2 составляет недели или месяцы. Разрушение коллагеновых волокон осуществляется активными формами кислорода и/или ферментативно (гидролитически).
Нативный коллаген не гидролизуется обычными пептидгидролазами. Основной фермент его катаболизма - коллагеназа, которая расщепляет пептидные связи в определённых участках спирализованных областей коллагена. Известны 2 типа коллагеназ:
1.Тканевая коллагеназа присутствует у человека в различных органах и тканях. В норме она синтезируется клетками соединительной ткани, прежде всего, фибробластами и макрофагами. Тканевая коллагеназа - металлозависимый фермент, который содержит Zn2+ в активном центре. В настоящее время известно 4 изоформы этого фермента. Активность коллагеназы зависит от соотношения в межклеточном матриксе её активаторов и ингибиторов. Среди активаторов особую роль играют плазмин, калликреин и катепсин В. Тканевая коллагеназа обладает высокой специфичностью, она перерезает тройную спираль коллагена в определённом месте, примерно на 1/4 расстояния от С-конца, между остатками глицина и лейцина (или изолейцина) (рис.12).
Образующиеся фрагменты коллагена растворимы в воде, при температуре тела они спонтанно денатурируются и становятся доступными для действия других протеолитических ферментов. Нарушение катаболизма коллагена ведёт к фиброзу органов и тканей (в основном печени и лёгких). А усиление распада коллагена происходит при аутоиммунных заболеваниях (ревматоидном артрите и системной красной волчанке) в результате избыточного синтеза коллагеназы при иммунном ответе.
2.Бактериальная коллагеназа синтезируется некоторыми микроорганизмами. Например,Clostridium histolyticum (возбудитель газовой гангрены) выделяет коллагеназу, расщепляющую пептидную цепь коллагена более чем в 200 местах. Этот фермент гидролизует следующую связь -X-Гли-Про-У- между звеньями X и Гли.
Таким образом разрушаются соединительнотканные барьеры в организме человека, что обеспечивает проникновение (или инвазию) этого микроорганизма и способствует возникновению и развитию газовой гангрены. Сам возбудитель не содержит коллагена и поэтому не подвержен действию коллагеназы.
У молодых людей обмен коллагена протекает интенсивно, с возрастом (и особенно в старости) заметно снижается, так как у пожилых и старых людей увеличивается количество поперечных сшивок, что затрудняет доступность коллагена для действия коллагеназы. Поэтому, если у молодых людей в возрасте 10-20 лет содержание гидроксипролина в моче может достигать 200 мг/сут, то с возрастом экскреция гидроксипролина снижается до 15-20 мг/сут.
В некоторых ситуациях синтез коллагена заметно увеличивается. Например, фибробласты мигрируют в заживающую рану и начинают активно синтезировать в этой области основные компоненты межклеточного матрикса. Результат этих процессов - образование на месте раны соединительнотканного рубца, содержащего большое количество хаотично расположенных фибрилл коллагена. Сходным образом происходит замещение погибающих клеток соединительной тканью в печени при циррозе, в стенках артерий при атеросклерозе, в мышцах при их дистрофии.
Коллаген является основным белком соединительной ткани млекопитающих и составляет около 30% от общей массы белков организма. Существование разновидностей волокнистой соединительной ткани: рыхлой и плотной (оформленной и неоформленной) во многом объясняется наличием всевозможных комбинаций различных типов коллагена, молекулы которых кодируются почти 20 генами.
Коллаген входит в состав косметических средств, используемых для:
1)образования воздухопроницаемого, влагоудерживающего слоя на поверхности кожи, обладающего пластифицирующими (разглаживающими) свойствами, со свойствами влажного компресса;
2)пролонгирования действия экстрактов, масел и др. в составе косметических композиций;
3)придания блеска волосам, создания коллагенового (защитного) слоя на поверхности волос.
1. Бурджанадзе Т.В. Термодинамическое обоснование водно-мостиковой структуры коллагена Биофизика, 1992;37(2):231-237.
2. Вавилова Т.П. Биохимия тканей и жидкостей полостей рта: учебное пособие / - 2-е изд., испр. и доп. - 2008. - 208 с. : ил.
3. Михайлов А.Н. Коллаген кожного покрова и основы его переработки. М., 1971;527.
4.Николаев А.Я. Биологическая химия.- 3-е изд., перераб. и доп.-М.: Медицинское информационное агенство.-2004.-566 с.: ил.
5. Павлова В.Н, Копьева Т.П, Слуцкий Л.И, Павлов Г.Г. Хрящ. М., 1988:325.
6. Степанов B.M. Молекулярная биология. М., 1996; 334.
7. Церетели Г.И. Тепловая денатурация коллагена в растворе и фибриллах. Биофизика 1982;27(5):780-784.
• Основная функция коллагена состоит в обеспечении структурной опоры тканей
• Коллагены представляют собой семейство, состоящее более чем из 20 различных белков внеклеточного матрикса. Эти белки — наиболее распространенные в царстве животных
• Коллагеновые субъединицы выходят из клеток и затем, во внеклеточном пространстве, собираются в более крупные фибриллы и волокна
• Мутации в коллагеновых генах вызывают множество патологических состояний, начиная от появления морщин до развития хрупкости костей и таких тяжелых заболеваний, как образование кожных волдырей
Семейство коллагенов включает более 20 белков, которые относятся к наиболее распространенным белкам клеток животных. У многоклеточных организмов коллагены существуют по крайней мере 500 млн лет. Почти все клетки животных синтезируют и секретируют по меньшей мере одну из форм коллагена.
Коллагены обеспечивают тканям структурную поддержку и существуют во множественных формах, организованных в различные структуры. Все белки семейства коллагенов характеризуются одним общим свойством: они собраны в тонкие (примерно 1,5 нм диаметром) тройные спиральные суперспирализованные структуры, состоящие из трех субъединиц коллагеновых белков, которые удерживаются вместе ковалентными и нековалентными связями.
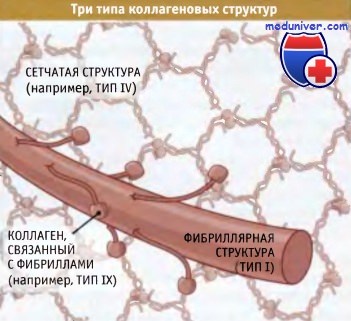
Коллагеновые субъединицы собираются в тройные спиральные структуры, которые организуются в фибриллы или в сеть,
где они связаны между собой другими белками внеклеточного матрикса, включая коллагены, связанные с фибриллами.
Суперспирализованные структуры бывают трех типов — фибриллярные, слоистые и связанные с фибринами:
• Слоистые коллагены представляют собой сеть, состоящую из суперспирализованных спиральных структур. Они в меньшей степени устойчивы к мышечным усилиям, но гораздо лучше противостоят растяжению в нескольких направлениях. Сеть таких структур, например, характерна для кожи.
Независимо от организации, коллагены образуют основную каркасную структуру внеклеточного матрикса. Такие входящие во внеклеточный матрикс белки, как фибронектин и витронектин, связываются с коллагенами и вплетены в структуры, образованные коллагеновым каркасом. Один из представителей семейства коллагенов представляет собой трансмембранный белок, который участвует в формировании межклеточных контактов.
Существует примерно 20 различных типов коллагена, большая часть которых может быть сгруппирована в четыре класса. Каждая из тройных спиралеобразных структур обозначается римской цифрой (I, II, III и т. д.). Каждая коллагеновая субъединица имеет обозначение как субъединица а, а ее типу присвоен номер (а1, а2, а3 и т. д.), после которого римской цифрой обозначен тип, в котором она находится. Например, основной фибриллярный коллаген хвоста (и других тканей) крыс относится к типу I и состоит из двух копий субъединиц а1(1) и одной копии субъединицы а2 (I).
На рисунке ниже представлена структура коллагеновых волокон. Три полипептидные субъединицы параллельно обернуты вокруг друг друга и образуют суперспирализованную спиральную структуру длиной 300 нм. Для коллагенов характерна повторяющаяся последовательность аминокислот, содержащая элемент глицин-X-Y, где X и Y могут представлять собой любую аминокислоту, но обычно это пролин и гидроксипролин соответственно.
Такая последовательность способствует плотной упаковке трех субъединиц и облегчает образование суперспиральной структуры. Субъединицы длиной 300 нм скрепляются вместе посредством ковалентных связей, которые образуются между N-концевым участком одной субъединицы и С-концевым участком примыкающей к ней. Суперспирализованные спиральные структуры располагаются параллельно, образуя между собой небольшие зазоры (64-67 нм). Эти зазоры обеспечивают характерный вид (исчерченность) фибрилл, видимый в электронном микроскопе.

Коллагеновые белки подразделяются на четыре основные группы, которые отличаются по молекулярной формуле,
характеру полимерных форм и по распределению в тканях. Некоторые группы включают коллагены нескольких типов.
Полностью собранные коллагеновые структуры (фибриллярные или сетчатые) по размерам оказываются гораздо больше, чем сами клетки; некоторые фибриллы могут достигать нескольких миллиметров длины. Таким образом, субъединицы коллагена синтезируются и секретируются в виде суперспирализованных спиральных структур, и окончательные этапы их сборки происходят вне клетки. Как показано на рисунке ниже, синтез коллагена и дальнейший его процессинг происходят на протяжении всего секреторного пути. При синтезе коллагеновые белки направляются в гранулярный эндоплазматический ретикулум (ЭПР) при участии частиц, распознающих сигнал и связанного с ними белкового аппарата.
После того как проколлагены попали в просвет ЭР, по мере транспорта из ЭР через аппарат Гольджи и в секреторные везикулы, они претерпевают серию модификаций. В процессе транспорта проколлагена через ЭР и аппарат Гольджи, к боковым цепям пролина и лизина, находящимся в средней части молекул проколлагена, добавляются гидроксильные группы (-ОН). При этом образуются гидроксипролин и гидроксилизин.
Эти модификации обеспечивают правильное образование водородных связей, которые скрепляют вместе три субъединицы в суперспирализованной спиральной структуре. Между амино- и карбоксиконцевыми частями пропептидов образуются дисульфидные связи, которые затем обеспечивают правильное расположение трех проколлагеновых субъединиц с образованием тройной спиральной суперспирализованной структуры. Затем спираль образуется спонтанно, в направлении от С-конца к N-концу.
Пропептиды препятствуют взаимодействию суперспирализованных спиралей друг с другом, тем самым предотвращая полимеризацию коллагена в клетке. Когда произошла секреция тройных спиралей проколлагена, ферменты, которые называются протеазы проколлагена, отщепляют пропептиды. Остающийся белок, известный под названием тропоколлагена, почти весь организован в тройную спираль и представляет собой основную структурную единицу коллагеновой фибриллы.
Фибриллы собираются просто: боковые цепи лизина в тропоколлагене модифицируются при действии фермента лизилоксидазы, образуя аллизины. Эти модифицированные лизины образуют ковалентные сшивки, которые обеспечивают полимеризацию тропоколлагенов. Лизилоксидаза представляет собой внеклеточный фермент, и эта стадия сборки фибрилл происходит только после выхода проколлагена из клетки. После сборки фибриллы могут объединяться, образуя большие пучки или волокна, характерные для фибриллярного коллагена.
Мутации в коллагеновом гене типа IV приводят к нарушению сборки базальной ламины в большинстве эпителиальных тканей и к развитию такого кожного заболевания, как буллезный эпидермоз.
Клетки связываются с коллагеном посредством специфических рецепторов, называемых интегринами. Эти рецепторы обеспечивают возможность обратимого связывания клеток с коллагенами по мере их движения по внеклеточному матриксу. Интегриновые рецепторы также активируют пути передачи сигналов, так что связывание с коллагенами (и с другими белками внеклеточного матрикса) изменяет активность в клетке биохимических процессов и, таким образом, способствует контролю над ростом и дифференцировкой клеток.
Схематическое строение тройной спиральной структуры коллагена (наверху),
организация витой структуры в фибрилле (в середине) и фибрилл в коллагеновом волокне (внизу).
Наличие 67-нм зазора между соседними спиральными структурами обусловливает видимую в электронном микроскопе исчерченность фибрилл, составляющих волокно. Посттрансляционная модификация и сборка субъединиц проколлагена в тройные спиральные структуры происходит при внутриклеточном перемещении по секреторному пути.
Однако сборка фибрилл происходит во внеклеточном пространстве после секреции тройных спиралей, обладающих витой структурой.
Для упрощения в тройных структурах не показаны гидроксильные группы и сахарные остатки. Лизилоксидаза катализирует ковалентное связывание двух боковых цепей лизина с образованием аллизинов (альдегидных производных лизина),
которые затем образуют между собой альдольную связь.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
В организме человека присутствует два вида белков: коллаген и эластин, которые отвечают за целостность, структуру и динамическое движение всех тканей. В данной статье обсудим именно эластин, его формирование и роль в организме.
Как и коллаген, эластин находится только во внеклеточном матриксе, наибольшую его концентрацию регистрируют в глубокой дерме - 2%. Он является необходимым компонентном таких жизненноважных структур организма человека, как артерии, легкие, соединительная ткань сердца, мочевой пузырь, сухожилии, то есть тех структур, которые постоянно растягиваются и сжимаются. Именно это свойство отличает эластин от коллагена - возвращаться в исходное состояние после растяжения. Жизнь волокон эластина, избежавших деградацию, может достигать до 75 лет.
Образование эластина происходит в межклеточном матриксе в несколько этапов.
Данный процесс называется эластогенез. Сначала формируются мономерные молекулы тропоэластина, далее они подвергаются продольной сшивке лизилоксидазой (LOX). При связывании с фибулином, молекулы тропоэластина образовывают водонерастворимый клубок. Процесс связывания десятков таких аморфных клубков приводит к образованию волокон полимерных молекул эластина, в которых хаотичным образом создаются поперечные сшивки лизин-пролина и лизин-аланина, благодаря которым волокна зрелого эластина легко подвергаются растяжению, а затем способны быстро принимать прежнюю форму.
Активный синтез эластина у млекопитающих происходит в период формирования плода в утробе матери, с рождением синтез эластина начинает постепенно замедляться и к 50 годам полностью прекращает свою активность. Локальная активация синтеза эластина обнаружена при повреждении соединительной ткани или кожи, а также при патологиях, например, при онкологии. Важнейшую роль в синтезе эластина играют цитокины, которые способоны, как активировать, так и подавлять данный процесс. Доказано, что стимулирующее воздействие на формирование эластина оказывают факторы: TGFβ1 и IGF-I. Одновременно им противодействуют bFGF/FGF-2, HBEGF,EGF, PDGF-BB, TGFα, TNF-α и IL-1β факторы.
Говоря о деградации волокон эластина, данный процесс осуществляется под действием трех ферментов эластазы:
- Фермент ММР-12 “отщипывает” молекулу тропоэластина в 89 местах
- Фермент ММР-7 “откусывает” молекулу тропоэластина в 58 местах
- Фермент ММР-9 в 63 местах
При этом в случае повреждения глубокой дермы происходит стимуляция синтеза эластаза ММР-12, который при нормальных условия производится макрофагами.
Огромное влияние на состояние и изменение внеклеточного матрикса оказывает ультрафиолет. Было выявлено, что УФ-излучение снижает содержание гомолога 1 лизилоксидазы (LOXL1) и активирует элафин. Как результат, накапливается нефункциональный эластин, который представляет собой агрегаты с элафином, при этом количество полноценных фибрилл значительно снижается. Кроме этого, с возрастом активируется эластаза неприлизин, производимый фибробластами. Он разрушает волокна эластина, которые уже ранее пострадали от эластаз ММР-7,9 и 12, что в итоге приводит к упадку эластиновых структур и общему ухудшению показателей кожи: упругости и эластичности.
Эластокины
Пептиды эластина, способные быть триггерами внутриклеточных молекулярных реакций. С помощью эксперимента были выявлены следующие активные пептиды эластина: GVYPG, GFGPG, GVLPG, YGARPGVGVGGIP и PGFGAVPGA. Самый изученный эластокин у человека - VGVAPG, VG-6, который входит в состав домена 24. Данный пептид оказывает стимулирующее воздействие на различные процессы, происходящие в фибробластах: меланогенез, деление прораковых, синовиальных, дендритных клеток и плателетов. В астроцитах пептид VGVAPG спобоствует снижению окиси азота и увеличивает концентрацию свободных радикалов кислорода. В фиброзной соединительной ткани присутствуют лишь фрагменты полимеров тропоэластина и эластина, чем обуславливается жесткость, например, шрамов. В раковых клетках VGVAPG приводит в действие эластазы ММР-2 и ММР-14, которые в итоге способствуют распространению раковых клеток из первичного очага в другие ткани.
Информация о способности фибрилл эластина взаимодействовать с клетками, дала возможность определить рецепторы эластина. Было установлено, что контакт производится через белок-медиатор эластонектин. Формирование эластонектина стимулируется фрагментами волокон эластина.
Главным рецептором для VGVAPG и других пептидов эластина является белок ЕВР.
Выявлено, что продолжительная активация данного белка приводит, например, к утолщению сосудистой ткани и пролиферации мускольной ткани.
У белка ЕВР отсутствует ферментативная функция, но он обладает двумя функциональными областями:
- для связывания с эластокинами или с интактным эластином
- для связывания сахаров
В заключении необходимо добавить, что сегодня эластин является крайне популярным объектом для изучения. Уже сейчас были выделены эластиноподобные полипептиды (ЭПП), которые по своим характеристикам не устапают естественному эластину. Однако, для выведения их в повсеместное использование они должны зарекомендовать себя, как безопасные и не вызывающие воспалительные реакции субстанции.
Читайте также:

