Катодное восстановление окислителей водорода и кислорода реферат
Обновлено: 07.07.2024
При электрохимической коррозии выделяют два взаимосвязанных процесса: анодный и катодный.
- Анодный процесс – окисление металла, проходит на участках изделий с меньшим потенциалом в данной среде. Анодные участки разрушаются.
- Катодный процесс – восстановление окислителя, находящегося в растворе или расплаве электролита, происходит на участках изделий с бóльшим потенциалом в данной среде. Катодные участки химически не изменяются. Они служат проводниками электронов от анодных участков к окислителю, чем усиливают коррозию анодных участков. Более подробно это будет рассмотрено далее на конкретных примерах.
Окислители при коррозии принято называть деполяризаторами. Коррозию с участием наиболее распространенных окислителей – растворенного кислорода и ионов водорода (кислоты или воды) соответственно называют коррозией с кислородной и водородной деполяризацией. Уравнения катодных процессов приведены в таблице.
| Уравнения катодного процесса при коррозии | |
| с водородной деполяризацией (в отсутствие растворенного О2) | с кислородной деполяризацией в присутствии растворенного О2) |
| кислая среда | |
| (1) | (3) |
| нейтральная и щелочная среда | |
| (2) | (4) |
Окислительно-восстановительные потенциалы кислорода и водорода в различных средах (точнее, соответствующих окислительно-восстановительных пар) указаны в таблице.
| Кислая среда (рН = 0) | Нейтральная среда (рН = 7) | Щелочная среда (рН = 14) | |||
| Oк/Вс | Е 0 , В | Oк/Вс | Е 0 , В | Oк/Вс | Е 0 , В |
| 2H + /H2 | 0,00 | 2H2O/H2 | -0,41 | 2H2O/H2 | -0,83 |
| O2/2H2O | +1,22 | O2/4OH – | +0,81 | O2/4OH – | +0,40 |
Окислительные свойства кислорода выше окислительных свойств иона водорода (или воды). В присутствии кислорода в растворе коррозия необязательно будет проходить за счет кислородной деполяризации, так как концентрация растворенного кислорода, как правило, невелика. Установлено, что при рН³7, т.е. в нейтральных и щелочных растворах, процесс обычно протекает с кислородной деполяризацией - уравнение (4), в кислых средах – преимущественно с водородной деполяризацией - уравнение (1).
Коррозия, как и любой окислительно-восстановительный процесс, может осуществляться только при условии, что потенциал окислителя больше потенциала восстановителя (металла анодных участков).
Электрохимическая коррозия — самопроизвольный окислительно-восстановительный процесс разрушения металлов и сплавов под влиянием внешних факторов, в котором, в отличие от химической коррозии, наблюдается направленное движение электронов от окисляемого металла к окислителю.
Электрохимическая коррозия возникает, когда соприкасаются два металла различной активности . Различие в энергиях ионизации и в величине сродства к электрону заставляет электроны переходить от более активного металла к менее активному, что и запускает процесс электрохимической коррозии.
Механизм электрохимической коррозии.
Процессы электрохимической коррозии протекают по законам электрохимической кинетики, когда общая реакция взаимодействия может быть разделена на следующие процессы:
1) анодный процесс — переход ионов окисленного металла в раствор, сопровождающийся гидратацией (сольватацией):
2) омический процесс — перетекание освободившихся электронов от анодных участков к катодным и движение ионов в растворе;
3) катодный процесс — ассимиляция электронов каким-либо окислителем, при этом происходит катодное восстановление окислителя Ох:
Окислителями при коррозии служат молекулы кислорода О2, хлора Cl2, ионы Н + , Fe 3+ , NO3 – и др. Наиболее часто при коррозии в нейтральной и щелочной среде наблюдается восстановление кислорода:
а в кислой среде — выделение водорода:
Коррозия с участием молекулярного кислорода называется коррозией с кислородной деполяризацией. Коррозия с участием ионов водорода называется коррозией с водородной деполяризацией.
Кроме электрохимических реакций при коррозии обычно протекают вторичные химические процессы, например взаимодействие образующихся ионов металла с гидроксид-ионами, концентрация которых повышается в результате катодных реакций:
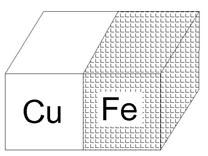 |
| Рис. 5. Атмосферная коррозия в результате контакта меди и железа |
Например, если железо находится в контакте с медью в атмосфере влажного воздуха (рис. 5), то менее активный металл медь выступает в роли катода, на котором происходит восстановление окислителя, а материал анода окисляется.
Возникает гальванопара, при работе которой происходят процессы:
анод Fe 0 – 2 → Fe 2+ ;
Далее происходят вторичные процессы:
Образующийся гидроксид железа (II) легко окисляется кислородом воздуха, что в конечном итоге приводит к образованию ржавчины mFe2O3 · nFeO · pH2O.
Образование гальванического элемента (гальванопары) из двух различных по активности металлов приводит к коррозии более сильной, чем для исходного активного металла. Например, цинк в растворе соляной кислоты (Е 0 Zn2+/Zn 0 = – 0,762 B) реагирует с выделением водорода:
или в ионном виде:
Zn + 2H + = Zn 2+ + H2↑;
но постепенно изолируется от раствора мелкими пузырьками образовавшегося газа, в результате чего его дальнейшее растворение прекращается.
Медь с разбавленной соляной кислотой не реагирует, так как находится в ряду напряжений после водорода, её стандартный электродный потенциал Е 0 Cu2+/Cu 0 = +0,34 B. Но цинк в контакте с медью образует в разбавленной соляной кислоте коррозионную гальванопару:
В кислой среде наблюдается электрохимическая коррозия Zn с водородной деполяризацией, в которой роль анода играет более электроотрицательный (более активный) металл — цинк, так как
В процессе коррозии цинк растворяется:
анод: Zn – 2 → Zn 2+ (окисление);
омический процесс — переход электронов с анода на катод:
катод: 2H + + 2 → H2 (на поверхности меди).
Продукт коррозии в кислой среде — хлорид цинка:
Zn 2+ + 2Cl – = ZnCl2.
Очень часто электрохимическая коррозия возникает, когда металл содержит вкрапления металла меньшей активности или неметаллические, но, вместе с тем, токопроводящие включения (как, например, происходит в стали, где есть многочисленные включения карбида железа FeC3), становящиеся катодными участками электрохимической коррозии.
В качестве примера рассмотрим железо, которое в качестве примеси содержит включения меди (рис. 6). Вся конструкция погружена в разбавленный раствор соляной кислоты HCl. На поверхности меди происходит восстановление окислителя, а материал анода окисляется и растворяется:
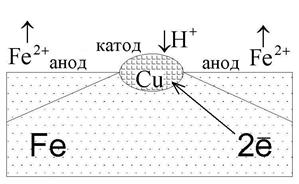 | HCl ←→ H + + Cl – . Анод Fe 0 – 2? → Fe 2+ ; Fe 2+ +2Cl – ←→ FeCl2. Катод H + + ? → Н 0 ; 2H 0 ←→ H2↑. |
| Рис. 6. Коррозия железа с включениями меди |
Электрохимическая коррозия и ЭДС гальванопары.
Возможность протекания коррозии может быть установлена по знаку ЭДС образующегося гальванического элемента. Если ЭДС > 0, то коррозия возможна. ЭДС равна разности потенциалов окислителя и восстановителя (катода и анода), поэтому коррозия возможна при условии, что потенциал катода (окислителя) положительнее потенциала анода (восстановителя). Если на аноде идет растворение металла, то должно быть ЕОх > ЕMen + /Me 0 .
Потенциал кислородного электрода при 298 К описывается уравнением:
Потенциал водородного электрода описывается уравнением:
Графики зависимостей приведены на рис. 7, по ним можно определить возможность протекания коррозии различных металлов в водных средах.
Если потенциал металла положительнее потенциала кислородного электрода (который равен +1,2 В в кислой среде при pH = 1 и составляет около +0,8 В в нейтральной среде при pH = 7), то коррозия металла невозможна (область III).
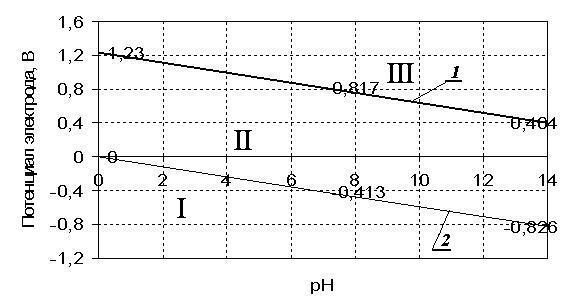 |
| Рис. 7. Зависимость потенциала кислородного (линия 1) и водородного (линия 2) электродов от значения pH среды при PO2 и PH2 = 1 атм |
Если потенциал металла положительнее потенциала водородного электрода (последний равен нулю в кислых средах при pH = 1 и составляет около – 0,41 В в нейтральной среде при pH = 7) и отрицательнее потенциала кислородного электрода (область II), то коррозия возможна с поглощением кислорода и невозможна с выделением водорода.
Если потенциал металла отрицательнее потенциала водородного электрода (область I), то возможна коррозия как с поглощением кислорода, так и с выделением водорода. К таким металлам относятся щелочные, щелочноземельные, алюминий, цинк, и др.
Скорость электрохимической коррозии.
Действие гальванических элементов в значительной мере зависит от поляризации и деполяризации. При этом может происходить как поляризация анода, которая выражается в том, что его потенциал становится более положительным, так и поляризация катода, вызываемая смещением его потенциала в отрицательную сторону.
Поляризация снижает скорость коррозии во много раз. Без поляризации многие металлы, в том числе и железо, корродировали бы с такой высокой скоростью, что потеряли бы свое техническое значение.
Скорость электрохимической коррозии можно определить по формуле:
где I — сила тока, величина которого указывает на скорость коррозии; R — омическое сопротивление раствора электролита; Па — поляризация анода, Пк — поляризация катода; Е — электродвижущая сила.
В зависимости от того, какая из величин (R, Па, Пк) оказывает ограничительное действие на скорость процесса, различают коррозию с различным контролем:
Контролирующая стадия является лимитирующей для всего процесса, т.е. ограничивает скорость коррозии в целом, так как протекает медленнее других. Возможен и смешанный контроль, когда слагаемые в знаменателе приблизительно равны по величине.
Коррозия металла в средах, имеющих ионную проводимость, протекает через анодное окисление металла
и катодное восстановление окислителя
Окислителями при коррозии служат молекулы кислорода хлора ионы и др. Наиболее часто при коррозии наблюдается ионизация (восстановление) кислорода
и выделение водорода
Коррозия с участием кислорода называется коррозией с поглощением кислорода (коррозия с кислородной деполяризацией). Коррозия с участием ионов водорода называется коррозией с выделением водорода (коррозия с водородной деполяризацией)
Кроме анодных и катодных реакций при электрохимической коррозии происходит движение электронов в металле и ионов в электролите. Электролитами могут быть растворы солей, кислот и оснований, морская вода, почвенная вода, вода атмосферы, содержащая и другие газы. Кроме электрохимических реакций при коррозии обычно протекают вторичные химические реакции, например взаимодействие ионов металла с гидроксид-ионами, концентрация которых повышается в результате катодных реакций
Как видно, процессы электрохимической коррозии подобны процессам, протекающим в гальванических элементах.
Основным отличием процессов электрохимической коррозии от процессов в гальваническом элементе является отсутствие внешней цепи. Электроны в процессе коррозии не выходят из корродирующего металла, а двигаются внутри металла. Химическая энергия реакции окисления металла передается не в виде работы, а лишь в виде теплоты. Схема электрохимической коррозии железа в контакте с углеродом приведена на рис. VIII, 1. На анодных участках происходит реакция окисления железа
На катодных участках происходит восстановление водорода
Рис. VIII. 1. Схема электрохимической коррозии железа в растворе кислоты
На рис. VIII.1 представлена схема коррозии металла с энергетически неоднородной поверхностью, имеющей участки железа и углерода.
Причинами энергетической неоднородности поверхности металла и сплава могут быть неоднородность сплава по химическому и фазовому составам, наличие примесей в металле, пленок на его поверхности и др. На поверхности металла могут быть участки, на которых катодные реакции протекают быстрее (катализируются), чем на других участках. Поэтому катодный процесс в основном будет протекать на этих участках; они называются катодными участками. Наличие участков, на которых катодные реакции протекают быстрее, увеличивает скорость коррозионного процесса. На других участках будет протекать в основном растворение металла и поэтому они называются анодными участками. Катодные и анодные участки чередуются и имеют очень малые размеры, т. е. речь идет о микроанодах и микрокатодах и соответственно о коррозионных микроэлементах. Таким образом, при наличии энергетической неоднородности поверхности металла коррозионный процесс заключается в работе огромного числа коррозионных микроэлементов. Коррозионный элемент в отличие от гальванического является коротко-замкнутым микроэлементом.
Однако разрушение металла по механизму работы короткозамкнутых элементов — не единственный путь электрохимической коррозии. Иногда энергетическая неоднородность металлов невелика и отсутствуют участки, катализирующие катодные реакции. Тогда как катодные, так и анодные процессы идут по всей поверхности металла. Коррозионный процесс в отсутствие участков, катализирующих катодные реакции, протекает медленнее, чем при наличии катодных катализаторов. Так, например, цинк высокой степени чистоты растворяется в растворе серной кислоты значительно медленнее, чем технический цинк, содержащий примеси, катализирующие реакцию выделения водорода.
Термодинамика электрохимической коррозии.
Рассмотрим условия, при которых возможна коррозия с кислородной и водородной деполяризацией. Коррозия как самопрозвольный процесс протекает, если энергия Гиббса реакции имеет отрицательное значение. А так как энергия Гиббса реакции непосредственно связана с ЭДС элемента то возможность протекания коррозии может быть установлена по знаку ЭДС элемента. Если ЭДС элемента имеет положительное значение то коррозия возможна. Так как ЭДС равна разности потенциалов окислителя и восстановителя , то коррозия возможна при условии, что потенциал окислителя положительнее потенциала металла: .
Потенциал кислородного электрода при 298 К описывается уравнением
Потенциал водородного электрода описывается уравнением
По рис. VI 1.4 можно определить возможность протекания коррозии различных металлов. Если потенциал металла положительнее потенциала кислородного электрода (область 5), то коррозия металла невозможна. Потенциал золота, например, в отсутствие комплексообразователя во всей области pH положительнее потенциала кислородного электрода, поэтому золото с поглощением и выделением корродировать не может. Если потенциал металла положительнее потенциала водородного электрода и отрицательнее потенциала кислородного электрода (область 2), то коррозия возможна с поглощением кислорода и невозможна с выделением водорода. Потенциалы многих металлов лежат в области 2. Наконец, если потенциал металла (область 1) отрицательнее потенциала водородного электрода, то возможна коррозия как с поглощением кислорода, так и с выделением водорода. К таким металлам относятся щелочные и щелочноземельные металлы, алюминий, цинк и др.
Таким образом, при контакте раствора электролита с атмосферой большинство металлов может корродировать в нем с поглощением кислорода и лишь некоторые металлы — с выделением водорода.
Скорость электрохимической коррозии.
Разность потенциалов металла и окислителя определяет возможность коррозии. Более важной характеристикой служит скорость коррозии, выражаемая через потери металла в единицу времени. Скорость коррозии может быть также выражена по закону Фарадея через ток или плотность тока.
Так как электрохимическая коррозия протекает через несколько взаимосвязанных стадий, то скорость ее зависит от скорости самой медленной стадии, называемой лимитирующей (контролирующей) стадией процесса. Все остальные стадии вынуждены иметь скорость, равную скорости лимитирующей стадии процесса. Поскольку коррозионные элементы являются короткозамкнутыми микроэлементами, движение электронов в металле не может быть лимитирующей стадией процесса. Движение ионов в растворе обычно также не лимитирует процесс коррозии ввиду очень малого расстояния между микроэлементами (исключение составляют растворы с очень малой электрической проводимостью). Следовательно, лимитирующими стадиями могут быть или реакции анодного окисления металла (анодный контроль), или реакции катодного восстановления окислителя (катодный контроль), или те и другие одновременно (смешанный контроль).
Рассмотрим случай коррозии с лимитирующей катодной
реакцией. Большинство металлов может корродировать с поглощением кислорода, причем реакция катодного восстановления кислорода часто бывает лимитирующей стадией коррозии. Растворимость кислорода в воде и водных растворах мала; так, при кПа (парциальное давление кислорода в атмосфере) в воде может быть растворено моль/см3 кислорода. Поэтому катодное восстановление кислорода обычно лимитируется скоростью диффузии кислорода и реакция протекает с концентрационной поляризацией. Максимальная скорость восстановления кислорода и соответственно максимальная скорость коррозии определяются предельной плотностью тока восстановления кислорода по уравнению (VII. 19):
где — коэффициент диффузии кислорода; — концентрация кислорода в растворе; — толщина диффузионного слоя.
Скорость коррозии с кислородной деполяризацией растет с увеличением коэффициента диффузии, растворимости кислорода и при перемешивании раствора (уменьшается б). Кривая зависимости скорости коррозии от температуры в системе, сообщающейся с атмосферой, проходит через максимум при Это обусловлено увеличением коэффициента диффузии кислорода и уменьшением растворимости кислорода в воде при повышении температуры.
Для борьбы с коррозией металла, контролируемой скоростью восстановления кислорода, следует снижать концентрацию кислорода, например, введением восстановителя в раствор или снижением давления кислорода над раствором. Скорость коррозии можно также снизить, изолируя металл от кислорода тем или иным способом. Изменение состава катодных участков мало влияет на коррозию с поглощением кислорода. Поэтому степень чистоты металла обычно не играет существенной роли при коррозии с поглощением кислорода.
Если потенциал металла отрицательнее потенциала водородного электрода, то процесс коррозии протекает как с поглощением кислорода, так и с выделением водорода. Если кислород в системе отсутствует или быстро расходуется в результате коррозии, например, в закрытой системе, то коррозия протекает лишь с выделением водорода. Однако и при наличии кислорода в системе скорость его восстановления в некоторых случаях мала по сравнению со скоростью выделения водорода, например, в растворе кислоты на цинке, железе, марганце. При этом в первом приближении можно пренебречь скоростью коррозии за счет поглощения кислорода и говорить лишь о скорости коррозии с выделением водорода. Ввиду большой подвижности ионов обычно стадия подвода не лимитирует реакцию катодного выделения водорода. Скорость процесса определяется скоростью собственной реакции восстановления ионов или соединением атомов водорода в молекулу .
Скорость катодного выделения водорода возрастает с увеличением температуры и концентрации ионов водорода (снижения pH). На скорость этого процесса заметно влияет природа катодных участков. Некоторые металлы, например платина, кобальт, никель и др., катализируют выделение водорода и катодный процесс на них протекает с высокими скоростями. Поэтому, если в составе металла или сплава находятся металлы, катализирующие выделение водорода, то коророзия может ускоряться за счет этих компонентов в сплаве. Другие металлы, например ртуть, свинец, кадмий, цинк, не катализируют или слабо катализируют катодное выделение водорода, и катодный процесс на них протекает медленно. Поэтому присутствие в составе сплава таких компонентов или не меняет скорости коррозии основного металла, или снижает ее из-за уменьшения площади поверхности, занимаемой основным металлом, на которой происходят и растворение металла и выделение водорода. Влияние природы металла на скорость выделения водорода количественно можно оценить по перенапряжению водорода на различных металлах (см. табл. VII.3). Чем ниже перенапряжение водорода, тем большей каталитической активностью к реакции выделения водорода обладает металл и тем выше скорость выделения водорода при данном потенциале катодного участка, а следовательно, .и больше скорость коррозии. Чем выше перенапряжение, тем меньше и скорость выделения водорода при данном потенциале катодного участка, тем ниже скорость коррозии металла. Таким образом, скорость коррозии с выделением водорода может быть замедлена снижением температуры и уменьшением концентрации ионов очисткой металла от примесей, катализирующих выделение водорода, а также изоляцией поверхности металла. Перемешивание раствора практически не влияет на скорость выделения водорода.
До сих пор рассматривалась скорость коррозии, лимитируемая катодными реакциями. Однако иногда коррозия может контролироваться и анодными реакциями. Обычно это наблюдается на металлах, способных пассивироваться, таких, как хром, алюминий, титан, цирконий, никель, тантал и др. Пассивностью металла называется состояние его повышенной коррозионной устойчивости, вызванное торможением анодного процесса. Согласно термодинамическим расчетам, пассивный металл может подвергаться коррозии, но практически не корродирует из-за того, что анодное растворение его протекает крайне медленно. Например, стандартные потенциалы алюминия , циркония , титана хрома значительно отрицательнее потенциалов кислородного и водородного электродов, поэтому можно было бы ожидать, что они будут корродировать как с выделением водорода, так и с поглощением кислорода. Однако они отличаются высокой коррозионной стойкостью благодаря склонности к пассивации. Пассивность в основном вызывается
образованием на поверхности металла оксидных или иных защитных слоев. Сильные окислители способствуют или даже вызывают пассивацию металлов.
Окислители играют двойную роль в коррозионных процессах. С одной стороны, они могут восстанавливаться и этим ускорять коррозию металлов, а с другой (для металла, способного к пассивации) — вызвать пассивацию металла и резкое торможение коррозии. Некоторые ионы, например ионы наоборот, активируют металлы, препятствуя их пассивации. Причиной активирующей способности ионов является его высокая адсорбируемость на металле и высокая растворимость хлоридов металла. Ионы вытесняют пассиваторы с поверхности металла, способствуя растворению пассивирующих пленок, и облегчают переход ионов металла в раствор. Поэтому в присутствии в растворе ионов и других активаторов у многих металлов способность к пассивации уменьшается или вообще исчезает. Особенно большое влияние ионы оказывают на растворение железа, хрома, никеля, алюминия и др.
При рассмотрении кинетики коррозионных процессов в растворах электролитов до сих пор принималось, что процесс в основном протекает по электрохимическому механизу, так как скорость коррозии по химическому механизму (т. е. прямому взаимодействию окислителя с металлом) мала. Однако советским ученым Я. М. Колотыркиным с сотр. было установлено, что некоторые металлы (железо хром) в растворах некоторых кислот (например, ) могут корродировать по химическому механизму с более высокими скоростями, чем по электрохимическому механизму.

1.1 Правила расчёта степени окисления (СО)……………..……….
Глава 2. КЛАССИФИКАЦИЯ ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ……………………….….……
2.1 Межмолекулярные окислительно –восстановительные реакции ……………….………………………..…………………..…
2.2 Внутримолекулярные окислительно –восстановительные реакции ……………….………………………..…………………..…
Глава 3. МЕТОД ЭЛЕКТРОННОГО БАЛАНСА………………..……
5.2 Этапы развития представлений об окислительно – восстановительных реакциях………………………………………..
Химия – фундаментальная наука, тесно связанная с материальным миром знакомство с химией как с наукой начинается со школьного урока. Именно на уроке впервые зарождается интерес к науке химии, именно на уроке ребята учатся писать первые химические формулы и уравнения реакций, именно на уроке начинают понимать химическую картину мира.
Окружающий мир постоянно изменяется. С каждым годом во все области человеческой деятельности поступает огромное количество различных веществ, роль химических знаний становится очевидной, и ценность их постоянно возрастает. Именно знания о химических процессах в значительной степени могут обеспечить экологически грамотное отношение к природе и умелое обращение с веществами. Глубокое изучение основ химии очень важно специалистам большинства отраслей народного хозяйства: будущим врачам, химикам-технологам, инженерам – биотехнологам, военным специалистам, агрономам, ветеринарам и т. д.
Окислительно-восстановительные процессы принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Окисление-восстановление - один из важнейших процессов природы. С этими реакциями связана жизнь любого живого существа: процессы обмена веществ в организме, фотосинтез, гниение и брожение. Окислительно-восстановительные реакции можно наблюдать при сгорании топлива, коррозии металлов, электролизе и выплавке металлов. С их помощью получают щелочи, кислоты и многие другие ценные химические вещества. Эти же реакции лежат в основе преобразования химической энергии в электрическую в гальванических и топливных элементах. Таким образом, окружающий нас мир можно рассматривать как гигантскую химическую лабораторию, в которой ежесекундно протекают химические реакции в основном окислительно-восстановительные.
Развитие представлений об окислительно-восстановительных реакциях началось с работ русского ученого и педагога С.В. Дайна, преподавателя Томского технологического института, который не только сформулировал и обобщил принципиальные особенности этого типа реакций, но и разработал методический подход к трактовке и изучению ОВР, как ряда последовательных стадий. Он теоретически обосновал и развил практические методы подбора стехиометрических коэффициентов в реакциях данного типа, фактически не претерпевшие изменений до настоящего времени.
При изучении школьного курса химии основной из задач учителя является формирование ключевых понятий (информационных, интеллектуальных, организационных, социальных, жизненных, предметных: обобщенно-теоретических и прикладных) у учащихся.
Если понятия не сформированы, то не могут быть усвоены ни законы, ни теории, поэтому данная проблема находится в центре внимания методистов и учителей. Согласно данным психолого-дидактических исследований можно выделить ключевые шаги формирования понятий:
применение понятий при усвоении новых знаний;
уточнение и закрепление содержания понятий.
Особенностью программы по химии является её концентричность, т.е. повторяемость из года в год одних и тех же тем с добавлением новых сведений, что способствует усвоению курса химии за весь период обучения. Такой подход делает процесс формирования понятий преемственным и непрерывным.
Изучение окислительно-восстановительных реакций вызывает у учащихся определенные трудности. Особенно сложно воспринимаются такие реакции в курсе органической химии, а между тем данная тема включена в задания части А, Б, С при сдаче экзамена в форме ЕГЭ. Все это требует поисков новых, нестандартных решений, оптимизации способов подачи материала.
- Глава 1. ПРИЗНАКИ ОИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ. СТЕПЕНЬ ОКИСЛЕНИЯ
- Глава 2. КЛАССИФИКАЦИЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
- Глава 4. НАПРАВЛЕННОСТЬ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ В РАСТВОРАХ
Окислительно-восстановительные реакции (ОВР) – это такие химические реакции, в которых происходит передача электронов от одних частиц (атомов, молекул, ионов) к другим, в результате чего степень окисления атомов, входящих в состав этих частиц, изменяется.
Наличие атомов, у которых в ходе реакции изменяется степень окисления - характерный признак ОВР.
Степень окисления (СО) – формальный заряд, который можно приписать атому, входящему в состав какой-либо частицы (молекулы, иона), исходя из предположения о чисто ионном характере связи в данной частице (частица состоит из ионизированных атомов).
1.1 Правила расчета степени окисления (СО)
Сумма СО всех атомов в частице равна заряду этой частицы (в простых веществах СО всех атомов равна 0).
В соединениях с ионным и ковалентно-полярным характером связи более электроотрицательным атомам соответствует более низкая СО. В бинарных ионных соединениях, атомы неметалла, как правило, проявляют минимальные СО.
Постоянную степень окисления имеют атомы: щелочных металлов (+1), щелочноземельных металлов (+2), водорода (+1) (кроме гидридов NaH, CaH2 и др., где степень окисления водорода -1), кислорода (-2) (кроме F2 -1 O +2 и пероксидов, содержащих группу –O–O–, в которой степень окисления кислорода -1). Например, в CaO2: СО(Сa)= +2, СО(О)= -1.
Степени окисления атомов в простых веществах равны нулю (Na 0 ; H2 0 ).
Максимальная СО равна номеру группы (для короткопериодного варианта периодической таблицы элементов Д.И. Менделеева), за исключением ряда элементов, входящих в VIIIБ и IБ-подгруппы, и некоторых f-элементов. Минимальная СО неметаллов = Nгр -8 . Например P +5 и P -3 , S +6 и S -2 .
Окислитель (Ox) – частица, которая в ходе ОВР приобретает электроны.
Восстановитель (Red) – частица, которая в ходе ОВР отдаёт электроны.
Восстановление – процесс, в ходе которого окислитель приобретает электроны и переходит в сопряжённую восстановленную форму. При восстановлении степень окисления понижается:
Mn +4 + 2ē → Mn +2 ; S 0 + 2ē → S -2 ; Cr +6 +3ē → Cr +3 ;
Cl2 0 +2ē → 2Cl - ; O2 0 + 4ē → 2O -2 .
Окисление – процесс, в ходе которого восстановитель отдаёт электроны и переходит в сопряжённую окисленную форму.
При окислении степень окисления повышается:
H2 0 - 2ē → 2H + ; S -2 - 2ē → S 0 ; Al 0 - 3ē → Al +3 ;
Fe +2 - ē → Fe +3 ; 2Br - - 2ē → Br2 0 .
Условная форма записи ОВР:
Cu 2+ + Zn 0 = Zn 2+ + Cu 0
Межмолекулярные окислительно-восстановительные реакции
Окислитель и восстановитель находятся в разных веществах; обмен электронами в этих реакциях происходит между различными атомами или молекулами:
S - восстановитель; O2 - окислитель
Внутримолекулярные окислительно - восстановительные реакции
Во внутримолекулярных реакциях окислитель и восстановитель находятся в одной и той же молекуле. Внутримолекулярные реакции протекают, как правило, при термическом разложении веществ, содержащих окислитель и восстановитель.
2KCl +5 O -2 → 2KCl -1 + 3O 0
Cl +5 - окислитель; О -2 – восстановитель
Диспропорционирование
Диспропорционирование - окислительно-восстановительная реакция, в которой один элемент одновременно повышает и понижает степень окисления.
Cl 2 0 + 2KOH → KCl +1 O + KCl -1 + H2O
Глава 3. МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
Уравнивание ОВР основано на записи полуреакций окисления и восстановления.
Алгоритм метода:
Найти атомы, у которых изменяется СО, и составить схему полуреакций окисления и восстановления с участием этих атомов.
Уравнять каждую полуреакцию, добиваясь:
материального баланса (равенства числа атомов каждого элемента в правой и левой частях уравнения)
баланса по зарядам (равенства суммарных зарядов в правой и левой частях уравнения реакции). Для этого к левой части полуреакции добавляют или вычитают из неё необходимое количество электронов.
Умножить каждую полуреакцию на коэффициенты:
учитывающие стехиометрию реагирующих (образующихся) молекул (численное отношение между атомами в полуреакциях должно соответствовать стехиометрии молекул)
для достижения электронного баланса: сумма отданных электронов должна быть равна сумме принятых электронов.
Сложить полуреакции (при этом Σe = 0).
Проверить материальный баланс.

Одна из ключевых задач химии – предсказание направления и глубины протекания химической реакции. В случае ОВР имеется удобная возможность экспериментального

определения как максимальной полезной электрохимической работы

при постоянных давлении (р) и температуре (Т): . Знак “-“ перед Аэл.хим соответствует термодинамической системе знаков. Он означает, что система совершает работу Аэл.хим над окружающей средой. Неравенству соответствует протекание неравновесного и необратимого процесса, равенство выполняется для обратимых равновесных окислительно-восстановительных процессов, в которых отсутствуют другие виды работ (кроме работы расширения р∆V): Действительно, характерная особенность ОВР, отличающая этот вид химических реакций от других, состоит в том, что процессы окисления и восстановления можно пространственно разделить, если проводить реакцию в электрохимической цепи. При этом удаётся осуществить перенос электронов через металлический проводник и измерить величину, непосредственно
связанную с Аэл.хим, а именно электродвижущую силу (ЭДС).
Рассмотрим устройство и работу электрохимической цепи на примере элемента Даниэля (рис.1). Он состоит из цинкового электрода, погруженного в раствор сульфата цинка, и медного электрода, погруженного в раствор сульфата меди. Электроды соединены металлическим проводником, а растворы – солевым мостиком. Солевой мостик – это трубка, заполненная концентрированным раствором электролита с равными или близкими подвижностями анионов и катионов (например, КCl). Один конец трубки погружён в раствор ZnSO4, другой – CuSO4. При погружении металлического проводника в раствор, содержащий катионы того же самого металла, устанавливается динамическое равновесие между катионами М n+ , находящимися в растворе, и атомами М на поверхности электрода: М n+ + ne=М.
Часть атомов М в виде катионов М n+ переходит в раствор, в тоже время катионы М n+ могут восстанавливаться на поверхности электрода. Если преобладает прямая реакция, то пластина заряжается положительно, а раствор вблизи электрода отрицательно. Если преимущественно идёт обратная реакция, то пластина заряжается отрицательно, а раствор вблизи электрода – положительно. В любом случае в результате пространственного разделения зарядов противоположного знака на границе электрод – раствор образуется разность потенциалов - двойной электрический слой. Величина электрического потенциала электрода называется
электродным потенциалом (обозначение или ). Она зависит от температуры, природы металла, состава раствора и концентрации катионов M n+ . Чем активнее металл, тем ниже его электродный потенциал, в частности . Для того, чтобы в электрохимической цепи протекала окислительно-восстановительная реакция, необходимо, чтобы электроды были соединены проводником, а растворы - солевым мостиком. В этом случае электроны перемещаются от электрода с меньшим потенциалом (Zn) к электроду с большим потенциалом (Cu).
Элемент Даниэля.

Э лектрод, на котором протекает процесс окисления, называется анодом Zn 0 –2e = Zn 2+ . Электрод, на котором протекает процесс восстановления, называется катодом Сu 2+ + 2e = Cu 0 .
Если ОВР в электрохимической цепи протекает самопроизвольно, то такая цепь называется гальваническим элементом. Гальванические элементы находят применение в качестве химических источников тока. Если ОВР идёт под внешним воздействием в направлении, противоположном самопроизвольному, то такая электрохимическая цепь называется электролитической ячейкой. В ней протекает электролиз. Действительно, если к элементу Даниэля подключить внешний источник тока и подать на Сu- и Zn-электроды достаточно большие положительный и отрицательный потенциалы, соответственно, то на электродах будут протекать процессы, противоположные самопроизвольным:
Читайте также:

