Изоэлектрическая точка белка реферат
Обновлено: 05.07.2024
1. Физико-химические свойства белков в связи со структурными особенностями. Факторы стабилизации белковых растворов (структурная организация, наличие заряда, наличие гидратной оболочки).
2. Способы осаждения белков (обратимые – высаливание, изоэлектрическое осаждение; необратимые - денатурация). Практическое применение.
3. Методы очистки белков от низкомолекулярных примесей (диализ, ультрафильтрация)
4. Хроматографические методы разделения белков (гель-хроматография, ионообменная хроматография, аффинная хроматография, адсорбционная хроматография). Принципы методов. Практическое применение.
5. Электрофорез белков сыворотки крови. Принцип, диагностическое значение. Особенности протеинограммы в детском возрасте. Диагностическое значение метода.
Различия белков по форме молекул.
Различия белков по молекулярной массе.
Суммарный заряд белков.
На –N, -C концах есть α-амино-, α-карбоксильная группы, способные к ионизации.
При pH около 7, все ионогенные группы находятся в ионизированном состоянии.
В кислой среде увеличение концентрации протонов (H + ) приводит к подавлению диссоциации карбоксильных групп и уменьшение отрицательного заряда белка: -COO - + H + = -COOH.
В щелочной среде Связывание избытка OH - и протонами, образующимися при диссоциации NH3 + с образование воды, приводит к уменьшению положительного заряда: -NH3 + + OH - = -NH2 + H2O
Соотношение полярных и неполярных групп на поверхности нативных молекул белков.
Растворимость белков.
Заряд белковой молекулы. На поверхности белковой молекулы имеются как положительно, так и отрицательно заряженные радикалы аминокислот. Количество этих групп, следовательно, и суммарный заряд белков зависят от рН среды. Значение рН, при котором белок имеет суммарный нулевой заряд, называется изоэлектрической точкой (ИЭТ). В ИЭТ количество положительно и отрицательно заряженных групп одинаково, т.е. белок находится в изоэлектрическом состоянии. Величина заряда белков - один из факторов, увеличивающий их растворимость. При потере заряда в изоэлектрической точке белки легче агрегируют и выпадают в осадок. Это особенно характерно для денатурированных белков, у которых на поверхности появляются гидрофобные радикалы аминокислот.
Гидратная оболочка - это слой молекул воды, ориентированных на поверхности белковой молекулы. Поверхность большинства белковых молекул заряжена отрицательно, и диполи воды притягиваются к ней своими положительно заряженными полюсами.
Температура кипения выше 100 0 С.
Температура замерзания ниже 0 О С.
В воде гидратной оболочки не растворяются различные соли и другие гидрофильные вещества.
Окружая каждую молекулу белка, гидратная оболочка не дает этим белковым молекулам сблизиться, соединиться и выпасть в осадок.
Обратимые
Высаливание - это осаждение белков высокими концентрациями нейтральных солей щелочных и щелочноземельных металлов, поскольку такие соли очень гидрофильны и обладают в высоких концентрациях водоотнимающими свойствами. Чаще это NaCl, Na2SO4, (NH4)2SO4, CaCl2. По мере добавления таких солей к раствору белка они сначала растворяюся в свободной воде, а затем, при дальнейшем повышении концентрации соли, конкурируют с белком за обладание водой, которая входит в состав гидратных оболочек. Белки менее гидрофильные, которые плохо удерживают воду гидратной оболочки, теряют ее раньше. Более гидрофильные белки требуют большей концентрации соли для высаливания. Поэтому с помощью высаливания можно разделить белки с разной степенью гидрофильности. Таким способом, например, можно разделить альбумины и глобулины плазмы крови.
Применение водоотнимающих свердств. Такими средствами являются растворители, которые смешиваются с водой в любых соотношениях. Чаще всего это ацетон, этиловый спирт. Эти вещества отнимают гидратные оболочки белков, и белки выпадают в осадок, если они лишены заряда. Но, в отличие от высаливания, осадок сразу (немедленно!) должен быть отделен от растворителя. Если растворитель и белок будут длительно находиться в контакте, то могут произойти необратимые изменения структуры белковой молекулы (денатурация).
Денатурация белков - это разрушение их нативной конформации, вызванное разрывом слабых связей, стабилизирующих пространственные структуры, при действии денатурирующих агентов. Денатурация сопровождается потерей биологической активности белка.
Уникальная трехмерная структура каждого белка разрушается, и все молекулы одного белка приобретают случайную конформацию, т.е. отличную от других таких же молекул.
Радикалы аминокислот, формирующие активный центр белка, оказываются пространственно удаленными друг от друга, т.е. разрушается специфический центр связывания белка с лигандом.
Гидрофобные радикалы, обычно находящиеся в гидрофобном ядре глобулярных белков, при денатурации оказываются на поверхности молекулы, тем самым создаются условия для агрегации белков. Агрегаты белков выпадают в осадок. При денатурации белков не происходит разрушения их первичной структуры.
Диализ — освобождение растворов высокомолекулярных веществ от растворённых в них низкомолекулярных соединений при помощи полупроницаемой мембраны, т. е. перегородки. Диализ известен нам как "избирательная диффузия". Избирательная диффузия - это диффузия (перемещение веществ от высокой концентрации к более низкой сквозь полупроницаемую мембрану), в процессе которой, в зависимости от мембраны, некоторые вещества будут проникать сквозь мембрану, а некоторые - нет. При диализе молекулы растворенного низкомолекулярного вещества проходят через мембрану, а неспособные диализировать (проходить через мембрану) частицы остаются за ней.
Диализ применяют для устранения из растворов белка и ДНК нежелательных низкомолекулярных примесей или замены состава этих растворов.
Его также применяют для очистки коллоидных растворов от примесей электролитов и низкомолекулярных неэлектролитов. Диализ применяют в промышленности для очистки различных веществ, например в производстве искусственных волокон, при изготовлении лекарственных веществ.
Ультрафильтрация, продавливание жидкости через полупроницаемую мембрану — проницаемую для малых молекул и ионов, но непроницаемую для макромолекул и коллоидных частиц. Вода и малые молекулы проходят через мембрану, а по другую сторону мембраны остается концентрированный раствор белка. Это достигается в специальных ячейках (объемом до 1 л) с перемешиванием раствора и с применением сжатого инертного газа. Этот же принцип лежит в основе ультрафильтрации на полых волокнах, используемых для концентрирования больших объемов растворов.
Концентрирование и очистка растворов белков, аминокислот;
Удаление солей из препаратов РНК и ДНК;
Удаление праймеров из ПЦР амплипированных ДНК;
Удаление ферментов из препаратов ДНК перед клонированием;
Удаление меченых аминокислот и нуклеотидов;
Удаление белка из образцов;
Подготовка образцов для ВЭЖХ;
Очистка антител и гормонов из биологических жидкостей и ферментационных бульонов.
Гель-фильтрационная хроматография.
Неподвижная фаза - жидкость внутри гранул, в которую способны проникать низкомолекулярные вещества и белки с небольшой молекулярной массой. Смесь белков, нанесённую на хроматографическую колонку, вымывают (элюируют), пропуская через колонку растворитель. Вместе с фронтом растворителя движутся и самые крупные молекулы.
Более мелкие молекулы диффундируют внутрь гранул сефадекса и на некоторое время попадают в неподвижную фазу, в результате чего их движение задерживается. Величина пор определяет размер молекул, способных проникать внутрь гранул.
Обратимая денатурация, её называют ренатурация, приводит к легко восстанавливаемым изменениям в структуре. Например, если денатурированный белок является ферментом, то в процессе ренатурации его каталитическая активность также может восстановиться и притом без изменения специфичности катализируемой реакции. Следовательно, при ренатурации белка восстанавливается его исходная биологическая… Читать ещё >
- амины
- аминоспирты
- аминокислоты
- белки
Кислотно-основные свойства белков. Изоэлектрическая точка ( реферат , курсовая , диплом , контрольная )
Белковая молекула содержит некоторое количество свободных аминои карбоксильных групп, и поэтому, подобно аминокислотам и пептидам, белки являются амфотерными соединениями. В щелочной среде белок диссоциирует как кислота, а в кислой — как основание. Отсюда следует, что в щелочной среде молекулы белка заряжаются отрицательно, а в кислой — положительно, и в электрическом поле будут перемещаться соответственно к катоду или к аноду. Для белков, так же как для аминокислот и пептидов, при определенном значении рН среды число положительных зарядов будет равно числу отрицательных, и в электрическом поле такая белковая молекула перемещаться не будет. Это значение рН среды называют изоэлектрической точкой белка.
В изоэлектрической точке белки в наименьшей степени гидрати-рованы и они легко выпадают в осадок, особенно при добавлении к ним водоотнимающих средств.
Оптические свойства белков Белки способны вращать плоскость плоскополяризованного света, так как в состав пептидных цепей входят б-аминокислоты, содержащие асимметрический атом углерода. Но оптическое вращение белковых молекул не является простой суммой величин оптического вращения отдельных аминокислотных остатков. Для белков характерна большая степень правого вращения, чем та, которая получается, если просто суммировать величины оптического вращения, обусловленные каждым асимметрическим центром. Способность вращать плоскость поляризации света свойственна асимметричным молекулам. В белках асимметрия молекул обусловлена двумя факторами: присутствием асимметрического атома углерода и наличием асимметрии, присущей б-спиральной структуре как таковой (поскольку она может существовать как в правой, так и в левой форме).
Коллоидные свойства белков Благодаря своему большому молекулярному весу и размерам, молекулы белка в растворе находятся в коллоидном состоянии. Белки являются гидрофильными коллоидами. При растворении белка вокруг каждой его молекулы образуется водная оболочка, в которой молекулы воды ориентированы в пространстве определенным образом. Вещества, разрушающие водные оболочки растворенных белков, вызывают выпадение их в осадок. К таким веществам относятся спирт, ацетон, нейтральные растворы солей щелочных металлов, растворы сульфата аммония. Процесс выпадения белка в осадок называется высаливанием. После удаления водоотнимающих веществ, при добавлении воды осадки белков вновь растворяются.
Одним из важнейших свойств белков, как лиофильных коллоидов, является их способность образовывать гели. При этом коллоидные частицы склеиваются друг с другом, образуя своеобразный каркас, в ячейки которого включается значительное количество молекул воды. Если гель высушить, а затем вновь поместить в воду, то он сильно набухает. Отделение воды от геля носит название синерезиса. При синерезисе гель уменьшается в объёме и сморщивается.
Денатурация белков Большая часть белковых молекул сохраняет биологическую активность только в пределах очень узкой области температур и рН. Макроструктура белка определяется весьма хрупким равновесием между различными силами притяжения и отталкивания, которые действуют между этим биополимером и окружающей его водной средой. Стоит только нарушить это равновесие, как вся структурная организация белка, кроме первичной структуры, исчезнет.
Разрыв большого количества слабых связей в молекуле белка приводит к разрушению её природной конформации. Этот процесс называется денатурацией белка.
Денатурация утрата белком природной (нативной) конформации, обычно сопровождающаяся потерей его биологической функции.
Денатурацию может вызвать:
- 1) повышение температуры;
- 2) изменение рН среды;
- 3) добавление окислителей или восстановителей, которые разрушают дисульфидные связи;
- 4) добавление солей тяжелых металлов;
- 5) внесение детергентов, нарушающих гидрофобные взаимодействия;
- 6) добавление сильных акцепторов водорода (например мочевины), которые разрушают водородные связи,
- 7) действие ультразвука, ультрафиолетовых и рентгеновских лучей,
- 8) добавление органических веществ, способных реагировать с функциональными группами, которые имеются в радикалах аминокислотных остатков.
Так как при денатурации не происходит разрыв пептидных связей, а разрываются ионные, гидрофобные и водородные, которые стабилизировали конформацию белка, был сделан вывод о том, что причиной денатурации является развертывание полипептидных цепей, которые в нативном белке были характерным образом свернуты. В денатурированном состоянии полипептидные цепи образуют случайные и беспорядочные клубки и петли, которые с течением времени могут изменяться.
Гидрофобные радикалы, которые в нативной структуре молекулы были спрятаны внутри гидрофобного ядра, оказываются на поверхности. Молекулы могут объединяться друг с другом гидрофобными взаимодействиями, при этом растворимость белка снижается и происходит выделение осадка. Компактная, плотная структура нативного белка при денатурации резко увеличивается в размерах и становится легко доступной для расщепления пептидных связей протеолитическими ферментами. Например, кислая среда желудка вызывает денатурацию белков, попавших в желудок с пищей, и облегчает её ферментативное переваривание в пищеварительном тракте.
При денатурации значительно повышается вязкость глобулярных белков. Объясняется это тем, что глобулы выпрямляются и, приобретая нитевидную форму, достигают больших размеров.
Денатурация фибриллярных белков вызывает уменьшение их вязкости, что, по-видимому, связано со скручиванием пептидных цепей и частичным уничтожением фибрилл.
В зависимости от степени нарушения структуры и от природы белка денатурация может быть либо обратимой, либо необратимой ["https://referat.bookap.info", 18].
Обратимая денатурация, её называют ренатурация, приводит к легко восстанавливаемым изменениям в структуре. Например, если денатурированный белок является ферментом, то в процессе ренатурации его каталитическая активность также может восстановиться и притом без изменения специфичности катализируемой реакции. Следовательно, при ренатурации белка восстанавливается его исходная биологическая активность. Никакой новой биологической активности, которая отсутствовала бы в исходном белке, при этом не возникает.
Необратимая денатурация это процесс, при котором происходят глубокие изменения в структуре белка, которые со временем не дают возможности восстановить исходную конфор-мацию белковой молекулы. Известным примером необратимой денатурации является свертывание яичного белка при варке яиц.
Качественные реакции на аминокислоты, пептиды и белки.
1) Реакция с нингидрином.
В присутствии нингидрина раствор аминокислоты окрашивается в сине-фиолетовый цвет.
2) Биуретовая реакция.
Эта реакция используется для обнаружения пептидных связей в белках и пептидах. При нагревании пептидов или белков в щелочном растворе с сульфатом меди появляется сине-фиолетовая окраска.
3) Ксантопротеиновая реакция Используется для обнаружения ароматических и гетеро-циклических аминокислотных остатков Исследуемые соединения с концентрированной азотной кислотой образуют нитросоединения, окрашенные в желтый цвет.
4) Реакция с ацетатом свинца.
Используется для обнаружения белков, содержащих цистеин. В щелочной среде образуется черный осадок сульфида свинца.
5) Реакция с диметиламинобензальдегидом (реакция Эрлиха).
Используется для качественного и количественного определения триптофана. В растворе, подкисленном серной кислотой, появляется красно-фиолетовое окрашивание.
Молекулы белков представляют собой амфотерные основания, поскольку содержат свободные амино- и карбоксигруппы. При рН раствора меньше 7 они имеют отрицательный заряд, а при рН больше 7 - положительный. При равенстве данных зарядов, которое достижимо при установлении в растворе определенной кислотности или щелочности, устанавливается так называемая изоэлектрическая точка белка.
Понятие об изоэлектрической точке
Белки состоят из аминокислот. Некоторые из этих соединений (аргинин, аспарагиновая кислота, гистидин, глутаминовая кислота, лизин) представлены в виде радикалов, содержащих ионогенные группы, то есть такие группы, которые способны к ионизации. Помимо них к ионизации способны альфа-карбоксильная и аминогруппы, расположенные на углеродном и азотном концах полипептидных цепей. Если рН раствора равен 7 или приближен к данной отметке, то в ионизированном состоянии находятся все ионогенные группы. По мере удаления от данного значения рН в ту или иную сторону, причем преимущественно в кислую, белок начинает переход в изоэлектрическое состояние, при котором молекула данного вещества становится электронейтральной, число ионизированных групп стремится к нулю. Величина рН, при которой белки переходят в изоэлектрическое состояние, называется изоэлектрической точкой белков (ИЭТ).
![изоэлектрическая точка белка]()
Физико-химическая природа белков
Из-за того, что в состав белков входят карбокси- и аминные группы, они могут диссоциировать как основания и как кислоты. Свободная карбоксильная группа при диссоциации отдает положительно заряженный ион водорода и анион COO-. В результате ион водорода присоединяется к аминогруппе, что характеризует основные свойства белка, в результате чего образуются частицы белка с отрицательным и положительным зарядами. При помещении белка в кислый раствор его кислотная диссоциация будет подавляться из-за значительного присутствия катионов водорода. И наоборот, при помещении его в основный раствор его основная диссоциация будет подавляться из-за присутствия анионов COO-.
Пропускание через белковый раствор электрического тока приведет к тому, что анионы начнут двигаться к катоду, а катионы - к аноду. В любом белке есть определенная величина рН, при которой движение ионов при пропускании тока не будет происходить. В этом случае говорят о равенстве разнонаправленных ионов и равенстве различных степеней (основной и кислой) в белковой молекуле, что характеризуется изоэлектрическим состоянием.
Как известно, вода представляет собой диполь, поэтому она располагает свои частицы вокруг белковой молекулы в зависимости от того, как она заряжена. В изоэлектрической точке молекула белка не имеет гидратно-ориентированной оболочки. Если осуществляется осаждение белков, необходимо, прежде всего, разрушить гидратную оболочку, сняв электрический заряд.
![от чего зависит изоэлектрическая точка белков]()
Использование ИЭТ в промышленности
В изоэлектрическом состоянии некоторые свойства раствора белка, такие как набухание, вязкость, осмотическое давление, светопропускание, имеют минимальные значения, при этом показатель преломления и оптическая плотность достигают, наоборот, максимальной величины. Изоэлектрическую точку белка можно определить опытным путем, определяя зависимость указанных выше свойств белкового раствора: от величины рН, при этом по положению экстремумов на графиках определяют ИЭТ. В изоэлектрическом состоянии казеин способен осаждаться, что применяется при производстве сыров и кисломолочных продуктов, для получения казеина из обезжиренного молока, как сырья в различных производствах (казеиновые клеи, искусственные продукты питания и т. д.). Измерение ИЭТ позволяет оценить качество белка, в частности, молочного продукта на наличие примесей. Это актуально на сегодняшний день, поскольку введение растительных добавок в молочную основу позволяет заменить часть животного белка растительным, который является более дешевым.
Помимо этого, изоэлектрическая точка белка может использовать при очистке сточных вод от птицефабрик. Так, основная доля загрязнений сточных вод убойного цеха птицефабрики приходится на белки крови. Учитывая то, что ИЭТ большинства белков находится в зоне слабокислой реакции среды, наиболее полное извлечение белков будет происходить при слабокислой реакции среды при величине рН, стремящейся к ИЭТ.
Факторы, оказывающие влияние на ИЭТ
![почему изоэлектрическая точка различна для разных белков]()
На ИЭТ оказывает влияние несколько факторов. Рассмотрим, от чего зависит изоэлектрическая точка белков. Прежде всего, она определяется преобладанием аминных или карбоксигрупп в составе молекулы белка. Большая часть белков представляют собой более сильные кислоты по сравнению с основаниями, поэтому для них ИЭТ меньше 7. Имеется группа белков, которые являются более сильными основаниями, чем кислотами, для них ИЭТ больше 7. Установлена сильная корреляционная зависимость между изоэлектрической точкой белка и содержанием ионов солей в растворе. Концентрация белка не оказывает никакого влияния на данный показатель. Рассмотренные факторы позволяют понять, почему изоэлектрическая точка различна для разных белков.
![методы определения изоэлектрической точки белков]()
Примеры ИЭТ белков:
- пепсин имеет значение ИЭТ около 1;
- казеин и желатин - 4,7;
- яичный альбумин - 4,8;
- муцин - 2,7;
- пепсиноген - 3,7;
- альбумины - 4,6;
- инсулин - 5,3;
- оксигемоглобин - 6,8;
- карбоксигемоглобин - около 6,9;
- миоглобин - 7,0;
- химотрипсин - 8,6;
- цитохром С - 10,5;
- сальмин - 12.
ИЭТ и ее определение
![изоэлектрическая точка растворов белков]()
Все методы определения изоэлектрической точки белков основаны на приготовлении буферных растворов, имеющих отличающуюся реакцию среды. Во все эти растворы помещаются одинаковые навески изучаемого белка, который может быть как в сухом виде, так и в виде раствора. Используются различные методы определения ИЭТ. Как определить изоэлектрическую точку белка?
Основными методами определения ИЭТ являются электрофорез, по минимуму вязкости и связанный с применением водоотнимающих веществ. Могут использоваться и некоторые другие методы, такие, как определение по степени набухания сухого белка, скорости застудевания, но они менее точные и требуют наличия большого количества белка.
Электрофорез
При использовании данного метода в прибор для его осуществления помещаются полоски хромотографической или фильтровальной бумаги, смоченные определенным буферным раствором. Посередине каждой полоски делается карандашная отметка, в которую при помощи пипетки наносится одна капля изучаемого раствора белка. Затем прибор включают и через эти полоски пропускают электрический ток. Макромолекулы изменяют свой заряд в зависимости от величины рН буферного раствора. Если величина рН превышает ИЭТ, то наблюдается отрицательный заряд макромолекул, и наоборот.
![изоэлектрическая точка белка и ее определение]()
Если рН равно ИЭТ, то макромолекулы становятся нейтрально заряженными. Через определенное время подача тока прекращается, полоски бумаги достаются из прибора и высушиваются, после чего пятна белка опрыскивают нингидрином для их проявления. ИЭТ устанавливают по буферному раствору полоски бумаги, где белковое пятно осталось там же, где была нанесена капля. При необходимости этот метод может быть применен и для тонкого фракционирования белков.
Применение других методов для определения ИЭТ
При нахождении в изоэлектрическом состоянии молекулы белков менее гидратированы, поэтому изоэлектрическую точку белка можно определить, используя метод по минимуму вязкости. Для его применения необходимо наличие вискозиметра. С помощью этого прибора определяют относительную вязкость буферных растворов. Молекулы белка, находящегося в изоэлектрическом состоянии, свернуты, поэтому самая небольшая вязкость будет у раствора, в котором его рН будет совпадать с ИЭТ.
На этом же свойстве основан метод, связанный с действием водоотнимающих средств. В качестве таких средств могут выступать ацетон, эфир или спирт. Выделение белков из соответствующих растворов потенциально происходит тем быстрее и полнее, чем полнее соответствует реакция среды ИЭТ. В изоэлектрической точке растворы белков неустойчивы.
Таким образом, существуют различные методы определения изоэлектрической точки белка. И ее определение должно выполняться в зависимости от имеющегося оборудования, материалов, количества белка.
Устойчивость белка в ИЭТ
В изоэлектрической точке белка силы отталкивания между белковыми частицами в макромолекуле ослабевают, благодаря чему происходи агрегация этих молекул и белок выпадает в осадок. Это свидетельствует о том, что в ИЭТ белок неустойчивый за счет потери заряда, который является фактором стабилизации водных белковых растворов. Если к белку добавить кислоту или основание, то молекулы перезаряжаются, белок осуществляет переход в раствор.
![изоэлектрическая точка белка как определить]()
В заключение
Таким образом, изоэлектрическая точка белка представляет собой значение реакции среды (рН), при котором в белковой молекуле отмечается равенство разнонаправленных (отрицательных и положительных) зарядов и равенство различных степеней (основных и кислотных) диссоциации. В данной точке белок теряет заряды и становится неустойчивым, вследствие чего выпадает в осадок. Молекула белка сворачивается, в то время, когда она несет в себе определенные заряды, она распрямлена в виде нити.
Биохимия - это наука о химических и физико-химических процессах, которые протекают в живых организмах и лежат в основе всех проявлений жизнедеятельности. Биохимия возникла на стыке органической химии и физиологии в конце прошлого века.
СТРОЕНИЕ И СВОЙСТВА БЕЛКОВ
БЕЛКИ или ПРОТЕИНЫ - это высокомолекулярные азотсодержащие органические вещества, линейные гетерополимеры, структурным компонентом которых являются аминокислоты, связанные пептидными связями.
В природе встречаются десятки тысяч различных белков. И все они отличаются друг от друга по пяти основным признаком.
Основные различия в строении белковых молекул
По количеству аминокислот
По соотношению количества различных аминокислот. Например, в белке соединительной ткани коллагене 33% от общего количества аминокислот составляет глицин, а в молекуле белкового гормона инсулина, вырабатываемого в поджелудочной железе, содержание глицина гораздо меньше – всего 8%.
Различная последовательность чередования аминокислот. Это означает, что даже при одинаковом соотношении разных аминокислот в каких-нибудь двух белках порядок их расположения этих аминокислот различен, то это будут разные белки.
Количество полипептидных цепей в различных белках может варьировать от 1 до 12, но если больше единицы, то обычно четное (2, 4, 6 и т.п.)
В природе встречается около 150 аминокислот. Для построения белков используются только 20 из них, хотя в метаболизме организма человека участвует большее количество аминокислот. Эти 20 аминокислот имеют несколько общих признаков строения (общие свойства аминокислот):
1. Все они являются альфа-аминокислотами . Аминогруппа общей части всех аминокислот присоединена к альфа-углеродному атому.
![]()
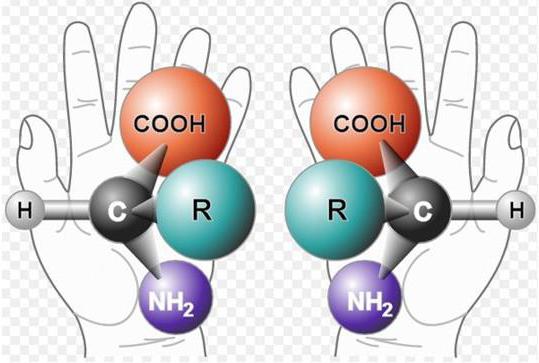
2. По стереохимической конфигурации альфауглеродного атома все они принадлежат к L-ряду.
Следовательно, все эти 20 аминокислот имеют совершенно одинаковый фрагмент молекулы. Различаются они по строению радикалов.
Молекула воды обладает полярными свойствами.
Атом кислорода сильнее притягивает электроны, чем атомы водорода, поэтому электронное облако смещено в сторону кислорода. Степень полярности определяется величиной частичных зарядов и расстоянием между центрами тяжести этих зарядов. Таким образом, молекула воды является диполем.
![]()
![]()
Молекулы воды структурированы и образуют кластеры.
В эти кластерные структуры хорошо встраиваются молекулы, которые сами являются полярными, потому что полярные вещества хорошо растворимы в воде. Полярными являются все те молекулы, которые содержат электроотрицательные атомы. В молекулах белков электроотрицательными атомами являются O (кислород), N (азот) и S (сера).
Высокая полярность обеспечивает остальные общие свойства аминокислот:
3. Хорошая растворимость в воде благодаря наличию общего фрагмента молекулы. Общий фрагмент обладает полярными свойствами, потому что содержит карбоксильную группу –COOH (при физиологическом значении pH эта группа заряжена отрицательно), и аминогруппы -NH2 (при физиологическом значении pH заряжена положительно).
4. Способность к электролитической диссоциации. Аминокислоты существуют в водном растворе в виде амфионов (биполярных ионов). В целом такая молекула при нейтральном значении pH (при pH=7) электронейтральна.
![]()
5. Наличие ИЗОЭЛЕКТРИЧЕСКОЙ ТОЧКИ (ИЭТ, pI). (ИЭТ) - это значение pH среды, при котором молекула амфотерного вещества (например, аминокислоты) находится в электронейтральном состоянии .
РАЗЛИЧИЯ В СТРОЕНИИ АМИНОКИСЛОТ
Радикалы аминокислот могут значительно отличаться друг от друга по строению.
Если есть дополнительные карбоксильные группы в радикале, то заряд молекулы в нейтральной среде отрицателен, а ИЭТ такой молекулы находится в кислой среде.
Аминокислота, в радикале которой есть дополнительная аминогруппа (NH2 -группа), в нейтральной среде заряжена положительно. ИЭТ такой аминокислоты находится в щелочной среде (pI>7). К таким аминокислотам относятся лизин, аргинин и гистидин.
Аминокислота, в радикале которой есть дополнительная карбоксильная группа (COOH-группа), в нейтральной среде заряжена отрицательно. ИЭТ такой аминокислоты находится в кислой среде (pI 3 Да. 1 дальтон равен 1/16 массы атома кислорода (кислородная единица массы).
КОНФИГУРАЦИЯ И КОНФОРМАЦИЯ БЕЛКОВОЙ МОЛЕКУЛЫ
Из всего сказанного можно заключить, что пространственная организация белков очень сложна. В химии существует понятие - пространственная КОНФИГУРАЦИЯ - жестко закрепленное ковалентными связями пространственное взаимное расположение частей молекулы (например: принадлежность к L-ряду стереоизомеров или к D-ряду).
Для белков также используется понятие КОНФОРМАЦИЯ белковой молекулы - определенное, но не застывшее, не неизменное взаимное расположение частей молекулы . Так как конформация белковой молекулы формируется при участии слабых типов связей, то она является подвижной (способной к изменениям), и белок может изменять свою структуру. В зависимости от условий внешней среды молекула может существовать в разных конформационных состояниях, которые легко переходят друг в друга. Энергетически выгодными для реальных условий являются только одно или несколько конформационных состояний, между которыми существует равновесие. Переходы из одного конформационного состояния в другое обеспечивают функционирование белковой молекулы. Это обратимые конформационные изменения (встречаются в организме, например, при проведении нервного импульса, при переносе кислорода гемоглобином). При изменении конформации часть слабых связей разрушается, и образуются новые связи слабого типа.
1) Лиганд белка-фермента – субстрат.
2) Лиганд траспортного белка – транспортируемое вещество.
3) Лиганд антитела (иммуноглобулина) – антиген.
4) Лиганд рецептора гормона или нейромедиатора – гормон или нейромедиатор.
Белок может изменять свою конформацию не только при взаимодействии с лигандом, но и в результате любого химического взаимодействия. Примером такого взаимодействия может служить присоединение остатка фосфорной кислоты.
В природных условиях белки имеют несколько термодинамически выгодных конформационных состояний. Это нативные состояния (природные). Natura (лат.) – природа.
НАТИВНОСТЬ БЕЛКОВОЙ МОЛЕКУЛЫ
НАТИВНОСТЬ - это уникальный комплекс физических, физико-химических, химических и биологических свойств белковой молекулы, который принадлежит ей, когда молекула белка находится в естественном, природном (нативном) состоянии.
Например: белок хрусталика глаза - кристаллин - обладает высокой прозрачностью только в нативном состоянии).
ДЕНАТУРАЦИЯ БЕЛКА
Для обозначения процесса, при котором нативные свойства белка теряются, используют термин ДЕНАТУРАЦИЯ.
ДЕНАТУРАЦИЯ - это лишение белка его природных, нативных свойств, сопровождающееся разрушением четвертичной (если она была), третичной, а иногда и вторичной структуры белковой молекулы, которое возникает при разрушении дисульфидных и слабых типов связей, участвующих в образовании этих структур. Первичная структура при этом сохраняется, потому что она сформирована прочными ковалентными связями. Разрушение первичной структуры может произойти только в результате гидролиза белковой молекулы длительным кипячением в растворе кислоты или щелочи.
ФАКТОРЫ, ВЫЗЫВАЮЩИЕ ДЕНАТУРАЦИЮ БЕЛКОВ
Факторы, которые вызывают денатурацию белков, можно разделить на физические и химические .
1. Высокие температуры. Для разных белков характерна различная чувствительность к тепловому воздействию. Часть белков подвергается денатурации уже при 40-50 0 С. Такие белки называют термолабильными . Другие белки денатурируют при гораздо более высоких температурах, они являются термостабильными .
2. Ультрафиолетовое облучение
3. Рентгеновское и радиоактивное облучение
5. Механическое воздействие (например, вибрация).
1. Концентрированные кислоты и щелочи. Например, трихлоруксусная кислота (органическая), азотная кислота (неорганическая).
2. Соли тяжелых металлов (например, CuSO4 ).
3. Органические растворители (этиловый спирт, ацетон)
4. Растительные алкалоиды.
5. Мочевина в высоких концентрациях
![]()
5. Другие вещества, способные нарушать слабые типы связей в молекулах белков.
Воздействие факторами денатурации применяют для стерилизации оборудования и инструментов, а также как антисептики.
В пробирке (in vitro) чаще всего это – необратимый процесс. Если же денатурированный белок поместить в условия, близкие к нативным, то он может ренатурировать, но очень медленно, и такое явление характерно не для всех белков.
Существует несколько семейств этих белков, они отличаются по молекулярной массе.
Например, известен белок hsp 70 – heatshock protein массой 70 kDa.
Такие белки есть во всех клетках организма. Они выполняют также функцию траспорта полипептидных цепей через биологические мембраны и участвуют в формировании третичной и четвертичной структур белковых молекул. Перечисленные функции белков стресса называются шаперонными . При различных видах стресса происходит индукция синтеза таких белков: при перегреве организма (40-44 0 С), при вирусных заболеваниях, отравлениях солями тяжелых металлов, этанолом и др.
В организме южных народов установлено повышенное содержание белков стресса, по сравнению с северной расой.
Молекула белка теплового шока состоит из двух компактных глобул, соединенных свободной цепью:
![]()
Разные белки теплового шока имеют общий план построения. Все они содержат контактные домены.
Разные белки с различными функциями могут содержать одинаковые домены. Например, различные кальций-связывающие белки имеют одинаковый для всех них домен, отвечающий за связывание Ca +2 .
Роль доменной структуры заключается в том, что она предоставляет белку большие возможности для выполнения своей функции благодаря перемещениям одного домена по отношению к другому. Участки соединения двух доменов – самое слабое в структурном отношении место в молекуле таких белков. Именно здесь чаще всего происходит гидролиз связей, и белок разрушается.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ. РАСТВОРИМОСТЬ БЕЛКОВ В ВОДЕ
Большинство белков гидрофильны. Однако белковые молекулы имеют очень большие размеры, поэтому белки не могут образовывать истинных растворов, а только коллоидные. Внешнее проявление этого - это эффект Тиндаля (или конус Тиндаля). Эффект Тиндаля вызывается рассеянием тонкого пучка света при прохождении через белковый раствор. Несмотря на большую величину, многие белковые молекулы не осаждаются в водных растворах. Осаждению белковых молекул препятствуют факторы стабилизации белкового раствора.
ФАКТОРЫ СТАБИЛИЗАЦИИ БЕЛКА В РАСТВОРЕ
ГИДРАТНАЯ ОБОЛОЧКА - это слой молекул воды, определенным образом ориентированных на поверхности белковой молекулы. Поверхность большинства белковых молекул заряжена отрицательно, и диполи молекул воды притягиваются к ней своими положительно заряженными полюсами (смотрите рисунок).
Чем больше гидрофильных свойств у белковой молекулы, чем больше в ее составе и на ее поверхности аминокислот с полярными (гидрофильными) радикалами, тем сильнее выражена и прочнее удерживается гидратная оболочка и тем больше в ней слоев. Вода гидратной оболочки обладает особыми свойствами: она не является свободной, а связана с белковой молекулой. Это - “связанная” вода. Она принадлежит белку, и поэтому имеет особые свойства.
![]()
Свойства воды гидратной оболочки
а) Температура кипения выше 100 0 С.
б) Температура замерзания ниже 0 О С.
в) В воде гидратной оболочки не растворяются различные соли и другие гидрофильные вещества.
г) Окружая каждую молекулу белка, гидратная оболочка не дает этим белковым молекулам сблизиться, соединиться и выпасть в осадок.
2) ЗАРЯД БЕЛКОВОЙ МОЛЕКУЛЫ. Поверхность большинства белковых молекул заряжена потому, что в каждой молекуле белка есть свободные заряженные СОО - и NH3 + группы. Изоэлектрическая точка (ИЭТ) большинства белков организма находится в слабокислой среде. Это означает, что у таких белков количество кислотных (СООН) групп больше количества основных групп (NH3 ). рН плазмы крови около 7,36 - это выше ИЭТ большинства белков, поэтому в плазме крови белки имеют отрицательный заряд.
СПОСОБЫ ОСАЖДЕНИЯ БЕЛКОВ
Делятся на две группы:
1) Способы осаждения нативного белка
2) Способы осаждения денатурированного белка
Чтобы осадить белок из раствора, надо лишить его обоих факторов стабилизации: и заряда, и гидратной оболочки.
ОСАЖДЕНИЕ НАТИВНЫХ БЕЛКОВ
Чтобы сохранить нативность белковой молекулы, ее заряд можно устранить только одним способом: приблизить рН среды к изоэлектрической точке белка (ИЭТ), а для большинства белков нашего организма ИЭТ находится в слабокислой среде. Другой фактор стабилизации - гидратную оболочку можно устранить разными способами.
Наиболее типичным примером осаждения нативного белка является ВЫСАЛИВАНИЕ.
а) ВЫСАЛИВАНИЕ - это осаждение белков высокими концентрациями нейтральных солей щелочных и щелочноземельных металлов, поскольку такие соли очень гидрофильны и обладают в высоких концентрациях водоотнимающими свойствами. Чаще это NaCl, Na2 SO4 , (NH4 )2 SO4 , CaCl2 . По мере добавления таких солей к раствору белка они сначала растворяюся в свободной воде, а затем, при дальнейшем повышении концентрации соли, конкурируют с белком за обладание водой, которая входит в состав гидратных оболочек. Белки менее гидрофильные, которые плохо удерживают воду гидратной оболочки, теряют ее раньше. Более гидрофильные белки требуют большей концентрации соли для высаливания. Поэтому с помощью высаливания можно разделить белки с разной степенью гидрофильности. Таким способом, например, можно разделить альбумины и глобулины плазмы крови.
При высаливании сохраняется нативность белковых молекул. Если осадить белки с помощью высаливания, а затем уменьшить концентрацию солей, например, методом диализа, то белок опять растворится .
Осаждения белков без потери ими нативности можно достичь также с помощью водоотнимающих средств.
б) ПРИМЕНЕНИЕ ВОДООТНИМАЮЩИХ СРЕДСТВ . Такими средствами являются растворители, которые смешиваются с водой в любых соотношениях. Чаще всего это ацетон, этиловый спирт . Эти вещества отнимают гидратные оболочки белков, и белки выпадают в осадок, если они лишены заряда. Но, в отличие от высаливания, осадок сразу (немедленно!) должен быть отделен от растворителя. Если растворитель и белок будут длительно находиться в контакте, то могут произойти необратимые изменения структуры белковой молекулы (денатурация).
ОСАЖДЕНИЕ ДЕНАТУРИРОВАННЫХ БЕЛКОВ
а) ДЕЙСТВИЕ СОЛЕЙ ТЯЖЕЛЫХ МЕТАЛЛОВ . Образуют соединения с SH-группами белков. Ядовиты для человека и животных. В медицинской практике применяются способы детоксикации при отравлениях тяжелыми металлами. В этих случаях для обезвреживания этих металлов дают внутрь молоко или другие белковые растворы.
б) КИПЯЧЕНИЕ (или просто нагревание до высоких температур) - усиливается тепловое движение молекул, ослабляются слабые типы связей, теряется нативность, белковая молекула “разворачивается”, гидрофобные структуры выходят наружу. Это приводит к потере гидратной оболочки, молекулы сближаются и взаимодействуют друг с другом. Это приводит к тому, что белок выпадает в осадок. При охлаждении нативность не восстанавливается.
При кипячении белок не всегда выпадает в осадок. Если нагревать белок в любой среде (сильно кислой, сильно щелочной или нейтральной средах), то денатурация белка происходит обязательно, белковые молекулы теряют гидратную оболочку. Но в сильно кислой или в сильно щелочной средах молекулы белка в осадок не выпадают, потому что у них остается один из факторов стабилизации - заряд. Сохранение заряда не позволяет молекулам белка сблизиться друг с другом - агрегация полипептидных цепей не происходит. Даже если раствор белка охладить - осадок все равно не выпадает - это будет коллоидный раствор денатурированного белка. Если приблизить затем рН среды к изоэлектрической точке белка (например, добавлением кислоты или щелочи), то белок выпадет в осадок, потому что будет лишен обоих факторов стабильности в растворе - и заряда, и гидратной оболочки.
Белки - высокомолекулярные азотистые органические вещества, построенные из аминокислот и играющие фундаментальную роль в структуре и жизнедеятельности организмов. Белки - основная и необходимая составная часть всех организмов.
Содержимое работы - 1 файл
Физико.docx
Белки - высокомолекулярные азотистые органические вещества, построенные из аминокислот и играющие фундаментальную роль в структуре и жизнедеятельности организмов. Белки - основная и необходимая составная часть всех организмов. Именно Белки осуществляют обмен веществ и энергетические превращения, неразрывно связанные с активными биологическими функциями. Сухое вещество большинства органов и тканей человека и животных, а также большая часть микроорганизмов состоят главным образом из белков (40-50%), причем растительному миру свойственно отклонение от этой средней величины в сторону понижения, а животному - повышения. Микроорганизмы обычно богаче белком (некоторые же вирусы являются почти чистыми белками). Таким образом, в среднем можно принять, что 10% биомассы на Земле представлено белком, то есть его количество измеряется величиной порядка 10 12 - 10 13 тонн. Белковые вещества лежат в основе важнейших процессов жизнедеятельности. Так, например, процессы обмена веществ ( пищеварение, дыхание, выделение, и другие) обеспечиваются деятельностью ферментов , являющихся по своей природе белками. К белкам относятся и сократительные структуры, лежащие в основе движения, например сократительный белок мышц ( актомиозин), опорные ткани организма (коллаген костей, хрящей, сухожилий), покровы организма ( кожа, волосы, ногти и т.п.) , состоящие главным образом из коллагенов, эластинов, кератинов, а также токсины, антигены и антитела, многие гормоны и другие биологически важные вещества.
В природе существует примерно 10 10 -10 12 различных белков, обеспечивающих жизнедеятельность организмов всех степеней сложности от вирусов до человека, они обеспечивают жизнь более 2 млн. видам организмов. Белками являются ферменты, антитела, многие гормоны и другие биологические активные вещества. Необходимость постоянного обновления белков лежит в основе обмена веществ. Именно поэтому белки и явились тем исключительным материалом, который послужил основой возникновения жизни на Земле. Ни одно вещество из всех веществ биологического происхождения не имеет столь большого значения и не обладает столь многогранными функциями в жизни организма как белки.
1 Роль индивидуальных белков в биохимических исследованиях
Важное место в биохимических исследованиях занимает выделение индивидуальных белков из органов и тканей. Очищенные индивидуальные белки нужны для изучения их первичной структуры, получения кристаллов белков с целью исследования их пространственной структуры методом рентгеноструктурного анализа, установления взаимосвязи между первичной, пространственной структурой белка и его функцией.
Некоторые очищенные индивидуальные белки используют в медицине как лекарственные препараты, например гормон инсулин применяют для лечения сахарного диабета, а пищеварительные ферменты поджелудочной железы назначают при нарушении её функций в качестве заместительной терапии. Кроме того, очищенные ферменты часто используют в биохимических исследованиях в качестве химических реактивов для определения веществ в биологических жидкостях.
Большинство методов, используемых для очистки индивидуальных белков, основано на различиях их физико-химических свойств, а также возможности специфично связываться с лигандом.
2 Физико-химические свойства белков
Индивидуальные белки различаются по своим физико-химическим свойствам: форме молекул, молекулярной массе, суммарному заряду молекулы, соотношению полярных и неполярных групп на поверхности нативной молекулы белка, растворимости белков, а также степени устойчивости к воздействию денатурирующих агентов.
Как уже говорилось выше, по форме молекул белки делят на глобулярные и фибриллярные. Глобулярные белки имеют более компактную структуру, их гидрофобные радикалы в большинстве своём спрятаны в гидрофобное ядро, и они значительно лучше растворимы в жидкостях организма, чем фибриллярные белки (исключение составляют мембранные белки).
Белки - высокомолекулярные соединения, но могут сильно отличаться по молекулярной массе, которая колеблется от 6000 до 1 000 000 Д и выше. Молекулярная масса белка зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков - и от количества входящих в него протомеров (или субъединиц).
Белки имеют в своём составе радикалы лизина, аргинина, гистидина, глутаминовой и аспарагиновой кислот, содержащие функциональные группы, способные к ионизации (ионогенные группы). Кроме того, на N- и С-концах полипептидных цепей имеются α-амино- и α-карбоксильная группы, также способные к ионизации. Суммарный заряд белковой молекулы зависит от соотношения ионизированных анионных радикалов Глу и Асп и катионных радикалов Лиз, Apr и Гис.
Степень ионизации функциональных групп этих радикалов зависит от рН среды. При рН раствора около 7 все ионогенные группы белка находятся в ионизированном состоянии. В кислой среде увеличение концентрации протонов (Н+) приводит к подавлению диссоциации карбоксильных групп и уменьшению отрицательного заряда белков: -СОО - + Н + → -СООН. В щелочной среде связывание избытка ОН - с протонами, образующимися при диссоциации NH3 + с образованием воды, приводит к уменьшению положительного заряда белков:
Так как большинство белков в клетке имеет в своём составе больше анионогенных групп (-СОО - ), то изоэлектрическая точка этих белков лежит в слабокислой среде. Изоэлектрическая точка белков, в составе которых преобладают катионогенные группы, находится в щелочной среде. Наиболее яркий пример таких внутриклеточных белков, содержащих много аргинина и лизина, - гистоны, входящие в состав хроматина.
Белки, имеющие суммарный положительный или отрицательный заряд, лучше растворимы, чем белки, находящиеся в изоэлектрической точке. Суммарный заряд увеличивает количество диполей воды, способных связываться с белковой молекулой, и препятствует контакту одноимённо заряженных молекул, в результате растворимость белков увеличивается. Заряженные белки могут двигаться в электрическом поле: анионные белки, имеющие отрицательный заряд, будут двигаться к положительно заряженному аноду (+), а катионные белки - к отрицательно заряженному катоду (-). Белки, находящиеся в изоэлектрическом состоянии, не перемещаются в электрическом поле.
- Соотношение полярных и неполярных групп на поверхности нативных молекул белков
На поверхности большинства внутриклеточных белков преобладают полярные радикалы, однако соотношение полярных и неполярных групп отлично для разных индивидуальных белков. Так, протомеры олигомерных белков в области контактов друг с другом часто содержат гидрофобные радикалы. Поверхности белков, функционирующих в составе мембран или прикрепляющиеся к ним в процессе функционирования, также обогащены гидрофобными радикалами. Такие белки лучше растворимы в липидах, чем в воде.
Растворимость белков в воде зависит от всех перечисленных выше свойств белков: формы, молекулярной массы, величины заряда, соотношения полярных и неполярных функциональных групп на поверхности белка. Кроме этого, растворимость белка определяется составом растворителя, т.е. наличием в растворе других растворённых веществ. Например, некоторые белки легче растворяются в слабом солевом растворе, чем в дистиллированной воде. С другой стороны, увеличение концентрации нейтральных солей может способствовать вьшадению определённых белков в осадок. Денатурирующие агенты, присутствующие в растворе, также снижают растворимость белков.
3 Методы выделения и очистки белков
Получение индивидуальных белков из биологического материала (тканей, органов, клеточных культур) требует проведения последовательных операций, включающих:
- дробление биологического материала и разрушение клеточных мембран;
- фракционирование органелл, содержащих те или иные белки;
- экстракцию белков (перевод их в растворённое состояние);
- разделение смеси белков на индивидуальные белки.
3.1 Методы разрушения тканей и экстракции белков
Для разрушения биологического материала используют методы: гомогенизации ткани, метод попеременного замораживания и оттаивания, а также обработку клеток ультразвуком.
Гомогенизация биологического материала
Ткань, находящуюся в буферном растворе с определённым значением рН и концентрацией солей, помещают в стеклянный сосуд (гомогенизатор) с пестиком. Вращающийся пестик измельчает и растирает ткань о притёртые стенки сосуда.
Метод замораживания и оттаивания ткани
В результате попеременного замораживания и оттаивания образующиеся кристаллы льда разрушают оболочки клеток.
После разрушения ткани нерастворимые части осаждают центрифугированием. Последующее центрифугирование гомогената с разной скоростью позволяет получить отдельные фракции, содержащие клеточные ядра, митохондрии и другие органеллы, а также надосадочную жидкость, в которой находятся растворимые белки цитозоля клетки. Искомый белок будет содержаться в одной из этих фракций.
Экстракция белков, связанных с мембранами, и разрушение олигомерных белков на протомеры
Если искомый белок прочно связан с какими-либо структурами клетки, его необходимо перевести в раствор. Так, для разрушения гидрофобных взаимодействий между белками и липидами мембран в раствор добавляют детергенты; чаще всего используют тритон Х-100 или додецилсульфат натрия.
При действии детергентов обычно разрушаются и гидрофобные взаимодействия между протомерами в олигомерных белках.
Удаление из раствора небелковых веществ
Нуклеиновые кислоты, липиды и другие небелковые вещества можно удалить из раствора, используя их Особенные физико-химические свойства. Так, липиды легко удаляются из раствора добавлением органических растворителей, например ацетона. Однако воздействие должно быть кратковременным, так как ацетон вызывает денатурацию некоторых белков. Нуклеиновые кислоты осаждают добавлением в раствор стрептомицина.
3.2 Методы очистки белков
Наиболее трудоёмкий этап получения индивидуальных белков - их очистка от других белков, находящихся в растворе, полученном из данной ткани. Часто изучаемый белок присутствует в небольших количествах, составляющих доли процента от всех белков раствора.
Так как белки обладают конформационной лабильностью, при работе с белками следует избегать денатурирующих воздействий, поэтому выделение и очистка белков происходят при низких температурах.
На первых стадиях очистки белков целесообразно использовать методы, учитывающие какую-либо характерную особенность данного белка, например термостабильность или устойчивость в кислых растворах. Первыми методами очистки необходимо удалить из раствора основную массу балластных белков, которые значительно отличаются от выделяемого белка физико-химическими свойствами. Впоследствии применяют всё более тонкие методы очистки белка.
Читайте также:
Если в белке содержится больше анионогенных групп (-COO - ), то изоэлектрическая точка находится в слабокислой среде. Если больше катионогенных групп, то в щелочной.
Чтобы сохранить нативность белковой молекулы, ее заряд можно устранить только одним способом: приблизить рН среды к изоэлектрической точке белка (ИЭТ), а для большинства белков нашего организма ИЭТ находится в слабокислой среде. Другой фактор стабилизации - гидратную оболочку можно устранить разными способами.