Ионное произведение воды водородный показатель реферат
Обновлено: 05.07.2024
описывается константой Кw, которая носит название “ионное произведение воды”. Ионное произведение воды равно:
Кw = [Н + ] [ОН — ] (1)
Для разбавленных водных растворов ионное произведение воды не зависит от состава раствора и постоянно при данной температуре. Так, Кw=10 — 14 для воды, миллимолярных растворов К2SO4, H2SO4 и KOH при Т=298 К. Строго говоря, постоянство Кw справедливо в случае, когда аналитические концентрации ионов заменены их активностями (лишь для малых концентраций Н + и ОН — значения концентрации и активности практически совпадают).
Процесс диссоциации Н2О идет с поглощением теплоты, поэтому при повышении температуры в интервале от 0 до 100 о С величина Кw увеличивается.
Для практических целей удобно пользоваться не концентрацией ионов водорода, а её водородным показателем – отрицательным десятичным логарифмом – рН. Величина рН равна:
рН = — lg[H + ]. (2)
Как выше отмечалось, более строгим является уравнение рН = – lg aН+, где aН+ – активность ионов водорода. Однако для практических целей при расчете рН разбавленных растворов обычно используется уравнение (2).
рН + рОН = 14, (3)
Для нейтральных растворов рН = 7, для кислых растворов рН 7. В аналитической практике редко приходится работать с растворами, рН которых выходит из интервала 0 ÷14. Тем не менее, в сильнощелочной среде рН может быть немного больше 14, а в очень кислой среде может принимать отрицательные значения.
Задача 1. Вычислите рН 0,001М растворов HСl и КОН.
Решение. HСl и КОН являются сильными электролитами и в разбавленных растворах практически полностью диссоциируют на ионы. В растворе НСl: [Н + ] = 0,001 моль/л.
рН = –lg [H + ] = –lg 0,001 = 3
В растворе КОН: [ОН – ] = 0,001 моль/л. рОН = –lg [ОH — ] = –lg 0,001 = 3. рН=14 – 3 = 11.
Задача 2. Рассчитайте рН раствора КОН, 350 мл которого содержат 0,0035 моль КОН.
Решение.
КОН → К + + ОН —
рОН = –lg [ОH — ] = –lg 0,01 = 2.
рОН + рН = 14. рН = 14 – 2 = 12
или [Н + ] = 10 –14 /[ОН – ] = 10 –14 /0,01 = 10 –12 моль/л.
рН = –lg 10 –12 = 12.
Задача 3. Вычислите молярную концентрацию раствора Ba(OH)2, если рН раствора составляет 12 при 298 К.
Решение.
Ba(OH)2 → Ва 2+ + 2ОН –
-lg [ОH – ] = 2, откуда [ОH – ] = 0,01 М.
Задача 4. Рассчитайте степень диссоциации и рН 0,01 М водного раствора аммиака при 298 К, если константа диссоциации NH4OH при указанной температуре равна 1,76·10 –5 .
Решение.
NH3 H2O ⇔ NH4 + + OH — или упрощенно: NH4ОH ⇔ NH4 + + OH —
[Н + ] = 10 -14 /[ОН — ] = 10 -14 /4,2·10 -4 = 2,4·10 -11 моль/л.
рН = –lg [H + ] = –lg 2,4·10 –11 = 10,6.
Задача 5. К 1 л 0,01М раствора CH3CОOH добавили 6 г СН3СООNa. Определите рН полученного раствора при Т = 298 К, если при указанной температуре Кд(CH3CОOH) = 1,75·10 –5 .
Решение.
Присутствие в растворе CH3CОOH сильного электролита СН3СООNa приводит к сдвигу равновесия диссоциации уксусной кислоты влево в силу действия принципа Ле Шателье. В результате степень диссоциации уксусной кислоты уменьшается.
n(СН3СООNa) = 6:82 = 0,073 моль.
(считаем, что объем раствора после добавления 6 г СН3СООNa не изменился).
Ацетат–ионы в растворе образуются как за счет диссоциации уксусной кислоты:
CH3CОOH ⇔ СН3СОО – + Н + ,
так и за счет диссоциации СН3СООNa:
СН3СООNa → СН3СОО — + Na +
Поскольку СН3СООNa в растворе диссоциирует полностью, то концентрацией ацетат-ионов, образующихся при диссоциации уксусной кислоты можно пренебречь, так как она мала по сравнению с величиной 0,073 моль/л. Принимаем, что:
Большинство химических реакций протекает в растворах. Среди растворителей исключительное место занимает вода. Это обуслов-лено ее уникальными свойствами, не присущими другим раство-рителям. Так, многие вещества в воде являются сильными электро-литами. Ионизирующая способность воды связана с высоким значе-нием диэлектрической проницаемости (ε = 81) и сольватирующей (гидратирующей) активностью. В этой связи полезно рассмотреть закономерности процессов, протекающих в водных растворах.
Ионное произведение воды. Водородный показатель
Вода относится к очень слабым амфотерным электролитам. Чистая вода в незначительной степени диссоциирует на ионы:
В водном растворе ионы водорода не существуют в свободном состоянии, а образуют ионы гидроксония Н3О + . Поэтому более строгой является следующая запись процесса диссоциации воды:
Однако для простоты пишут Н + .
Применяя закон действующих масс, можно написать:
В чистой воде, и в разбавленных водных растворах кислот, гидроксидов и солей активность ионов (а) практически не отличается от концентрации, поэтому:
Так как степень диссоциации воды незначительная, то равновесную концентрацию недиссоциированных молекул воды [Н2О] можно считать постоянной и объединить ее с (H2O) в одну величину :
Константу KW, равную произведению концентраций ионов Н + и ОН - , называют ионным произведением воды.
Строго говоря, постоянной величиной является произведение не концентраций, а активностей ионов Н + и ОН - :
Однако в разбавленных растворах, в которых коэффициенты активности близки к единице, этим различием при не очень точных расчетах можно пренебречь.
Величина постоянна только при данной температуре. При увеличении температуры степень диссоциации воды возрастает (диссоциация воды ‑ процесс эндотермический), что приводит к повышению концентраций ионов Н + и ОН - . Следовательно, повышение температуры увеличивает значение : при изменении температуры от 0 до 100 0 С оно возрастает приблизительно в 300 раз.
(H2O) была определена методом электропроводности и при 22 0 С ее величина составила 1,8×10 - 16 . Этим же методом было установлено, что в одном литре воды (1000 г) на ионы диссоциирует 10 - 7 моль воды. Таким образом, из 55,6 моль , содержащихся в 1 л воды, только 10 - 7 моль находятся в диссоциированном состоянии. Следовательно:
Таким образом, при температуре 20-25 0 С ионное произведение воды = 10 - 14 , а показатель ионного произведения воды pKW = 14 (pKW = -lgKW = -lg10 - 14 = 14).
Так как в чистой воде и в разбавленных водных растворах кислот, оснований и солей величина KW постоянная, то концентрации ионов Н + и ОН - являются величинами сопряженными, т. е. зависящими друг от друга.
Например, если в растворе при 20-25 0 С [Н + ] = 10 - 3 моль/л, то в этом же растворе:
В чистой воде при диссоциации ее молекул образуется одинаковое количество ионов Н + и ОН - , следовательно, при 20-25 0 С:
[H + ] = [OH - ] = 10 - 7 моль/л.
В водных растворах различных соединений в зависимости от соотношения концентраций ионов Н + и ОН – реакция среды может быть:
[H + ] = [OH - ] = 10 - 7 моль/л;
[H + ] > 10 - 7 моль/л; [OH - ] - 7 моль/л;
[H + ] - 7 моль/л; [OH - ] > 10 - 7 моль/л.
На практике наиболее важное значение имеет активная реакция среды, определяемая активностью (концентрацией) ионов Н + или ионов ОН - , содержащихся в данной среде (активная кислотность, активная щелочность).
Активную кислотность принято характеризовать отрицательным десятичным логарифмом активности (концентрации) ионов водо-рода - водородным показателем (рН):
а для разбавленных растворов:
Водородный показатель (рН) - количественная характеристика активной кислотности.
Для количественной характеристики активной щелочности применяют гидроксидный показатель (рОН):
а для разбавленных растворов:
Если выражение KW = [Н + ]×[ОН - ] прологарифмировать (записать отрицательный десятичный логарифм левой и правой части), то получим:
Так как при t 0 = 20-25 0 С pKW = 14 (KW = 10 - 14 ), то при этой температуре:
| pH + pOH = 14 | (10) |
При помощи водородного показателя удобно выражать характер среды:
нейтральная среда: рН = 7 (рН = рОН),
кислая среда: рН 7 (рН > рОН).
Таким образом, увеличение концентрации ионов Н + уменьшает рН (величина рОН при этом возрастает), а уменьшение концентрации ионов Н + увеличивает рН (величина рОН при этом уменьшается). При сопоставлении значений pН разных растворов следует относить эти значения к одной и той же температуре.
В растворах кислот различают: активную кислотность, потенци-альную кислотность и общую кислотность.
Активная кислотностьобусловлена наличием свободных ионов Н + в растворе. Эта кислотность характеризуется определенным значением рН.
Потенциальная кислотностьобусловлена наличием ионов Н + , связанных в молекулах кислот.
Общая кислотность- сумма активной ипотенциальной кислотностей.
В разбавленных растворах кислот, полностью диссоциированных на ионы, общая кислотность практически равна активной кислотности.
В растворах слабых кислот активная кислотность всегда меньше общей кислотности:
Вода является практически незаменимым растворителем в экспериментальной и прикладной химии, поэтому необходимо изучение ее свойств. Остановимся на таких понятиях как ионное произведение воды и водородный показатель pH.
Ионное произведение воды
При определенных условиях, вода может вести себя как акцептор протонов (в присутствии кислоты) или как донор протонов (в присутствии основания). Интересной особенностью воды является то, что она может подвергаться процессу самодиссоциации (автоионизации), т.е. быть одновременно и донором и акцептором протонов по отношению к самой себе.
Эта реакция – самопроизвольная диссоциация, осуществляется в небольшой степени. Ее можно упростить, если H3O + заменить на H +
H2O ↔ H + + OH —
Запишем выражение для константы равновесия, опираясь на закон действия масс:
K = [H + ]·[OH — ]/[H2O]
Концентрацию воды, принято исключать из данного выражения, вследствие ее практически постоянного значения в разбавленных растворах. Получаем новую константу равновесия KН2О, которая называется ионным произведением воды:
KН2О = [H + ]·[OH — ]
При температуре 25ºС ионное произведение воды KН2О = 1·10 -14 и остается постоянным в водных растворах кислот, щелочей, солей или других соединений.
KН2О = [H + ]·[OH — ] = 1·10 -14
При повышении температуры ионное произведение воды сильно возрастает.
Полученное выражение применимо не только к чистой воде, но и к растворам.
Если осуществляется условие [H + ] = [OH — ], то раствор называется нейтральным, но обычно эти величины не совпадают, тогда при увеличении одного показателя, другой должен уменьшаться, так, чтобы их произведение оставалось постоянным (1·10 -14 )
Водородный показатель pH
Кислотно – основные свойства растворов определяются величиной концентрации ионов водорода или гидроксила. Мы уже знаем, что ионное произведение воды при определенной температуре постоянно, а [H + ] и [OH — ] — переменные, и по их величинам можно говорить о кислотности или щелочности раствора.
При нейтральном характере раствора, т.е. при равенстве концентраций ионов водорода и гидроксид-ионов [H + ] = [OH — ], получаем следующее выражение:
[H + ] = [OH — ] = (KН2О) 1/2 = (1·10 -14 ) 1/2 = 10 -7 М
Увеличение или уменьшение концентраций иона водорода или гидроксид — иона меняет характер среды.
Таким образом, в растворах с различным характером среды, при температуре 25ºС, выполняются следующие условия:
| Нейтральная среда | [H + ] = [OH — ] = 10 -7 М |
| Кислая среда | [H + ] > [OH — ], [H + ] > 10 -7 М, [OH — ] ˂ 10 -7 М |
| Щелочная среда | [H + ] ˂ [OH — ], [H + ] ˂ 10 -7 М, [OH — ] > 10 -7 М |
Следует помнить, что не зависимо от характера среды, в водных растворах всегда существуют оба иона.
Выражение характера среды данным способом информативно, но сопряжено с некоторыми трудностями в случае выражения небольших значений концентрации иона водорода.
Более удобно пользоваться водородным показателем pH.
Водородный показатель pH — это отрицательный логарифм концентрации ионов водорода
pH = -lg[H + ] = lg (1/[H + ])
Отметим, что изменению [H + ] в 10 раз соответствует изменение pH всего на 1 единицу.
Противоположный водородному показатель — показатель основности раствора рОН
pOH = -lg[OH — ] = lg (1/[OH — ])
pH и pOH нейтрального раствора равен 7:
pH = -lg[H + ] = -lg(1·10 -7 ) = 7
| Нейтральная среда | pH = pOH = 7, pH + pOH = 14 |
| Кислая среда | pH ˂ pOH, pH ˂ 7, pH + pOH = 14 |
| Щелочная среда | pH > pOH, pH > 7, pH + pOH = 14 |
На следующем рисунке наглядно показано зависимость характера среды от величины pH
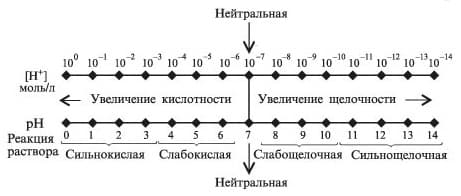
шкала pH
Активность ионов водорода и гидроксид-ионов
Все рассмотренные нами представления об ионном произведении воды справедливы для случая диссоциации химически чистой воды. Если же равновесные концентрации H + или ОH — составляют большие величины, то ионное произведение воды выражается через активности ионов водорода и гидроксид-ионов:
где aH + и aOH — — соответственно активности ионов водорода и ионов гидроксила;
K ` H2O — истинная константа, значение которой не зависит от величины ионной силы раствора.
Для определения характера среды раствора существует много методов, самый простой из них – применение индикаторов. Далее приведены некоторые индикаторы и зависимость изменения их окраски от концентрации ионов водорода.
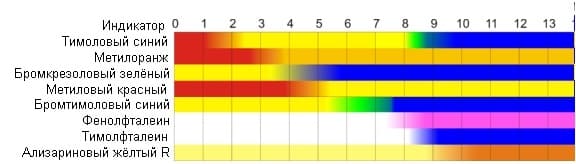
изменение окраски индикатора в зависимости от характера среды
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам

Описание презентации по отдельным слайдам:

Химическое равновесие в гомогенных системах. Ионное произведение воды. Водородный показатель и характер среды. 12 класс Бозаджи Н.М. учитель химии высшей категории

1.Составлять уравнения реакции нейтрализации, опираясь на молекулярный способ; молекулярно-ионный способ; сокращенный молекулярно-ионный способ; 2.Находить ионное произведение воды Кв; 3.Вести расчеты по формулам рН = –lg [Н+]; рН + рОН = 14. 4. Осуществлять рефлексию своей деятельности В результате изучения темы, вы будете способны:



В реакциях между сильными кислотами и основаниями (щелочами), проходящими в водных растворах, всегда выделяется одно и то же количество теплоты в расчете на 1 моль образующейся воды, а именно 58 кДж/моль: HCl + NaOH = H2O + NaCl, ∆Н = –58 кДж/моль, HCl + КOH = H2O + КCl, ∆Н = –58 кДж/моль, HNO3 + NaOH = H2O + NaNO3, ∆Н = –58 кДж/моль, HNO3 + KOH = H2O + KNO3, ∆Н= –58 кДж/моль. Все уравнения записаны молекулярным способом: формулы исходных веществ и продуктов реакции представлены для молекул, даже если такие молекулы и не существуют в водном растворе. Реакции нейтрализации

Во всех приведенных реакциях образуется одно общее вещество – вода. Поэтому можно предположить, что тепловой эффект таких реакций в растворе обусловлен образованием воды из ионов водорода (протонов) и гидроксид-ионов, находящихся в растворах всех этих реагирующих веществ в одинаковом состоянии. Этот факт очень важен для доказательства ионного поведения кислот, оснований и солей в водных растворах. Реакции нейтрализации

Все перечисленные реакции – это реакции нейтрализации сильной кислоты сильным основанием. Равенство тепловых эффектов этих реакций доказывает, что кислоты, основания и образующиеся соли находятся в ионном состоянии. С учетом этого уравнение каждой реакции можно записать молекулярно-ионным способом, в котором сильные электролиты представляют в виде ионов, а слабые – в виде молекул. Например: H+ + Cl– + Na+ + OH– = H2O + Na+ + Сl–, ∆Н = –58 кДж/моль. Реакции нейтрализации

Очевидно, одни и те же ионы, входящие в правую и левую части уравнения реакции, можно не записывать. Тогда все приведенные выше четыре уравнения реакции могут быть выражены одним уравнением: H+ + OH– = Н2О, ∆Н = –58 кДж/моль. Такой способ написания уравнений реакций носит название сокращенного молекулярно-ионного. Реакции нейтрализации

Заметим, что запись формул сильных электролитов в виде формул молекул принципиально неправильна, т. к. в водном растворе нет таких веществ, как HCl, HNO3, NaOH, KOH, NaCl, KCl, NaNO3, KNO3, а есть только ионы этих веществ. В молекулярном виде уравнение может быть записано, если реакция проходит в газообразном состоянии, между кристаллами или в неводном растворе, в котором вещества не диссоциируют на ионы. Реакции нейтрализации

Уравнения реакций в виде формул молекул записывают для неэлектролитов, слабых электролитов, газообразных и малорастворимых в воде веществ. В качестве примеров приведем уравнения реакций нейтрализации с участием слабых электролитов: CH3COOH + NaOH = CH3COONa + H2O (неверная запись для водного раствора!), CH3COOН + OH– = CH3COO– + H2O (записывать только так!); Реакции нейтрализации

*NH4OH + HCl = NH4Cl + H2O (неверная запись для водного раствора!), NH4OH + HCl =NH4++Cl- + H2O (записывать только так!); *CH3COOH + NH4OH = NH4CH3COO + H2O (неверная запись для водного раствора!), CH3COOH + NH4OH = NH4++ CH3COO– + H2O (записывать только так!). Однако, если вас попросят ответить на вопрос, какие вещества останутся в чашке после выпаривания раствора, вы можете уверенно написать формулы солей, содержащих в своем составе ионы. Реакции нейтрализации

Уравнение нейтрализации Н+ + ОН– = Н2О, ∆Н = –58 кДж/моль, записанное в обратном направлении: Н2О = Н+ + ОН–, ∆Н = 58 кДж/моль, есть уравнение диссоциации воды как слабого электролита. Реакции нейтрализации

1,8*10-16 = ρ (воды)= 1000г/л; М(воды)= 18г/моль С= ν/V ν= m/M C=m/VM m= Vρ C=Vρ/VM C=ρ/M 1000/18 = 55,56 моль/л [Н2О] =

В воде и водных растворах концентрации ионов Н+ и ОН– взаимосвязаны константой диссоциации воды: Н2О = Н+ + ОН– Кдисс = [Н+][ОН–]/[Н2О] = 1,8•10–16 (при 25 °С). Мольная концентрация воды из-за ее крайне незначительной диссоциации остается постоянной, поэтому она равна [Н2О] = 1000/18 = 55,56 моль/л. Объединим константу равновесия диссоциации воды с постоянным значением ее концентрации: К•[Н2О] = 1,8•10–16•55,56 = 1•10–14. Реакции нейтрализации

![Полученная величина называется ионным произведением воды КH20 : КH20 = [Н+][О.](https://ds05.infourok.ru/uploads/ex/0b1c/001010ab-a5a468ce/img15.jpg)
Полученная величина называется ионным произведением воды КH20 : КH20 = [Н+][ОН–] = 1•10–14. Это произведение согласно закону действующих масс, являясь константой равновесия, не зависит от концентраций ионов водорода и гидроксид-ионов и постоянно при данной температуре. Ионное произведение воды

В чистой воде или нейтральном (не кислотном, не щелочном) растворе концентрации ионов водорода и гидроксид-ионов равны: [Н+] = [ОН–], поэтому КH2O= [Н+][ОН–] = [Н+]2 = 1•10–14. В чистой воде или нейтральном водном растворе концентрация ионов водорода равна а концентрация гидроксид-ионов равна: Ионное произведение воды

Если в чистую воду добавить ионы водорода (прилить кислоту), то получится кислотный раствор, в котором концентрация ионов водорода будет больше 1•10–7 моль/л: [Н+] > 1•10–7 моль/л. Если в чистую воду добавить гидроксид-ионы (прилить щелочи), то получится основный (щелочной) раствор, в котором концентрация ионов водорода будет меньше 1•10–7 моль/л: [Н+] 1•10–7 моль/л. Ионное произведение воды

Пользоваться такими значениями концентраций, выраженными в виде числа 10 в отрицательной степени, очень неудобно, и было предложено применять отрицательные десятичные логарифмы концентраций ионов водорода и гидроксид-ионов и обозначать их соответственно рН и рОН: рН = –lg [Н+], pOH = –lg [ОН–] Водородный показатель

Величина рН называется водородным показателем. В 1909 г. С.Сёренсен предложил для выражения кислотности растворов указывать величину отрицательного десятичного логарифма концентрации ионов водорода, которая получила обозначение pH (potential hydrogeni ): pH = –lg [H+]. Водородный показатель

lg 1= lg 105 = lg 10-2 = lg a*b = lg a/b = lg an = lg a1/n = Вычисление десятичного логарифма на калькуляторе Что же такое логарифм? 0 5 -2 lga+lgb n(lga) Lga-lgb 1/n(lga)
![Прологарифмировав выражение [Н+][ОН–] = 1•10–14 , получим lg [Н+] + lg [ОН–].](https://ds05.infourok.ru/uploads/ex/0b1c/001010ab-a5a468ce/img21.jpg)
Прологарифмировав выражение [Н+][ОН–] = 1•10–14 , получим lg [Н+] + lg [ОН–] = –14. Для водных растворов выполняется соотношение: рН + рОН = 14. Для нейтральных растворов рН = 7, для кислотных растворов рН 7. Изменение рН на единицу соответствует изменению водородных ионов в 10 раз. Водородный показатель
![рН = - lg [H+] [ H+]= 10-7 pH=7 [ H+]= 10-3 pH=3 [ H+]= 10-9 pH=9 Вывод: при.](https://ds05.infourok.ru/uploads/ex/0b1c/001010ab-a5a468ce/img22.jpg)
рН = - lg [H+] [ H+]= 10-7 pH=7 [ H+]= 10-3 pH=3 [ H+]= 10-9 pH=9 Вывод: при рН 7 среда щелочная среда нейтральная среда кислая среда щелочная


Принято считать сильнокислотными растворами те растворы, рН которых равен 1–2, слабокислотными – 4–5, нейтральными – около 7, слабощелочными – 9–10 и сильнощелочными – 12–13. Водородный показатель

Решите задачи Концентрация ионов водорода в растворе равна 10-3 моль/л. Определите рН раствора. Определите концентрацию ионов водорода в растворе, pН которого равен 6. Чему равна концентрация гидроксид-ионов в растворе, pH которого равен 8? рН одного раствора равен 2, а другого - 6. В л какого раствора концентрация ионов водорода больше и во сколько раз? Окраска лакмуса в растворе с концентрацией ОН-ионов равной 10-5 моль/л - - - + -3 -11 11 3 - - - + 106 10-6 -6 6 - - - + 10-8 10-6 -8 108 - - - + В 1-м в 10 тыс. раз В 2-м в 10 тыс. раз В 1-м в 1 тыс. раз В 2-м в 10 тыс. раз - - - +
Читайте также:

