Иммунные механизмы взаимодействия организма матери и фетоплацентарного комплекса реферат
Обновлено: 06.07.2024
Проведено исследование цитокинового статуса у беременных с хронической плацентарной недостаточностью (ХПН). Учитывались сроки клинической манифестации церебральной патологии у их новорожденных: перинатальное поражение ЦНС, клинически выявляемые с рождения; перинатальное поражение ЦНС, клинически выявляемые через 1 месяц после рождения. Установлено, что сроки манифестации перинатального поражения ЦНС у новорожденных от матерей с хронической плацентарной недостаточностью ассоциированы с различными вариантами иммунного реагирования. При ранней манифестации перинатального поражения ЦНС у новорожденных при декомпенсированной хронической плацентарной недостаточности развивается системный воспалительный ответ, который верифицируется повышением в сыворотке крови беременной содержания IL-1, IL-6, IL-8, IL-12, TNF-α, IFN-γ, неоптерина, что сочетается со снижением IL-4. Выявленные иммунные сдвиги могут быть использованы для диагностики и прогноза церебральных нарушений у новорожденных от матерей с хронической плацентарной недостаточностью с целью раннего назначения адекватной терапии, что снизит частоту инвалидизирующих состояний у данного контингента детей.

1. Клементе Апумайта Х.М. Показатели иммунного статуса у беременных с хронической плацентарной недостаточностью (компенсированная форма) под воздействием озонотерапии и ГБО / Х.М. Клементе Апумайта, A.B. Мурашко, И.С. Сидорова, C.B. Пак, Г.О. Гречканев, С.А. Дворянский, Э.М. Путинский // Актуальные проблемы управления здоровьем населения: сборник научных трудов с международным участием. – Н.Новгород, 2010. – С. 41-43.
2. Краснопольский В.И. Система оценки степени тяжести фетоплацентарной недостаточности у беременных и рожениц / В.И. Краснопольский, Л.С. Логутова, В.А. Петрухин // Российский вестник акушера-гинеколога. – 2008. – № 5. – С. 87-95.
3. Липатов И.С. Прогнозирование и диагностика плацентарной недостаточности на основе маркеров эндотелиальной дисфункции, децидуализации, апоптоза и клеточной пролиферации / И.С. Липатов, Ю.В. Тезиков // Саратовский научно-медицинский журнал. – 2011. – Т.7, № 1. – С. 52-59.
5. Brennan L.J. Vascular Dysfunction in Preeclampsia / L.J. Brennan, J.S. Morton, S.T. Davidge // Microcirculation. – 2014. – Vol. 21. – №2. – P. 4–14.
6. Li M. Innate immunity, coagulation and placenta-related adverse pregnancy outcomes / M. Li, S.J. Huang // Thrombosis Research. – 2009. – Vol. 124, № 6. – P. 656–662.
7. Scifres C.M. Intrauterine growth restriction, human placental development and trophoblast cell death / C.M. Scifres, D.M. Nelson // J. Physiology. – 2009. – Vol. 587, №14. – P. 3453–3458.
8. Tosun M. Maternal and umbilical serum levels of interleukin-6, interleukin-8, and tumor necrosis factor-α in normal pregnancies and in pregnancies complicated by preeclampsia / M. Tosun, H. Celik, B. Avci // J. Maternal-Fetal and Neonatal Medicine. – 2010. – Vol. 23, № 8. – P. 880–886.
Прогресс в современной перинатологии привел к необходимости решения новых проблем, связанных с гестационным процессом и антенатальной охраной плода. Среди них ведущее значение принадлежит хронической плацентарной недостаточности, которая, будучи частым осложнением беременности (от 14 до 22 %), сопровождается гипоксией, задержкой внутриутробного роста плода и является одной из наиболее частых причин перинатальной заболеваемости (до 60 %) и смертности [2, 3,4].
При всем многообразии патогенетических механизмов осложнений беременности реализация их происходит через нарушение нормального функционирования фетоплацентарного комплекса (ФПК). Его деятельность осуществляется благодаря взаимодействию материнских, плодовых и плацентарных факторов. Плацентарная недостаточность – клинический синдром, состоящий из комплекса нарушений трофической, эндокринной и метаболической функции плаценты, ведущих к развитию неспособности поддерживать адекватный и достаточный обмен между организмом матери и плода [1].
При плацентарной недостаточности происходит нарушение иммунобиологических взаимодействий в системе мать-плацента-плод, инициируется запуск каскада патологических процессов, развитие которых может приводить, с одной стороны, к гибели нервных клеток, а с другой, вызывать различные иммунологические сдвиги.
Иммунные медиаторы играют особую роль в запуске реакций воспаления и нарушений микроциркуляции, повышении проницаемости ГЭБ. Нарушение проницаемости ГЭБ обуславливает возможность выхода нейроспецифических белков, обладающих высокой антигенностью, в интерстициальное пространство, распространение током ликвора и поступление в кровь в повышенной концентрации. При этом возникшие морфологические изменения ведут к высвобождению первичных медиаторов воспаления, что сопровождаются рядом клинических симптомов.
Иммунологические процессы в организме беременной определяют физиологическое течение беременности, а нарушение регуляции иммуногенеза в перинатальном периоде может стать ведущей причиной необратимых структурных повреждений мозга и оказать влияние на последующее развитие нервной системы ребенка. На основании современных и высокоинформативных методов доказано взаимовлияние иммунной системы и центральной нервной системы.
Иммунный баланс в функциональной системе мать-плацента-плод формируется под влиянием факторов, среди которых значительную роль играют состояние здоровья женщины до беременности, иммунные генетические различия супругов, местные иммунные реакции на границе раздела мать-фето-плацентарный комплекс. Поскольку нарушение плодово-материнских иммунных взаимоотношений при плацентарной недостаточности является важным звеном патогенеза, оценка цитокинового статуса должна быть неотъемлемой частью комплексного обследования беременных с этой патологией.
Данные о роли факторов иммунной системы матери в формировании неврологической патологии у их новорожденных, малочисленны, следовательно, изучение иммунной реактивности у беременных с плацентарной недостаточностью откроет новые возможности ранней диагностики перинатального гипоксически-ишемического поражения ЦНС и, несомненно, будет способствовать улучшению исходов беременности для новорожденного.
Цель исследования: изучение роли иммунологических факторов беременной с наличием хронической плацентарной недостаточности в формировании церебральных нарушений у их новорожденных.
Материалы и методы
Под наблюдением находилось 80 беременных женщин в сроке 38–39 недель гестации. Из них 61 беременная с декомпенсированной формой плацентарной недостаточности I–II степени (I группа) и 19 пациенток с физиологическим течением беременности и родов (контрольная группа). Разделение на подгруппы проведено с учетом сроков клинической манифестации церебральной патологии у новорожденных: Iа –перинатальное поражение ЦНС, клинически выявляемые с рождения, (n = 35); Ib – перинатальное поражение ЦНС, клинически выявляемые через 1 месяц после рождения, (n = 26). Критериями включения в исследование явились: беременность, осложненная ХПН. Критериями исключения – тяжелая экстрагенитальная патология, активная формы инфекции, пороки развития плода. Диагноз хронической плацентарной недостаточности (ХПН) был установлен на основании данных анамнеза, течения беременности, результатов ультразвуковой диагностики, допплерометрии, гормональных исследований. Разделение беременных на клинические группы проводилось с учетом варианта течения хронической плацентарной недостаточности, основываясь на классификации, приведенной в Национальном руководстве по акушерству.
Результаты и обсуждение
Сравнительный анализ факторов риска у пациенток исследуемых групп показал, что в I группе по сравнению с контрольной группой достоверно чаще встречались гипертоническая болезнь, ожирение, хронический пиелонефрит, нарушение менструальной функции, хронические воспалительные заболевания органов малого таза (р
Иммунологически привилегированные органы. Иммунные взаимоотношения матери и плода. Антигены сперматозоидов и семенной плазмы. Система защиты слизистых репродуктивного тракта. Факторы иммуносупрессии при беременности. Лечение невынашивания беременности.
| Рубрика | Медицина |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 24.06.2015 |
| Размер файла | 571,1 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Иммунологически привилегированные органы. Иммунные взаимоотношения матери и плода
Оплодотворение представляет иммунный процесс - специфическое взаимное распознавание поверхностных детерминант на яйцеклетке и сперматозоиде.
Основные иммунные механизмы, обеспечивающие выживание и нормальное развитие плода (полуаллогенного трансплантата)
· Отсутствие на клетках трофобласта классических Аг HLA I и II классов
· Сдвиг функционального баланса Т-хелперов в сторону клеток 2 типа (Тх2)
· Иммунорегуляторная роль плаценты, обеспечивающая иммуносупрессивный фон в организме матери
История открытия половых клеток
· Сперматозоиды были открыты в 1678 г. микроскопистами А. Ван Левенгуком и Н. Хартсекером.
· Роль, выполняемая спермием в процессе оплодотворения, была выяснена только в XIX столетии.
1826 г. - Открытие яйцеклетки млекопитающих русским эмбриологом Карлом Бэром
Зрелый сперматозоид имеет длину до 50--60 мкм и состоит из головки, шейки и хвостовой части.
Головка сперматозоида, имеющая овальную форму, содержит ядро, окруженное тонким слоем протоплазмы.
В результате колебательных движений хвостовой части сперматозоиды способны совершать самостоятельные движения со скоростью 2-3 мм/мин.
Способность к движениям сперматозоиды получают после их контакта с секретом семенных пузырьков и предстательной железы - семенной жидкости.
Антигены сперматозоидов и семенной плазмы
· групп крови - АВО
· тканевой совместимости - HLA I и II класса
· дифференцировочные - T/t антигены
· рецепторы к Fc IgG
· оболочный SCA (Spermatozoa Coatiug Antigen)
· Антиген МА-1
Характеристика МА-1 антигена сперматозоида
МА-1 Аг взаимодействует со специфическим рецептором блестящей оболочки яйцеклетки
Выраженность экспрессии рецептора к МА-1 не постоянна и зависит от многих факторов:
· Блокада рецептора эндогенными белками
· Удаление рецептора различными ферментами
· Подавление экспрессии рецептора стрессовыми факторами
· Яйцеклетка
· - женская половая клетка, округлой формы, диаметром примерно 130 мкм
· В цитоплазме яйцеклеток (ооплазме) содержатся совокупность питательных веществ -- желток.
· Снаружи яйцеклетка покрыта непроницаемой для макромолекул и лимфоцитов блестящей оболочкой
· Яйцеклетки образуются в результате оогенеза под контролем гонадотропных гормонов (ФСГ, ЛГ), стероидных гормонов (эстрогенов, андрогенов, прогестерона)
Антигены яйцеклетки:
· антигены HLA,
· дифференцировочные T/t антигены,
· специфические антигены прозрачной зоны.
Биологические функции прозрачной зоны яйцеклетки:
· защита фолликулярных ооцитов;
· связывание сперматозоидов в начальной стадии фертилизации;
· предупреждение полиспермии;
· осмотическая регуляция яйцеклетки и развивающегося эмбриона;
· ограничение и защита яйцеклетки и эмбриона в яйцеводе и матке;
· участие в начальных стадиях имплантации.
Система местной защиты слизистых репродуктивного тракта
иммунный невынашивание беременность
Гистогематические барьеры слизистых оболочек:
- цилиндрический эпителий шейки матки
- цервикальные железы
Нормальная микрофлора влагалища и шейки матки (лактобактерии, бифидобактерии и другие).
ГУморальные факторы: клеточные факторы:
Иммуноглобулины Лимфоциты (T, B, NK)
(IgM, IgG, IgA, sIgA)
Цитокины (ИФН) Макрофаги
Комплемент Нейтрофилы
Лизоцим Эпителиальные клетки
Лактоферрин
Трансферрин
Фибронектин
Альбумины
в-лизины
Плацента
· Важнейший орган беременности, обеспечивающий обмен веществ между матерью и плодом, а также защиту плода от инфекционных агентов и от иммунной системы матери, гормональную подготовку к родам и последующей лактации.
· Гормоны плаценты, ее растворимые и фиксированные иммуносупрессорные факторы, почти полная механическая непроницаемость для лимфоцитов и материнских антител делают ее уникалиным иммунорегуляторным барьером.
Функции плаценты (обеспечивает иммунологическое равновесие между матерью и плодом)
1. Обменная (транспортная) функция
· Транспорт IgG к плоду
· Доставка в кровь матери продуцируемого плодом б-фетопротеина, эстрогенов и ГКС, синтезируемых надпочечниками плода, клеток трофобласта, лейкоцитов и эритроцитов
· (б-фетопротеин - белок с мощной иммуносупрессивной активностью)
2. Барьерная функция (предохранение эмбриона от вредных воздействий со стороны организма матери)
Сорбция анти-HLA-антител, направленных против отцовских HLA-антигенов
(анти-HLA-антитела не проявляют цитотоксической активности по отношению к трофобласту за счет инактивации С3-конвертазы системы комплемента)
3. Иммунорегуляторная функция осуществляется путем синтеза гормонов с иммуносупрессивной активностью, необходимых для поддержания иммунологического равновесия в системе мать-плод
· Цитокины (ИЛ-10, ГМ-КСФ)
· Простогландин Е2 (ингибирует активность рецепторов к ИЛ-2 на лимфоцитах)
· Хорионический гонадотропин (ингибирует процесинг и презентацию Аг макрофагами)
· Трофобластический бета1-гликопротеин
· Плацентарный лактоген
· Прогестерон индуцированный фактор
· Альфа-фетопротеин
Механизмы толерантности матери к плоду
· анти-HLA-антителами, не оказывающими цитотоксического эффекта на плацентарную ткань за счет присутствия на поверхности трофобласта факторов, инактивирующих С3-конвертазу>не активируется комплемент> не реализуется цитотоксическое действие анти-HLA-антител
· Синтезом IgG антител (блокирующих ат) в организме беременной против специфических антигенов трофобласта, предохраняющих его от иммунных реакций матери
Факторы иммуносупрессии при беременности:
1. Фактор ранней беременности (ФРБ) - появляется сразу после оплодотворения яйцеклетки и тормозят распознавание лимфоцитами оплодотворенной яйцеклетки.
ФРБ-б (продуцируется на яйцеводах и фиксируется на лимфоцитах)
ФРБ-в (синтезируется желтым телом)
2. Антиген TLX (трофобласт-лимфоцитперекрестный антиген), сенсибилизация к которому создает необходимый фон для развития механизмов супрессии.
3. Отсутствие на трофобласте классических антигенов HLA I класса, препятствующее созреванию трофобластических Т-киллеров
4. Наличие на трофобласте антигенов HLA-G локуса, способствующее созреванию Т-супрессоров, подавлению функции ЕК-клеток
5. Супрессия функции макрофагов
6. Барьерная функция плаценты
7. Роль плаценты, как сорбента HLA-антител
8. Иммунорегуляторная роль плаценты, приводящая к локальной иммуносупрессии за счет ХГТ, плацентарного лактогена, прогестерониндуцированного фактора (подавляет функцию ЕК-клеток, ФНО-б; усиливает функцию Тх-2, продукцию ГКС, ТРФ-в, ПГЕ-2)
9. Онкофетальный б-фетопротеин, обладающий мощным иммуносупрессивным потенциалом
10. Усиление функции Тх-2 - повышение продукции ИЛ-4, ИЛ-10, блокирующих антител (IgG1)
11.Снижение функции Тх-1 - уменьшение продукции ИЛ-2, ИФН-г, ФНО-б, цитотоксических IgG2, оказывающих цитопатогенный эффект на клетки трофобласта.
Супрессорных иммунитет при беременности обеспечивается:
· увеличением популяции клеток - супрессоров (специфических - действующих против МНС - антигенов плода отцовского происхождения; неспецифических - гормонозависимых)
· продукцией супрессорных факторов
· местной иммуносупрессией
Иммунологические критерии невынашивания беременности:
· наличие не менее 3-х самопроизвольных выкидышей в анамнезе без установленной этиологии, отсутствие детей в данном браке,
· совпадение (гомозиготность) супругов не менее чем по двум HLA-антигенам,
· ослабленный иммунный ответ лимфоцитов беременной на аллоантигены мужа и плода,
· снижение блокирующей активности сыворотки беременной по отношению к аутологичным лимфоцитам в реакциях клеточного иммунитета,
· высокий титр противоспермальных антител;
· наличие аутоиммунных реакций, направленных против антигенов прозрачной зоны яйцеклетки.
· снижение супрессорной активности сыворотки беременной.
Значение иммунологических факторов в развитии бесплодия
Бесплодие в браке может быть обусловлено следующими иммунными факторами:
· Вторичным иммунодефицитом у жены (инфекция >воспаление>нарушение эндокринно-иммунных взаимодействий >ВИД)
· Антиспермальным - антигаметным иммунным конфликтом (воспаление >активация местного иммунитета >снижение иммуносупрессивных свойств семенной плазмы); генетическая предрасположенность иммунной системы женщины к усиленному антителосинтезу
· Повышенной степенью гистосовместимостью между супругами (относительное бесплодие)
Лечение невынашивания беременности:
1) трансплантация кожного лоскута от мужа.
2) предварительная внутрикожная иммунизация взвесью лимфоцитов мужа,
3) внутривенное введение лейкоцитов крови донора
Подобные документы
Выкидыш - прекращение беременности, вследствие рождения плода до истечения 28 недель, когда он еще нежизнеспособен. Классификация выкидышей и причины невынашивания плода. Симптомы самопроизвольного аборта. Неотложная помощь и лечение при угрозе выкидыша.
реферат [34,5 K], добавлен 23.09.2011
Обследование до наступления беременности. Клиническая картина и диагностика переношенной беременности. Несовместимость организма матери и плода. Классификация невынашиваний по срокам возникновения. Лабораторно-инструментальные методы исследования.
презентация [2,6 M], добавлен 28.11.2015
Понятие и основные причины патологий беременности: невынашивания и перенашивания, преждевременных родов. Факторы риска и основные методы профилактики. Аборт как прерывание беременности сроком до 22 недель с массой плода
Большого внимания заслуживает состояние во время беременности иммунной системы матери и плода, Эмбрион и плод человека получают от отца 50 % генетической информации, которая чужеродна для организма матери. Другая половина генетической информации плода является общей для него и матери. Таким образом, плод всегда является генетически "полусовместимым трансплантатом" по отношению к организму матери.
В процессе развития беременности между организмами матери и плода возникают и формируются очень сложные иммунологические взаимоотношения, основанные на принципе прямой и обратной связи. Эти взаимоотношения обеспечивают правильное, гармоничное развитие плода и препятствуют отторжению плода как своеобразного аллотрансплантата.
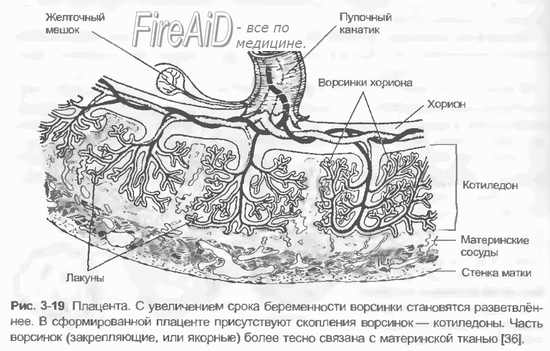
Антигенная активность плода возникает и развивается постепенно. Самым ранним иммунным барьером является блестящая оболочка, которая образует защитный слой вокруг яйцеклетки и в дальнейшем сохраняется от момента оплодотворения почти до стадии имплантации. Установлено, что блестящая оболочка непроницаема для иммунных клеток, вследствие чего антитела матери, которые могли бы образоваться в оплодотворенной яйцеклетке и эмбрионе на ранних стадиях развития, не могут пройти через этот барьер. В дальнейшем иммунная защита эмбриона и плода начинает осуществляться другими сложными механизмами, обусловленными изменениями в материнском организме и плаценте.
Антигены трофобласта возникают приблизительно на 5-й неделе внутриутробного развития, а антигены плода — на 12-й неделе. Именно с этого периода начинается и профессирует иммунная "атака1' плода. Каким же образом материнский организм реагирует на эту прогрессирующую иммунологическую атаку? Каковы важнейшие механизмы защиты плода от иммунологической афессии матери, что в конечном итоге способствует неотторжению плодного яйца как аллотрансплантата? Необходимо отметить, что эти вопросы, несмофя на значительное количество клинических и экспериментальных исследований, изучены до настоящего времени недостаточно, а полученные данные нередко носят противоречивый характер.
Важнейшим фактором защиты плода является иммунологическая толерантность материнского организма к антигенам плода отцовского происхождения, обусловленная различными механизмами. Известно, что реакции антиген—антитело регулируются гуморальными и клеточными механизмами. При физиологическом развитии беременности гуморальное звено иммунитета, оцениваемое на основании уровня в крови иммуноглобулинов классов А, М и G, существенно не изменяется, за исключением концентрации иммуноглобулина G, которая в конце беременности несколько снижается в результате перехода IgG через плаценту к плоду. Не претерпевает значительных изменений во время беременности и такая важнейшая составная часть иммунной системы, как система комплемента, Следовательно, организм беременной не только адекватно отвечает на антигенную стимуляцию плода, но и вырабатывает антитела, связывающие антигены отцовского происхождения.
Во время беременности соотношение Т-, В-лимфоцитов, Т-хелперов и Т-супрессоров существенно не меняется, хотя абсолютное количество этих клеток подвержено определенным колебаниям. Повышение количества лимфоцитов, характерное при беременности, не имеет существенного значения в процессах иммуномодуляции. Следовательно, для физиологически протекающей беременности характерна известная иммунологическая толерантность материнского организма к антигенам плода отцовского генеза. Эта толерантность обусловлена рядом факторов, Большую роль ифают гормоны и специфические белки плаценты.
Выраженными иммунодепрессивными свойствами обладает хорионический гонадотропин, который продуцируется трофобластом с самых ранних стадий беременности. Аналогичными свойствами обладает плацентарный лактоген. Наряду с этими гормонами известную роль в процессах иммуносупрессии играют также глюкокортикоиды, прогестерон и эстрогены, которые в возрастающем количестве вырабатываются плацентой на протяжении беременности. Кроме гормонов, подавлению реакций иммунитета материнского организма способствуют альфа-фетопротеин — белок, продуцируемый эмбриональными клетками печени, а также некоторые белки плаценты зоны беременности (альфа2-гликопротеин и трофобластический бета1-гликопротеид), Эти белки плаценты в совокупности с хорионическим гонадотропином и плацентарным лактогеном создают как бы зону биологической защиты фетоплацентарного комплекса от действия клеточных и гуморальных компонентов иммунной системы матери.
Большую роль в иммунной защите плода играет плацента. Наличие трофобластического, а затем и плацентарного барьеров, разделяющих организм матери и плода, обусловливает выраженные защитные функции. Установлено, что трофобласт резистентен к иммунному отторжению. Кроме того, трофобласт со всех сторон окружен слоем аморфного фибриноидного вещества, состоящего из мукополисахаридов. Этот слой надежно защищает плод от иммунологической агрессии организма матери. Известная роль в подавлении иммунных реакций в плаценте принадлежит также Т- и В-лим-фоцитам, макрофагам, гранулоцитам и некоторым другим клеточным элементам, которые обнаруживают в тканях плаценты. Таким образом, иммунологические взаимоотношения системы мать—плод являются физиологическим процессом, направленным на создание и обеспечение необходимых условии для нормального развития плода. Нарушение этого процесса нередко приводит к развитию патологии беременности (невынашивание, гестозы и др.).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
В обзоре изложены современные представления об этиологии и патогенезе гестоза. Показано значение как генетически детерминированного, так и обусловленного развитием воспалительного процесса гениталий повышения проницаемости маточно-плацентарного барьера для антигенов плода. Рассмотрена роль иммунокомплексной патологии как пускового механизма в развитии гестоза, значение нарушения продукции плацентой белков беременности и цитокинов с иммуносупрессивным действием при осложненном течении беременности.

Среди распространенных теорий патогенеза гестоза ведущей является точка зрения о гиперреактивности организма матери на антигены плода, попадающие в ее кровоток и индуцирующие развитие аллергических реакций гуморального типа, в частности, иммунокомплексной патологии [5,11].
В то же время рядом исследователей выявлена тесная взаимосвязь между нарастанием уровня антител к антигенам клеточных мембран и наличием рано развивающегося тяжелого гестоза [3,17].
При иммунофлюоресцентном анализе почечных биоптатов у женщин в сроки от 8 дней до 1,5 лет после завершения беременности, сопровождавшейся развитием тяжелой формы гестоза, было обнаружено отложение иммуноглобулинов основных классов - IgG, IgM, IgA в эпителии клубочков почек, в стенке артерий, в мезангии у 15 из 17 обследованных женщин, что не характерно для здоровых женщин. Одновременно выявлено отложение С3 компонента комплемента в клубочках почек [8]. ысокая частота выявления в почечных биоптатах иммуноглобулинов различных классов и иммунных комплексов позволяет высказать точку зрения, согласно которой в основе развития полиорганной недостаточности при этой патологии лежит срыв иммунологической толерантности матери по отношению к антигенам плода и развитие системных иммуноаллергических реакций.
Касаясь происхождения потенциальных антигенов, обеспечивающих сенсибилизацию матери при развитии гестоза, следует отметить, что в оплодотворенной яйцеклетке выделяют по крайней мере 3 группы антигенов: отцовские аллоантигены, эмбриональные антигены, появляющиеся на определенном этапе развития, а также продукты женских половых путей. HLA-антигены появляются на клетках плода между 8 и 9 неделями эмбрионального развития [7,13].
Следует отметить, что в половом тракте женщины развита система местного иммунитета, представленная макрофагами, нейтрофилами, CD-4 и CD-8 Т-лимфоцитами, а также иммуноглобулинами классов IgG и IgA, содержащими антиспермальные антитела [4].
Несмотря на наличие указанных местных механизмов защиты, не происходит полной элиминации сперматозоидов, нарушения имплантации оплодотворенной яйцеклетки и отторжения бластоцисты. Это обусловлено тем, что иммунная система беременной толерантна к антигенам эмбриона и плода в связи с наличием плацентарного барьера (трофобласта), обеспечивающего изоляцию фетального кровотока от иммунокомпетентных клеток матери. Кроме того, трофобласт обладает низкой плотностью антигенов тканевой гистосовместимости (HLA) и соответственно не обеспечивает возможного механизма "двойного распознавания" лимфоцитами антигенов плаценты [7,20].
Анализируя данные литературы, касающиеся возможных механизмов срыва иммунологической толерантности матери по отношению к антигенам плода, необходимо выделить следующие пусковые механизмы, приводящие к аутосенсибилизации матери антигенами плода и развитию гестоза:
- генетически детерминированнная недостаточность продукции иммуносупрессирующих факторов плаценты, сцепленная с различными изоантигенами гистосовместимости (HLA B7, HLA B17 ,HLA B27 и др.) Замечено, что среди дочерей женщин с преэклампсией число заболеваний гестозом в 8 раз выше, чем в нормальной популяции. Создана генетическая карта исключения, согласно которой имеет место аутосомно-рецессивный путь наследования заболевания.
- приобретенная форма патологии плаценты инфекционно-воспалительной природы, сопровождающаяся нарушением трофики и васкуляризации плаценты, изменением ее функциональной активности и соответственно недостаточностью продукции цитокинов, обладающих иммуносупрессорным действием (ФНО-a, М-КСФ и ГМ-КСФ, ИЛ-6, ИЛ-8 и др ).
В настоящее время четко определена иммуносупрессирующая роль плаценты за счет продукции цитокинов и белков беременности, что препятствует отторжению плода как носителя генетически чужеродной информации. В связи с этим целесесообразно остановиться на соответствующих данных литературы. Характерной особенностью плаценты является синтез более 25 эмбриоспецифических белков, называемых иногда онкофетальными или раковоэмбриональными. В настоящее время предполагается, что именно фетальные белки играют решающую роль в индукции и поддержании иммунологической толерантности в системе мать-плод. Среди онкофетальных белков с иммуносупрессивным действием наиболее важная роль отводится трофобластическому β -гликопротеину (ТБГ) и α-фетопротеину (АФП), которые препятствуют отторжению плода во время беременности [1, 16].
Следует отметить, что иммуномодулирующие свойства плаценты, препятствующие отторжению плода как носителя генетически чужеродной информации, обеспечиваются не только продукцией альфа-фетопротеина и трофобластического β-гликопротеина, но и различными цитокинами.
Как известно, плацента является важнейшим продуцентом гормонов, биологически активных соединений, цитокинов. За последнее 10-летие установлено что плацента и некоторые репродуктивные ткани способны синтезировать широкий спектр цитокинов (фактор некроза опухоли a, интерлейкины 1,2, 6, 8, 15, трансформирующий фактор роста β, колониестимулирующие факторы, интерфероны α и β). Цитокины плаценты обладают чрезвычайно высокой активностью и принимают непосредственное участие в механизмах, обеспечивающих физиологический уровень сосуществования генетически чужеродных организмов матери и плода при беременности [6,14,19].
Среди указанных цитокинов плаценты наиболее важная роль отводится фактору некроза опухолей α (ФНО-α). Рядом авторов было выявлено более высокое содержание указанного цитокина в крови женщин с преэклампсией по сравнению со здоровыми беременными [15].
Как указывалось выше, цитокинами плаценты и лимфоидной ткани являются ИЛ-6 и ИЛ-8, оказывающие иммуномодулирующие эффекты. ИЛ-6, продуцируемый трофобластом, является звеном цитокинового каскада фетоплацентарного комплекса, который, с одной стороны, реализует совместно с ИЛ-1 и ФНО-α перестройку эндокринной системы матери, а с другой - контролирует иммунные реакции в фетоплацентарной зоне. Не исключено, что в зоне контакта иммунокомпетентных клеток матери и плаценты ИЛ-6 препятствует эффекторным реакциям материнских лимфоцитов благодаря активации CD8+-клеток-супрессоров и блокирования реакций гиперчувствительности замедленного типа, лежащих в основе механизма отторжения тканей. Таким образом, выявленное рядом авторов уменьшение продукции ИЛ-6 у беременных с гестозом может быть одним из патогенетических факторов подавления иммуносупрессорных реакций и срыва иммунологической толерантности матери по отношению к антигенам плода. Иммуномодулирующими цитокинами плаценты являются ИЛ-2, ИЛ-10, ИЛ-15,трансформирующий фактор роста b (ТРФ-β).
Известно, что плацента при беременности продуцирует два гемопоэтических фактора роста: гранулоцитарномакрофагальный колониестимулирующий фактор (ГМ-КСФ) и макрофагальный колониестимулирующий фактор (М-КСФ).
Наиболее существенными эффектами М- и ГМ-КСФ являются следующие: оба КСФ оказывают выраженные трофические эффекты на ткани плаценты; факторы способствуют притоку моноцитов и макрофагов в плацентарный компартмент, поддерживая их жизнеспособность и дифференцировку, а также выступают индукторами цитокинов. Отмечено снижение концентрации М-КСФ и ГМ-КСФ в сыворотке крови у беременных с гестозом [18].
Плацента продуцирует также интерфероны 1 типа ИНФ-α и ИНФ-β, оказывающие преимущественно депрессорные эффекты, однако в настоящее время в литературе в отношении значимости указанных цитокинов в отношении гестоза отсутствуют сколько-нибудь систематизированные данные.
Вышеизложенное делает очевидным тот факт, что недостаточность продукции лимфоидной тканью, макрофагальными элементами, плацентой цитокинов с иммуносупрессивной направленностью действия (ТРФ-β, ИНФ 1-го типа, М-КСФ, ГМ-КСФ, ИЛ-2, ИЛ-6 , ИЛ-10, ИЛ-15) или усиление продукции цитокинов с иммуностимулирующим эффектом (ФНО-α,ИЛ-1) могут обеспечить срыв иммунологической толерантности лимфоидной системы матери по отношению к антигенам плода.
Нарушение продукции плацентой цитокинов и гормонов, регулирующих иммунный ответ, может носить не только наследственный характер, но и иметь место при локальных воспалительных процессах гениталий инфекционной природы. Так, данные литературы свидетельствуют о том, что у погибших вследствие гестоза женщин оказался высоким процент сопутствующих гинекологических заболеваний, причем наиболее часто имели место воспалительные заболевания: сальпингооофорит, эндоцервицит, трихомониаз, острая гонорея, распространенний кондиломатоз наружных половых органов и влагалища и др. [9,10].
Молекулярно-клеточные механизмы этих процессов могут быть представлены в аспекте современных данных об общих закономерностях развития воспаления и формирования иммунных механизмов защиты у плода. Как известно, в случае развития острых и хронических воспалительных процессов гениталий инфекционной природы (хламидиоз, уреаплазмоз, трихомониаз, бактериальная инфекция) неизменно возникает закономерное усиление продукции в фазу альтерации медиаторов воспаления с выраженным вазоактивным действием, вызывающих резкое повышение проницаемости сосудов, их расширение, явления тромбоза, эмболии, циркуляторной гипоксии, усугубляющей повышение проницаемости маточно-плацентарного барьера [2].
Повышение проницаемости маточно-плацентарного барьера и соответственно проникновение антигенов плода в кровоток матери, индукция иммунного ответа может иметь место и при различных формах экстрагенитальной патологии, характеризующейся развитием хронической циркуляторной гипоксии у больных с гипо- и гипертензивным синдромом, с сердечной и легочной недостаточностью, различными эндокринопатиями, патологией почек, сопровождающейся нарушением сосудистого тонуса, васкуляризации и трофики тканей [5,12].
При всех вышеперечисленных видах патологии в связи с развитием циркуляторной , дыхательной, тканевой гипоксии возможно нарушение трофики плаценты. При этом не только нарушается продукция цитокинов с иммуносупрессирующими свойствами, но и повышается проницаемость маточно-плацентарного барьера для эмбриональных антигенов, возникает проникновение их в системный кровоток с последующей индукцией иммунного ответа.
Анализ приведенных выше данных литературы убедительно свидетельствует о возможности срыва иммунологической толерантности матери по отношению к антигенам плода и развитию сенсибилизации материнского организма вследствие комплекса патогенетических факторов:
- Генетически детерминированной недостаточности продукции плацентой иммуносупрессирующих гормонов и цитокинов.
- Приобретенного повышения проницаемости маточно-плацентарного барьера для антигенов плода при одновременном подавлении продукции иммуносупрессирующих субстанций плацентой в случае развития инфекционного процесса в матке, плаценте и оболочках плода.
В случае развития системной циркуляторной, дыхательной, тканевой гипоксии и нарушения гемодинамики и микроциркуляции в маточно-плацентарном комплексе с последующим подавлением иммуносупрессивной функции плаценты при экстрагенитальной патологии (сердечная и легочная недостаточность, ожирение, эндокринопатии).

Состояние полости рта беременных всегда обращало на себя внимание врачей-стоматологов, однако ещё не разработан комплекс адекватных профилактических мероприятий для предупреждения развития заболеваний пародонта и твердых тканей зуба у женщин в период беременности. Это объясняется тем, что всякая профилактика заболеваний, так же как и патогенетическая терапия, предполагает прежде всего знание их этиологии и патогенеза. Между тем, данные отечественной и зарубежной литературы, касающиеся изучения патологии твердых тканей зуба и пародонта в период беременности, как и взгляды на этиопатогенез этих заболеваний разноречивы.
Ряд учёных придерживается мнения о связи стоматологического статуса с гормональными сдвигами в организме беременных женщин.
К концу I триместра между организмами матери и плода устанавливается сложный обмен гормонов. Формирующаяся к этому времени плацента начинает продуцировать большое количество гормонов белковой и стероидной природы, в 10-100 раз превышающее суточную продукцию гормонов классическими эндокринными железами.
Такой резкий скачок уровня гормонов находит своё отражение и в полости рта, что может быть объяснено наличием высокоспецифичных эстрогенных рецепторов в культуре клеток костной ткани, в тканях маргинального пародонта, в мелких сосудах, либо влиянием половых гормонов на состояние десны через иммунную систему, которая претерпевает изменения на протяжении всего периода беременности.
Учёные амстердамского университета пришли к выводу, что повышение уровня эстрогенов и прогестерона слизистой оболочки десен влияет на проницаемость сосудов и экссудацию вплоть до остановки микроциркуляции, ведет к увеличению образования простагландина Е2 слизистой оболочки, вызывает недостаточность солей фолиевой кислоты, снижает способность к кератинизации и клеточной регенерации, а, следовательно, изменяет барьерную функцию эпителия, чем и объясняется усиление клинических проявлений при гингивитах.
Meijer van Putten J.B. (1998) отмечает усиление воспалительного процесса в десне, при котором имеет место физиологический сосудистый феномен (гиперемия и отек). Кроме того, эстроген и прогестерон изменяют микроокружение бактерий полости рта и содействуют их росту, а также являются причиной изменчивости их популяции [336, 348]. Это подтверждает данные китайских учёных С.С. Tsai, K.S. Chen (1995), выявивших положительную корреляцию между уровнем прогестерона, беременностью, тяжестью гингивита и процентом пигментообразующих бактерий. И.Я. Бутане оценивала и доказала влияние гормональных сдвигов при беременности на состояние зубочелюстной системы.
B.JI. Губаревская (экспериментальными исследованиями установила, что прогестерон вызывает рост эпителия сосочков десны в подлежащую соединительную ткань без признаков воспаления в ней, а введение подопытным животным эстрогенов вызывало выраженные изменения десневого края во второй половине беременности.
Однако при изучении литературы мною не было обнаружено никаких данных, касающихся влияния белковых гормонов плаценты, самым важным из которых является хорионический гонадотропин (ХГ), на стоматологический статус беременных женщин.
Известно, что в первые недели и месяцы беременности происходит усиленный синтез ХГ – гормона, вырабатываемого сначала трофобластом, а затем плацентой, который, поступая в кровь, способствует функционированию желтого тела, а, следовательно, физиологическому течению всех процессов, возникших в матке в ранние сроки беременности.
Под влиянием ХГ протекает период органогенеза человека, который начинается на 12-14 день беременности. Доказательством значения ХГ в процессе беременности является то, что при угрожающем аборте и при рвоте беременных обнаружено резкое снижение концентрации ХГ в организме женщин, что позволило авторам по экскреции ХГ судить о функции плаценты и прогнозировать течение беременности. Состояние невынашивания беременности, угрожающего аборта коррегируется введением ХГ.
Значение ХГ в защите беременности, росте и развитии плода проявляется ещё и в том, что при снижении синтеза ХГ в процессе беременности новорождённые рождаются с функционально незрелыми системами, с повышенной заболеваемостью, признаками гипотрофии, при которой смертность их в 3 раза выше, чем при нормальном течении беременности, когда этот процесс контролируется достаточным количеством ХГ.
Синтез ХГ начинается на 5-6-е сутки беременности, затем его концентрация быстро нарастает, достигая своего пика между 60-м и 80-м днями беременности, потом она быстро снижается и остаётся до конца беременности на сравнительно низком уровне, и только между 210-м и 240-м днями беременности продукция гормона вновь повышается, но далека от первоначально высоких значений.
При неполноценной функции трофобласта нарушаются процессы синтеза и секреции ХГ, в результате чего уменьшается его содержание в крови. Это вызывает снижение синтеза эстрогенов и прогестерона, обеспечивающих течение нормальных биохимических и физиологических процессов в мышце матки, приводит к усилению сократительной активности миометрия и угрозе прерывания беременности.
Действуя в защиту беременности, ХГ играет важную роль в регуляции механизмов, предотвращающих иммунологический конфликт между матерью и плодом. А.Р. Weetman рассматривает беременность как состояние иммунного балансирования, когда иммунная система матери должна остаться терпимой к антигенам главного комплекса гистосовместимости отца и одновременно поддерживать нормальную иммунокомпетентность для защиты против микроорганизмов.
Способность ХГ подавлять продукцию антител организма матери была обнаружена J.B. Youger, G. Pierre, С.М. Zmijewski ещё в 1969 году и подтверждена многочисленными авторами. Кроме непосредственного действия ХГ на процесс торможения антителообразования, гормон влияет на этот процесс и опосредованно, через стимуляцию синтеза стероидных гормонов, тоже обладающих выраженными иммунодепрессивными свойствами.
Во время беременности организмы матери и плода тесно связаны между собой и плацентой. Это допускает обмен клеток и обуславливает перестройку иммунокомпетентных органов беременности, функции которых выполняются преимущественно двумя типами клеток.
По мнению В.Н. Серова, Е.В. Жарова, О.И. Сускова беременность относится к вторичным иммунодефицитным состояниям и характеризуется количественными и функциональными изменениями в Т- и В-системах иммунитета и неспецифических факторов защиты.
При исследовании клеточного иммунитета у женщин в I триместре физиологически протекающей беременности установлено снижение относительного и абсолютного количества Т- и В-лимфоцитов, снижение уровня Т-хелперов и выраженная неспецифическая Т-клеточная супрессия. Кроме того, отмечается достоверное увеличение уровня иммуноглобулина G (IgG) и некоторое снижение иммуноглобулина A (IgA), по сравнению со здоровыми небеременными женщинами.
Снижение количества Т-лимфоцитов в ранние сроки беременности, по-видимому, направлено на предотвращение реакций, связанных с отторжением генетически чужеродного плод. Падению уровня Т-лимфо-цитов (субпопуляции Т-хелперов) до минимума предшествует пик содержания ХГ, оказывающего иммуносупрессивное действие.
При изучении иммунитета у женщин с угрозой прерывания и не вынашивания беременности в анамнезе выявлено нарастание хелперной и снижение супрессорной субпопуляций Т-лимфоцитов, увеличение хелперно-супрессорного коэффициента в два раза, снижение уровня блокирующих факторов по сравнению со здоровыми беременными, достоверное повышение количества Т- и В-лимфоцитов и резкое снижение 0- лимфоцитов.
У беременных с выраженной рвотой не было обнаружено повышения активности иммунной системы.
При гестозах, развивающихся вследствие истощения нейроэндокринной системы, иммунных сдвигов в организме матери и плода, несостоятельности маточно-плацентарного барьера, генетического конфликта, осложняющих течение беременности, наблюдается общая Т-лимфопения, а также закономерное снижение количества активных Т- и В-лимфоцитов при нарастании тяжести позднего токсикоза.
По мнению В.И. Говалло и В.М. Сидельниковой, антигенные различия матери и плода стимулируют развитие иммунорегуляторных механизмов.
В защите организма от проникновения антигенов через слизистые оболочки большую автономную роль играет местный иммунитет, функцию которого выполняет комплекс неспецифических биологически активных веществ (лактоферрин, лизоцим, опсонины, интерферон, муцины, гликопротеиды секретов и др.), клеточный и секреторный иммунитет (Т-клетки, антитела).
Неспецифическая защита принимает на себя роль первого барьера на пути антигена, при этом ведущее значение имеет лизоцим – щелочной белок, действующий как муколитический фермент, главным источником лизоцима в ротовой полости являются эпителиальные клетки протоков слюнных желёз (80%) и в меньшей степени полиморфно-ядерные лейкоциты (ПМЯЛ), моноциты и их предшественники (20%).
Лизоцим стимулирует фагоцитарную активность лейкоцитов, участвует в регенерации биологических тканей, способствует реализации иммунного ответа посредством slgA; по уровню снижения лизоцимной активности слюны у беременных женщин прогнозируется возможное невынашивание беременности.
Стимулом для образования и секреции лизоцима является повышение количества микрофлоры в ротовой полости; оптимум действия наблюдается при рН 5-7.
В секретах лизоцим действует не изолированно, а в комплексе с иммуноглобулимною. Отличием секреторной иммунной системы от системы крови является различное количественное соотношение отдельных классов иммуноглобулинов: в сыворотке крови преобладают IgG и IgM, слабо представлен IgA; в секретах же, наоборот, доминирует IgA при низком содержании IgG и IgM. Соотношение IgA : IgG : IgM в слюне составляет приблизительно 20:3:1.
Иммуноглобулин A (IgA) – основной и преобладающий вид иммуноглобулинов, участвующих в местном иммунитете, он препятствует соединению местнообразующихся IgG и IgM с различными антигемною, что привело бы к лизису антигенов и повреждению тканей.
Секреторный иммуноглобулин A (slgA) изучался многими исследователями с целью выяснения вопросов о механизме синтеза, о способах определения, функциях и биологическом значении, свойствах и возможностях использования. SlgA состоит из 2-х молекул IgA, соединённых с секреторным компонентом (SC) и представлен двумя субклассами: ]£А1 (90%) и 1£А2 (10%). Наибольшая концентрация из группы больших слюнных железах отмечается в секрете околоушных слюнных желёз. Содержание ^ в слюне зависит от внутренних факторов: возраста и пола.
Важную роль в формировании противоинфекционного иммунитета играет иммуноглобулин С (^С). К этому классу иммуноглобулинов относится порядка 90% антитоксинов, притивобактериальных и противовирусных антител. Защитная противоинфекционная функция основана на свойстве иммуноглобулинов этого класса активизировать комплемент и реакции, способствующие фагоцитозу и внутриклеточному аутолизу микроорганизмов, нейтрализации токсинов, избыточное накопление его в секретах свидетельствует о повышении антигенной нагрузки. При воспалительных заболеваниях пародонта его количество в ротовой жидкости резко увеличивается, что может рассматриваться как компенсаторный механизм при низком содержании б^А .
Иммуноглобулин М (1ёМ) – наименьший из классов иммуноглобулинов ротовой жидкости и отвечает за работу системы местного иммунитета полости рта (МИПР) в условиях нарастания тяжести воспалительного процесса.
Изучением функциональных связей факторов резистентности полости рта, обеспечивающих эффективность барьерной функции, а также зависимости стоматологического уровня здоровья от МИПР занимались многие учёные. Высокая интенсивность кариеса зубов на фоне повышенного содержания б^А и выраженного дефицита и ^М в слюне, что характерно для острого течения кариеса, была отмечена А.И. Марченко, Г.Д. Овруцкий. В то же время имеются сведения, указывающие на высокую интенсивность кариеса сопровождаемую снижением уровня slgA.
Существенное значение имеет гигиеническое состояние полости рта в момент обследования. При рациональном гигиеническом уходе за зубами, приводящем к значительному снижению индекса гигиены полости рта, уровень slgA в слюне существенно повышается.
При изучении гуморального иммунитета при кариесе зубов Г.Д. Овруцким, А.И. Марченко, H.A. Зелинской установлено повышение содержания IgA и IgG, а также снижение содержания IgM. Тогда как ранее Г.Д. Овруцким, Ф.З. Савранским выявлено существенное снижение содержания сывороточного IgG, тенденция к уменьшению уровня сывороточного IgA у лиц с множественным кариозным поражением, а при низкой интенсивности кариеса была отмечена лишь тенденция к снижению показателя IgG. Кроме того, на интенсивность кариозного процесса оказывает влияние состояние противомикробной активности цельной крови.
В настоящее время накапливается всё больше данных о ключевой роли эпителиоцитов пародонта и Pix взаимосвязи как с факторами местного иммунитета, так и клеточного и гуморального иммунитета в целом.
Е.А. Земская, В.В. Хазанова уже в начале развития пародонтита установили факт снижения уровня slgA, достоверное повышение уровня IgG и IgA, поступающих из сыворотки и выполняющих компенсаторную функцию.
Установлена зависимость slgA от функции Т-системы иммунитета на основании того факта, что у тимэктомированных собак резко снижается продукция slgA, а при помощи избирательного активирования Т-лимфоцитов системы, осуществляемой повторными аппликациями препарата 2,4-динитрохлорбензола, создаётся модель заболевания пародонта у морских свинок и белых крыс.
Снижение общего числа Т-лимфоцитов при заболеваниях пародонта некоторые учёные связывают с недостаточностью дифференцировочного фактора тимуса в крови больных. Другие исследователи отмечают зависимость снижения относительного и абсолютного содержания Т-лимфоцитов от тяжести развития процесса.
По мере истощения супрессорной функции Т-лимфоцитов начинается бесконтрольная активация иммунного ответа на аутоантигены.
Разностороннее изучение показателей клеточного и гуморального иммунитета при заболеваниях пародонта показало существенные нарушения иммунных процессов. При этом выявлены неоднозначные иммунные перестройки, характеризующиеся волнообразным течением с активацией иммунных реакций в зависимости от степени заболевания.
D.E. Lopatin et al. наблюдаемой во II триместре беременности иммуносупрессией объясняли отсутствие расширения реакции бласттрансформации на бактерии полости рта, связанные с развитием гингивита, что характерно для гингивита вне беременности.
JI.B. Гноевая выявила взаимосвязь характера течения патологического процесса в тканях пародонта с изменениями показателей иммунного статуса при беременности: наибольшая активность хелперных Т-клеток наблюдалась при гипертрофическом гингивите и тяжёлой степени катарального гингивита.
Имеющиеся данные об антиадгезионном действии факторов местного иммунитета на патогенные микроорганизмы и о влиянии этих факторов на формирование зубной и поддесневой бляшки наводят на мысль об изменениях в системе местного иммунитета, как механизма развития стоматологических заболеваний в период беременности.
Так, Л.Д, Романовская отметила, что на фоне развивающегося вторичного физиологического иммунодефицита значительно повышается роль местных раздражающих факторов в развитии патологического процесса в пародонте.
В свете всего вышесказанного в литературе последних лет дискутируется вопрос о том, что приводит к развитию стоматологических заболеваний в период беременности – перестройка гормонального статуса, влекущая за собой изменения в системном иммунитете или наличие микробов, вызывающих снижение естественной резистентности организма. Вот почему изучение ХГ – главного специфического гормона беременности, показателей местного иммунитета полости рта параллельно с общим иммунным статусом представляет значительный интерес, является совершенно новым и перспективным направлением в терапевтической стоматологии, позволяющим глубже внедриться в этиопатогенез заболеваний пародонта и твёрдых тканей зуба в период беременности.
Читайте также:

