Иммобилизованные клетки и ферменты реферат
Обновлено: 05.07.2024
Как уже обсуждалось во введении к данному разделу, коммерческое использование ферментов ограничено рядом факторов. Важнейшие из них — нестабильность ферментов и их высокая стоимость. Стоимость можно существенно снизить за счет иммобилизации фермента. Это означает, что фермент закрепляют на поверхности или внутри твердой подложки, которую легко удаляют из реакционной смеси после завершения ферментации. Фермент может быть использован повторно, что существенно снижает стоимость процесса.
Другое преимущество иммобилизации заключается в том, что фермент становится более стабильным, вероятно, за счет ограничения его способности денатурировать при изменениях рН, температуры и растворителей. К примеру, иммобилизованная глюкозоизомераза стабильна при 65 °С в течение года, тогда как в растворе она денатурирует при 45 °С за несколько часов.
Иммобилизованный фермент можно использовать для непрерывного (открытого) производства, пропуская реагенты через фермент и собирая продукт на конечном этапе.
Методы иммобилизации ферментов
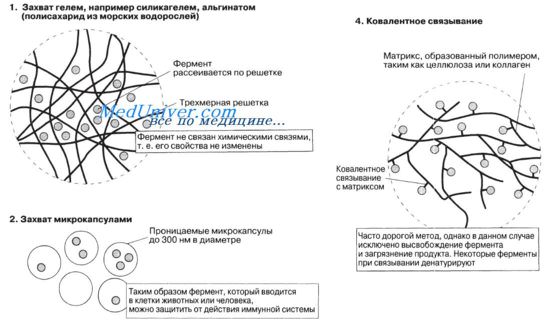
Существуют различные способы иммобилизации ферментов. Они включают либо механическое включение (захват) фермента, либо его присоединение к определенной структуре, или матрице. Преимуществом метода захвата является то, что фермент сохраняется в естественном состоянии. Однако крупным молекулам трудно добраться до фермента.
Захват шариками альгината легко продемонстрировать на лабораторных занятиях; он является наиболее распространенным промышленным методом. Раствор, содержащий фермент и альгинат натрия, по каплям вносят в раствор хлористого кальция. Как только капельки вступают в контакт с хлористым натрием, они немедленно начинают превращаться в гель; при этом образуются идеальные по форме шарики геля, содержащие внутри захваченный фермент. Для длительного использования гель можно стабилизировать полиакриламидом или приготовить его в виде пластин, если поместить его на тканевую основу.
Применение иммобилизованных ферментов
Лучшим примером процесса, в котором успешно используются иммобилизованные ферменты, является производство кукурузного сиропа с высоким содержанием фруктозы. Он широко используется в США и Японии в качестве подсластителя, например во фруктовых напитках, так как он значительно дешевле сахарозы. Сироп готовят из относительно дешевого источника углеводов — крахмала, получаемого из кочерыжек кукурузных початков. Процесс осуществляется с участием трех ферментов. Сначала получают крахмальную массу путем перемалывания (растирания) кукурузы, затем две амилазы превращают крахмал в глкжозный сироп. Обесцвеченный и сконцентрированный сироп добавляют в различные пищевые продукты и напитки. С помощью фермента глкжозоизомеразы можно превратить этот сироп в смесь, содержащую равные количества глюкозы и фруктозы. Для этого сироп пропускают через колонку, в которой содержится фермент, иммобилизованный путем адсорбции на целлюлозном ионообменнике. Активность фермента со временем постепенно снижается, поэтому обычно используют несколько колонок, работающих одновременно. Фруктоза слаще глюкозы, хотя обе содержат одинаковое число калорий на единицу массы. Это означает, что, используя кукурузный сироп с высоким содержанием фруктозы, можно получить такой же сладкий продукт как с глюкозой, но с меньшим количеством калорий. Ежегодно в США производится около 4 млн. тонн сиропа.
Первым иммобилизованным ферментом, примененным в промышленном масштабе, была аминоацилаза. Она была использована в Японии в 1969 г. для производства аминокислот, добавляемых в корм животных. На мировом рынке эта продукция пользуется большим спросом.
Каждая молекула аминокислоты может существовать в двух формах, одна из которых является зеркальным отображением другой, как правая и левая рука. Эти две формы называются оптическими изомерами и являются право- и левовра-щающими формами, или D- и L-формами (по направлению вращения ими плоскости поляризации света). Все существующие в природе аминокислоты являются L-аминокислотами. Гораздо легче получить аминокислоты путем химического синтеза, чем выделять их из клеток, однако синтезированные аминокислоты образуются в виде смеси равных количеств D- и L-изомеров. Проблема получения L- аминокислот решается с помощью ферментов, специфически катализирующих превращения только одной из форм. Основные стадии процесса представлены в виде диаграммы на рисунке.
Фермент иммобилизуют путем ионного связывания на колонке с носителем. После непрерывной автоматизированной работы в течение 30 дней при 50 °С активность фермента снижается до 40%; для восстановления активности добавляют свежий фермент. В результате благодаря иммобилизации экономится 40% фермента.
Другой пример использования иммобилизованных ферментов — производство полусинтетических пенициллинов из природных пенициллинов. Иммобилизованный фермент химически модифицирует одну из боковых групп молекулы пенициллина, что приводит к повышению антибиотической активности пенициллинов.
- Вернуться в оглавление раздела "Биология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Принципиально новые перспективы открылись перед прикладной энзимологией в результате создания нового типа биоорганических «катализаторов, так называемых иммобилизованных ферментов,т.е.ферментов,связанных с носителем.Нельсон и Гриффинц уже в 1916 г.показали,что инвертаза,если адсорбировать её на угле или алюмогеле,сохраняет каталитическую активность,однако целенаправленная разработка такого рода гетерогенных катализаторов на основе ферментов началась лишь в 50-х годах.
Содержание
Введение ……………………………………………………………….3
Понятие ферментов …………………………………………………. 4
Общая характеристика иммобилизованных ферментов…….………5
Классификация носителей для ферментов …………….……………6
Методы иммобилизации ферментов …………………………………9
Иммобилизация клеток ……………………………………………. 17
Применение иммобилизованных ферментов ………………………19
Применение иммобилизованных ферментов в пищевой промышленности ………………………………….…………………20
Заключение ……………………………………….…………………..21
Список используемых источников …………………………………23
Работа состоит из 1 файл
Копия Копия МОЙ РЕФЕРАТ.doc
Федеральное агентство по образованию
Волгоградский Государственный Технический Университет
Реферат по биотехнологии
студентка группы хт-444
Волгоград 2010
Общая характеристика иммобилизованных ферментов…….………5
Классификация носителей для ферментов …………….……………6
Методы иммобилизации ферментов …………………………………9
Иммобилизация клеток ……………………………………………. 17
Применение иммобилизованных ферментов ………………………19
Применение иммобилизованных ферментов в пищевой промышленности ………………………………….…………………20
Список используемых источников …………………………………23
Принципиально новые перспективы открылись перед прикладной энзимологией в результате создания нового типа биоорганических «катализаторов, так называемых иммобилизованных ферментов,т.е.ферментов, связанных с носителем.Нельсон и Гриффинц уже в 1916 г.показали,что инвертаза,если адсорбировать её на угле или алюмогеле,сохраняет каталитическую активность,однако целенаправленная разработка такого рода гетерогенных катализаторов на основе ферментов началась лишь в 50-х годах.
Во-первых, гетерогенный катализатор легко отделить от реакционной среды, что позволяет: 1) остановить реакцию; 2) использовать катализатор повторно; 3) получать продукт, не загрязненный ферментом. Последнее особенно важно в ряде пищевых или фармацевтических производств.
Во-вторых, гетерогенные катализаторы позволяют проводить ферментный процесс непрерывно (например, в проточных реакторах) и регулировать скорость катализируемой реакции (или выход продукта) скоростью потока.
В-третьих, иммобилизация или модификация позволяют целенаправленно изменять свойства фермента, в том числе его специфичность (особенно в отношении к макромолекулярным субстратам), зависимость активности от рН-среды и, что особенно важно, его стабильность по отношению к различного рода денатурирующим воздействиям среды.
Ферменты (от лат. fermentum - брожение, закваска), специфические белки, присутствующие во всех живых клетках и играющие роль биологических катализаторов. Через их посредство реализуется генетическая информация и осуществляются все процессы обмена веществ и энергии в живых организмах. Ферменты бывают простыми или сложными белками, в состав которых наряду с белковым компонентом (апоферментом) входит небелковая часть - кофермент.
Эффективность действия ферментов определяется значительным снижением энергии активации катализируемой реакции в результате образования промежуточных фермент-субстратных комплексов. Присоединение субстратов происходит в активных центрах, которые обладают сходством только с определенными субстратами, чем достигается высокая специфичность (избирательность) действия ферментов.
Одна из особенностей ферментов - способность к направленному и регулируемому действию. За счёт этого контролируется согласованность всех звеньев обмена веществ. Эта способность определяется пространственностью структурной молекулы ферментов. Она реализуется через изменение скорости действия ферментов и зависит от концентрации соответствующих субстратов и кофакторов, рH среды, температуры, а также от присутствия специфических активаторов и ингибиторов (например, адениловых нуклеотидов, карбонильных, сульфгидрильных соединений и др.).
Известно более 20000 различных ферментов, из которых многие выделены из живых клеток и получены в индивидуальном состоянии. Первый кристаллический фермент (уреаза) выделен американским биохимиком Д.Самнером в 1926 г. Для ряда ферментов изучена последовательность аминокислот и выяснено расположение полипептидных цепей в трёхмерном пространстве. В лабораторных условиях осуществлен искусственный химический синтез фермента рибонуклеазы. Ферменты используют для количественного определения и получения различных веществ, для модификации молекул нуклеиновых кислот методами генной инженерии, диагностики и лечения ряда заболеваний, а также в ряде технологических процессов, применяемых в лёгкой, пищевой и фармацевтической промышленностях.[2]
Общая характеристика иммобилизованных ферментов.
В современной биотехнологии одно из видных мест принадлежит ферментам. Ферменты и ферментные системы широко используются в различных отраслях промышленности, медицине, сельском хозяйстве, химическом анализе и т.д.
Ферменты - вещества белковой природы и поэтому неустойчивы при хранении, а также чувствительны к тепловым воздействиям. Кроме того, ферменты не могут быть использованы многократно из-за трудностей в отделении их от реагентов и продуктов реакции. Решить эти проблемы помогает создание иммобилизованных ферментов. Начало этому методу было положено в 1916 году, когда Дж.Нельсон и Е.Гриффин адсорбировали на угле инвертазу и показали, что она сохраняет в таком виде каталитическую активность. Сам термин "иммобилизованные ферменты узаконен в 1971 году, и означает любое ограничение свободы передвижения белковых молекул в пространстве.
Сущность иммобилизации ферментов — прикрепление их в активной форме к нерастворимой основе или заключение в полупроницаемую мембранную систему. Прикрепление фермента к носителю осуществляется адсорбционно, химической связью или путем механического включения фермента в органический или неорганический гель (в капсулу и т. п.). При этом допускается прикрепление фермента только за счет функциональных групп, не входящих в активный центр фермента и не участвующих в образовании фермент-субстратного комплекса. Носитель фермента или матрица может иметь вид зернистого материала, волокнистой структуры, пластинчатой поверхности, пленок или тканей, полых волокон, трубочек, капсул и т. д. Имеет значение размер частиц носителя. Важно иметь большую поверхность, поэтому рекомендуются небольшие частицы диаметром 0,1—0,2 мм. Носитель фермента может быть как природное вещество, так и синтетический полимер.
Ещё раз повторю,преимущества иммобилизованных ферментов перед предшественниками:
1. Гетерогенный катализатор легко отделим от реакционной среды, что дает возможность остановить реакцию в любой момент, использовать фермент повторно, а также получать чистый от фермента продукт.
2. Ферментативный процесс с использованием иммобилизованных ферментов можно проводить непрерывно, регулируя скорость катализируемой реакции и выход продукта.
3. Модификация фермента целенаправленно изменяет его свойства, такие как специфичность (особенно в отношении макромолекулярного субстрата), зависимость каталитической активности от рН, ионного состава и других параметров среды, стабильность к денатурирующим воздействиям.
4. Можно регулировать каталитическую активность иммобилизованных ферментов путем изменения свойств носителя действием физических факторов, таких как свет и звук. Иммобилизовать ферменты можно как путем связывания на нерастворимых носителях, так и путем внутримолекулярной или межмолекулярной сшивки белковых молекул низкомолекулярными бифункциональными соединениями, а также путем присоединения к растворимому полимеру. [3]
Классификация носителей для ферментов.
Для получения иммобилизованных ферментов используется ограниченное число как органических, так и неорганических носителей. К носителям предъявляются следующие требования (Дж.Порат, 1974):
высокая химическая и биологическая стойкость;
высокая химическая прочность;
достаточная проницаемость для фермента и субстратов, пористость, большая удельная поверхность;
возможность получения в виде удобных в технологическом отношении форм (гранул, мембран);
Классификация носителей схематично представлена на рисунке 1.
Рис. 1. Классификация носителей для иммобилизованных ферментов
Следует отметить, что органические носители (как низко-, так и высокомолекулярные) могут быть природного или синтетического происхождения. Природные полимерные органические носители делят в соответствии с их биохимической классификацией на 3 группы: полисахаридные, белковые и липидные.
Синтетические полимеры также можно разделить на группы в связи с химическим строением основной цепи макромолекул: полиметиленовые, полиамидные, полиэфирные.
Для иммобилизации ферментов наиболее широко используются природные полисахариды и синтетические носители полиметильного типа, остальные применяются значительно реже. Большое значение природных полимеров в качестве носителей для иммобилизации объясняется их доступностью и наличием реакционно-способных функциональных групп, легко вступающих в химические реакции. Характерной особенностью этой группы носителей также является их высокая гидрофильность. Недостаток природных полимеров - неустойчивость к воздействию микроорганизмов и довольно высокая стоимость.
Наиболее часто для иммобилизации используются такие полисахариды, как целлюлоза, декстран, агароза и их производные. Целлюлоза гидрофильна, имеет много гидроксильных групп, что позволяет модифицировать её, замещая эти группы. Для увеличения механической прочности целлюлозу гранулируют путем частичного гидролиза, в результате которого разрушаются аморфные участки. На их место для сохранения пористости между кристаллическими участками вводят химические сшивки. Гранулированную целлюлозу довольно легко превратить в различные ионообменные производные, такие как ДЭАЭ-целлюлоза, КМЦ и т.д.
Широко распространены носители на основе декстрана, выпускаемые под названием "сефадексы". При высушивании они легко сжимаются, в водном растворе сильно набухают. В этих носителях размер пор в геле регулируется степенью сшитости. К группе декстранов относят и крахмал. Химически модифицированный крахмал сшивается агентами, такими как формальдегид. Таким способом был получен губчатый крахмал, обладающий повышенной устойчивостью по отношению к ферментам, гидролизу. Водорастворимые препараты на основе декстрана часто применяются как носители лекарственных средств в медицине.
В основном, как видно, это относится к пищевой промышленности, где применяются главным образом малоочищенные комплексные ферментные препараты для гидролиза природных полимеров — белков, крахмала, пектинов.
В последние полтора-два десятилетия определились пути расширения областей применения ферментов. Они связаны с получением так называемых иммобилизованных ферментов, а также иммобилизованных клеток микроорганизмов [2]. Сочетание уникальных каталитических свойств ферментов с их водонерастворимостью в иммобилизованном виде послужило основой для создания ряда новых технологических процессов [4]. Эти процессы в настоящее время применяются главным образом в производстве пищевых продуктов.
К настоящему времени шесть процессов с использованием иммобилизованных ферментов или клеток нашли крупномасштабное применение в пищевой промышленности ряда развитых стран мира.
1. Получение глюкозо-фруктозных сиропов и далее фруктозы из глюкозы.
2. Получение оптически активных D-аминокислот из их рацемических смесей.
3. Синтез L-аспарагиновой кислоты из фумаровой кислоты.
4. Синтез L-яблочяой кислоты из фумаровой кислоты.
5. Получение диетического безлактозного молока.
6. Получение cахаров из молочной сыворотки.
Получение глюкозо-фруктозных спиртов
Научные основы процесса довольно просты. Фермент глюкозо-изомераза-катализирует превращение (изомеризацию) глюкозы во фруктозу в одну стадию, и реакция протекает до тех пор, пока в реакционной системе количества глюкозы и фруктозы не станут приблизительно равными. После этого реакция останавливается, и полученную смесь можно либо использовать в виде глкжозо-фруктозного сиропа, либо отделить фруктозу и оставшуюся глюкозу опять подвергнуть изомеризации. Этот процесс проводят непрерывно в реакционных колоннах высотой до 5 м, - которые предварительно заполняют иммобилизованным ферментом в виде гранул, полых нитей, кусочков геля (типа желатины) и т. д. В колонну непрерывным потоком подают раствор глюкозы (предварительно полученной при гидролизе кукурузного или картофельного крахмала), из колонны вытекает глюкобзо-фруктозный сироп.
Об эффективности такой технологии свидетельствуют следующие данные: на 1 кг иммобилизованного фермента за 100 дней работы получается 4 т фруктозы (в пересчете на сухой продукт) [4]. При этом время, за которое активность фермента уменьшается вдвое (так называемое время полуинактивации фермента) составляет от 20 до 50 дней. Иначе говоря, катализатор (иммобилизованный фермент) в колонне следует заменять только раз в 2 или даже 3 мес и процесс благодаря этому становится экономически выгодным, особенно по сравнению с использованием растворимой глюкозоизомеразы. Расчеты показывают, что в последнем случае затраты на фермент в 10 раз выше, и трудозатраты выше в 3 раза. В целом стоимость процесса с иммобиллизованным ферментом составляет лишь 61% от стоимости процесса с растворимым ферментом [4].
Современный завод по производству глюкозо-фруктозных сиропов с помощью иммобилизованного фермента, которых в мире имеется уже несколько десятков, производит до 400 т продукта в день в пересчете на сухое вещество: В целом мировое производство глюкозо-фруктозных сиропов в 1980 г. достигло 2,5 млн. т и, по оценкам, составит около 4 млн. т в 1985 г. и Свыше 5 млн. т в 1990 г. В США уже в 1998 г. потребление населением фруктозы составило 12% от потребления сахара и ожидается дальнейший рост вплоть до 30—40% к 2000 г. В Японии уже к 1985—1990 г,. около 30% потребляемого в стране сахара будет заменено на глюкозо-фруктозную смесь и чистую фруктозу [4].
9.2. Получение аминокислот
В качестве исходного вещества используются ацилированные L- и D-аминокислоты, полученные с помощью обычного химического синтеза, и их подвергают воздействию аминоацилазы. Фермент гидролизует только ацил-L-изомер, отщепляя от него объемную аыильную группу и тем самым резко увеличивая растворимость образующейся L-аминокислоты по сравнению с присутствующим в реакционной системе ацил-D-изомером. После этого вещества легко отделяются друг от друга с помощью известных физико-химических приемов, продуктом является чистая L-аминокислота.
Остающаяся ацил-D-аминокислота при нагревании рацемизуется, т. е. переходит опять в смесь ацилированных L- и D-аминокислот, и процесс повторяют сначала. Таким образом, в итоге единственным продуктом является L-аминокислота. Оказалось, что для аминоацилазы не имеет значения, какую аминокислоту ей гидролизовать, важно лишь строение ацильной части, к которой фермент имеет строгую специфичность. Благодаря этому одна и та же реакционная колонна с иммобилизованной аминоацилазой может быть использована для производства самых различных, L-аминокислот.
Иммобилизованный фермент легко готовить, так как он просто адсорбируется на специальной смоле, которую затем помещают в колонну объемом 1 м 3 . Время полуинактдвации иммобилизованного фермента в промышленных условиях составляет 65 дней, и, когда активность катализатора падает ниже нормы (раз в несколько месяцев), в колонну добавляют раствор свежего фермента, который опять адсорбируется на носителе. Устойчивость полимерного носителя для иммобилизации фермента столь высока, что он используется японской компанией более 8 лет в той же колонне без замены.
9.3. Получение L-аспарагиновой кислоты
Аспарагиновая кислота не принадлежит к числу незаменимых, но производится в мире многими тысячами тонн. Она находит широкое применение в пищевой промышленности для придания (в сочетании с другой аминокислотой—глицином) кондитерским изделиям и напиткам различных оттенков кислого или сладкого вкуса.
9.4. Получение L-яблочной кислоты
Яблочная кислота находит спрос на мировом рынке в качестве заменителя лимонной кислоты в продуктах питания и фармацевтических препаратах. Химическим путем (гидролизом ангидрида яблочной кислоты) производят только рацемическую смесь оптических изомеров яблочной кислоты, в то время как оптически активный L-изомер, который получают микробиологическим способом, пока слишком дорог для широкого промышленного производства.
В то же время L-яблочную кислоту можно получать ферментативным путем из той же фумаровой кислоты, из которой получают L-аспарагиновую кислоту (см. выше). Только в данном случае ферментом является фумараза, которая присоединяет по двойной связи фумаровой кислоты не аммиак, а воду. В остальном реакция происходит так же, и в качестве ферментного катализатора используют клетки, содержащие фумаразу и иммобилизованные в гель. В обычных (интактных) клетках время полуинактивации фумаразы составляет 6 дней, в иммобилизованных в полиакриламид-ный гель — 55 дней.
9.5. Получение без лактозного молока
Лактоза, или молочный сахар, содержится в достаточно больших количествах в молоке и молочной сыворотке. Этот сахар характеризуется малой сладостью и низкой, растворимостью, и именно из-за его присутствия происходит кристаллизация мороженого и других молочных изделий и продуктов, которая иногда случается и приводит к малоприятным вкусовым ощущениям.
Молекулы лактозы состоят из глюкозы и галактозы и распадаются на них при гидролизе под действием лактазы или b-галактозидазы. Молоко после такой обработки приобретает новые диетические качества, поскольку определенная часть населения не может употреблять молоко именно из-за наличия в нем лактозы. Это качество организма получило название лактазной недостаточности, и в целом по направлению с севера нашей планеты на юг доля людей, испытывающих лактазную недостаточность заметно возрастает. В Африке, например, целые племена и этнические группы не могут пить молоко домашних животных из-за сильных аллергических откликов или неприятных физиологических ощущений. В то же время они нормально усваивают молоко, не содержащее лактозы или предварительно обработанное иммобилизованной лактазой.
9.6. Получение сахаров из молочной сыворотки
Молочная сыворотка содержит в своем составе большое количество лактозы—около 5% в жидкой и 75% в высушенной сыворотке. Ферментативный гидролиз лактозы в этом случае открывает новые возможности получения сахаристых веществ и.з нетрадиционного сырья, вносит определенный вклад в решение кормовой проблемы и в проблему охраны окружающей среды, поскольку сыворотка большей частью не утилизируется.
Первый промышленный процесс гядролиза лактозы в молочной сыворотке с помощью иммобилизованной лактазы был реализован в 1980 г. совместно английской, французской и американской организациями одновременно в Англии и Франции.
Перед введением в колонный реактор с иммобилизованным ферментом сыворотку пастеризуют, подвергают ультрафильтрации и пропускают через ионообменник, таким образом ее деминерализуя. Мощность установки составляет около 1000 л/ч при степени конверсии лактозы 80%. Установка полностью автоматизирована. Получаемые при этом сахара (глюкоза и галаястоза) по сладости в полтора раза превышают сладость сахара в расчете на одинаковые экономические затраты.
1. Иммобилизованные ферменты Под ред. И. В. Березина, В. К. Антонова, К. Мартинека. М.: Изд-во МГУ, 1996. Т. 1. 296 с.; Т. 2. 358 с.
2. Березин И. В., Варфоломеев С. Д. Биокинетика. М.: Наука, 1979. 312 с.
3. Березин И. В., Варфоломеев С. Д., Казанская Н. Ф., Никольская И. И. Светочувствительные каталитические системы.—Усп. науч. фотографии, 1988, 19, с. 255-262.
4. Березин И. В. и др. Кинетические особенности катализа иммобилизованными ферментами.—Усп. химии, 1985.
5. Березин И. В. и др. Механохимия иммобилизованных ферментов.— Журн. физ. химии, 1975, 49, с. 2519—'2528.
6. Введение в прикладную энзимологию — иммобилизованные - ферменты/Под ред. И. В. Березина, К. Мартинека. М.: Изд-во МГУ, 1982. 383 с.
7. Березин И. В., Мартинек К. Искусственные ферментативные светочувствительные системы.—Усп. химии, 1989.
8. Химическая энзимология/Под ред. И. В. Березина, К. Мартинека. М.: Изд-во МГУ, 1983. 285 с.
9. Березин И. В., Мартинек К; Чазов Е. И. Ферментативные детекторы слабых сигналов.—Природа, 1980, № 11.
10. Варфоломеев С. Д. Конверсия энергии биокаталитическими системами. М.: Изд-во МГУ, 1981.256с.
11. Кулис Ю. Ю. Аналитические системы на основе иммобилизованных ферментов. Вильнюс: Мокслас, 1981. 200 с.
12. Марголин А. Л., Изумрудов В. А., Швядас В. Ю. и др. Обратимо растворимая пенициллинамидаза, иммобилизованная в полиэлектролитных комплексах—Докл. АН СССР, 1990.
13. Мартинек К„ Березин И. В. Стабилизация ферментов—ключевой фактор при внедрении биокатализа в практику.—Усп. химии, 1980, 49, с. 737—770.
14. Мартинек К; Левашов А. В., Клячко Н. Л., Березин И. В. Катализ водорастворимыми ферментами в органических растворителях.—Докл. АН СССР, 1977, 236, с. 920—923.
15. Мартинек К; Семенов А. Н. Катализ ферментами в органическом синтезе— Усп. химии, 1981, 50, с. 1376—1406.
16. Можаев В. В. Иммобилизация ферментов как подход к исследованию фундаментальных проблем биохимии.—Усп. биологической химии, 1983, 24.
17. Стрельцова 3. А., Швядас В. К; Максименко А. В. Влияние полиэлектролитов на свойства пенициллинамидазы,— Биоорган, химия, 1975.
Ферменты - вещества белковой природы и поэтому неустойчивы при хранении, а также чувствительны к тепловым воздействиям. Кроме того, ферменты не могут быть использованы многократно из-за трудностей в отделении их от реагентов и продуктов реакции. Решить эти проблемы помогает создание иммобилизованных ферментов. Начало этому методу было положено в 1916 году, когда Дж.Нельсон и Е.Гриффин адсорбировали на угле инвертазу и показали, что она сохраняет в таком виде каталитическую активность. Сам термин "иммобилизованные ферменты узаконен в 1971 году, и означает любое ограничение свободы передвижения белковых молекул в пространстве.
Оглавление
1. Общая характеристика иммобилизованных ферментов…стр.3;
2. Классификация носителей для ферментов…стр.4;
3. Методы иммобилизации ферментов…стр.6;
4. Применение иммобилизованных ферментов…стр.10;
5. Список литературы…стр.11.
Файлы: 1 файл
ферменты.doc
При иммобилизации ферментов с использование систем двухфазного типа ограничение свободы перемещения фермента в объеме системы достигается благодаря его способности растворяться только в одной из фаз. Субстрат и продукт ферментативного превращения распределяются между обеими фазами в соответствии с их растворимостями в этих фазах. Природа фаз подбирается таким образом, что продукт накапливается в той из них, где фермент отсутствует. После завершения реакции эту фазу отделяют и извлекают из нее продукт, а фазу, содержащую фермент, вновь используют для проведения очередного процесса. Одним из важнейших преимуществ систем двухфазного типа является то, что они позволяют осуществлять ферментативные превращения макромолекулярных субстратов, которые невозможны при применении жестких носителей с ограниченным размером пор.
Главным отличительным признаком химических методов иммобилизации является то, что путем химического взаимодействия на структуру фермента в его молекуле создаются новые ковалентные связи, в частности между белком и носителем. Препараты иммобилизованных ферментов, полученные с применением химических методов, обладают по крайней мере двумя важными достоинствами. Во-первых, ковалентная связь фермента с носителем обеспечивает высокую прочность образующегося конъюгата. При широком варьировании таких условий, как рН и температура, фермент не десорбируется с носителя и не загрязняет целевых продуктов катализируемой им реакции. Это особенно важно при реализации процессов медицинского и пищевого назначения, а также для обеспечения устойчивых, воспроизводимых результатов в аналитических системах. Во-вторых, химическая модификация ферментов способна приводить к существенным изменениям их свойств, таких как субстратная специфичность, каталитическая активность и стабильность. Химическая иммобилизация ферментов является искусством, уровень которого определяется, в первую очередь, умением экспериментатора. Основная задача экспериментатора заключается в формировании новых ковалентных связей в молекуле фермента при использовании его функциональных групп, несущественных для проявления его каталитической активности. При химической модификации фермента его активный центр желательно защищать. При сопоставлении различных приемов иммобилизации химические методы для крупномасштабных биотехнологических процессов кажутся малопривлекательными из-за сложности и дороговизны. В промышленных процессах обычно используются те или иные методы физической иммобилизации.
4.Применение иммобилизованных ферментов
Особенно ощутимый вклад иммобилизованные ферменты внесли в тонкий органический синтез, в анализ, в медицину, в процессы конверсии энергии, в пищевую и фармацевтическую промышленности.
Для синтетической органической химии важно то, что в двухфазных реакционных средах фермент сохраняет каталитическую активность даже при исключительно малом содержании воды, поэтому равновесие катализируемой реакции (выход продукта) экспериментатор может регулировать в широких пределах, подбирая нужный органический растворитель. Иммобилизованные ферменты дали толчок к созданию принципиально новых методов "безреагентного" непрерывного анализа многокомпонентных систем органических (в ряде случаев и неорганических) соединений.
В будущем важную роль в контроле окружающей среды и в клинической диагностике должны сыграть такие методы, как биолюминесцентный анализ и иммуноферментный анализ.
В медицине иммобилизованные ферменты открыли путь к созданию лекарственных препаратов пролонгированного действия со сниженной токсичностью и аллергенностью. Иммобилизационные подходы способствуют решению проблемы направленного транспорта лекарств в организме.
Проблемы биоконверсии массы и энергии в настоящее время пытаются решить микробиологическим путем. Тем не менее иммобилизованные ферменты вносят ощутимый вклад в осуществление фотолиза воды и в биоэлектрокатализ.
Заслуживает внимание и использование иммобилизованных ферментов в процессах переработки лигноцеллюлозного сырья.
Иммобилизованные ферменты могут использоваться и как усилители слабых сигналов. На активный центр иммобилизованного фермента можно подействовать через носитель, подвергая последний ультразвуковой обработке, механическим нагрузкам или фотохимическим превращениям. Это позволяет регулировать каталитическую активность системы фермент - носитель под действием механических, ультразвуковых и световых сигналов. На этой основе были созданы механо- и звукочувствительные датчики и открыт путь к бессеребряной фотографии.
Промышленные процессы с применением иммобилизованных ферментов внедрены прежде всего в пищевую и фармацевтическую промышленность. В пищевой промышленности с участием иммобилизованных ферментов идут процессы получения глюкозо-фруктовых сиропов, глюкозы, яблочной и аспарагиновой кислоты, оптически активных L- аминокислот, диетического безлактозного молока, сахаров из молочной сыворотки и др.
В медицине иммобилизованные ферменты используются также как лекарственные препараты, особенно в тех случаях, когда необходимо локальное воздействие. Кроме того, биокатализаторы широко используются в различных аппаратах для перфузионной очистки различных биологических жидкостей. Возможности и перспективы использования в медицине ферментов в иммобилизованном состоянии гораздо шире, чем достигнутые на сегодняшний день, именно на этом пути медицину ждет создание новых высокоэффективных методов лечения.
2. Тривен М. Иммобилизованные ферменты. М.: Мир, 1983. 213 с. 27.
3. Скрябин Г.К., Кощеенко К.А. Иммобилизованные клетки микроорганизмов // Биотехнология. М.: Наука, 1984.
4. Мартинек К. Иммобилизованные ферменты // Биотехнология. М.: Наука, 1984
5. Клесов А.А. Применение иммобилизованных ферментов в пищевой промышленности//Биотехнология. М.: Наука, 1984.
6. Иммобилизованные клетки и ферменты. Методы / Под ред. Дж. Вудворта. М.: Мир, 1988. 215 с.
7. Березин И.В., Клячко Н.Л., Левашев А.В. и др. Иммобилизованные ферменты. М.: Высшая школа, 1987. 160 с.
Читайте также:

