Химия и цвет реферат
Обновлено: 05.07.2024
Реферат на тему: "Химия цвета" Выполнила: Кекало Екатерина Минск, 2004г Содержание: Введение Строение молекул и цвет Спектры поглощения и цвет неорганических веществ Особенности твердого состояния неорганических красителей Цвет металлов Атомы те же – окраска разная Молекулы бесцветны, а вещество окрашено Цвет полярных молекул Связь цвета вещества с положением в периодической системе Разноцветные ионы одного металла
Среда воздействует на цвет Основы структурной теории цветности органических молекул Колориметрия (наука о методах измерения и количественного выражения цвета) Список литературы Введение. Знаменитые строки, принадлежащие перу великого русского поэта Сергея Есенина: Словно я весенней гулкой ранью Проскакал на розовом коне… долгое время казались лишь великолепным поэтическим образом, не имеющим никакого реального
основания. Всем известно, что розовых лошадей в природе не бывает. Однако на самом деле это факт, который не ускользнул от точного взгляда поэта. На рассвете, когда не само солнце, а лишь его лучи появляются над землей, "алый свет зари" окрашивает белые цвета в нежные розовые тона. Отражать от белой поверхности, "красные" лучи, преобладающие и потоке света, вызывают ощущение розового или красноватого цвета. Такова
одна из особенностей восприятия нами красочного мира. Значит, цвет зависит не только от того, как окрашено вещество, но и от того, как оно освещено. Ведь цвет у вещества мы различаем лишь в том случае, когда на него падает луч света. В темноте все кажется черным. Следовательно, чтобы разобраться в природе цвета, надо помнить свойства световых лучей. Обстоятельства совсем другого характера убеждают нас в том, что выражение
"голубая кровь" может иметь не иносказательный, а самый прямой смысл. Кровь рыб, выловленных в море, ничем не отличается по цвету от крови других крупных живых существ. Но в глубинах океана обитают существа, в теле которых действительно кровь голубого цвета. Одними из таких представителей являются голотурии. В пигменте, обеспечивающем цвет крови, вместо железа содержится ванадий. Именно его соединения придают голубую
Строение молекул и цвет. Особенности твердого состояния неорганических красителей. Цвет металлов. Молекулы бесцветны, а вещество окрашено. Цвет полярных молекул. Среда воздействует на цвет. Колориметрия.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 22.08.2007 |
| Размер файла | 1,2 M |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Известно, что кристаллический иод практически не-растворим в воде. В 100-процентной H2SO4 образуется розовый раствор, а в 30-процентвом олеуме 0,5 М раствор иода имеет коричневый цвет, такой же, как и в этиловом спирте. Растворители меняют состояние молекул и ионов. В среде концентрированной серной кислоты существуют комплексы и ионы; розовый -- I3 + , синий I + , коричне-вый I5 + .
Основы структурной теории цветности органических молекул
Попытки связать цвет органического вещества с его структурой предпринимаются исключительно давно. При-мерно сто лет назад была выдвинута порвал теория, соединившая окраску с наличием в молекуле соединений опре-деленных групп атомов.
Особое значение для структуры окрашенного соедине-ния имеет цепочка атомов С, связанных друг с другом чередующимися двойными и одинарными связями:
В таких цепочках проявляется эффект сопряжения. Происходит как бы выравнивание двойных и одинарных связей:
Перекрывание орбиталей, на которых находятся р-электроны, таково, что появляется возможность образования как бы дополнительной связи и между теми углеродными атомами, которые соединены одинарной связью; все атомы охватываются едиными молекулярными орбиталями. Элек-трон получает возможность передвигаться по всей моле-куле в целом.
С подобным эффектом сопряжения мы встречаемся при изучении свойств бензола, у которого невозможно разли-чить отдельные двойные и одинарные связи; да их в молекуле СбНб и нет -- все связи равноценные (рис. 12).
Однако образование таких делокализованных л-связей накладывает ограничение на строение молекулы: чтобы электронные орбитали могли перекрываться, атомы в мо-лекуле должны лежать хотя бы примерно в одной плос-кости.
Рис. 12. Электронное строение молекулы бензола: а -- у-связи; б -- р--связи.
Опытным путем еще до того, как были открыты зако-номерности электронного строения и его изменение при взаимодействии молекулы вещества с лучом света, удалось подметить наиболее важное по влиянии структурных фрагментов молоекул па цвет соединений. Так оказалось, что удлинение цепи сопряженных двойных связей приво-дит к переходу от бесцветного или слабоокрашенного к темным цветам:
Если вместо простых ароматических ядер (типа бен-зольных) появляются конденсированные (типа нафтали-на), то это вызывает углубление цвета,
Группы С = О, связанные друг с другом, вызывают более глубокий цвет соединения:
Более прочная и более тесная связь между атомами угле-рода, относящимися к отдельным частям молекулы, при-водит к более интенсивной и более глубокой окраске:
Вещества, содержащие хромофоры, называются хромо-генами. Сами по себе эти вещества еще не являются кра-сителями, потому что не отличаются ни яркостью, ни чистотой цвета. Объясняется это тем, что хотя и происходит в таких молекулах перераспределение электронов и их энергии, но не настолько, чтобы избирательно и в значи-тельном количестве поглощать кванты света только одной определенной длины волны. Такая возможность появля-ется лишь после того, как в молекулу соединения будут введены группы, отличающиеся либо резко выраженным сродством к электрону, либо способные свои электроны в значительной мере отдавать в общее пользование. Одним словом, такие группы, которые резко меняют состояние электронов в хромофорных группировках.
Только после введения ауксохромов цвет соединения становится чистым (начинается избирательное поглощение лучей определенной длины волны) и достаточно интенсив-ным (падающий свет легко сдвигает электроны в молеку-ле). Наибольший эффект достигается, когда в молекуле соединения присутствуют одновременно и электронодонорные и электронофильные группы атомов. Одни из них отдают, а другие соответственно притягивают электроны общей электронной системы молекулы.
Итак, из структурных особенностей органических мо-лекул для появления цвета у вещества имеют значение следующие: 1) цепочка из чередующихся одинарных и двойных связей (при этом в такой цепочке могут участво-вать и двойные связи не только между углеродными ато-мами) ; 2) наличие групп или атомов, сильно притягиваю-щих или, наоборот, легко отдающих свои электроны в об-щую электронную систему молекул; 3) атомы в молекуле должны лежать в одной плоскости (или весьма близко к этому состоянию).
Все это подчинено одной цели -- легкости воздействия квантов видимого света на электронную систему молекул и перевод ее в возбужденное состояние.
Колориметрия
Цветометрия (колориметрия), наука о методах измерения и количественного выражения цвета. Последний рассматривают как характеристику спектрального состава света (в т. ч. отраженного и пропускаемого несамосветящимися телами) с учетом зрительного восприятия. В соответствии с трехкомпонентной теорией зрения любой цвет можно представить как сумму трех составляющих, так называемых основных цветов. Выбор этих цветов определяет цветовую координатную систему, в которой любой цвет может быть изображен точкой (или цветовым вектором, направленным из начала координат в эту точку) с тремя координатами цвета - тремя числами. Последние соответствуют количествам основных цветов в данном цвете при стандартных условиях его наблюдения.
Фундаментальной характеристикой цвета, его качеством, является цветность, которая не зависит от абсолютной величины цветового вектора, а определяется его направлением в цветовой координатной системе. Поэтому цветность удобно характеризовать положением точки пересечения этого вектора с цветовой плоскостью, которая проходит через три точки на осях основных цветов с координатами цвета, равными 1.
Поскольку, согласно закону Г. Грассмана (1853), при данных условиях основные цвета производят в смеси одинаковый визуальный эффект независимо от их спектрального состава; по кривым сложения цветов можно определить координаты цвета сложного излучения. Для этого сначала цвет последнего представляют в виде суммы чистых спектральных цветов, а затем определяют количества основных цветов, требуемых для получения смеси, зрительно неотличимой от исследуемого цвета.
Фактически основой всех цветовых координатных систем является Международная колориметрическая система RGB (от англ. Red, Green, Blue - красный, зеленый, синий), в которой основными цветами являются красный (соответствующий из-лучению с длиной волны Х= 700 нм), зеленый (Х = 546,1 нм) и синий (Х = 435,8 нм). Измеряемый цвет С в этой системе может быть представлен уравнением: C = R + G + B, где R, G, и В - координаты цвета С. Однако большинство спектрально чис-тых цветов невозможно представить в виде смеси трех упо-мянутых основных цветов. В этих случаях некоторое количество одного (или двух) из основных цветов добавляют к спектраль-ному цвету и полученную смесь уравнивают со смесью двух оставшихся цветов (или с одним оставшимся цветом). В приведенном выше уравнении это учитывается переносом соответствующего члена из левой части в правую. Например, если был добавлен красный цвет, то C+R = G + B, или C= - R+G + B. Наличие отрицательных координат для некоторых цветов - существенный недостаток системы RGB.
Наиболее распространена международная система XYZ, в которой основные цвета X, Y и Z - нереальные цвета, выбранные так, что координаты цвета не принимают отрицательных значений, причем координата У равна яркости наблюдаемого окрашен-ного объекта.
Недостаток цветовой координатной системы XYZ - неравноконтрастность: в зависимости от области цветового пространства на одинаковые по величине участки приходится разное число (от 1 до 20) цветовых порогов, т.е. границ различения цветов. Это существенно затрудняет согласование измерений с визуальной оценкой.
Поэтому была предложена (1976) цветовая координатная система Lab, где L - яркость, или светлота, которая изменяется от 0 (абсолютно черное тело) до 100 (белое тело), координаты -а, +а, -b, +b определяют зеленый, красный, синий и желтый цвета соответственно.
Цветность представляет собой проекцию данного цвета на плоскость ab. Система Lab более однородна и дает лучшую корреляцию с визуальными определениями, т.к. ее параметры - L, цветность и координаты а и b - близки привычным субъективным характеристикам цвета: светлоте, насыщенности и цветовому тону соответственно.
Восприятие цвета существенно зависит от условий наблюдений. Поэтому в любой цветовой координатной системе при изменении условий изменяются координаты цвета. Это явление называется метамеризмом. Различают 4 основных вида метамеризма, связанные с изменением: 1) источника освещения; 2) наблюдателя; 3) размера измеряемого поля; 4) геометрии наблюдения (напр.. под каким углом смотрят на объект; вида освещения - диффузное или направленное).
Измерения цвета лежат в основе инструментальных методов оценки качества окраски различных материалов красителями, расчета смесевых рецептур крашения, оптимизации и автоматизации химико-технологических процессов крашения и производства красителей.
Список литературы.
Функция "чтения" служит для ознакомления с работой. Разметка, таблицы и картинки документа могут отображаться неверно или не в полном объёме!
Реферат на тему: "Химия цвета" Выполнила: Кекало Екатерина Минск, 2004г
Содержание: Введение
Строение молекул и цвет
Спектры поглощения и цвет неорганических веществ Особенности твердого состояния неорганических красителей Цвет металлов Атомы те же – окраска разная Молекулы бесцветны, а вещество окрашено Цвет полярных молекул Связь цвета вещества с положением в периодической системе Разноцветные ионы одного металла Среда воздействует на цвет Основы структурной теории цветности органических молекул
Колориметрия (наука о методах измерения и количественного выражения цвета)
Список литературы
Введение. Знаменитые строки, принадлежащие перу великого русского поэта Сергея Есенина: Словно я весенней гулкой ранью
Проскакал на розовом коне… долгое время казались лишь великолепным поэтическим образом, не имеющим никакого реального основания. Всем известно, что розовых лошадей в природе не бывает. Однако на самом деле это факт, который не ускользнул от точного взгляда поэта. На рассвете, когда не само солнце, а лишь его лучи появляются над землей, "алый свет зари" окрашивает белые цвета в нежные розовые тона. Отражать от белой поверхности, "красные" лучи, преобладающие и потоке света, вызывают ощущение розового или красноватого цвета. Такова одна из особенностей восприятия нами красочного мира.
Значит, цвет зависит не только от того, как окрашено вещество, но и от того, как оно освещено. Ведь цвет у вещества мы различаем лишь в том случае, когда на него падает луч света. В темноте все кажется черным. Следовательно, чтобы разобраться в природе цвета, надо помнить свойства световых лучей.
Обстоятельства совсем другого характера убеждают нас в том, что выражение "голубая кровь" может иметь не иносказательный, а самый прямой смысл. Кровь рыб, выловленных в море, ничем не отличается по цвету от крови других крупных живых существ. Но в глубинах океана обитают существа, в теле которых действительно кровь голубого цвета. Одними из таких представителей являются голотурии. В пигменте, обеспечивающем цвет крови, вместо железа содержится ванадий. Именно его соединения придают голубую окраску жидкости, содержащейся в глоуториях. В тех глубинах, где они обитают, кислорода в воде очень мало и им приходится приспосабливаться к такимусловиям.Возникают в организмах соединения, которые "работают" совершенно иначе, чем у обитателей воздушного окружения. Структура образовавшихся соединений определяет и цвет.
Садоводов и цветоводов трудно удивить необычностью окрасок цветов и листьев. Черные тюльпаны, голубые розы и самые разнообразные оттенки сирени можно видеть на всех выставках цветов. И все же листья имеют зеленый цвет (так как в них образуется хлорофилл), однако не у всех растений. Вам могут перечислить целый ряд таких, у которых листья имеют другой цвет: лиловый, фиолетовый, присный или смесь оттенков незеленого цвета. Процессы, происходящие в листьях этих растений, приводят к образованию не только зеленого хлорофилла, но и химических структур, преобладающих в них и придающих необычный цвет, казалось бы, обычным листьям. Как тут не вспомнить другие есенинские строки: Ягненочек
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
XVI городская научно-практическая конференция школьников
Автор работы :
Глущенко Ирина Андреевна
Место выполнения работы:
г. Невинномысск, ул. Калинина д.159-а
Руководитель:
Дунаева Ирина Ивановна,
зам. директора по УВР,
учитель химии высшей категории
МБОУ СОШ № 20 города Невинномысска
Невинномысск, 2018 год
Мы живем в удивительном и прекрасном цветном мире. Любуемся прекрасным голубым небом, оранжевым солнцем, яркой зеленью весны, разноцветьем лета, ослепительной белизной зимы. Как радуются дети и взрослые, когда после теплого летнего дождика на небе появляется радуга. Разноцветная радуга восхищает и изумляет. Никто и никогда не задумывался, откуда берется цвет? Почему небо голубое? Трава зеленая, солнце рыжее? Я всегда любила и люблю цвет. Люблю рисовать и на протяжении нескольких лет училась в художественной школе. Рисую разными красками. Больше люблю масляные краски: они яркие и насыщенные. Так же мне нравится акварель за её восхитительную нежность и прозрачность.
Цвет, как и любое сложное явление природы, имеет особенности, которые относятся к различным областям естествознания. Свойства светового луча, его природа, спектр, энергия, которую несет луч,— это физическое явление. Окраска вещества и причины ее возникновения – это химия; природа восприятия цвета человеком – биология; воздействие цвета на человека – экология. Таким образом, мы попытаемся ответить на вопросы, связанные, прежде всего с химией. В виду того, что в школьной лаборатории пока недостаточно реактивов, наши экспериментальные иллюстрации получились скромные, но они подтверждают все приведенные теоретической выкладки.
Литературный обзор.
История возникновения красок.
1.2 Современные краски.
В настоящее время почти все краски делают в лабораториях и на заводах из химических элементов. Поэтому некоторые краски даже ядовиты, например, красная киноварь из ртути. Фиолетовые краски могут делать из персиковых косточек или из виноградных шкурок. Сухой краситель не может держаться на холсте, поэтому нужно связующее вещество, которое склеивает, связывает частички сухого красителя в единую цветную краску–массу. Художники брали то, что было под рукой: масло, мед, яйцо, клей, воск. Чем ближе друг к другу частички пигмента, тем гуще краска. Густоту краски можно определить, если взглянуть, как растекается капля меда, яйца, на долго сохнущую каплю масла, которая даже не соединяется с водой, а при высыхании оставляет жирный след.
Разные связующие вещества дают разные краски с разными названиями. Для приготовления красок используют высыхающие масла: маковое, ореховое (из ядер грецких орехов), конопляное, оливковое, льняное. Из них лучшие свойства краскам обеспечивает льняное, так как оно содержит наибольшее количество триглицеридов ненасыщенных карбоновых кислот. При контакте с воздухом все перечисленные масла высыхают, ненасыщенные карбоновые кислоты окисляются и полимеризуются. В результате образуется прочная прозрачная пленка. Линоксин-пленка, образуемая льняным маслом, отличается наибольшей прочностью и эластичностью. Синтетические красящие вещества отличаются максимальной устойчивостью к влажности, атмосферным осадкам, свету и газам. Они характеризуются яркостью оттенков. Благодаря таким качествам искусственные пигменты давно заняли лидирующее место среди всех красителей. Красители синтетического происхождения делятся на неорганические или минеральные. Неорганические пигменты производят путем сложных химических реакций. Синтетические неорганические пигменты характеризуются постоянством химической структуры, ярким и чистым цветом. Стоимость изготовления таких компонентов стоит довольно дорого по сравнению с натуральными красящими веществами. Применяются неорганическая синтетика в строительной отрасли для создания неводных лакокрасочных составов.
1.3 Разновидности красок для живописи
Акриловые краски – воднодисперсные краски на основе полиакрилатов (преимущественно метил-, этил- и бутилакрилатов), а также их сополимеров в качестве пленкообразователей. Эти краски довольно быстро сохнут, образуя стойкое покрытие, которое не смывается водой и не выгорает на солнце.
Гуашь . Художественная гуашь – это растертые пигменты, с добавлением дистиллированной воды, белил и гуммиарабика. Эта краска обладает прекрасной кроющей способностью, матовостью и бархатистостью. В составе гуашевых красок в качестве добавок в разных количествах применяются белила, что придает им белесоватый вид после высыхания.
Масляные краски . Масляные краски производятся из пигментов, перетертых в высыхающем масле. По сравнению с другими материалами для живописи масляными красками можно работать существенно дольше – до тех пор,
пока они сохраняют влажность. В масляной технике нанесенная влажная краска не меняет свой цвет после высыхания.
Темперные краски . Темпера (итал. tempera , от латинского temperare – смешивать краски) – водоразбавляемые краски, приготовляемые на основе сухих порошковых пигментов. Связующим веществом темперных красок служат эмульсии – натуральные (разбавленный водой желток куриного яйца или цельное яйцо) или искусственные (высыхающие масла в водном растворе клея, полимеры). По своим свойствам и составу темпера занимает промежуточное положение между акварельными и масляными красками. Темперные краски можно разбавлять водой и писать на бумаге, картоне, а также, как маслом, по загрунтованному холсту.
Акварель . Связующим веществом для акварельных красок служат легко растворимые водой прозрачные растительные клеи гуммиарабик (вязкая жидкость, затвердевающая на воздухе) и декстрин (полисахарид, получаемый термической обработкой картофельного или кукурузного крахмала). В качестве пластификатора (вещество, которое вводят в состав полимерных материалов для повышения эластичности и пластичности) в них добавляют глицерин и инвертированный сахар, удерживающие влагу. Без них краски
будут легко пересыхать и становиться хрупкими. Другая добавка к акварельным краскам, служащая поверхностно-активным веществом (снижение поверхностного натяжения) – бычья желчь. Она препятствует скатыванию красок в капли, облегчая рисование. Для защиты от плесени вводится антисептик – фенол. Акварель (фр. аquarelle – водянистая) – живописная техника, использующая специальные акварельные краски. При растворении их в воде образуется прозрачная взвесь тонкоизмельченного пигмента, позволяющая создавать эффект легкости, воздушности и тонких цветовых переходов. Акварельные краски наносятся, как правило, на бумагу, которую часто предварительно смачивают водой для достижения особой размытой формы мазка. Акварельная техника стала развиваться в Китае после изобретения бумаги во II в. н.э. Предшественницей акварельной техники в Европе была роспись по сырой штукатурке (фреска), позволявшая получать сходные эффекты. В Европе акварельная живопись вошла в употребление позже других родов живописи. Из первостепенных художников ренессанса значительный след в акварели оставили А.Дюрер, затем акварели отдали дань А. ван Дейк, К.Лоррен и Д.Кастильоне. Популярность акварели возросла и в связи с распространением во второй половине XVIII в. моды на портретную миниатюру – жанр, который с успехом начали осваивать многочисленные художники-любители. Основные качества акварели – прозрачность, мягкость, чистота и яркость цвета. Краска должна хорошо браться влажной кисточкой и легко размываться. Красочный слой должен легко смываться водой с поверхности бумаги или грунта. Акварельная краска, разжиженная водой, должна ровно ложиться на бумагу, не образовывать пятен и точек. При действии прямых солнечных лучей краска должна быть светостойкой и не изменять цвета. После высыхания давать прочный, не трескающийся слой. Не проникать на обратную сторону бумаги. Главные составные части акварельной краски – краситель и вода, но есть и другие обязательные компоненты. Связующими веществами могут служить гуммиарабик, леденцовый сахар, желатин, рыбий клей и т.д. Выбор связующих веществ можно варьировать широко, но высшего качества акварельные краски получаются на чистом гуммиарабике в смеси с сахаром или медом. Обыкновенно берут 2 весовые части гуммиарабика и 1 весовую часть сахара.
1.4 Как приготовить краски
Акварельные краски выпускаются в фарфоровых или пластиковых чашечках и тюбиках. Производство этих видов красок не имеет принципиального различия и в основном проходит через следующие стадии:
1) смешивание связующего с пигментом;
2) перетир смеси;
3) подсушка до вязкой консистенции;
4) наполнение краской чашечек или тюбиков;
Для смешивания пигментов со связующим веществом применяются обычно механические смесители с опрокидывающимся кузовом. Для небольших количеств чаще всего замесы приготовляются вручную в металлических эмалированных бачках при помощи деревянных лопаток. В смеситель загружается связующее вещество и вводится небольшими порциями пигмент в сухом виде или в виде водной пасты. Перетир акварельных красок производится на трехвальцовых краскотерочных машинах. Из-за чувствительности некоторых красок к железу рекомендуется применять вальцы из гранита или порфира, а стальной съемочный нож заменять деревянным. При перетире на краскотерочной машине пигмент тщательно смешивается со связующим веществом в однородную красочную пасту. Качество и количество перетиров зависит от смачиваемости пигментов, вязкости связующего вещества, степени измельчения и твердости пигментов, скорости вращения валов и величины зажатия их. В производстве акварельных паст пользуются обыкновенно разбавленными растворами связующих веществ, т.к. при употреблении густых растворов при перетире не достигается получения однородной красочной пасты. Перетертая краска поступает на подсушку с целью удаления излишней влаги и получения густой пасты для фасовки в чашечки или тубы. Подсушка пасты ведется в специальных сушильных камерах или на гранитных плитах при температуре 35–40 °С. После удаления части воды сгустившаяся паста раскатывается в ленты толщиной в 1 см, разрезается на отдельные кусочки размером по площади кюветки и укладывается в нее. Сверху краска закрывается листочком целлофана и, наконец, обертывается фольгой и бумагой с этикеткой. При выпуске акварельных красок в тубах наполнение туб пастой производится автоматически тубонабивочными машинами.
Практическая часть
Получение красок в лаборатории.
Изготовление красок состоит из нескольких операций:
Приготовление красок. Цветные реакции проводят с использованием 5%-х растворов различных веществ, имеющихся в школьной лаборатории. Для приготовления пигментов цветные осадки фильтруют и прокаливают в фарфоровой чашке. Для получения акварели пигменты смешивают с декстрином, перетирая в ступке.
Получение белых и черных пигментов
Белые осадки
2) ZnCl 2 + Na 2 S = = Zn S + 2NaCl.
4) ZnCl 2 + 2KOH == Zn(OH) 2 + 2KCl.
Черные осадки
FeCl 2 + Na 2 S = FeS + 2NaCl.
Получение коричневых и зеленых пигментов
Коричневые осадки
Зеленые осадки
3) CrCl 3 + 3KOH == Cr(OH) 3 + 3KCl.
Co(OH) 2 = = t CoO + H 2 O.
Получение красных, оранжевых и желтых пигментов
Красные и оранжевые осадки
FeCl 3 +3 KCNS = Fe ( CN ) 3 +3 KCl
Желтые осадки
Получение синих, голубых и фиолетовых пигментов
Голубые и синие осадки
2.2 Выполнение рисунков приготовленными красками и акварельными красками.
Было выполнено 2 одинаковых изображения новогодней елки. Раскрашены эти изображения различными способами: с помощью самодельных красок и настоящими красками. Зелёный цвет был получен с помощью реакции обмена с получением гидроксида железа (2). Красный цвет – это роданид железа (3). Желтый цвет –иодид свинца. Синий цвет – малахитовая зелень. (Приложение 6). На наш взгляд, опыт удался. И оба рисунка выглядят замечательно. Конечно, наши полученные краски недолговечны, но они дают стойкий цвет закрашиваемой поверхности.
4. Энциклопедический словарь юного химика. М., Педагогика. 1982.
5. Егоров С.А . Химия. Репетитор для поступающих в вузы. Ростов- на-Дону: Феникс, 2008;
6. Лучинская М.Г. Неорганическая химия. М.: ГЭОТАР-Медиа, 2009; Титова И. Вещества и материалы в руках художника. М.: МИРОС, 1994;
7. Хомченко Г.П. Пособие для поступающих в вузы. М.: Новая волна, 2002;
Приложение 1. История возникновения краски.

Приложение 2. Малахит и лазурит.



Приложение 3. Минеральные красители.
Вы когда-нибудь задавались вопросом: откуда берется цвет? В этой статье мы расскажем, как с химической точки зрения можно объяснить разные цвета соединений.
Vladislav Cherdantsev

Почему некоторые химические соединения цветные, а другие нет?
Вообще, химические вещества бывают органические и неорганические. Все вещества, содержащие углерод — это органические вещества (иногда органическую химию называют просто химией углерода). Цветные неорганические вещества обуславливаются одним фактором, а цветные органические — совсем другим, хотя в основе лежит один и тот же процесс.
Начнем с неорганических соединений.
Если посмотреть на периодическую таблицу элементов Дмитрия Ивановича Менделеева в длиннопериодном варианте (изображение ниже), то можно заметить особую группу элементов (химики называют их переходными металлами), которая находится в центре таблицы. Всего 66 переходных металлов, причем 38 из них \(d\)-элементы, а 28 – \(f\)-элементы. В неорганической химии чаще всего окрашены именно соединения переходных металлов.

Периодическая таблица Менделеева. \(d\)-элементы окрашены в голубой, \(f\)-элементы окрашены в зеленый (лантаноиды) и красный (актиноиды)
Немного отвлечемся, чтобы понять как устроен атом и где находятся электроны.
Устройство атома
Молекулы состоят из атомов, атомы состоят из ядра и окружающих его электронов. Электроны заряжены отрицательно, поэтому для соблюдения электронейтральности атома, их количество равно количеству положительно заряженных протонов, находящихся в ядре. Ядро состоит из положительно заряженных протонов и нейтронов (не имеющих заряда), но именно электроны представляют нам больший интерес.
Очень знаменитый физик Нильс Бор предложил теорию атома водорода, согласно ее математическому аппарату, скорость электрона в атоме водорода равна 2190 км/с. В атоме водорода всего один протон и соответственно один электрон. По мере увеличения числа электронов они находятся все дальше и дальше от ядра, и их скорость увеличивается. То есть 2190 км/с — это самая минимальная скорость электрона.
Существует некая иерархия электронов в атоме. Сначала есть энергетические уровни — 1, 2, 3, 4, 5, 6, 7, потенциально могут быть и дальнейшие, но пока изучено 118 элементов, и электроны последнего умещаются на 7 уровнях. Энергия этих уровней возрастает от 1 и выше. Затем есть электронные орбитали — \(s\), \(p\), \(d\), \(f\), которые различаются по своей форме. Энергия орбитали тоже возрастает начиная от \(s\) и выше в том порядке, в котором они перечислены. Что такое орбиталь? В общем, любая точка внутри орбитали — это положение, в котором электрон может находиться с наибольшей вероятностью. Трудно уследить за маленькой частичкой, масса которой \(9\cdot 10^\) кг и которая двигается с огромными скоростями, поэтому согласно квантовой теории говорят о том, где вероятность нахождения электрона наивысшая.
На каждой из орбиталей может находиться некое количество электронов на s — 2, на p — 6, на d — 10, на f — 14. Поэтому электроны можно называть \(1s\), или \(2s\), или \(2p\), или \(3s\), или \(5s\) и так далее. В принципе, можем возвращаться к переходным металлам. Любые химические соединения образуются благодаря спариванию электронов двух элементов (электронов наиболее удаленных от ядра).
Цвета соединений переходных элементов
Переходные металлы обладают уникальным свойством, у них наиболее удаленные орбитали — \(d\) или \(f\). Помните мы употребляли термины \(d\)-элемент и \(f\)-элемент? Это просто показатель где находятся валентные электроны (т.е участвующие в образовании химической связи). А чем же особенны \(d\) и \(f\) орбитали? В них помещается очень много электронов, 10 и 14 соответственно. Более того, согласно Теории Кристаллического поля, внутри \(d\)-орбитали есть различные положения, обладающие разной энергией, которые может занимать электрон, .
Если сообщить электрону энергию (облучить электромагнитной волной) — он займет положение с высшей энергией. Если у электрона будет возможность занять положение с низшей энергией — он займет ее, а избыток энергии излучится в виде электромагнитной волны. От разницы энергий двух состояний зависит какая электромагнитная волна излучается или поглощается.
Внутри \(d\)- и \(f\)-элементов электроны могут поглощать электромагнитные волны из видимого диапазона, этот процесс называется возбуждением электрона (когда он занимает высшую по энергии позицию). Почему именно из видимого диапазона? Так получается, что именно волны этого диапазона обладают достаточно высокой энергией для возбуждения, при этом достаточно низкой энергией, чтобы предотвратить переходы электрона на другую орбиталь, или вовсе другой энергетический уровень.
Любое соединение \(d\)- и \(f\)-элемента поглощает определенную волну из видимого диапазона, причем длина поглощаемой волны зависит от природы элемента. И то, что происходит дальше — крайне интересно. Любой белый свет состоит из всех волн видимого диапазона (все же знают опыт по разложению спектра на его составляющие?). Когда белый свет проходит сквозь эти соединения, поглощается определенная длина волны. И что мы видим? Мы видим весь спектр без одной какой-то волны, к примеру синей, поэтому соединение уже не может быть бесцветным, нам оно кажется окрашенным.
Еще интересней тот факт, что в соединениях эти \(d\)- и \(f\)- элементы отдают электроны другим элементам, и в зависимости от того, сколько электронов отдаст элемент — будет различаться цвет соединения. Например, если марганец отдаст 7 электронов, то соединение будет фиолетовым (марганцовка), если он отдаст 6 электронов — соединение будет темно зеленым, а если отдаст 4 — темно-коричневым, почти черным.

Более того, на цвет влияет не только то, сколько электронов отдает атом, но и то, кем он окружен. Слева направо: никель окружен аммиаком, диаминэтиленом, хлором и водой (комплексные соединения никеля)
Перейдем к органическим соединениям.
Здесь похожий принцип, только в иной форме.
Нам нужно изучить сопряженные органические вещества. Как я уже говорил, все органические соединения содержат углерод, причем только в молекуле природного газа (метан) всего один атом углерода, а в остальных молекулах присутствуют связи углерод-углерод. Более того, связи могут быть одинарными, двойными и тройными.
Сопряженные соединения — это такие соединения, в которых идет чередование двойных и одинарных связей по типу углерод-углерод. Например, \(CH_2=CH-CH=CH-CH=CH_2\) (где C — атом углерода, H — атом водорода). Все связи между атомами образуются перекрыванием электронных облаков, то есть электроны двух атомов становятся общими. Любая одинарная связь образована двумя электронами. Двойная связь — это сочетание одинарной связи и еще одной очень интересной связи, которая называется пи-связь. Электроны, образующие пи-связь обладают гораздо большей свободой, чем электроны, образующие обычную связь. Поэтому, в сопряженных соединениях они могут грубо говоря гулять по молекуле (только внутри сопряженной части молекулы), то есть они делокализуются. Этот момент пригодится чуть позже.
Когда образуется пи-связь, электроны занимают новые молекулярные орбитали (их количество равно числу электронов образующих связь). Сопряженные системы поглощают электромагнитные волны из ультрафиолетового спектра для того чтобы пи-электроны могли переместиться с высшей, по энергии, занятой молекулярной орбитали (ВЗМО) на низшую, по энергии, не занятую молекулярную орбиталь (НСМО).
Но мы знаем, что ультрафиолетовая область граничит с областью видимого света. Поэтому в соединениях с очень большими сопряженными системами (много чередующихся двойных и одинарных связей), электроны распространены на настолько большое расстояние (о чем я говорил ранее), что они обладают совсем маленькой энергией (чем больше пространства для движения электрона — тем меньше его энергия), и соответственно им нужно поглотить меньшую энергию для перескока электрона на другую молекулярную пи-орбиталь. Усиливает этот эффект тот факт, что в больших системах много молекулярных орбиталей, то есть у электрона много вариантов куда перескочить, и наверняка найдется возможность перескочить с минимальной разницей в энергии.
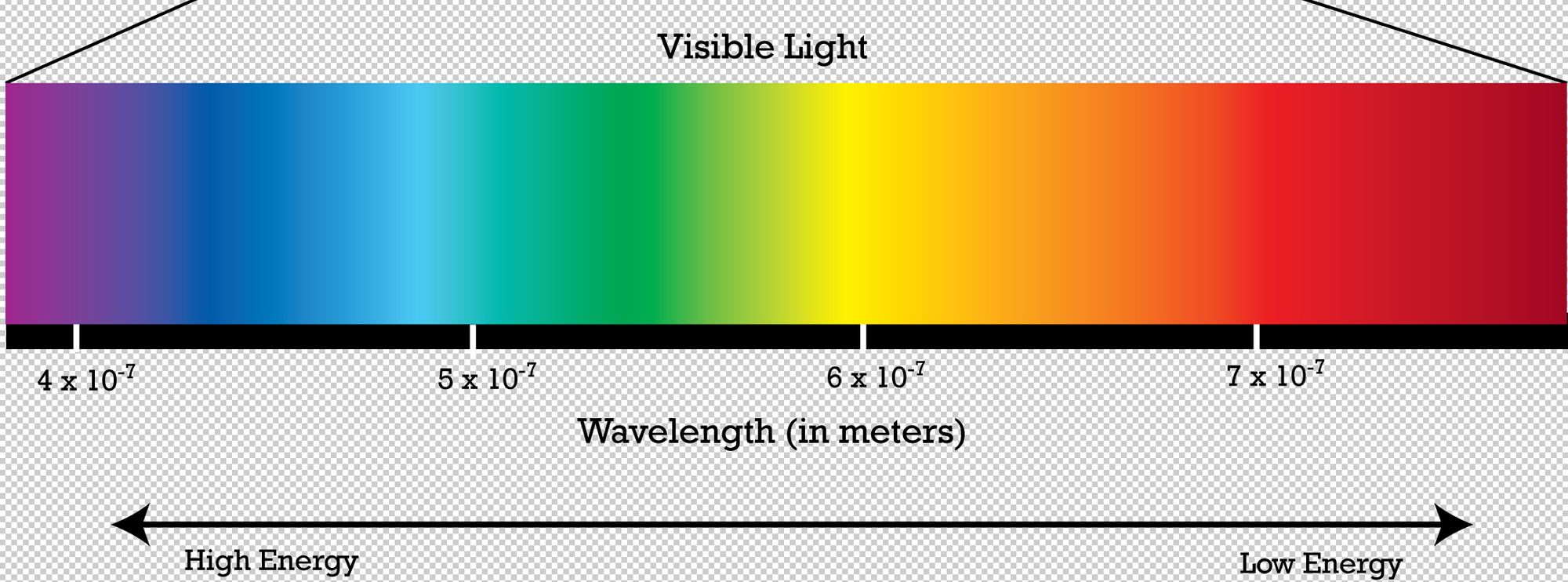
Волны видимого диапазона. Справа налево увеличение энергии, уменьшение длины волны
Если, посмотреть на электромагнитный спектр, мы заметим, что у ультрафиолетовых волн длина волны меньше, чем у видимого света. То есть, их частота больше и энергия выше, чем у видимого света. И получается, что в больших сопряженных системах нет смысла поглощать ультрафиолетовые лучи, ведь есть возможность поглощать видимый свет (таковой возможности нет у маленьких сопряженных систем).
Отсюда можно заключить следующую тенденцию — чем больше сопряженная система, тем ниже нужна энергия для осуществления электронных переходов, и тем дальше идет сдвиг в сторону микроволн. Разные сопряженные системы поглощают электромагнитное излучение разных длин волн. Например, тот самый пигмент из морковок, бета-каротин, содержит 11 двойных связей в сопряжении и поглощает свет с длиной волны 455 нм.

бета-каротин
Белый свет от солнца или настольной лампы, как я уже говорил ранее, состоит из волн всех длин видимого региона. Когда белый свет проходит через бета-каротин, волны с длиной от 400 до 500 нм (соответствующие синему цвету) поглощаются, а все остальные проходят дальше и достигают наших глаз. Таким образом, мы видим свет, без одной волны синего цвета, и получаем желто-оранжевую окраску для бета-каротина.
Что особенно интересно, так это то, что сопряженные соединения могут видоизменяться в зависимости от кислотности среды, то есть меняется и цвет самих соединений. Вот почему, например, цвет плодов меняется с зеленого на красный по мере созревания.
Эта статья является переизданием одноименной статьи из журнала Квазар от 15 января 2016 года. Многие авторы статей Квазара теперь являются участниками команды BeyondCurriculum и пришли к выводу, что некоторым людям может быть удобнее получать информацию в виде коротких статей онлайн. Если вы хотите получить полноценный опыт от чтения журнала, мы приглашаем вас скачать pdf с сайта Квазара.
Автор оригинальной статьи: Антон Моргунов
Редактор переиздания: Владислав Черданцев
Хочешь получать рассылку от нас?

WRO-2019-дағы Қазақстан командасы: Робототехникада нақты нұсқаулық жоқ

V дегеніміз вакцина
Иммунитеттің қызметі неде? Вакциналар қалай жұмыс істейді? Әртүрлі вакциналар арасындағы айырмашылық қандай? Вакциналар сіздің ДНК-ңізді өзгертеді ме?
![[Математика ғажабы] Пифагор теоремасы](https://blog.bc-pf.org/content/images/size/w300/2021/12/joel-filipe-Wc8k-KryEPM-unsplash-1--1-.jpg)
[Математика ғажабы] Пифагор теоремасы
Если не указано иначе, все текстовые материалы блога ОФ Beyond Curriculum лицензированы под CC BY-NC-SA 4.0
Читайте также:

