Химические процессы в природе реферат
Обновлено: 05.07.2024
Вещество и химическая реакция — два понятия, без которых невозможно в полной мере понять значение химических процессов в природе. Все потому, что природные и синтетические органические и неорганические вещества являются строительным материалом для создания окружающего мира, такого большого и разнообразного. Ежесекундно происходит огромное количество химических реакций, в результате которых одни вещества превращаются в другие.
Горение, дыхание и фотосинтез — наиболее важные процессы, имеющие химическую природу. Они заметно влияют на свойства окружающего мира, а также способы и формы существования живых и неживых организмов. Их протекание связано с биогеохимическими процессами, которые свойственны для биосферы и обусловлены деятельностью организмов.
Утверждение в химии кислородной теории горения А. Л. Лавуазье называют большой французской революцией в химии. С ее началось правильное понимание окислительных процессов, происходящих при участии кислорода: горения, дыхания, гниения.
Под химической реакцией понимают процесс превращения одних химических веществ в другие.
Эти процессы в природе происходят постоянно. К примеру, реакции наблюдаются между горными породами, водой и воздухом, в организмах людей, растений и животных, а также на многочисленных небесных телах.
Химические реакции или химия жизни крайне важны для природы и человека. Они используются в добыче металлов, минеральных удобрений, пластмасс, медикаментов и др.
Также реакции — источник различного вида энергии.
Источник энергии
Химия в природе связана с процессом фотосинтеза. Накапливание энергии в растениях является результатом фотосинтеза. Это едва ли не самый важный процесс на нашей планете. Зеленое растение — единственная земная лаборатория, усваивающая солнечную энергию и сохраняющая ее в виде химических связей углеводородов, которые и синтезированы растением.
Благодаря зеленому растению животный и растительный мир, лишенный зеленой окраски, получает питательные вещества. Зеленое растение кормит, одевает и согревает человечество.
Даже если мы видим, что горит дерево, нефть или газ, то это все результат жизнедеятельности зеленого растения.
Солнечный луч, поглощенный растением сотни миллионов лет назад сохранился до наших дней в виде каменного угля.
Фотосинтез или процесс образования органических веществ (сахаров) из неорганических (воды и углекислого газа) происходит в хлоропластах зеленых растений. Важное условие: фотосинтез осуществляется только при участии света.
Фотосинтез может происходить и в случае искусственного освещения. За счет этого у людей есть возможность выращивать овощи круглый год.
Реакция фотосинтеза выглядит следующим образом:

Ежегодно за счет фотосинтеза синтезируется примерно 150 млрд тонн углеводородов, а также происходит выделение свыше 200 млрд тонн кислорода.
Всасываемая корнями растения вода и углекислый газ из воздуха становятся в хлоропластах глюкозой. Освобожденный кислород при этом выходит в атмосферу. Кислород — основа дыхания.
В результате воздействия солнечных лучей часть кислорода превращается в озон, образующий озоновый слой. Его функция — поглощение коротковолновых космических ультрафиолетовых лучей, пагубно воздействующих на живые организмы.
Дыхание — один из процессов, непосредственно связанных с фотосинтезом. Оно является неотъемлемым признаком растительного и животного мира. Полное прекращение дыхания означает смерть организма.
Дыхание — это комплекс взаимосвязанных окислительно-восстановительных процессов, протекающих при участии ферментов. Этот процесс является источником энергии для всех биохимических процессов организма. В процессе дыхания происходит образование веществ, которые нужны для синтеза составных частей цитоплазмы.
Химическая энергия, освобожденная в процессе дыхания, способна превращаться во что-то другое и участвовать в ряде физиологических процессов организма: росте, движении, усвоении питательных веществ. Часть химической энергии выделяется в виде тепла, а часть — скапливается в митохондриях в составе АТФ.
Если представить химическую реакцию дыхания в виде схемы, то она будет противоположной фотосинтезу:

Молочнокислое брожение — распространенный в природе процесс, который вызывают различные группы бактерий. Такой процесс встречается при брожении капусты, огурцов, помидоров, силоса, при изготовлении кумыса, сметаны и кефира. Молочная кислота, которая образуется в процессе, подавляет действие гнилостных бактерий.
Закваска для выпечки черного хлеба содержит, кроме дрожжей, бактерии молочнокислого брожения.
Процесс фотосинтеза помогает зеленым растениям накапливать энергию в виде химических связей синтезированных ими органических соединений.
Процесс дыхания сопровождается окислительно-восстановительными реакциями. В результате энергия, накопленная зелеными растениями, высвобождается. Часть этой энергии идет на процессы жизнедеятельности, другая часть используется для поддержания температуры тела (если речь идет о растениях, то выделяется в атмосферу), еще часть — аккумулируется в митохондриях.
Распространенным процессом является маслянокислое брожение. В результате образуется масляная кислота.
Прогорклость животного масла при длительном хранении — результат маслянокислого брожения.
Нитрификующие бактерии также занимают важное место в природе. Они делают доступным для растений нитроген — в результате последовательного окисления аммониака до нитратов.
Хемотрофные организмы способствуют процессам круговорота веществ в природе.
Круговорот веществ в природе
Важные составляющие круговоротов оксигена и карбона — такие процессы как горение, дыхание и фотосинтез, имеющие химическую природу.
Если говорить упрощенно, то круговорот оксигена можно описать так: процесс образования кислорода в результате фотосинтеза растений и использование его в процессе дыхания, а также в реакциях окисления и горения. Благодаря круговороту оксигена атмосфера и гидросфера связываются с земной корой.
Карбон является составной частью всех органических веществ. Круговорот карбона тесно связан с круговоротом оксигена. Среди звеньев круговорота карбона можно выделить горение ископаемого топлива, образование глюкозы и крахмала из углекислого газа и воды в процессе фотосинтеза, процессы обмена в живых организмах, гниение отмерших органических остатков.
Дыхание представляет собой определенные процессы, в результате которых органические вещества, имеющие сложное строение, окисляются и образуют углекислый газ и воду.
Две стороны одного окислительно-восстановительного процесса — окисление и восстановление соответственно. Окислению в результате горения и дыхания соответствует процесс восстановления в процессе фотосинтеза.
Природные химические процессы в жизни человека
Первые объекты исследования в науке — органические вещества живой природы. В дальнейшем эти исследования оформились в отдельную науку: органическую химию. Это понятие было введено шведским ученым Берцелиусом. В учебнике по химии 1827 года он говорит о том, что элементы в живой природе находятся в подчинении законов, отличных от тех, что действуют в неживой природе.
По этой причине невозможно образование органических веществ под воздействием обычных физических и химических сил. В этом случае есть необходимость в особой жизненной силе. Так, органическая химия была определена Берцелиусом как химия растительных и животных веществ.
Тем не менее живая природа — кладезь органических веществ.
По сей день человечество использует выработанные живыми организмами органические вещества для удовлетворения своих потребностей. В основном — в продуктах, одежде, жилье, гигиене и здоровье.
Новые токсические источники загрязнения окружающей среды — результат создания синтетических материалов и синтеза искусственных радионуклидов. А это является реальной угрозой жизни на нашей планете.
Успешное использование природных ресурсов зависит от того, насколько хорошо люди смогут разобраться в законах природы.

ГОСТ
Значение химических процессов в природе
Значение химических процессов в природе невозможно охватить в полной степени без понимания содержания двух важнейших понятий химии – вещество и химическая реакция. Ведь природные и синтетические органические и неорганические вещества – строительный материал, из которого создан окружающий мир во всём его величии и разнообразии. Каждую секунду и даже за меньшие промежутки времени происходит множество химических реакций, вследствие которых одни вещества превращаются в другие.
Химическую природу имеют и чрезвычайно важные процессы, которые существенно влияют на свойства окружающего мира, способы и формы сосуществования живого и неживого на планете Земля – это горение, дыхание, фотосинтез. С их течением тесно связаны биогеохимические процессы, характерные для биосферы и обусловленные деятельностью организмов.
Большая французская революция в химии – именно так характеризуют учёные утверждение в химии кислородной теории горения А.Л. Лавуазье. Она открыла путь к правильному пониманию всех окислительных процессов с участием кислорода – горения, дыхания, гниения.
Химические реакции – процесс превращения одних веществ в другие, постоянно происходят в природе. Реакции проходят между горными породами, воздухом и водой, в организмах растений, животных и человека, на различных небесных телах в Космосе.
Химические реакции имеют огромное значение как для природы, так и для человечества. Их используют для добывания металлов, пластмасс, минеральных удобрений, медикаментов и многих других веществ.
Реакции являются источником добывания энергии различного вида.
Откуда же берётся энергия?
Энергия накопляется в растениях в процессе фотосинтеза. Значение этого процесса для существования жизни на Земле тяжело переоценить. Именно зелёное растение является той единственной в мире лабораторией, которая усваивает солнечную энергию и сохраняет её в виде химических связей синтезированных им углеводородов. Зелёное растение образует питательные вещества для животного и растительного мира, которые не имеют зелёной окраски. Оно в буквальном понимании слова кормит, одевает и согревает нас. Горят дрова, нафта или газ – всё это результат его жизнедеятельности. Поглощённый сотни миллионов лет назад зелёным растением солнечны й луч сохранился до наших дней в виде каменного угля. В хлоропластах зелёных растений происходит фотосинтез – процесс образования органических веществ (сахаров) из неорганических (воды и углекислого газа). Этот процесс происходит лишь под действием света.
Готовые работы на аналогичную тему
Процесс фотосинтеза происходит и при искусственном освещении, что позволяет выращивать овощи на протяжении года.
Во время фотосинтеза происходит такая реакция:
Каждый год благодаря фотосинтезу на Земле синтезируется около 150 млрд т углеводородов и выделяется более 200 млрд т кислорода.
Вода, которую растения всасывают корнями, и углекислый газ из воздуха превращаются в хлоропластах в глюкозу, а освобождённый кислород выходит в атмосферу. Кислород необходим для дыхания. В листьях глюкоза превращается в крахмал, крахмал может превращаться в сахар и частично оттекать от листа в другие органы растения.
Часть кислорода под действием космических лучей превращается в озон, который образует озоновый слой. Он поглощает коротковолновые космические ультрафиолетовые лучи, которые пагубно действуют на живые организмы.
С процессом фотосинтеза тесно связан другой естественный процесс – дыхание. Дыхание – характерный признак жизни как растительного, так и животного организма. Смерть организма характеризуется полным прекращением дыхания.
Дыхание представляет собой комплекс тесно взаимосвязанных окислительно – восстановительных процессов, которые происходят с участием ферментов. Дыхание является источником энергии для всех биохимических процессов в организме. В процессе дыхания образуются вещества, необходимые для синтеза составных частей цитоплазмы.
Освобождённая в процессе дыхания химическая энергия поддаётся превращениям, обуславливает ряд физиологических процессов в организме (рост, движение, усвоение питательных веществ). Часть её выделяется в виде тепла, часть накопляется в митохондриях в составе АТФ.
Химическая реакция дыхания противоположна фотосинтезу:
Широко распространено в природе молочнокислое брожение. Оно вызывается целой группой бактерий. Этот процесс используется при квашении капусты, огурцов, помидор, силоса, изготовлении кумыса, кефира, сметаны. Образованная при этом молочная кислота угнетает действие гнилостных бактерий. Закваска для приготовления чёрного хлеба, кроме дрожжей, содержит и бактерии молочнокислого брожения.
Благодаря процессу фотосинтеза зелёные растения накопляют энергию в виде химических связей синтезированных ими органических соединений.
Во время дыхания происходят окислительно – восстановительные реакции, в результате которых накопленная зелёными растениями энергия освобождается. Часть этой энергии используется на процессы жизнедеятельности, часть – на поддержание температуры тела (в случае растений – выделяется в атмосферу), а часть аккумулируется в митохондриях.
Широко распространено и маслянокислое брожение, при котором образуется масляная кислота.
Последствием маслянокислого брожения является прогорклость животного масла при длительном хранении.
Большое значение в природе играют нитрификующие бактерии. Окисляя последовательно аммониак до нитратов, тем самим делают доступным Нитроген для усвоения растениями.
Хемотрофные организмы содействуют процессам кругооборота веществ в природе.
Круговорот веществ
Горение, дыхание, фотосинтез имеют химическую природу и являются важными звеньями планетарных процессов – кругооборотов Оксигена и Карбона.
Упрощённо кругооборот Оксигена в природе можно описать как процесс образования кислорода в результате фотосинтеза растений и использование его во время дыхания, в реакциях окисления и горения. Кругооборот Оксигена связывает атмосферу и гидросферу с земной корой.
Карбон – составная всех органических веществ, его кругооборот связан с кругооборотом Оксигена. Горение ископаемого топлива, образование глюкозы и крахмала из углекислого газа и воды во время фотосинтеза, обменные процессы в живых организмах, гниение отмерших органических остатков – звенья кругооборота Карбона.
Дыхание – череда процессов, в ходе которых органические вещества сложного строения окисляются с образованием углекислого газа и воды.
Природные химические процессы в жизни человека
Однако живая природа с давних времён была и остаётся неисчерпаемым источником органических веществ, важность которых невозможно переоценить.
До нашего времени человечество использует органические вещества, выработанные живыми организмами, чтобы удовлетворить материальные потребности, прежде всего – в пищевых продуктах, удобной одежде, комфортном жилище, соблюдении гигиены, сохранении здоровья и т. п.
Создание синтетических материалов, синтез искусственных радионуклидов обусловили появление новых токсических источников загрязнения окружающей среды, что, в конце концов, вызывает огромную угрозу для существования жизни на Земле.
Успехи человечества в использовании природных ресурсов зависят от познания законов природы и умелого их использования.
Хаос, беспорядок, понятие окончательно оформившееся в древнегреческой философии - это трагический образ космического первоединства, начало и конец всего, вечная смерть всего живого и одновременно принцип и источник всякого развития, он неупорядочен, всемогущ и безлик. Рассмотрим кинетическую энергию совокупности частиц. Если вдруг окажется, что все частицы движутся в одном и том же направлении с одинаковыми скоростями, то вся система, подобно теннисному мячу, будет находится в состоянии полета. Система ведет себя в этом случае аналогично одной массивной частице, и к ней применимы обычные законы динамики, такое движение называется движением центра масс. Существует, однако, и другой вид движения. Можно представить себе, что частицы системы движутся не упорядоченно, а хаотически: полная энергия системы может быть той же самой, что и в первом случае, но теперь отсутствует результирующее движение, поскольку направления и скорости движения атомов беспорядочны. Если бы мы могли проследить за какой-либо отдельной частицей, то увидели бы, что она проходит небольшое расстояние вправо, затем, соударяясь с соседней частицей, смещается немного влево, снова соударяется и т. д. Основная черта этого вида движения состоит в отсутствии корреляции между движениями различных частиц; иными словами, их движения некогерентны (неупорядочены).
Описанное случайное, хаотическое, некоррелированное, некогерентное, неупорядоченное движение называется тепловым движением. Очевидно, понятие теплового движения неприменимо к отдельной частице, поскольку бессмысленно говорить о некоррелированном движении одной частицы. Иными словами, когда мы переходим от рассмотрения движения отдельной частицы к системам многих частиц и при этом возникает вопрос о наличии корреляций в их движениях, мы по существу переходим от обычной динамики в новую область физики, которая называется термодинамикой. Итак, существует два вида движения частиц в сложных системах: движение может быть когерентным (упорядоченным), когда все частицы движутся согласованно (“в ногу”), или, напротив, неупорядоченным, когда все частицы движутся хаотически. Естественное стремление энергии к рассеянию определяет и направление, в котором происходят физические процессы в природе. Под этим понимается рассеяние энергии в пространстве, рассеяние частиц, обладающих энергией, и потеря упорядоченности, свойственное движению этих частиц. Первое начало термодинамики в принципе не отрицает возможности событий, казалось бы противоречащих здравому смыслу и повседневному опыту: например, мяч мог бы начать подскакивать за счет своего охлаждения, пружина могла бы самопроизвольно сжаться, а кусок железа мог бы самопроизвольно стать более горячим, чем окружающее пространство. Все эти явления не нарушили бы закона сохранения энергии. Однако в действительности ни одно из них не происходит, поскольку нужная для этого энергия, хотя и имеется в наличии, но недоступна. Если не принимать всерьез существующий в принципе, но чрезвычайно небольшой шанс, можно смело утверждать, что энергия никогда не может сама по себе локализоваться, собравшись в избытке в какой-либо небольшой части Вселенной. Однако, если бы даже произошло, еще менее вероятно, что подобная локализация была бы упорядоченной. Естественные процессы - это всегда процессы, сопровождающие рассеяние, диссипацию энергии. Отсюда становится ясным, почему горячий объект охлаждается до температуры окружающей среды, почему упорядоченное движение уступает место неупорядоченному и, в частности, почему механическое движение вследствие трения полностью переходит в тепловое. Столь же просто осознать, что любые проявления асимметрии, так или иначе сводятся к рассеянию энергии. Проявление любых диспропорций в организационной структуре объекта приводит к образованию асимметрии как по отношению к окружающей среде, так и для самой структуры в частности, это может привести к увеличению потенциальной энергии или, при большом скоплении этой энергии, к распаду системы, как противоречащей законам природы (общества). Организация создается из хаоса (общества) одним или несколькими возбужденными атомами (предпринимателями) и в хаос проваливается при ликвидации. Естественные, самопроизвольно происходящие процессы - это переход от порядка к хаосу. Поставим теперь следующий вопрос: сколькими способами можно произвести перестройку внутри системы, так чтобы внешний наблюдатель не заметил ее. Отметим, что в формулировке вопроса учтено то существенное, что характеризует переход от мира атомов к макроскопической системе, а именно “слепота” внешнего наблюдателя по отношению к “индивидуальностям” атомов, образующих систему. Термодинамика имеет дело только с усредненным поведением огромных совокупностей атомов, причем поведение каждого отдельного атома не играет роли. Если внешний наблюдатель, изучающий термодинамику, не заметил, что в системе произошло изменение, то состояние системы считается неизменным. Лишь “педантичный” наблюдатель, тщательно следящий за поведением каждого атома, будет знать, что изменение все-таки произошло. Сделаем теперь последний шаг на пути к полному определению хаоса. Предположим, что частицы вселенной не закреплены и могут, подобно состоянию возбуждения и энергии, свободно перемещаться с места на место; например, такое могло бы случиться, если бы Вселенная была газом. Предположим также, что мы создали начальное состояние вселенной, пустив струю газа в правый нижний угол сосуда. Интуитивно мы понимаем, что произойдет: облако частиц начнет самопроизвольно распространяться и через некоторое время заполнит весь сосуд. Такое поведение вселенной можно трактовать как установление хаоса. Газ — это облако случайно движущихся частиц (само название “газ” происходит от того же корня, что и “хаос”). Частицы мчатся во всех направлениях, сталкиваясь и отталкиваясь друг от друга после каждого столкновения. Движения и столкновения приводят к быстрому рассеиванию облака, так что вскоре оно равномерно распределяется по всему доступному пространству. Теперь существует лишь ничтожно малый шанс, что все частицы газа когда-нибудь спонтанно и одновременно вновь соберутся в угол сосуда, создав первоначальную конфигурацию. Разумеется, их можно собрать в угол с помощью поршня, но это означает совершение работы, следовательно, процесс возврата частиц в исходное состояние не будет самопроизвольным.
Ясно, что наблюдаемые изменения объясняются склонностью энергии к рассеянию. Действительно, теперь состояние возбуждения атомов оказалось физически рассеянным в пространстве вследствие спонтанного рассеяния атомов по объему сосуда. Каждый атом обладает кинетической энергией, и потому распространение атомов по сосуду приводит и к распространению энергии. В химии, как и в физике, все естественные изменения вызваны бесцельной “деятельностью” хаоса. Мы познакомились с двумя важнейшими достижениями Больцмана: он установил, каким образом хаос определяет направление изменений и как он устанавливает скорость этих изменений. Мы убедились также в том, что именно непреднамеренная и бесцельная деятельность хаоса переводит мир в состояния, характеризующиеся все большей вероятностью. На этой основе можно объяснить не только простые физические изменения (скажем, охлаждение куска металла), но и сложные изменения, происходящие при превращениях вещества. Но вместе с тем мы обнаружили, что хаос может приводить к порядку. Если дело касается физических изменений, то под этим понимается совершение работы, в результате которой в свою очередь могут возникать сложные структуры, иногда огромного масштаба. При химических изменениях порядок также рождается из хаоса; в этом случае, однако, под порядком понимается такое расположение атомов, которое осуществляется на микроскопическом уровне. Но при любом масштабе порядок может возникать за счет хаоса; точнее говоря, он создается локально за счет возникновения неупорядоченности где-то в ином месте. Таковы причины и движущие силы происходящих в природе изменений.
Исходя из изложенного материала, можно выделить следующие принципы:
1. Все происходящие события, процессы, явления и т.д. носят случайный характер. В системе постоянно происходят необратимые явления.
2. Необратимые процессы являются источником порядка, что считается высоким уровнем организации материи, например, диссипативные структуры. Второе начало термодинамики – это не просто безостановочный переход систем к виду, лишённому какой-либо организации, т.е. энтропия – это характеристика порядка на различных уровнях эволюции.
3. Обратимость (если речь идет о больших промежутках времени) присуща всем замкнутым системам, а необратимость – возможно, всей остальной части Вселенной. При неравновесных условиях энтропия характеризует не деградацию, а установление нового порядка.

Физические изменения не связаны с химическими реакциями и созданием новых продуктов, например, таяние льда. Как правило, такие преобразования являются обратимыми. Кроме примеров физических явлений, в природе и в повседневной жизни встречаются также химические трансформации, при которых образуются новые продукты. Такие химические явления (примеры будут рассмотрены в статье) являются необратимыми.
Химические изменения
Химические изменения можно рассматривать как любое явление, которое позволяет ученым измерять химические свойства. Многие реакции также являются примерами химических явлений. Хотя не всегда легко сказать, что произошло именно химическое изменение, есть некоторые контрольные признаки. Что такое химические явления? Приведем примеры. Это может быть изменение цвета вещества, температуры, образование пузырьков или (в жидкостях) выпадение осадка. Можно привести следующие примеры химических явлений в жизни:
- Ржавчина на железе.
- Сжигание древесины.
- Метаболизм пищи в организме.
- Смешивание кислоты и щелочи.
- Приготовление яйца.
- Переваривание сахара амилазой в слюне.
- Смешивание в выпечке соды и уксуса для получения газообразного диоксида углерода.
- Выпекание пирога.
- Гальванизация металла.
- Батарейки.
- Взрыв фейерверков.
- Гниющие бананы.
- Образование молочно-кислых продуктов.
И это далеко не весь список. Можно рассмотреть некоторые из этих пунктов более подробно.

Наружный огонь с использованием дерева
Огонь - это тоже пример химического явления. Это быстрое окисление материала в экзотермическом химическом процессе горения, высвобождение тепла, света и различных продуктов реакции. Огонь является горячим, потому что происходит конверсия слабой двойной связи в молекулярном кислороде O2 к более сильным связям в продуктах сгорания углекислого газа и воды. Выделяется большая энергия (418 кДж на 32 г O2); энергии связи топлива играют лишь второстепенную роль здесь. В определенный момент реакции горения, называемой точкой воспламенения, образуются пламя.
Это видимая часть огня, которая состоит в основном из двуокиси углерода, водяного пара, кислорода и азота. Если температура достаточно высокая, газы могут стать ионизированными для получения плазмы. В зависимости от того, какие вещества загораются и какие примеси подаются снаружи, цвет пламени и интенсивность огня будут разными. Огонь в его наиболее распространенной форме может привести к пожару, который может нанести физический ущерб при горении. Огонь является важным процессом, который затрагивает экологические системы по всему миру. Положительные эффекты пожара включают стимулирующий рост и поддержание различных экологических систем.
Ржавчина
Так же, как и огонь, процесс ржавления является также окислительным процессом. Вот только не таким быстропротекающим. Ржавчина представляет собой оксид железа, обычно красный оксид, образованный окислительно-восстановительной реакцией железа и кислорода в присутствии воды или воздуха. Несколько форм ржавчины различаются как визуально, так и спектроскопией и формируются при разных обстоятельствах. Учитывая достаточное время, кислород и воду, всякая масса железа в конечном итоге полностью превращается в ржавчину и разлагается. Поверхностная ее часть является шелушащейся и рыхлой, и она не защищает подстилающее железо, в отличие от образования патины на медных поверхностях.
Такой пример химического явления, как ржавление, является общим термином для коррозии железа и его сплавов, таких как сталь. Многие другие металлы подвергаются аналогичной коррозии, но полученные оксиды обычно не называются ржавчиной. Существуют другие формы этой реакции как результат реакции между железом и хлоридом в среде, лишенной кислорода. Примером может служить арматура, используемая в подводных бетонных столбах, которая генерирует зеленую ржавчину.
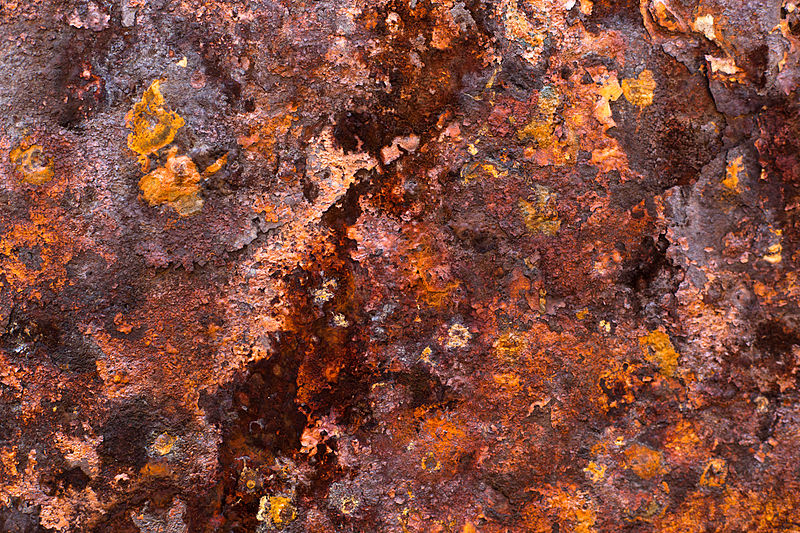
Кристаллизация
Еще одним примером химического явления является кристаллический рост. Это процесс, в котором ранее существовавший кристалл становится больше по мере увеличения количества молекул или ионов в их положениях в кристаллической решетке. Кристалл определяется как атомы, молекулы или ионы, расположенные в упорядоченном повторяющемся образце, кристаллической решетке, распространяющейся во всех трех пространственных измерениях. Таким образом, рост кристаллов отличается от роста капли жидкости тем, что во время роста молекулы или ионы должны попадать в правильные положения решетки, чтобы упорядоченный кристалл мог расти.

Когда молекулы или ионы попадают в положение, отличное от положений в идеальной кристаллической решетке, образуются дефекты кристалла. Как правило, молекулы или ионы в кристаллической решетке улавливаются в том смысле, что они не могут двигаться от своих положений, и поэтому рост кристаллов часто необратим, так как когда молекулы или ионы встали на место в растущей решетке, они фиксируются в ней. Кристаллизация является обычным процессом как в промышленности, так и в естественном мире, и кристаллизация обычно понимается как состоящая из двух процессов. Если ранее не существовало кристалла, то новый кристалл должен зарождаться, а затем он должен подвергаться росту.

Химическое происхождение жизни
Химическое происхождение жизни относится к условиям, которые могли бы существовать и, следовательно, способствовали появлению первых дублируемых форм жизни.

Главным примером химических явлений в природе является сама жизнь. Считается, что совокупность физических и химических реакций смогла привести к появлению первых молекул, которые, репродуцируясь, привели к появлению жизни на планете.

В основе жизни, как и в основе изменения химического состава биосферы, лежат химические процессы, для описания и управления динамическим равновесием в биосфере необходимо знание химических механизмов взаимодействия между отдельными подсистемами. Эта область экологии оформилась в отдельную научную дисциплину – химическую экологию, под которой понимается наука о химических взаимодействиях между живыми организмами и неживой природой. В задачи химической экологии входят вопросы о степени влияния отдельных видов антропогенных воздействий на живую природу, предсказания возможных экологических последствий химических загрязнений. Доминирующим аспектом здесь является биологический.
В настоящее время экология представляет собой сложный интегрированный комплекс наук. Специалисты-химики должны иметь достаточно ясное понимание вопросов взаимоотношения современного технизированного общества и окружающей среды, функционирования биосферы в условиях все усиливающегося антропогенного давления, методов анализа природных объектов, контроля качества окружающей среды и места химии в экологической науке.
Целью данного реферата является рассмотрение взаимосвязи химии и экологии в аспекте химических процессов, протекающих в биосфере, как глобальной экосистеме Земли.
На основе цели можно выделить ряд задач реферата: рассмотреть роль и место химии в науке экологии, проанализировать строение биосферы и химические процессы, протекающие в ее компонентах: атмосфере, гидросфере, литосфере и почве.
Для выполнения реферата были использованы учебные пособия по химической экологии, химии окружающей среды и статьи из периодических изданий по теме реферата.
Роль и место химии в науке экологии
Экология – это наука об отношениях организмов и образуемых ими сообществ между собой и окружающей средой. Экология – это раздел биологии, изучающий взаимосвязи между организмами и их средой обитания, о круговороте веществ в природе и потоках энергии, делающих возможной саму жизнь на Земле. Главная задача современной экологии – изучение и прогнозирование антропогенных изменений в среде обитания, обоснование и разработка методов ее сохранения и улучшения в интересах человечества.
Современная экология охватывает чрезвычайно широкий круг вопросов и тесно переплетается с целым рядом смежных наук таких, как география, геология, физика, химия, генетика, математика, медицина, агрономия, архитектура. Приставка эко- появляется у многих естественных и общественных наук.
- вещества, входящие в состав организма, их структуру, распределение, превращение и функции изучает наука биохимия;
- с точки зрения биологии в рамках экосистемы существует понятие химической экологии – это наука о химических взаимоотношениях живых организмов между собой и с живой и неживой природой.
Предмет химической экологии – это химизм и принципы взаимодействия животных и растительных организмов между собой и неорганической средой посредством взаимно перекрещивающегося действия различных молекул.
Природные вещества в биосфере, их превращение и транспорт в естественных условиях и под воздействием антропогенного фактора изучает экологическая химия. Однако иногда особо выделяется антропогенное химическое воздействие на процессы в биосфере посредством действия любых химических веществ – продуктов деятельности человека, например, СО2, и действия веществ не свойственных природе, например, пестициды, и называют этот раздел экологической химией, однако такое представление слишком узко.
На рисунке 1 схематически представлены области исследования химической, биологической и экологической наук и их взаимосвязь.
Рис. 1. Связь химических, биологических и экологических наук 1
Роль химической экологии в общей системе экологических знаний и природоохранной деятельности возрастает по нескольким причинам.
1. Среди факторов, нарушающих природные равновесия, химические вещества различного происхождения имеют первостепенное значение.
2. Химические факторы более заметны и легче поддаются анализу, чем, например, изменения биологического или географического фактора.
3. Химическим методам и средствам (химической технологии) принадлежит ведущая роль в охране окружающей среды.
Задачи химической экологии как любой науки – это описание, объяснение тех или иных процессов в системе и предсказание поведения системы в заданных условиях. В случае химической экологии объектом внимания является конкретная экосистема или биосфера в целом. 2
Строение и химический состав биосферы
Биосфера, являясь глобальной экосистемой (экосферой) как и любая экосистема, состоит из биотической и абиотической частей. Биотическая часть состоит из живых организмов таксонов, осуществляющих важнейшую функцию биосферы, без которой не может существовать сама жизнь: биогенный ток атомов.
Абиотическая часть представлена:
- почвой и подстилающими ее породами до глубины, где еще есть живые организмы, вступающие в обмен с веществом этих пород, и физической средой порового пространства.
- атмосферным воздухом до высоты, на которой возможны еще проявления жизни.
- водной средой океанов, рек, озер.
Биосферу слагают три категории субстанций.
1. Живое вещество – совокупность всех живых организмов: микроорганизмы, растения и животные, их активная биомасса.
Под живым веществом В.И. Вернадский, автор учения о биосфере, понимает все количество живых организмов планеты как единое целое. Его химический состав подтверждает единство природы – он состоит из тех же элементов, что и неживая природа, только соотношение этих элементов различное и строение молекул другое.
Общим свойством жизни является присутствие в живом веществе активных белковых молекул. С химической точки зрения, живое и биогенное вещество биосферы представлено 3 :
- аминокислотами, составляющими основу белка
Последние являются составными частями нуклеиновых кислот, содержащихся в каждой клетке (дезоксирибонуклеиновые кислоты – ДНК – в ядре клетки и рибонуклеиновые – РНК – в цитоплазме). Из названных органических соединений образуются сложные молекулы углеводов, белков, жиров, и нуклеиновых кислот.
2. Биогенное вещество – мертвая органика, все формы детрита, а также биогенные горные породы, включая часть ископаемого топлива. Биогенными элементами называют растворимые элементы, жизненно необходимые организмам.
Макробиогенными элементами называют элементы, требующиеся организмам в сравнительно больших количествах.
Микробиогенными элементами называют элементы и их соединения, которые хотя и необходимы для жизнедеятельности биосистем, но требуются в крайне малых количествах. Для растений, например, наиболее важны 10 микроэлементов: Fe, Mn, Cu, Zn, B, Si, Mo, Cl, Co, V.
Для фотосинтеза необходимы: Fe, Mn, Cl, V.
Для азотного обмена необходимы: Fe, Mо, В.
Для других метаболических функций необходимы: Mn, В, Co, Cu, Si.
Все эти элементы кроме бора необходимы и животным, кроме того им может требоваться Se, Cr, Ni, F, I, Sn.
Между макро- и микроэлементами нельзя провести четкую границу, так же как и между различными группами организмов.
3. Биокосное вещество – смеси живого вещества и биогенных веществ с минеральными породами небиогенного происхождения (почва, илы, природные воды, газо- и нефтеносные сланцы, битумные пески, часть осадочных пород; сюда же можно отнести и земную атмосферу).
Биогеохимические принципы Вернадского включают в себя следующие положения:
1) биогенная миграция химических элементов в биосфере всегда стремится к максимальному своему проявлению. Этот принцип в наши дни нарушен человеком.
2) эволюция видов в ходе геологического времени, приводящая к созданию устойчивых в биосфере форм жизни, идет в направлении, усиливающем биогенную миграцию атомов. Этот принцип при антропогенном измельчении средних размеров особей биоты земли, к примеру, когда лес сменяется лугом, а крупные животные мелкими, начинает действовать аномально интенсивно.
3) живое вещество находится в непрерывном химическом обмене с окружающей средой, создающейся и поддерживающейся не Земле космической энергией Солнца.
Вследствие нарушения двух первых принципов космические воздействия из поддерживающих биосферу могут превратиться в разрушающие ее факторы.
Для того, чтобы понять роль химических элементов в функционировании биосферы, необходимо также рассмотреть явление биогеохимических циклов, которые совершают химические элементы в биосфере.
Биогеохимические циклы химических элементов
Чтобы жизнь продолжала существовать, химические элементы должны постоянно циркулировать из внешней среды в живые организмы и обратно, переходя из протоплазмы одних организмов в усвояемую для других организмов форму. Таким образом, перемещения и превращения веществ и элементов в природе под действием биологических и геологических факторов, сопровождающиеся перераспределением энергии, поступающей от Солнца, образуют биогеохимические циклы.
Существование биогеохимических циклов создает возможность для саморегуляции системы, что придает экосистеме устойчивость – постоянство процентного состава различных элементов в ней или так называемый гомеостаз. Механизмы, обеспечивающие восстановление равновесия в круговороте, возвращение элементов в круговорот, во многих случаях основаны на биологических процессах. Вещества в круговоротах постоянно трансформируются, перестраиваются, обмениваясь атомами, а сами атомы остаются неизменными.
В науке выделяются большой и малый круговороты веществ.
В основе большого или геологического (абиотического) круговорота веществ лежит процесс переноса минеральных соединений из одного места в другое в масштабах планеты. Около половины падающей на Землю лучистой энергии расходуется на перемещение воздуха, выветривание горных пород, испарение воды, растворение минералов. Движение воды и ветра приводит к эрозии, транспорту, перераспределению, осаждению и накоплению механических и химических осадков на суше и в океане. В течение длительного времени образующиеся в море напластования могут возвращаться на сушу – и процессы возобновляются.
В основе малого или биологического (биотического) круговорота веществ в природе лежат процессы синтеза и разрушения органических соединений. Все организмы экосистемы связаны между собой и абиотическим окружением потоками вещества и энергии. В отличие от геологического, биологический круговорот характеризуется ничтожным количеством энергии. На создание органического вещества затрачивается всего около 1 % падающей на Землю лучистой энергии. Однако эта энергия, вовлеченная в биологический круговорот, совершает огромную работу по созиданию живого вещества.
Большой и малый круговорот веществ составляют биогеохимические циклы элементов – это перемещения и превращения элементов через косную и органическую природу при активном участии живого вещества. Эти процессы обеспечивают жизнь и составляют одну из главных ее особенностей. Общая схема и взаимосвязь потоков в глобальном круговороте веществ представлена на рис. 2.
Рис. 2. Схема круговорота веществ в природе (биогеохимических циклов элементов) 4
В каждом биогеохимическом цикле, то есть для каждого отдельного элемента, можно выделить два фонда:
1) резервный – большая масса медленно движущихся веществ, содержащих данный элемент, в основном в составе абиотического компонента;
2) обменный (подвижный) – меньший фонд, но более активный. Для него характерен быстрый обмен между организмами и их непосредственным окружением. Цикл представлен пищевой цепью и связан с резервным фондом.
Среди биогеохимических циклов элементов выделяют циклы двух типов: циклы газообразных веществ и цикл осадочных веществ. Такое деление основано на проявлении склонности химических элементов образовывать газообразные соединения (С, О, N, S) и не газообразные вещества (Р, Са, Fe) в условиях Земли.
Самоконтроль циклов второго типа затруднен, они легче нарушаются в результате местных перетрубаций, поскольку в этих циклах основная масса вещества сосредоточена в малоактивном резервном фонде. В связи с хозяйственной деятельностью человека и вовлечением в биосферный поток техногенных продуктов этой деятельности возникли проблемы, обусловленные нарушением природных биогеохимических циклов. Циклы некоторых элементов, например, азота, серы, фосфора, калия, стали природно-антропогенными, характеризующимися значительной незамкнутостью. Некоторые же соединения и материалы, созданные человеком, например, пластмассы, вообще не способны включаться в природные или природно-антропогенные циклы, так как не перерабатываются в экосистемах, загрязняя их.
Для более подробного изучения вопроса круговорота химических веществ в биосфере можно рассмотреть особенности химических реакций, протекающих в отдельных ее компонентах, а именно атмосфере, гидросфере, литосфере и почве.
Экологическая химия атмосферы и гидросферы
Общий состав атмосферы почти одинаков по всей Земле в результате высокой степени перемешивания в пределах атмосферы и представлен в табл. 1.
Таблица 1 – Валовой состав незагрязненного воздуха 5
Читайте также:

