Генная терапия человека реферат
Обновлено: 05.07.2024
Существует тяжёлое заболевание – гиперхолестеринемия. Причиной его является недостаток или дефект генов ЛПНП-рецептора – мелких структур на поверхности клеток печени, "вытягивающих" липопротеиды низкой плотности (ЛПНП), вредные для здоровья человека, из крови и ответственных за их разрушение и ответственных за их разрушение в печени. Джеймс Вильсон, бывший исследователь из Медицинской школы Мичиганского университета в Энн-Арбор, сделал попытку внедрить копии нормального гена ЛПНП-рецептора пациенту.
Содержание
1. Введение. 3
2. Генная терапия. 4
3. Историческая справка. 6
4. методы генотической трансфекции в генной терапии. 8
4.1. РЕТРОВИРУСЫ. 10
4.2. АДЕНОВИРУСЫ. 11
5. Искусственные транспортнные средства. 12
5.1. ПОЛИМЕРЫ. 12
5.2. ЛИПОСОМЫ. 12
6. Механизмы липофекции. 14
6.1. ДОСТАВКА ДНК К ПОВЕРХНОСТИ КЛЕТОК. 14
6.2. Взаимодействие комплексов с клеточной поверхностью и проникнование в цитоплазму. 14
6.3. Освобождение ДНК в цитоплазу и транспорт в ядро. 15
7. Моральные проблемы генной терапии. 20
8. Заключение. 22
9. Список литературы. 25
Прикрепленные файлы: 1 файл
раид.doc
Министерство образовании РФ
Пензенский государственный университет
Микробиологии , эпидемиологии и инфекционных болезней>>
Курсовая работа
Выполнил: студент Мохаммад Раед
Принимала : СТ. преподаватель
- Введение. . . . 3
- Генная терапия. . . 4
- Историческая справка. . . 6
- методы генотической трансфекции в генной терапии. 8
- РЕТРОВИРУСЫ. . . 10
- АДЕНОВИРУСЫ. . . 11
- ПОЛИМЕРЫ. . . 12
- ЛИПОСОМЫ. . . 12
- ДОСТАВКА ДНК К ПОВЕРХНОСТИ КЛЕТОК. 14
- Взаимодействие комплексов с клеточной поверхностью и проникнование в цитоплазму. . 14
- Освобождение ДНК в цитоплазу и транспорт в ядро. 15
За последние десятилетия появился совершенно новый подход к лечению заболеваний – генная терапия. Принципиальное отличие нового способа лечения от традиционных состоит в том, что он направлен на устранение первопричины заболевания, а не ее следствий. В данной статье рассмотрены основные аспекты терапии на уровне генов, приведены примеры успехов и неудач, сопутствующих становлению этого направления науки.
На современном этапе генную терапию можно определить как лечение наследственных и ненаследственных заболеваний путем введения генов в клетки пациентов с целью направленного изменения генных дефектов или придания клеткам новых функций.
Лечение заболеваний на генном уровне представляет собой весьма заманчивую перспективу. Но, как и любое вмешательство в организм человека, оно может привести к абсолютно непредсказуемым результатам.
За полувековой период развития данной области медицины был накоплен как положительный, так и отрицательный опыт использования генотерапии. Тем не менее нельзя однозначно сказать, является ли вмешательство на уровне генов благом или непоправимой ошибкой.
С момента своего зарождения концепция генной терапии вызывала множество споров. Сторонники преобразования организма на уровне генов утверждали, что данный вид лечения – медицина будущего.
Существует тяжёлое заболевание – гиперхолестеринемия. Причиной его является недостаток или дефект генов ЛПНП-рецептора – мелких структур на поверхности клеток печени, "вытягивающих" липопротеиды низкой плотности (ЛПНП), вредные для здоровья человека, из крови и ответственных за их разрушение и ответственных за их разрушение в печени. Джеймс Вильсон, бывший исследователь из Медицинской школы Мичиганского университета в Энн-Арбор, сделал попытку внедрить копии нормального гена ЛПНП-рецептора пациенту. Сначала он отделил у женщины 15% печени (6 млрд. клеток), которые были выращены в 800 чашках с питательными средствами. В них был введён искусственно выведенный безвредный вирус, содержащий нужный ген. Восприняли ген около 20% растущих клеток печени. Модифицированные клетки были введены в тело пациентки с помощью катетера в вену, ведущую непосредственно к печени, где, как рассчитывал исследователь, они присоединятся к остальным клеткам и начнут делиться. Через несколько месяцев малая печёночная биопсия показала, что новый ген функционирует в некоторых из введённых клетках печени. Более того, содержание ЛПНП в крови пациентки упало на 15-30%. Вильсон сказал, что улучшение стало достаточным для того, чтобы далее обходиться только лекарствами для дальнейшего снижения уровня ЛПНП. Решающие достижения молекулярной биологии и генетики в изучении тонкой структуры генов эукариот, их картирования на хромосомах млекопитающих, и, прежде всего человека, бурный рост в области биотехнологии и генной инженерии привели к тому, что уже в 1989 году были предприняты первые попытки лечения моногенных болезней.
Генную терапию на современном этапе можно определить как лечение наследственных, мультифакториальных и ненаследственных (инфекционных) заболеваний путём введения генов в клетки пациентов с целью направленного изменения генных дефектов или придания клеткам новых функций.
Работы по генной терапии у человека ограничены в основном соматическими тканями, поскольку манипуляции на половых или зародышевых клетках могут привести к серьёзным и непредсказуемым последствиям.
Уже разработанная и применяемая на практике методика генной терапии эффективна не только при лечении моногенных заболеваний, но и таких широко распространённых патологий мультифакториальной природы (то есть вызванными генетическими и экзогенными факторами), как злокачественные опухоли, многие виды тяжёлых вирусных, сердечно-сосудистых и др. заболеваний.
Первые клинические испытания в генной терапии прошли в мае 1989 года. Т-лимфоциты, взятые из опухоли у больного меланомой, были помечены прокариотическим геном neo, устойчивым к неомицину. Это позволило легко отделить эти клетки в культуре, а затем детально проследить их судьбу в кровотоке и избирательное накопление в опухолях.
Первым моногенным наследственным заболеванием, к которому применили методы генной терапии, стал наследственный иммунодефицит, обусловленный мутацией в гене фермента аденозиндезаминазы. 14-го сентября 1990 года в Бетесде (США) четырёхлетней девочке, страдающей этой достаточно редкой патологией (1:100000) пересадили её собственные лимфоциты, которые предварительно трансформировали in vitro геном АДА (ген АДА + ген neo + ретровирусный вектор). Лечебный эффект наблюдался в течение нескольких месяцев, после чего процедуру повторяли с интервалом в 3-5 месяцев. В результате лечения состояние пациентки настолько улучшилось, что она смогла вести нормальный образ жизни и не бояться случайных инфекций.
Большинство проектов в генной терапии (около 80%) касаются лечения онкологических заболеваний, а также ВИЧ-инфекции. Начаты клинические испытания моногенных наследственных болезней и таких как:
- Семейная гиперхолестеринемия (1992)
- Гемофилия В (1992)
- Болезнь Гоше (1993)
Программы генной терапии для клинических испытаний должны включать:
- Обоснование выбора заболевания для проведения такой терапии
- Определение типа клеток, подлежащих генетической модификации
- Схему конструирования экзогенной ДНК
- Обоснование биологической безопасности вводимой генной конструкции, включая опыты на культурах клеток и на модельных (трансгенных) животных.
- Разработку её переноса в клетки пациента
- Методы анализа работы введённых генов
- Оценки клинического (терапевтического) эффекта
- Возможные побочные последствия и методы их предупреждения.
В зависимости от способа введения экзогенной ДНК в геном пациента генная терапия может проводиться либо в культуре клеток (ex vivo), либо непосредственно в организме (in vivo). Клеточная генная терапия или терапия ex vivo предполагает:
- Выделение и культивирование специфических типов клеток пациента.
- Введение в них чужеродных генов.
- Отбор трансфецированных клеток.
- Реинфузию их тому же пациенту.
Генная терапия in vivo основана на прямом введении клонированных и определённым образом упакованных последовательностей ДНК в специфические ткани больного. Особенно перспективным для лечения генных болезней in vivo представляется введение генов с помощью аэрозольных или инъецируемых вакцин. Аэрозольная генотерапия разрабатывается, как правило, для лечения пульмонологических заболеваний (муковисцидоз, рак лёгких).
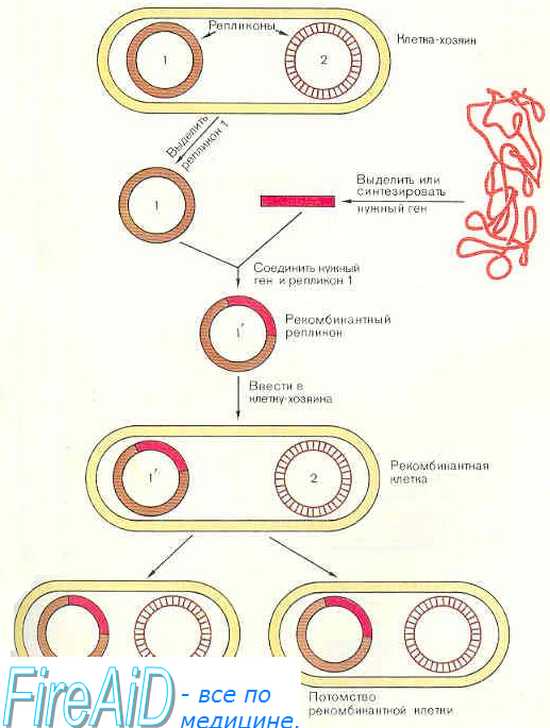
- Методы генетической трансфекции в генной терапии.
Решающим условием успешной генотерапии является обеспечение эффективной доставки, то есть трансфекции (в широком смысле) или трансдукции (при использовании вирусных векторов) чужеродного гена в клетки-мишени, обеспечение длительного функционирования его в этих клетках и создание условий для полноценной работы гена (его экспрессии).
Трансфекция может проводиться с использованием чистой ("голой"-naked) ДНК, легированной (встроенной) в соответствующую плазмиду, или комплексированной ДНК. Комплексированная – плазмидная ДНК, соединённая с солями, белками (трансферрин), органическими полимерами, или ДНК в составе вирусных частиц, предварительно лишённых способности к репликации.
Обнажённая ДНК при внутримышечном введении способна экспрессироваться в количествах, достаточных для развития иммунного ответа на появление новых белков. Этот эффект потенциально может быть использован в целях вакцинации против определённых патогенных вирусов, однако не достаточен для большинства терапевтических целей.
Для доставки генетического материала идеальной представляется "молекулярная машина", обладающая такими качествами как:
- высокая степень безопасности и надёжности в сочетании с достаточной дешевизной и возможностью широкого применения;
- способность сохранять активность при движении в русле крови в течение длительного и контролируемого времени, и при этом не распознаваться иммунной системой, не вызывать воспалительных процессов;
- высокая избирательность взаимодействия только с клетками-мишенями;
- достаточный объём генетической информации и высокая эффективность, при которой достигается экспрессия каждой доставляемой молекулы ДНК;
- возможность трансформировать заданное количество клеток от нескольких процентов до заведомо гарантированной 100%-й трансформации, что особенно важно при лечении онкологических заболеваний и некоторых вирусных инфекций;
- возможность контролировать как интенсивность, так и время экспрессии на основе данных клинического наблюдения.
Основные методы доставки чужеродных генов в клетки разделяются на физические, химические и биологические.
ФИЗИЧЕСКИЕ: микроинъекция, инъекция струёй, электропорация, замораживание-оттаивание, биобаллистика (бомбардирование клеток каплями жидкости или суспензией частичек золота с адсорбированной плазмидой).
ХИМИЧЕСКИЕ: соли некоторых катионов, например, кальция, ДЕАЕ декстран, полилизин, липосомы.
Генная диагностика. Генная терапия. Что такое генная диагностика и генная терапия? Виды генной терапии.
Генная диагностика имеет большое будущее в экспресс-диагностике инфекционных болезней. На ранних этапах инфекции, когда AT в организме ещё не выработаны, диагностика основана на идентификации Аг, в том числе специфических генов возбудителя. Для этого выявления наиболее часто применяют методы гибридизации и амплификации ДНК (см. также главу 11).
14 сентября 1990 г. была проведена первая успешная попытка коррекции генных дефектов при наследуемом Т-клеточном иммунодефиците, связанном с недостаточностью фермента аде-нозин дезаминазы. Двум больным девочкам провели пересадку собственных Т-лимфоцитов, в которые был внесён трансген — нормальный ген недостающего фермента. В результате нескольких проведённых инфузий у обеих пациенток наступило полное выздоровление. В настоящее время несколько тысяч больных несут в своём организме клетки, генетически изменённые искусственным путём.
![Генная диагностика. Генная терапия. Что такое генная диагностика и генная терапия? Виды генной терапии.]()
Виды генной терапии
В настоящее время разработаны три основных вида генной терапии, различаемых по способу доставки вектора в поражённые клетки.
Генная терапия ex vivo. Поражённые клетки выделяют из организма пациента, инкубируют с вектором, после чего генно-инженерные (генетически изменённые) клетки вносят в организм. Наиболее часто метод применяют в отношении клеток крови. Это связано с простотой их выделения и последующего обратного введения.
Генная терапия in situ. В этом случае вектор вводят непосредственно в поражённые ткани. Например, пациентам с муковисцидозом аденовирусные векторы доставляют непосредственно в трахею и бронхи; в некоторые опухоли непосредственно инъецируют вектор, несущий цитокин или токсин; в мышцу больного, страдающего мышечной дистрофией, производят инъекцию вектора, несущего ген дистрофина.
Генная терапия in vivo — вектор вводят в кровоток. До настоящего времени на практике этот метод не применяли, однако метод прост и удобен, поэтому его считают наиболее перспективным.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздравсоцразвития России
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздрава России
Генная терапия — новое направление в медицине
Журнал: Онкология. Журнал им. П.А. Герцена. 2016;5(2): 64-72
![]()
![]()
![]()
![]()
![]()
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздравсоцразвития России
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздрава России
Достижения молекулярной биологии и генетики в изучении тонкой структуры генов эукариот, картирование генов на хромосомах млекопитающих, их идентификация и клонирование, обнаружение мутаций в генах, ассоциированных с наследственными и приобретенными заболеваниями, наряду с бурным ростом в области биотехнологий, клеточных технологий и успехами генной инженерии привели к тому, что в конце прошлого века начался бум в исследованиях по анализу молекулярно-биохимических дефектов, ассоциированных с определенной патологией, который привел к пониманию того, что большинство грозных заболеваний человека сопровождается серьезными изменениями в генетическом аппарате клетки. Особенно выражены и наиболее исследованы эти изменения при злокачественных новообразованиях. Из этих данных следует логичный вывод о том, что наиболее радикальным способом борьбы с заболеваниями, вызываемыми изменениями в генетическом аппарате клеток, должны быть мероприятия, направленные непосредственно на причину заболевания, а не ее последствия.
Генная терапия — это лечение наследственных, мультифакториальных и ненаследственных (инфекционных, злокачественных и др.) заболеваний путем введения генов в соматические клетки пациентов с целью направленного изменения генных дефектов или придания клеткам новых свойств.
В 1976 г. в Университете Пенсильвания, США, Уильям Андерсон предложил использование вирусов в качестве носителей ДНК, а в 1990 г. этот исследователь в клинике Университета Пенсильвания ввел больной Ашанти ДеСильва с синдромом комбинированного иммунодефицита (СКИД) генетически модифицированные геном аденозиндезаминазы ее собственные лимфоциты, в последующие 3 года провел 23 внутривенных трансфузии и получил длительную ремиссию, а затем выздоровление.
В 1990—1999 гг. Департамент здравоохранения США за год после выздоровления Ашанти создает свыше сотни лабораторий по генной терапии, проводит более 400 клинических исследований по генной терапии, в которых принимает участие свыше 4 тыс. пациентов. Однако в 1999 г. в госпитале Университета Пенсильвании, США, происходит событие, которое резко затормозило исследования по генной терапии в США. Это — внезапная смерть 17-летнего Джесси Гелзингер в процессе лечения наследственного заболевания печени.
В то же время метод генной терапии все шире распространялся по миру и к настоящему моменту в мире проведено и проводится более 2210 клинических испытаний по генной терапии. География их широка и разнообразна. Это — Америка (63,9%), Европа (24,1%), Азия (6,0%), Австралия (1,5%), международные (4,2%) [1]. По странам имеется распределение, свидетельствующее о том, что эта технология наиболее развита в США и ряде Европейских стран.
Спектр заболеваний, при которых проводятся клинические испытания по генной терапии, также чрезвычайно широк (табл. 1). Независимо от нозологии, в области соматической генной терапии имеются общие задачи. Это:
![]()
Таблица 1. Клинические испытания в области генной терапии
— выбор наиболее эффективного для лечения гена;
— разработка способов доставки требуемого гена в нужные клетки;
— изучение и обеспечение эффективных подходов и способов нужной регуляции гена;
— вопросы длительности существования и экспрессии введенного гена;
— обеспечение безопасности больного.
Типы генов, используемых при генной терапии, разнообразны, и их выбор определяется патогенетическими механизмами развития заболевания, идентификацией наиболее болезнетворных генов.
Наиболее простая задача в выборе гена стоит при моногенных наследственных заболеваниях, то есть там, где показано, что определенный дефект в данном гене вызывает патологический процесс. Совершенно другая задача по степени сложности в выборе гена для терапии стоит при многофакториальных заболеваниях, таких как злокачественные новообразования, кардиоваскулярные болезни, при которых в патогенезе заболеваний, во-первых, пока много неясного, во-вторых, задействован ряд генов.
Для эффективной работы выбранный терапевтический ген снабжают сигнальными (регулирующими) элементами, которые необходимы для синтеза полноценной мРНК и целевого белка, а также позволяют управлять специфичностью экспрессии в определенном типе клеток или ткани, длительностью функционирования и нужной регуляцией гена в клетке (рис. 1) [2, 3].
![]()
Рис. 1. Схема генно-терапевтической конструкции.
Специфичность экспрессии генов в заданной клетке достигается конструированием векторов, несущих терапевтические гены под контролем промоторов, работающих только в данном типе клеток. К настоящему моменту выявлен ряд тканеспецифичных промоторов, обеспечивающих селективную экспрессию терапевтических трансгенов в клетках определенных органов. В экспериментальной генной терапии сердечно-сосудистых заболеваний в настоящее время используют промоторы, которые обеспечивают преимущественную экспрессию трансгена в миокарде (SM22α-промотор и др.) [4]. Разработан целый ряд тканеспецифичных промоторных систем, в которых использованы гены, высокоэкспрессированные, главным образом, в опухолевых клетках: простатспецифический и простатспецифический мембранный антигены при раке предстательной железы [5], гены, кодирующие сурфактантные белки, А и В, при раке легкого [6, 7], ген мембранно-связанного муцина MUC1/DF3 при раке молочный железы, трахеи, легкого, тонкого или толстого кишечника [8], ген α-фетопротеина — белка, синтезируемого в печени, при раке печени [9], промоторы гена сурвивина человека (hSurv) и гена обратной транскриптазы теломеразы человека (hTERT), обеспечивающих экспрессию трансгена в клетках широкого спектра опухолей [10, 11] (табл. 2).
![]()
Таблица 2. Опухолеспецифичные промоторы
Поскольку тканеспецифичные промоторы обладают общим недостатком — низким уровнем экспрессии гетерологичных генов, а также ограниченной областью применения, обусловленной их тканеспецифичностью, в настоящее время идет активный поиск промоторов генов человека, не обладающих тканевой специфичностью — универсальных или гибридных промоторов, направленных исключительно на пролиферирующие клетки и не затрагивающих нормальные дифференцированные клетки.
Одной из сложнейших проблем в генной терапии является доставка требуемого гена в нужные ткани при минимизации его контакта с биологическими средами организма до достижения клетки-мишени, а также обеспечение доставки гена в нужную клетку с целью его эффективной и безопасной работы в ней.
![]()
Рис. 2. Системы доставки генетического материала в клетку. (Адаптировано по: Thomas SM, Grandis JR. The Current State of Head and Neck Cancer Gene Therapy. 2009; Y20: 1565—1575 [12])
Альтернативным способом доставки терапевтических генов является использование векторов вирусной, бактериальной и химической природы. Вектор должен эффективно и специфически трансфицировать/трансдуцировать делящиеся и неделящиеся таргетные клетки, экспрессировать трансген в адекватных количествах в течение длительного времени, производиться легко и рентабельно по количеству и качеству, не быть иммуногенным и использоваться для повторного введения гена, являться безопасным при введении и не иметь побочных эффектов.
В качестве векторов для доставки генетического материала в клетку-мишень используют самые разнообразные вирусы, но наиболее распространены векторы на основе аденовируса (ADV), аденоассоциированного вируса, ретро- (RV), лентивируса (LV) и вируса простого герпеса (HSV) (табл. 3). При этом нативные полные вирусные частицы никогда не используются в качестве векторов, так как в этом случае есть опасность встраивания их генетического материала в клетки хозяина с целью приобретения метаболических и биосинтетических продуктов для вирусной транскрипции и репликации. Поэтому вирусы предварительно подвергаются существенной генетической модификации, приводящей к утере их репликационной способности и повышению тропизма к тканям и клеткам.
![]()
Таблица 3. Вирусные векторы для генной терапии
Вирусные векторы достаточно хорошо изучены, они имеют высокую эффективность трансфекции in vivo, для их наработки существуют коммерческие паковочные клеточные линии. Векторы на основе аденовируса и аденоассоциированных вирусов не встраиваются в геном клетки, а остаются эпихромосомными. Это уменьшает опасность мутагенеза, который может быть индуцирован при внедрении вируса в геном. При конструировании специфически направленных аденовирусных векторов эффективной оказалась замена вирусных промоторов, контролирующих основные транскрипционные области, так называемыми транскрипционными регуляторами, в результате чего экспрессия гена и репликация вируса происходят преимущественно в целевых клетках [14, 15].
Ретровирусные векторы интегрируют в геном хозяина, что при генной терапии обеспечивает стабильность и стойкую экспрессию трансгена в дочерних клетках, однако несет риск инсерционного мутагенеза, который может вызывать инактивацию генов-супрессоров опухолевого роста или активации онкогенов [16].
Несмотря на описанные недостатки, вирусный метод доставки трансгенов в клетки успешно развивается и в настоящее время является доминирующим: около 70% клинических исследований посвящено изучению генетических конструкций, снабженных вирусными векторами.
В то же время в последние годы активно разрабатываются невирусные системы доставки генетического материала с использованием высокомолекулярных химических соединений для конденсации с ДНК: липидсвязанные комплексы — липоплексы либо поликатионные комплексы, имитирующие поверхность вируса — полиплексы (табл. 4). Эти наночастицы защищают плазмидную ДНК в межклеточном пространстве от деградации нуклеазами и облегчают проникновение в клетки-мишени. Положительно заряженные комплексы связываются со специфическими рецепторами (при наличии на их поверхности макромолекул, обладающих свойствами специфического лиганда) или непосредственно с поверхностью клетки. Комплексы проникают в клетку по механизму эндоцитоза. После высвобождения из эндосомы и разборки комплекса нуклеиновая кислота проникает через поры в ядро клетки [20].
![]()
Таблица 4. Невирусные векторы для генной терапии
Невирусные системы на основе катионных липидов или полимеров имеют ряд преимуществ перед вирусными системами доставки: большой объем несущей ДНК, отсутствие какой-либо вирусной составляющей, а следовательно, низкая иммуногенность, высокая технологичность производства. Однако низкая трансфицирующая способность невирусных векторов и недостаток информации о безопасности у человека тормозят развитие исследований в этом направлении, только 5,2% приходится на клинические испытания, где в качестве системы доставки терапевтических генов используют липоплексы или полиплексы.
К настоящему моменту сформировалось два типа геннотерапевтического воздействия: индивидуализированный подход ex vivo — трансфекция стволовых гемопоэтических клеток, полученных из периферической крови и трансплантированных затем больному, и in vivo — трансфекция клеток внутри организма, куда генетический материал в составе вектора доставляется в результате внутривенной или внутриартериальной (в печеночную артерию) инфузии, внутримышечного, подкожного, интратуморального, интраназального или сублингвального введения. В практике лечения сердечно-сосудистых заболеваний испытываются прямые игольные инъекции конструкций в миокард, введение вирусных векторов при помощи разнообразных катетеров, использование стентов с покрытиями, обеспечивающими дозированный выход лекарственного средства. В онкологии используют, как правило, внутриопухолевое введение целевого гена в составе различных векторов.
![]()
Таблица 5. Подходы к генной терапии онкологических заболеваний
Представления о патогенезе злокачественных новообразований, в основе которого, в том числе, лежат активация онкогенов и инактивация генов-супрессоров опухолевого роста, позволяют искать пути подавления или восстановления функции этих генов.
К настоящему моменту известно более 24 генов-супрессоров, среди них наиболее изученным является ген р53, контролирующий клеточный цикл и поврежденный в ≈50% опухолей человека [21]. Так, коррекционная замена мутантного гена p53 в опухолевых клетках геном дикого типа (не содержащим мутаций) с помощью методов генотерапии приводила к восстановлению функций белка p53 и инициации процессов, запускающих программированную гибель злокачественных клеток. Клинические испытания аденовирусного вектора Ad-p53 показали, что восстановление дикого типа р53 путем доставки гена при помощи дефектного по репликации Ad приводило к значительному противоопухолевому эффекту на фоне низкой общей токсичности [22]. Более того, восстановление р53 сопровождалось увеличением чувствительности опухолевых клеток к химио- и радиотерапии [23].
Наиболее успешным онколитическим препаратом является OncoVexGMCSF на основе вируса простого герпеса, который проходит II/III фазы клинических испытаний для лечения меланомы, рака молочной железы, опухолей головы и шеи. В геноме этого вируса сохранен ген тимидинкиназы для проведения GDEPT, но удалены обе копии ICP34.5 гена, отвечающего за вирусную репликацию в нормальных клетках, а в область ICP47 встроен ген GM-CSF. Продуцируемый GM-CSF привлекает дендритные клетки (DC) и может стимулировать выброс цитотоксических Т-лимфоцитов [35].
Следует отметить, что современная стратегия развития иммунотерапии рака на фоне расширяющихся знаний о функционировании иммунной системы и формировании иммунного ответа является главной предпосылкой для усовершенствования подходов к лечению с привлечением инновационных лекарственных средств, созданных методами генной инженерии, таких как генные вакцины.
Исследования в этой области ведутся в трех направлениях: модификация опухолевых клеток для придания им большей иммуногенности, введение генов опухолеассоциированных антигенов в дендритные клетки, геномодификация лимфоцитов для повышения цитотоксического ответа.
Метод, известный как технология химерных антигенных рецепторов, или CAR-технология (от англ. chimeric antigen receptor), в настоящее время является одним из наиболее перспективных и быстро развивающихся направлений в области иммунотерапии злокачественных новообразований [42]. Эта технология заключается в выделении из периферической крови пациента Т-лимфоцитов и их двухкомпонентной модификации в условиях ex vivo: присоединение к их поверхности рецептора, распознающего экспрессируемый большинством лейкемических клеток белок CD19, и введение мощного внутриклеточного механизма, запускающего активный рост и деление клеток в ответ на их взаимодействие с белком-мишенью. Такие генномодифицированные Т-лимфоциты возвращают в кровоток пациента. Предварительные результаты исследований свидетельствуют о том, что этот подход позволяет получить хорошие результаты у 2/3 пациентов, не ответивших на традиционные методы лечения [43—45].
![]()
Таблица 6. Официнальные препараты для генной терапии различных заболеваний
Заключение
Таким образом, использование метода генной терапии может быть результатом уже не столь отдаленного будущего, но говорить о реальных перспективах этого направления в медицине, по-видимому, пока преждевременно. Несмотря на то, что большинство клинических испытаний свидетельствует об относительной безопасности геннотерапевтических препаратов, требуется время для окончательного доказательства их эффективности. Возможно, в будущем метод генной терапии станет основным в лечении наследственных заболеваний, а для заболеваний онкологического профиля генная терапия будет рассматриваться как часть комплексного противоопухолевого лечения.
![]()
За последние десятилетия появился совершенно новый подход к лечению заболеваний. Этот подход носит название генная терапия. Принципиальное отличие нового способа лечения от традиционных состоит в том, что он направлен на устранение первопричины заболевания, а не её следствий. На современном этапе генную терапию можно определить как лечение наследственных и ненаследственных заболеваний путём введения генов в клетки пациентов с целью направленного изменения генных дефектов или придания клеткам новых функций. Лечение заболеваний на генном уровне представляет собой весьма заманчивую перспективу. Но, как и любое вмешательство в организм человека, оно может привести к абсолютно непредсказуемым результатам. За полувековой период развития данной области медицины был накоплен как положительный, так и отрицательный опыт использования генотерапии. Тем не менее, нельзя однозначно сказать, является ли терапия на уровне генов благом или непоправимой ошибкой. В данной работе рассмотрены основные аспекты генотерапии, приведены примеры успехов и неудач, сопутствующих становлению этой области. С момента своего зарождения концепция генной терапии вызывала множество споров. Сторонники преобразования организма на уровне генов утверждали, что за данным видом лечения стоит будущее медицины. Противники же приводили ряд опасений, основанных на том, что человек слишком мало знает, чтобы вмешиваться в епархию Бога. По прошествии нескольких десятков лет споры не только не утихли, но и разгорелись с новой силой, оппоненты получили весомые аргументы, основанные на победах и поражениях исследователей в этой области.
Генная терапия достигла некоторых успехов в борьбе с опухолевыми заболеваниями. К настоящему моменту разработаны несколько основных подходов. Прежде всего, это нормализация работы онкогенов и супрессоров опухолей. Не менее перспективным представляется и другой подход, связанный с обучением иммунной системы распознавать антигены раковых клеток. На этом принципе основано создание противоопухолевых вакцин. Так, для лечения рака простаты широко применяют стратегию замены генов-супрессоров опухолей p53, H-ras, Rb, p21, антисмысловые олигонуклеотиды к гену Bcl2 (для супрессии антиапоптотических генов), традиционные гены-самоубийцы (вирусная тимидинкиназа или цитозин-дезаминаза), а также гены, корректирующие чувствительность опухолевых клеток к андрогенам. Не менее перспективным представляется и другой подход, связанный с обучением иммунной системы распознавать антигены раковых клеток. Поскольку иммунная система не способна сама распознавать и элиминировать раковые клетки, задача учёных сводится к приданию ей этих свойств. На этом принципе основано создание противоопухолевых вакцин.
Ощутимые результаты получены в области нейродегенеративных заболеваний, таких как болезнь Паркинсона, хорея Гентингтона и др. В данном случае принцип генотерапевтического вмешательства, находящегося на стадии клинических испытаний, основан на введении в определённые подкорковые отделы мозга культуры клеток, синтезирующих набор белков, которые препятствуют дегенерации нервных клеток. Кроме того, нельзя не отметить достижения генотерапевтических подходов в лечении ВИЧ-инфицированных больных, в кардиологии, а также в ряде других заболеваний.
Потрясающие успехи генной терапии сопровождают и весомые неудачи. В 2003 году FDA приняло решение о временном прекращении клинических испытаний с использованием ретровирусов на стволовых клетках крови. Причиной послужило развитие лейкемии у двух из десяти детей, подвергнутых терапии тяжелого комбинированного иммунодефицита (SCID). Было выяснено, что побочный эффект является следствием того, что вирус, использованный для доставки терапевтического гена, активировал онкоген. В апреле 2004 года FDA, учитывая достигнутые успехи этого вида генной терапии, все же ослабило запрет на её проведение, разрешив применение ретровирусных векторов для лечения тех больных, для которых другие способы оказались неэффективны.
Генная терапия способна дать человечеству мощный инструмент для перехода медицины на совершенно новый уровень развития. Там, где методы традиционной медицины оказались бессильны, на помощь пришла генотерапия, дав возможность выздоровления неизлечимо больным. Тем не менее, нельзя отрицать, что, имея в своих руках такое мощное оружие, как способность изменять гены, человечество встаёт перед проблемой грамотного использования этой технологии. Уже сейчас теоретически вполне возможны модификации генома с целью улучшения некоторых физических, психических и интеллектуальных параметров. Современная наука на своём новом витке развития вернулась к идее улучшения человеческой породы, что само по себе опасно.
При использовании генной терапии непременно должно соблюдаться условие: все генотерапевтические мероприятия должны быть направлены только на конкретного больного, и касаться только соматических клеток. Современный уровень знаний не позволяет проводить коррекцию генетических дефектов в клетках зародышевого пути в виду опасности засорения генофонда нежелательными искусственными генными конструкциями или внесением мутаций с непредсказуемыми последствиями для будущего человечества. Генная терапия представляет собой достаточно дорогостоящее лечение, которое вряд ли удастся сделать доступным широким массам. Кроме того, применение генной терапии к клеткам зародышевого пути ущемляет право будущих поколений на наследование природного немодифицированного генома.
Наличие трудностей, связанных с разработкой и внедрением генотерапевтических подходов, существенно тормозит развитие этой отрасли. Накапливается множество примеров разных эффектов применения одной и той же терапии на животных и человека. Например, введение аденовирусных векторов экспериментальным животным сопровождается быстрой продукцией противовирусных антител, в то время как для человека такой острый иммунный ответ не характерен. Бывают и обратные ситуации. Так у одного из пациентов с муковисцидозом, которому в дыхательные пути вводили аденовирусный вектор с CFTR (трансмембранный регулятор муковисцидоза), развился воспалительный синдром, хотя у мышей при дозах препарата на три порядка выше никаких побочных эффектов не наблюдалось.
Таким образом, терапевтический потенциал геномных преобразований поистине огромен, однако, не следует забывать о подстерегающих опасностях. Наряду с разработкой методологической экспериментальной базы для генотерапии, следует обратить внимание на решение ряда вопросов социального и этического характера. Несмотря на почти полувековую историю развития генной терапии, данная отрасль всё ещё находится на начальном этапе своего становления. С момента возникновения она приковывала к себе внимание людей по всему миру. Проникнув в область, ранее не доступную человечеству, генная терапия открыла фантастические перспективы. Она наделила людей способностью вносить изменения на уровне генов, дав им возможность победить ранее неизлечимые заболевания. Однако вместе с тем, генотерапия подарила человечеству мощное и опасное оружие, способное принести больше вреда, чем пользы. Учёным предстоит прояснить ещё множество аспектов научного, этического, социального и экономического характера. Никто не знает, какие открытия ещё предстоят и что они принесут с собой. Тем не менее, не вызывает сомнений, что за развитием генотерапевтических подходов к лечению болезней стоит будущее.
Читайте также: