Электролиттік диссоциация теориясы реферат
Обновлено: 04.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам

Описание презентации по отдельным слайдам:

Адамнан ғылым айла асырмаған, құпиясын құлыптап жасырмаған. Кел, бәріміз ғылымның тілін зерттеп, Бір жұмбағын ашайық ашылмаған .


Электролиттік диссоциация теориясы

Фарадея терминдері Майкл Фарадей (1791 -1867) Ион- Катион- Анион- Электролит- Катод- Анод- Электролиз- Диэлектрдік өткізгіштік - 1833-1834 гг.


ЭДТ-сының ашылуы Рудольф Клаузиус 1857 ж. Р. Клаузиус электрөткізгіштік теориясын жасады. Тоқ күшінің әсерінен ерітінде иондар пайда болады..


Ерітінділері мен балқымалары электр тоғын өткізеді Заттар Электрөткізгіштік Электролиттер Бейэлектролиттер Ерітінділері мен балқымалары электр тоғын өткізбейді

Иондық немесе ковалентті күшті полюсті байланыс Негіздер Қышқылдар Тұздар Ковалентті полюссіз немесе әлсіз полюсті байланыс Органикалық қосылыстар Газдар Бейметалдар Электролиттер Бейэлектролиттер

Электролиттік диссоциация теориясы С. А. Аррениус (1859-1927) процесс растворения электролитов сопровождается образованием заряженных частиц, способных проводить электрический ток Электролиттердің еру немесе балқу процессі электр тогын өткізе алатын зарядталған бөлшектер түзе жүретін процесс

1. Электролиттік диссоциация-электролиттердің суда ерігенде оң және теріс зарядталған иондарға ыдырауы. 2. Электр тоғының әсерінен теріс полюсқа оң зарядталған иондар жылжиды(катиондар), ал оң полюсқа теріс зарядталған иондар жылжиды(аниондар). 3. Диссоциация – қайтымды процесс. Молекулалардың иондарға ыдырау процесімен қатар иондардың молекулалар процесі жүреді.(ассоциация)




Натрий хлориді кристалдарының құрылысы қант кристалдары құрылысынан мүлде өзгеше Ас тұзы суда ерігенде заряды бар бөлшектер – иондар түзіліп,электр тоғын тасымалдайды ал, Қант ерігенде зарядсыз бөлшектер – молекулаларға дейін ғана ыдырайтындықтан,электр тоғын тасымалдай алмайды.


Иондық қосылыстардың диссосиациялануы

Гидратталған иондар-ерітіндіге өтеді

Гидраттанған иондар Гидраттану реакциясының мәнін алғаш ашқан орыс ғалымы И.А Каблуков Гидраттану нәтижесінде кристаллогидраттар түзіледі. Кристалл торында өз молекулаларымен және иондарымен қоса су молекулалары да болады ондай су кристалдық су деп аталады. Мысалы: MgSO4 *10H2O

Ковалентті полюсті байланысқан қосылыстардың диссоциациясы

Электролиттік ыдырау нәтижесінде түзілген гидратталған иондардыңдың қысқашадиссоциация теңдеуі.

Егер электролит молекуласында әртүрлі полюсті байланыс болса , бірінші кезекте күшті полюсті байланыспен байланысқандары диссоциацияға ұшырайды NaHSO4 Na+ + HSO4- H++SO4-2

Диссоциацияға ұшыраған молекулалар санының жалпы молекулаларға қатынасы Электролиттердің күші

Күшті, әлсіз электролиттер электро лит табиғатына t ° с байланысты Тұздар Сілтілер HCl, HBr, HI H2SO4 HNO3 HClO4, HClO3 H3PO4 HF HNO2 H2SO3 Органикалық қышқылдар Н2S H2SiO3 H2CO3 HCN Әлсіз 30%

бейэлектролит Күшті электролит Әлсіз электролит


Күшті электролиттер Суда еритін орта тұздар Сілтілік және сілтілік жер металдарының гидроксидтері LIOH-CsOHCa(OH)2- --Ba(OH)2 Минералды қышқылдар H2SO4,HNO3,HCIO3,HCIO4 HBrO3,HJO3,HCI,HBr,HJ

Күші орташа электролиттер H3PO4 HPO3,HCIO2, H4P2O7,H2SO3,HF,Fe(OH)2

Әлсіз электролиттер Органикалық қышқылдар HCOOHCH3COOH, C2H5COOH, Минералдықышқылдар HNO2, HCIO, , H2SiO3, H2CO3H3BO3,H3PO3,H2S Белсенділігі аз металдардың гидроксидтері Cu(OH)2, Fe(OH)3,Ae(OH)3, Cr(OH)3, NH4OH

Температураны көтерген сайын диссоциациялану дәрежесі артады Концентрацияны көтерген сайын электролиттердің диссоциациялану дәрежесі кемиді

Диссоциациялану Константасы Әлсіз электролиттің иондарға ыдырау қабілеттілігін көрсетеді

Негіздік және қышқылдық тұздар анықтамасын беру. Н+ ОН- R- Me+ Қышқыл + + Негіз + + Орта тұз + + Негіз тұз + + + Қышқыл тұз + + +

Вильгельм Оствальд (Ostwald W.F.) (2.IX.1853 - 4.IV.1932) Оствальдың сұйылту заңы K ~ α2 C Ерітіндіні сұйылту кезінде диссоциация деңгейі жоғарылайды K = α2 C/ 1- α α
- подготовка к ЕГЭ/ОГЭ и ВПР
- по всем предметам 1-11 классов
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 932 человека из 80 регионов

Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 27 человек из 18 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- ЗП до 91 000 руб.
- Гибкий график
- Удаленная работа
Дистанционные курсы для педагогов
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 602 722 материала в базе
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
Свидетельство и скидка на обучение каждому участнику
Другие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарий
- 22.10.2015 5830
- PPTX 2.1 мбайт
- 77 скачиваний
- Рейтинг: 4 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Жолмагамбет Мендегуль Жакиевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
40%
- Подготовка к ЕГЭ/ОГЭ и ВПР
- Для учеников 1-11 классов
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Инфоурок стал резидентом Сколково
Время чтения: 2 минуты
Минпросвещения России подготовит учителей для обучения детей из Донбасса
Время чтения: 1 минута
Школьник из Сочи выиграл международный турнир по шахматам в Сербии
Время чтения: 1 минута
Университет им. Герцена и РАО создадут портрет современного школьника
Время чтения: 2 минуты
В ростовских школах рассматривают гибридный формат обучения с учетом эвакуированных
Время чтения: 1 минута
В Белгородской области отменяют занятия в школах и детсадах на границе с Украиной
Время чтения: 0 минут
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.

C. Аррениус теориясын толы?тыр?ан ?алымдар - И.А. Каблуков, В.А. Кистяковский, Д.И. Менделеев. Диссоциацияланатын заттар электролиттер, ал диссоциация?а ?шырамайтын заттар бейэлектролиттер. Т?здар, ?ыш?ылдар, негіздер ерігенде ж?не бал?ы?анда иондар?а ыдырайды. ерітінділер мен бал?ымаларды? ток ?ткізгіштігі осы иондарды? концентрациясына т?уілді болады, оларды? о? зарядтал?аны катод?а тартылатынды?тан катиондар деп, ал анод?а тартылатындары аниондар деп аталады.
құпиясын құлыптап жасырмаған.
Кел, бәріміз ғылымның тілін зерттеп,
Бір жұмбағын ашайық ашылмаған .

Электролиттік диссоциация

Электролиттік диссоциация теориясы

1833-1834 гг.
Диэлектрдік өткізгіштік -
Майкл Фарадей
Менделеевтің ерітінділер теориясы
1865-1887 ж. Ерітіндінің гидраттану теориясы
1865 г. Докторлық диссертация
1887 г. «салмақтары арқылы
233 затты құрамындағы тығыздықтары арқылы анықтады
H 2 SO 4 H 2 O
H 2 SO 4 6 H 2 O
H 2 SO 4 150 H 2 O

1857 ж. Р. Клаузиус электрөткізгіштік теориясын жасады.
Тоқ күшінің әсерінен ерітінде иондар пайда болады..
Электролиттік диссоциация теориясы
1883 г. – диссертацияны қорғау
Полюсті еріткіштің әсерінен электролиттер
ерітіндіде иондарға ыдырайды.
Электролититік диссоциация
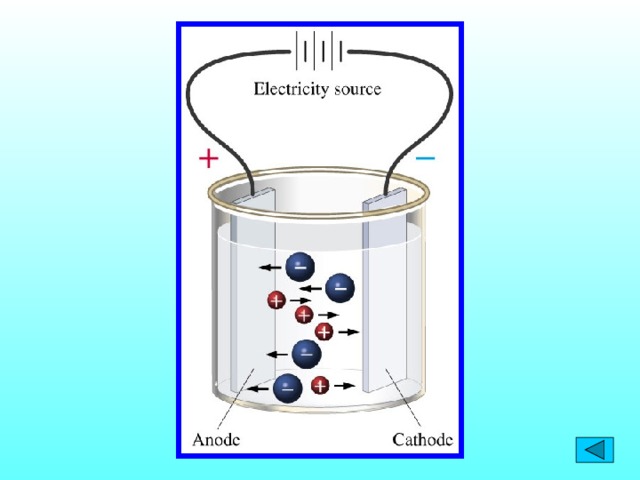
Ионы существенно отличаются от атомов.
В растворе ионы движутся хаотично.
При пропускании через раствор электролита постоянного
электрического тока ионы перемещаются направленно:
катионы к катоду, анионы к аноду.
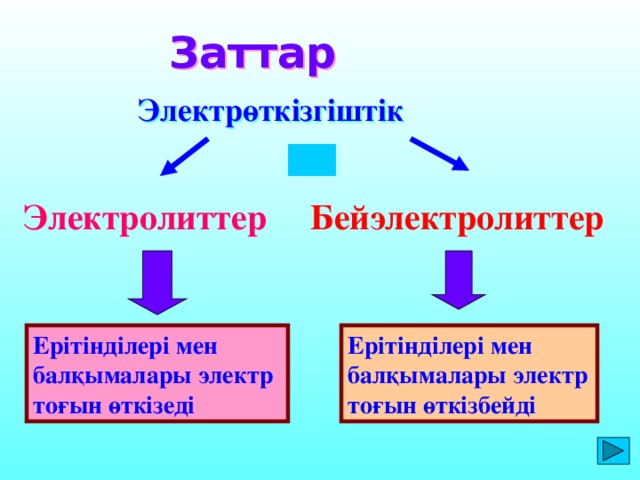
Электрөткізгіштік
Электролиттер
Бейэлектролиттер
Ерітінділері мен балқымалары электр тоғын өткізеді
Ерітінділері мен балқымалары электр тоғын өткізбейді
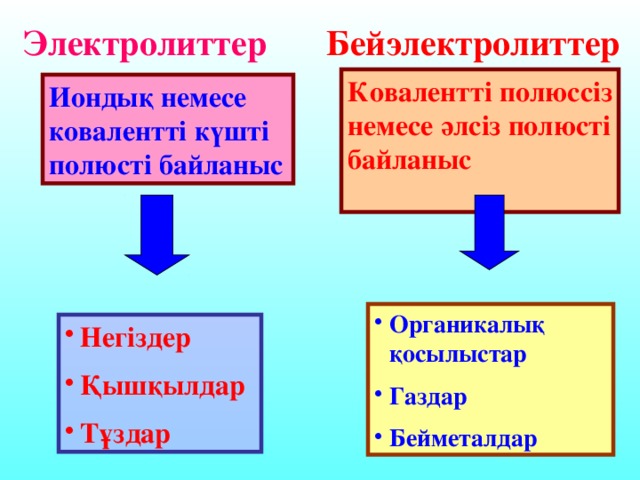
Бейэлектролиттер
Электролиттер
Ковалентті полюссіз немесе әлсіз полюсті байланыс
Иондық немесе ковалентті күшті полюсті байланыс
Электролиттік диссоциация теориясы
Электролиттердің еру немесе балқу процессі электр тогын өткізе алатын зарядталған бөлшектер түзе жүретін процесс
процесс растворения электролитов сопровождается образованием заряженных частиц, способных проводить электрический ток
С. А. Аррениус (1859-1927)

1. Электролиттік диссоциация-электролиттердің суда ерігенде оң және теріс зарядталған иондарға ыдырауы.
2. Электр тоғының әсерінен теріс полюсқа оң зарядталған иондар жылжиды( катиондар ), ал оң полюсқа теріс зарядталған иондар жылжиды( аниондар ).
3. Диссоциация – қайтымды процесс. Молекулалардың иондарға ыдырау процесімен қатар иондардың молекулалар процесі жүреді.( ассоциация )


Натрий хлориді кристалдарының құрылысы қант кристалдары құрылысынан мүлде өзгеше
Заттардың суда диссоциациялану себептері
1. Су- полюсті молекула
2. Су, иондар арасындағы әрекеттесуді 81 есе әлсіретеді .
Кристалл торы бұзылады

Балқымаларда заттардың иондарға ыдырау себептері
Қыздырғанда кристал торларының түйіндерінде орналасқан иондар тербелісі күшейеді – кристалл торы бұзылады .
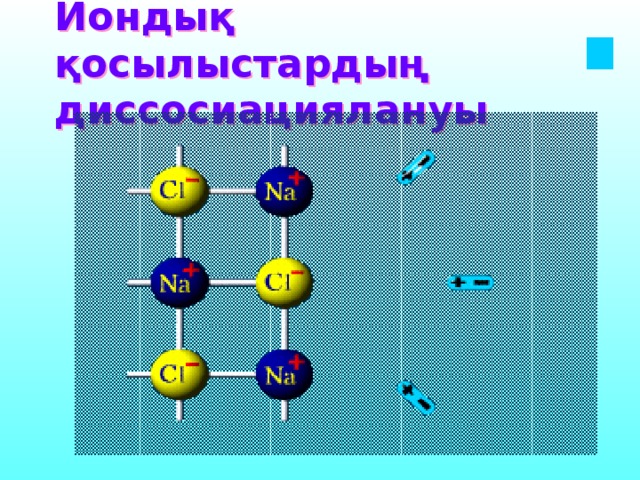
Иондық қосылыстардың диссосиациялануы
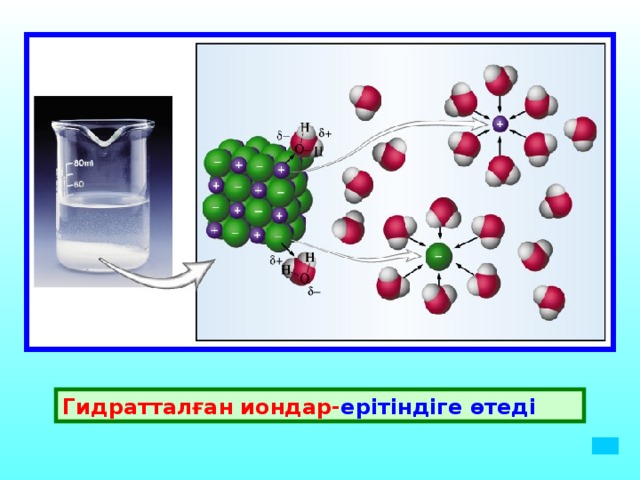
Гидратталған иондар- ерітіндіге өтеді

- Гидраттану реакциясының мәнін алғаш ашқан орыс ғалымы И.А Каблуков
- Гидраттану нәтижесінде кристаллогидраттар түзіледі.
- Кристалл торында өз молекулаларымен және иондарымен қоса су молекулалары да болады ондай су кристалдық су деп аталады. Мысалы : MgSO 4 *10H 2 O
Ковалентті полюсті байланысқан қосылыстардың диссоциациясы

Электролиттік ыдырау нәтижесінде түзілген гидратталған иондардыңдың қысқашадиссоциация теңдеуі.
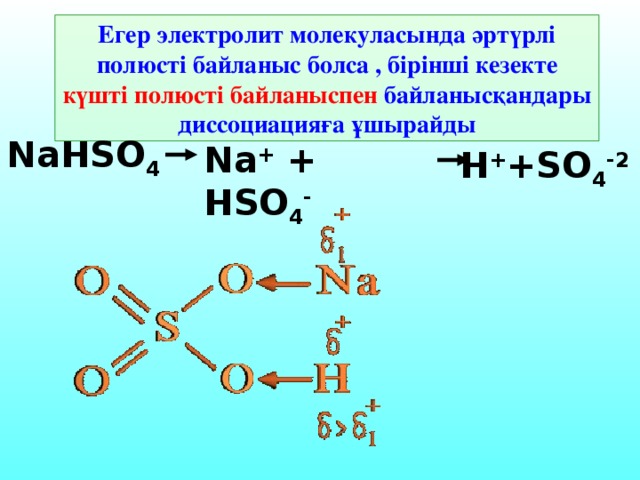
Егер электролит молекуласында әртүрлі полюсті байланыс болса , бірінші кезекте күшті полюсті байланыспен байланысқандары диссоциацияға ұшырайды
NaHSO 4
Na + + HSO 4 -
H + +SO 4 -2

Диссоциацияға ұшыраған молекулалар санының жалпы молекулаларға қатынасы
Электролиттердің күші
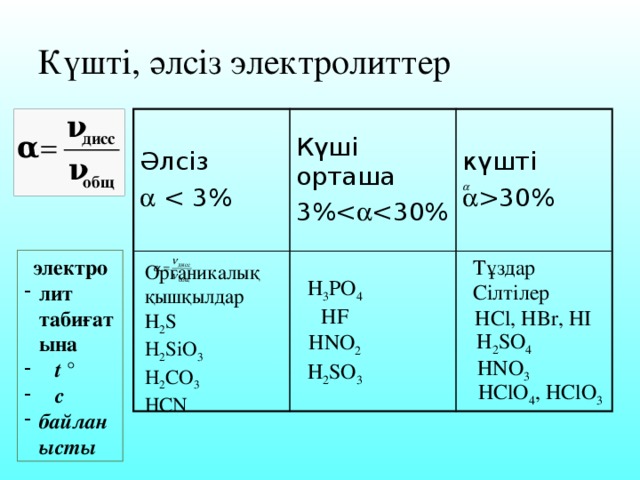
30% электро Тұздар лит табиғатына t ° с байланысты Органикалық қышқылдар Н 2 S H 2 SiO 3 H 2 CO 3 HCN H 3 PO 4 HF HNO 2 H 2 SO 3 Сілтілер HCl, HBr, HI H 2 SO 4 HNO 3 HClO 4 , HClO 3" width="640"

Білімділік – оқушылардың электролиттік диссоциация теориясы тақырыбы бойынша алған білімдерін практикалық іс-әрекетте пайдалана білу, реакция теңдеулерін жазу дағдысын жетілдіру.
Дамытушылық – оқушылардың ой өрісін, есте сақтау қабілетін, тұлғалық қасиеттерін қалыптастыра отырып дамыту.
Тәрбиелік – оқушыларға саналы да терең тиянақты білім бере отырып, өз бетінше шығармашылықпен ізденуге тәрбиелеу.
Сабақтың құрал жабдығы, реактивтер: интерактивті тақта, компьютер, Zn, HNO3, HCl, ZnCl2, NaOH, BaCl2, H2SO4, CaCO3 лакмус қағазы пробиркалар, пиипетка, кеспе қағаздар т.б
Сабақтың түрі: білімді қорытындылау, жүйеге келтіру.
Сабақтың әдісі: интерактивті, аралас
Сабақтың пәнаралық байланысы: биология, медицина, экология.
Сабақтың барысы:
4.Білімқұмарлар мен зеректер
7.Өз қолыммен жасасам түсінемін (практикалық жұмыс)
9.Үйге тапсырма
1.Ұйымдастыру кезеңі: сабақтың мақсатымен таныстыру
2.Сергіту сәті:
3.Фронтальді сұрақтар:
ЭДТ тұрғысынан негіздер,қышқылдар,тұздар дегеніміз не?
Электролит дегеніміз не?
Бейэлектролит дегеніміз не?
Әлсіз,орташа,күшті электролиттер дегеніміз не?
Бейтараптану реакциясына анықтама бер.
Тұздар гидролизі дегеніміз не?
Күшті негіз бен күшті қышқылдан құралған тұздарды ата
Күшті негіз бен әлсіз қышқылдан құралған тұздар
Әлсіз негіз бен күшті қышқылдан құралған тұздар
Қышқыл ортада түстерін қызылға өзгертетін индикатор
4.Білімқұмарлар мен зеректер
1.Жазба жұмысын тексеру
2.Кім жүйрік?
1.Массасы 6,4г күкірт жанғанда неше литр (қ.ж) күкірт(IV) оксиді түзіледі.
2.Массасы 200г темір сульфиді ертіндісін массасы 8г натрий гидроксидің ертіндісімен араластырғанда неше грамм тұнба түзіледі.
3.Оқулықпен жұмыс:
6.Бейнезертхана
4.CaCO3 +2HCl = CaCl2 + CO2+ H2O
7.Өз қолыммен жасасам түсінемін (практикалық жұмыс)
Zn + 2HCl = ZnCl2 + H2
1.Мына заттар ерітінділері арасында жүретін реакцияны жазыңдар?
2.Мына айналуларды іске асырыңдар
3.Төменедегі қысқартылған иондық теңдеулері берілген реакциялардың толық молекулалық және толық иондық теңдеулерін жазыңдар?
б) Ba 2+ +SO4 2- =BaSO4
8.Қорытынды
9.Үйге тапсырма
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A - (анион)
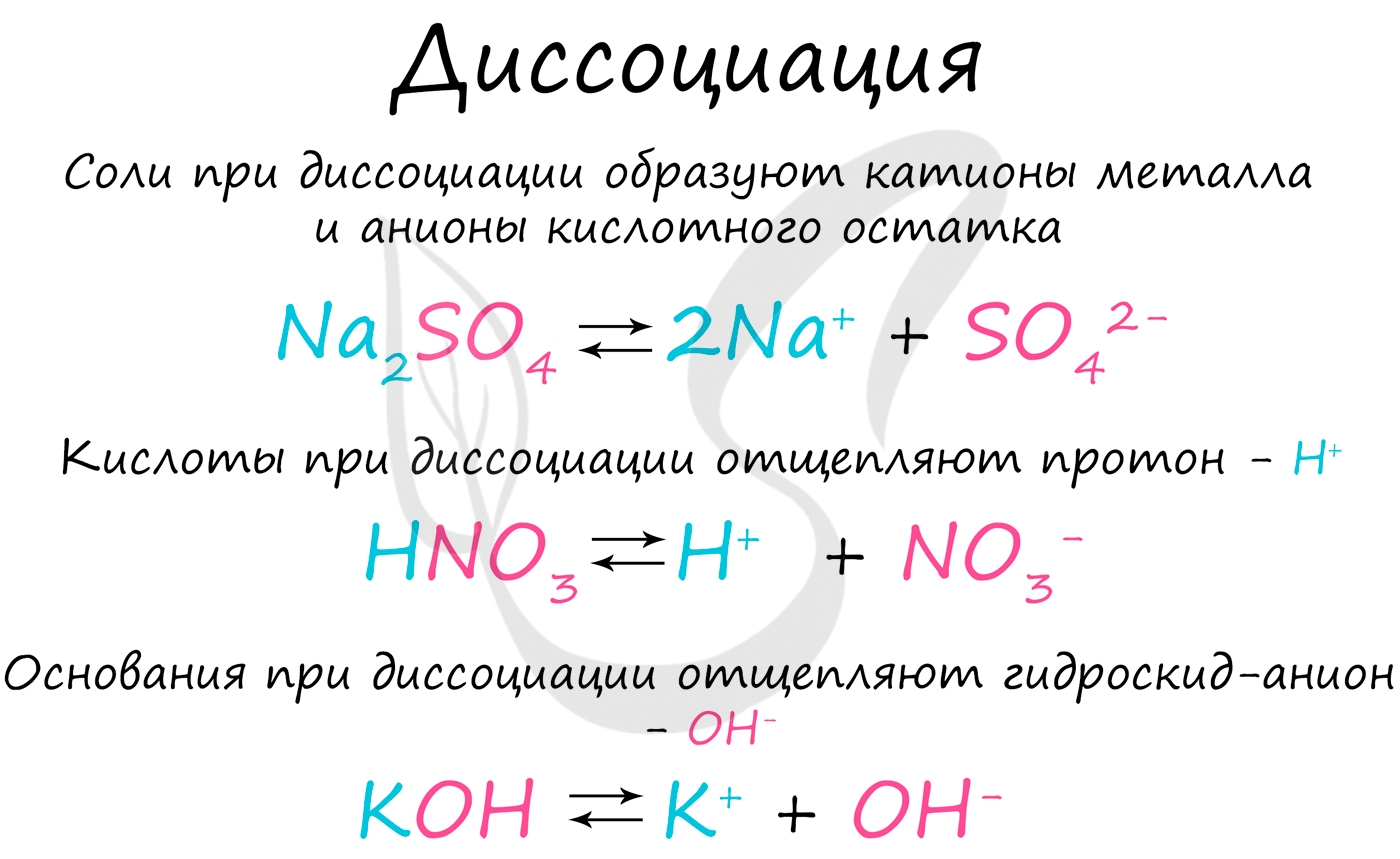
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
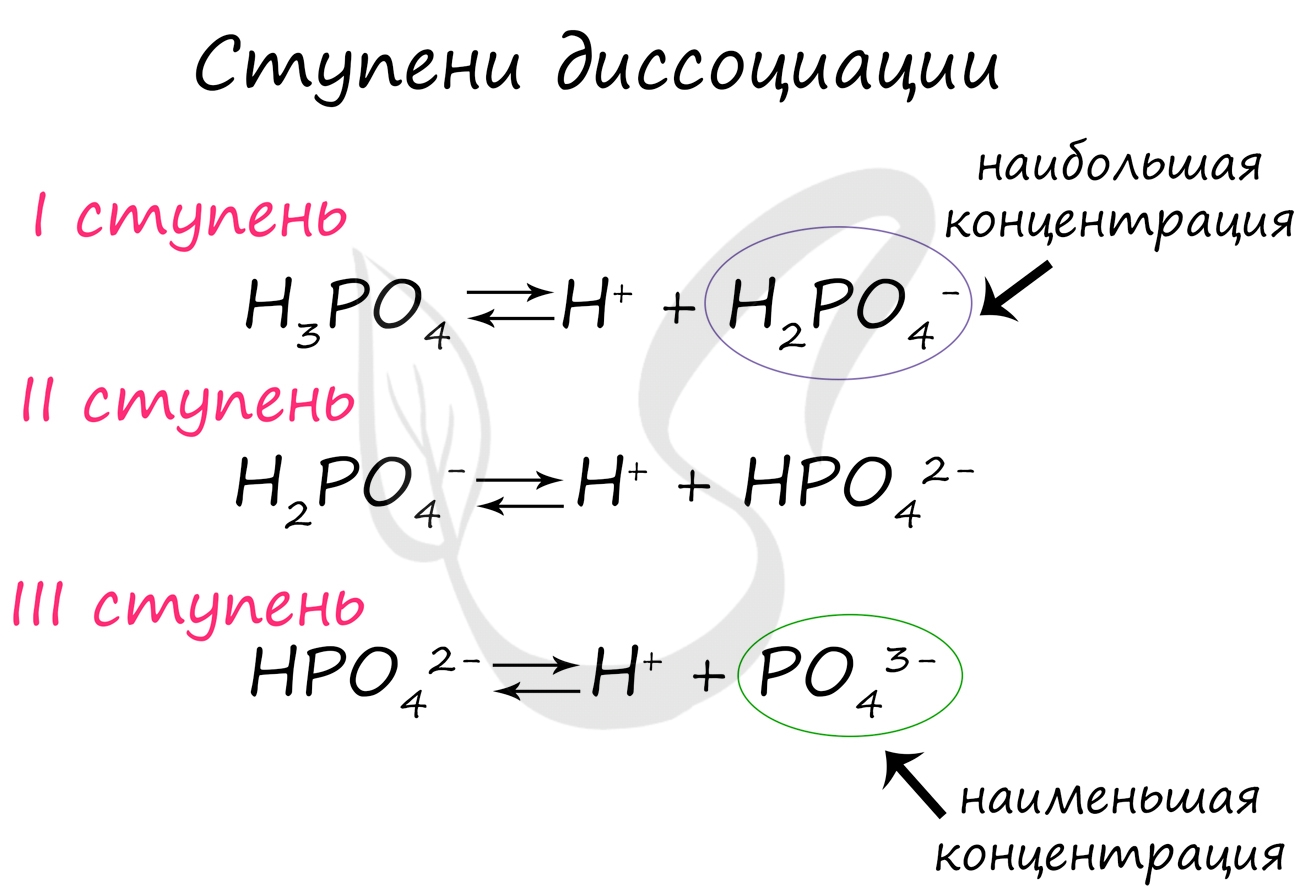
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
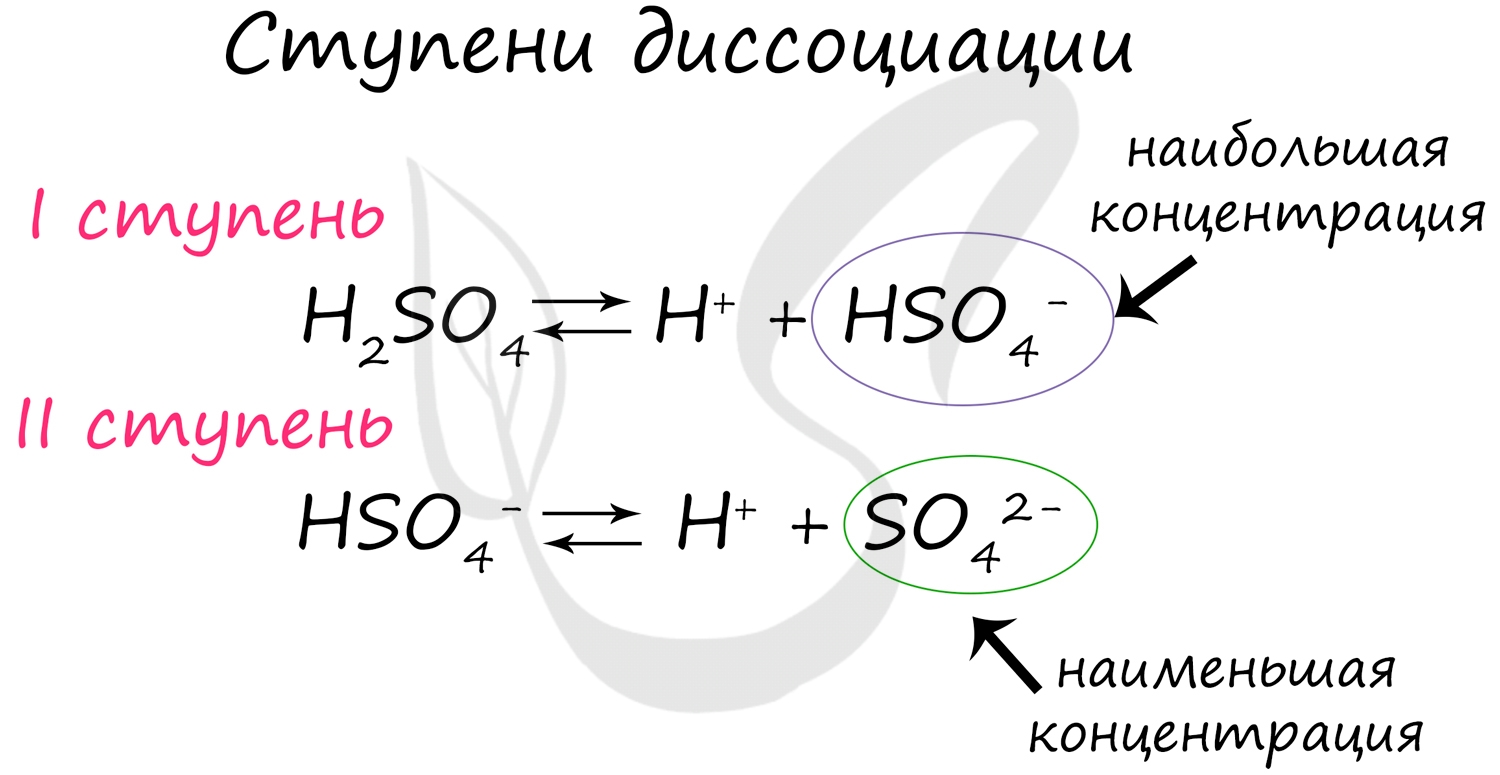
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.

Электролиты - жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
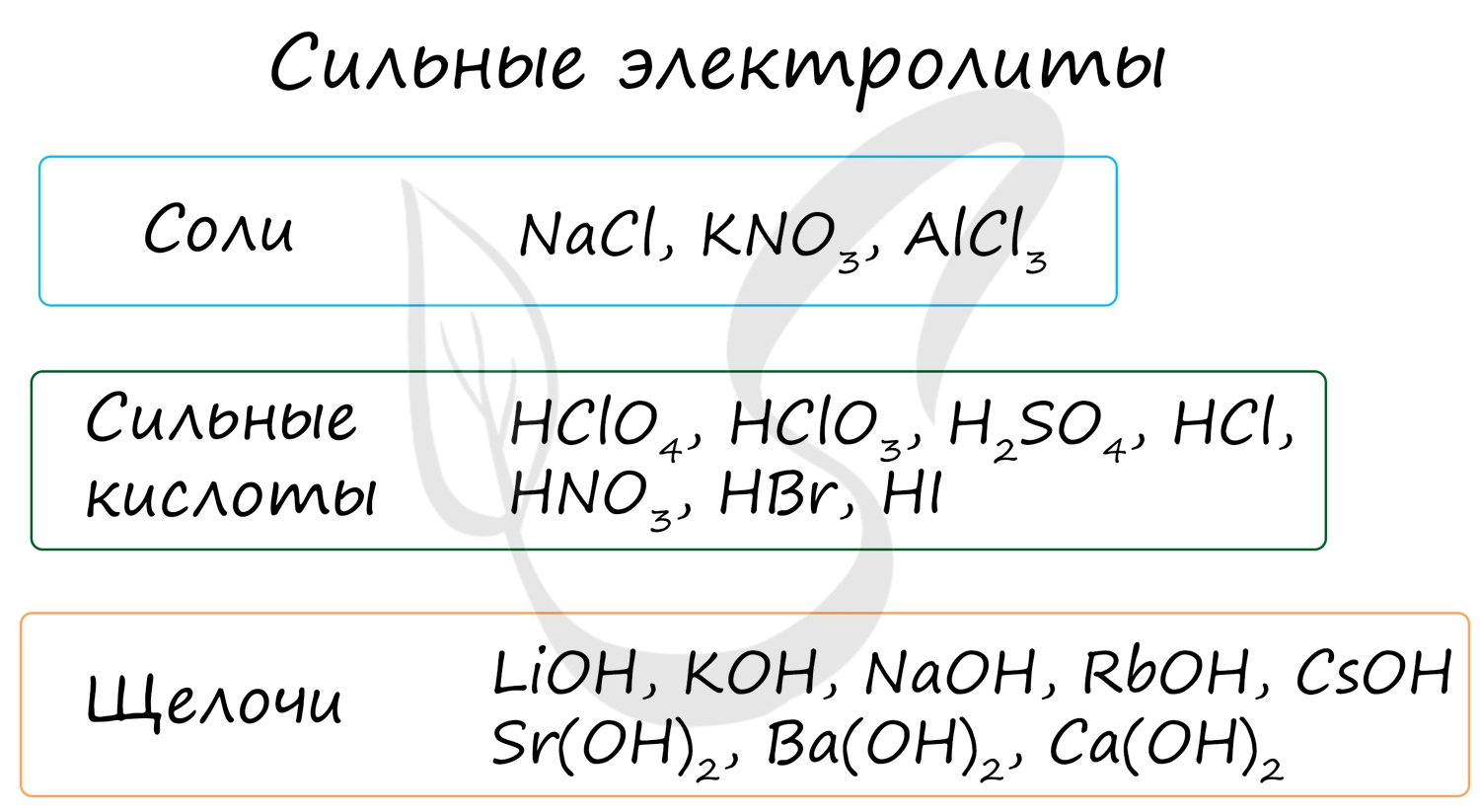
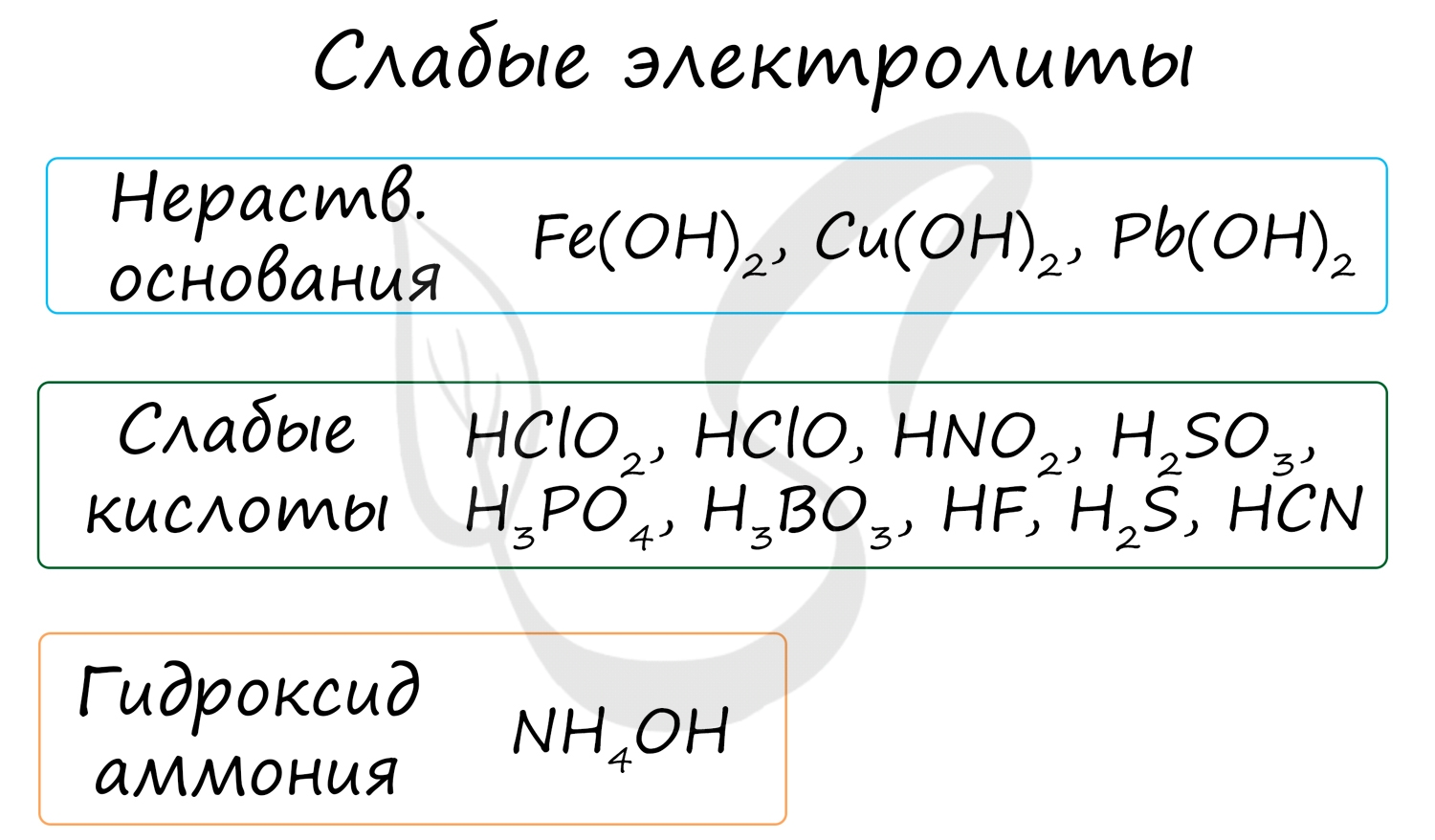
Неэлектролиты - вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
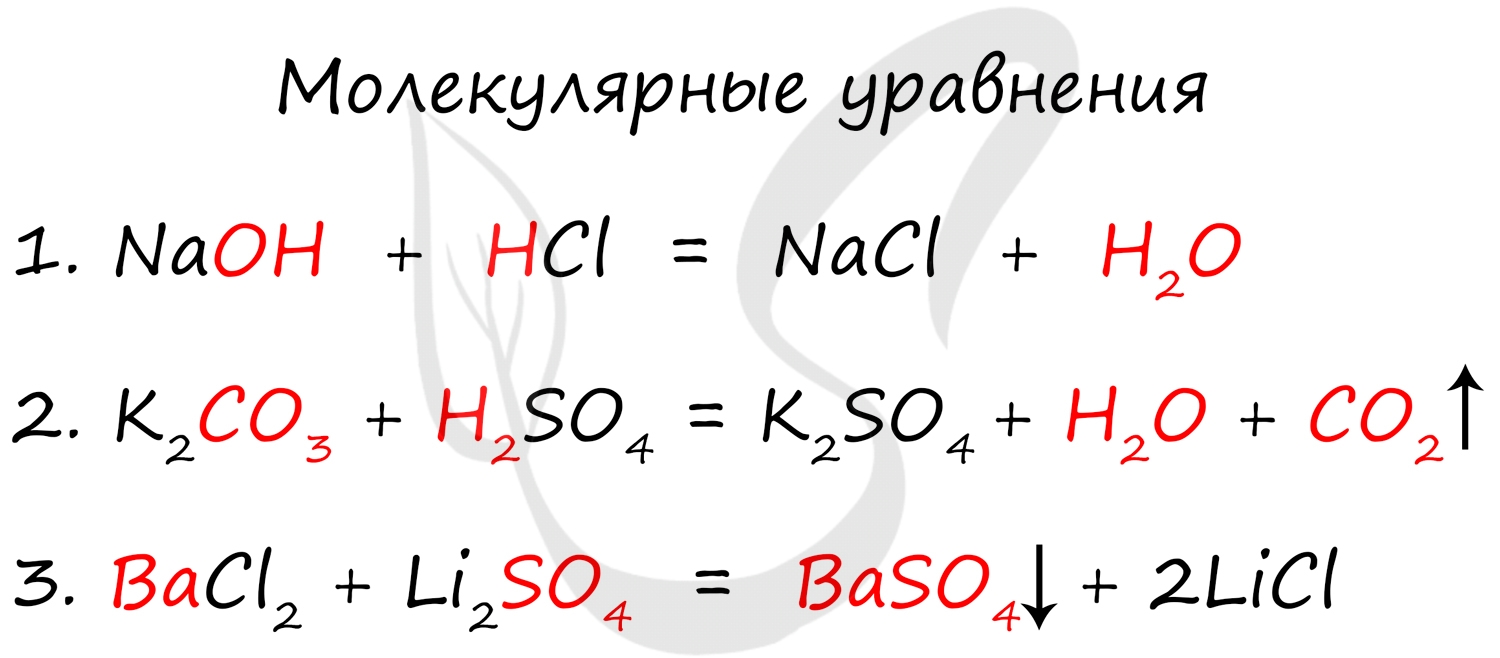
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы

Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике - остается только то, что сократить нельзя.
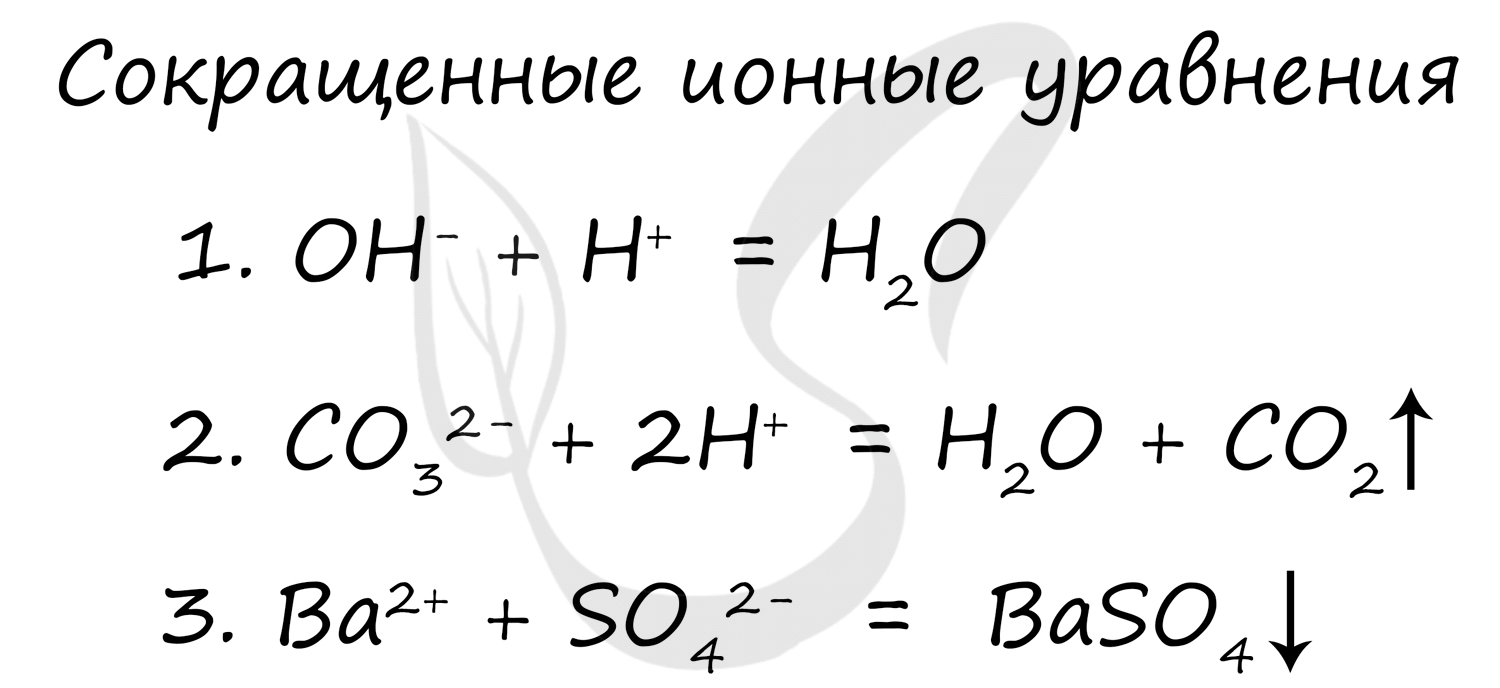
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:

