Единство химической организации реферат
Обновлено: 08.07.2024
2. ЕДИНСТВО СОСТАВА ЖИВОЙ МАТЕРИИ
Молекулы, из которых состоят живые организмы, подчиняются всем известным законам химии, но, кроме того, они взаимодействуют между собой в соответствии с другой системой принципов, которой можно дать общее название - молекулярная логика живого состояния. Эти принципы вовсе не всегда представляют собой какие-то новые, до сих пор еще неизвестные физические законы или силы. Их следует рассматривать скорее как особую систему закономерностей, характеризующих природу, функции и взаимодействие биомолекул, т. е. таких молекул, которые входят в состав живых организмов.
Все живые организмы содержат органические макромолекулы, построенные по общему плану. Большинство химических компонентов живых организмов представляют собой органические соединения, т. е. соединения углерода, в которых атомы углерода ковалентно связаны с другими атомами углерода, а также с атомами водорода, кислорода и азота. Живая материя состоит из великого множества самых разнообразных органических соединений, причем многие из них представляют собой необычайно большие и сложные молекулы. Даже самые простые, мельчайшие по размеру бактериальные клетки содержат очень большое число различных органических молекул. Например, в клетке бактерии Escherichia coli (обычная кишечная палочка) насчитывается около 5000 разных видов органических соединений, в том числе 3000 различных белков и 1000 разных типов нуклеиновых кислот.
Белки и нуклеиновые кислоты - это очень крупные и сложные молекулы (макромолекулы), известно точное строение лишь немногих из них. В гораздо более сложном организме человека встречается около 5000000 типов белковых молекул. Фактически каждый вид живых организмов содержит свой набор белков и нуклеиновых кислот, и почти все они четко отличаются от белков и нуклеиновых кислот, принадлежащих другому виду. Поскольку существуют около 10 млн видов живых организмов, легко подсчитать, что все эти виды, вместе взятые, должны содержать, по минимальной оценке, 1011 различных белков и почти столько же различных нуклеиновых кислот. Однако, как это ни парадоксально, все огромное разнообразие органических молекул в живых организмах сводится к довольно простой картине. Это связано с тем, что все макромолекулы в клетке состоят из простых и небольших молекул нескольких типов, используемых в качестве строительных блоков, которые связываются в длинные цепи, содержащие от 50 до многих тысяч звеньев.
Длинные, похожие на цепи молекулы дезоксирибонуклеиновой кислоты (ДНК) построены всего из четырех типов строительных блоков - дезоксирибонуклеотидов, расположенных в определенной последовательности. Белки представляют собой цепи, состоящие из 20 различных ковалентно связанных друг с другом аминокислот - низкомолекулярных органических соединений с известной структурой. Эти аминокислоты могут быть расположены в самых разных последовательностях и образовывать огромное множество разнообразных белков, подобно тому, как 33 буквы алфавита, расположенные в определенном порядке, составляют почти неограниченное число слов, предложений и даже книг. Более того, те четыре нуклеотида, из которых построены все нуклеиновые кислоты, и 20 аминокислот, из которых построены все белки, одинаковы во всех организмах, включая животных, растения и микроорганизмы. Этот факт убедительно свидетельствует в пользу того, что все живые организмы произошли от общего предка.
Для простых молекул, из которых построены все макромолекулы, характерна еще одна примечательная особенность. Она состоит в том, что каждая из них выполняет в клетке сразу несколько функций. Различные аминокислоты служат не только строительными блоками белков, но и предшественниками гормонов, алкалоидов, пигментов и многих других биомолекул. Нуклеотиды используются не только как строительные блоки нуклеиновых кислот, но и как коферменты и переносчики энергии. В живых организмах обычно не бывает соединений, которые не выполняли бы какой-либо функции, хотя функции некоторых биомолекул нам пока неизвестны. Исходя из всех этих рассуждений, можно сформулировать ряд принципов молекулярной логики живого: структура биологических макромолекул проста в своей основе. Все живые организмы состоят из одних и тех же молекул, используемых как строительные блоки, что указывает на их происхождение от общего предка. Идентичность организмов каждого вида сохраняется благодаря наличию свойственного только ему набора нуклеиновых кислот и белков. Все биомолекулы выполняют в клетках специфические функции.
3. ХИМИЯ ЖИВОЙ МАТЕРИИ
Кроме четырех основных элементов, в клетке в заметных количествах (десятые и сотые доли процента) содержатся натрий, калий, кальций, хлор, фосфор, сера, железо, магний. Каждый из них выполняет важную функцию в клетке. Например, ионы Na+, К+ и Cl- обеспечивают проницаемость клеточных мембран для различных веществ и проведение импульса по нервному волокну. Кальций и фосфор участвуют в формировании костной ткани, обеспечивая прочность кости. Кроме того, кальций - один из факторов, влияющих на процесс свертывания крови. Железо входит в состав гемоглобина - белка эритроцитов, - связывающего кислород. Магний в клетках зеленых растений - компонент хлорофилла - пигмента, обеспечивающего преобразование солнечной энергии в энергию химических связей (фотосинтез), в клетках животных находится в составе ряда ферментов.
Остальные элементы (цинк, медь, йод, фтор и др.) содержатся в живых организмах в очень малых количествах - в общей сложности до 0,02 %. Они встречаются главным образом в специализированных клетках, где участвуют в образовании биологически активных веществ. Так, цинк входит в молекулу гормона поджелудочной железы инсулина, регулирующего углеводный обмен, йод - компонент гормона щитовидной железы тироксина, регулирующего интенсивность обмена веществ и рост организма в процессе развития. Все химические элементы находятся в организме либо в виде ионов, либо входят в состав тех или иных соединений - молекул неорганических и органических веществ.
Из неорганических соединений самое распространенное в живых организмах - вода. Вода является наиболее широко распространенным веществом в живой природе, и ее весовое содержание в большинстве живых организмов составляет 70 % и более. Ее содержание в клетках разного типа колеблется в широких пределах: в клетках эмали зубов воды около 10 %, а в клетках развивающегося зародыша - более 90 %. В теле медузы воды до 98 %. Кроме того, первые живые организмы возникли, вероятно, в первичном океане, так что вода - это по существу прародительница всего живого.
Вода заполняет все составные части каждой живой клетки, и именно она представляет собой ту среду, в которой осуществляются транспорт питательных веществ, катализируемые ферментами метаболические реакции и перенос химической энергии. Поэтому все структурные элементы живой клетки и их функции обязательно должны быть приспособлены к физическим и химическим свойствам воды. Более того, клетки научились использовать уникальные свойства воды для реализации некоторых процессов их жизнедеятельности.
Часто мы рассматриваем воду просто как безвредную инертную жидкость, удобную для практического использования в разных целях. Хотя в химическом отношении вода весьма устойчива, она представляет собой вещество с довольно необычными свойствами. В самом деле, вода и продукты ее ионизации - ионы Н+ и ОН- - оказывают очень большое влияние на свойства многих важных компонентов клетки, таких, как ферменты, белки, нуклеиновые кислоты и липиды. Например, каталитическая активность ферментов в значительной мере зависит от концентрации ионов Н+ и ОН-.
Среди других химических веществ живой клетки преобладают органические соединения. Они составляют в среднем 20-30 % массы организма. К ним относятся биологические полимеры - белки, нуклеиновые кислоты и углеводы, а также жиры и ряд небольших молекул - гормонов, пигментов, аминокислот, нуклеотидов, АТФ и др. В различные типы клеток входит неодинаковое количество тех или иных органических соединений. Например, в растительных клетках преобладают сложные углеводы - полисахариды; в животных - больше белков и жиров. Тем не менее, каждая группа органических веществ в любом типе клеток выполняет сходные функции.
Практически все сухое вещество клеток составляют органические соединения, представленные четырьмя основными видами молекул: белками, нуклеиновыми кислотами, полисахаридами и липидами.
1) азотистого основания;
2) пятиуглеродного сахара;
3) фосфорной кислоты.
Словом, все многообразие живых организмов зависит от последовательности размещения в молекуле ДНК четырех структурных единиц - нуклеотидов.
Полисахаридам присущи важные биологические функции. Крахмал и гликоген используются как временные депо глюкозы. Нерастворимые полимеры углеводов выполняют функции структурных и опорных элементов в клеточных стенках бактерий и растений, а также в соединительной ткани и оболочках клеток животных. Полисахариды других типов служат в качестве смазки в суставах, обеспечивают слипание клеток и придают биологическую специфичность поверхности животных клеток.
4. МАКРОМОЛЕКУЛЫ И ИХ СОСТАВ
единый план молекулярного строения организмов, идея единства материального мира.
В чем проявляется единство химического состава живого. После изучения всего многообразия соединений и веществ, которые являются обязательными компонентами живого, нельзя обойти вниманием очевидную универсальность химического состава живых существ, который можно назвать единым планом молекулярного строения организмов. Эти общие свойства, доказывающие единство живого, можно свести к нескольким основным. В чем они заключаются ?
Единство и постоянство химического состава живых существ
1. Все живые организмы состоят из атомов одних и тех же химических элементов. Причем 98 % их массы приходится на четыре органогенных элементы. (Вспомните, какие.) Еще 20 биогенных элементов (все макроэлементы и часть микроэлементов), постоянно входящие в состав клетки. Без них невозможна жизнь клетки, хотя их соотношение у разных организмов и типах клеток меняется.
2. Без воды нет жизни. Основным веществом любого организма является вода. В клетках грибов и растений вода составляет 80-90 %. В наиболее функционально активных органах животных содержание воды достигает 90 %. (Как вы считаете, почему в семенах растений или жировой ткани животных на воду приходится всего 10-12 % ?) Такая потребность живых организмов в воде вызвана тем, что она является не только постоянным участником химических реакций, происходящих в клетках, но и универсальным растворителем – средой для их прохождения.
3. Общим для всех видов организмов является набор ионов основных минеральных солей. Универсальное свойство живого – раздражимость – осуществляется изменением соотношения ионов К + и Na + снаружи и внутри клетки, именно с их помощью транспортируются вещества в клетку и за ее пределы. Ионы Mg2 + являются активаторами работы многих ферментов независимо от того, в клетке животного, растения или гриба они работают.
4. В клетках всех живых существ сохраняется постоянный уровень концентрации ионов водорода, что соответствует значению pH, близком к нейтральному. Поддерживается этот баланс за счет катионов ортофосфорной кислоты.
5. В состав клеток всех живых организмов без исключения входят четыре типа органических соединений, которые выполняют общие для всех организмов функции:
• липиды – гидрофобные соединения, в состав молекул которых входят остатки жирных кислот и многоатомных спиртов. Жиры – эфиры трехатомных жирных кислот и глицерина, является энергетическим резервом любого организма. Жироподобные вещества – это более сложно построенные многоатомные эфиры, имеющие гидрофобные или амфифильные свойства. За счет этого они способны удерживать внутри клетки воду, а потому фосфолипидп являются обязательными компонентами клеточных мембран всех организмов без исключения;
• углеводы – многоатомные Альдегидоспирты, в эмпирической формуле которых на атом углерода приходится молекула воды. Моносахариды, особенно глюкоза, является универсальным источником энергии. Полисахариды, состоящие из остатков молекул глюкозы, – основные резервные вещества клеток всех организмов. (Вспомните, что вы знаете о крахмал, гликоген, инулин.) Некоторые полисахариды (клетчатка, хитин) концентрируются на поверхности клеток, образуя защитные структуры;
• белки – уникальные строительные вещества клетки, выполняют еще много других функций. Есть белки, универсальные для всех существ без исключения (дыхательные белки – цитохромы, белки цитоскелета, клеточных мембран, рибосом), а некоторые – специфичные для конкретных групп организмов. (Вспомните, в которых организмах вырабатывается гемоглобин, казеин, инсулин.) С 20 универсальных аминокислот построены полипептидные цепи всех живых существ без исключения. Ферменты – универсальные биологические катализаторы, построенные из одного или нескольких белковых молекул. Поскольку в разных организмах происходят подобные химические реакции, то и набор ферментов, катализирующих эти реакции в клетках различных групп живых существ подобный. Более того, пространственная структура ферментов, выполняющих те же функции у разных видов организмов, а также последовательность аминокислот в их полипептидных цепях очень похожи;
• нуклеиновые кислоты (ДНК и РНК) входят в состав всех клеток без исключения. Построены они из четырех типов нуклеотидов. ДНК – двойная макромолекула, состоящая из двух полинуклеотидных цепей. Ее функция – хранение генетической информации. Молекулы РНК служат для синтеза белка, они бывают трех типов и случаются у всех живых организмов без исключения.
6. Основным накопителем энергии во всех клетках является АТФ. В молекуле АТФ энергия запасается в виде мак – роергичних химических связей.
Химический состав живых существ и идея единства мира. Важнейшим следствием универсальности принципов строения всех живых существ на молекулярном уровне является обоснование идеи единства материального мира. Ее суть заключается в том, что все организмы построены из атомов тех же химических элементов, что и неживые, а также подчиняются всем без исключения физическим законам. (Вспомните, каким еще физическим законам, кроме закона сохранения и превращения энергии, подчиняется жизни живых существ.) Эта идея четко подтверждается наличием единого плана молекулярного строения, свойственный всем живым существам. Наличие такого плана проявляется и на уровне органических веществ.
Макромолекулы у человека и шимпанзе по своему строению настолько похожи, что кровь человека можно успешно переливать в кровеносного русла шимпанзе и при этом реципиент не обнаружит никаких признаков болезни. (Вспомните, можно свободно переливать кровь от одного человека к другому.)
Что доказывает единство общего плана молекулярного строения. Прежде всего, все виды живых организмов, обитающих на Земле, в большей или меньшей степени родственны между собой, а значит они возникли от общих предков – очень примитивных существ, существовавших на Земле более 3,5 млрд. лет назад.
Большинство ученых предполагают, что жизнь на Земле возникла в Мировом океане, который покрывал весь Земной шар. Тогда активно шли геологические процессы, сопровождаясь выделением из недр различных веществ. В тех местах, где они выделялись, вода не только имела повышенную температуру, но даже кипела, причем на дне океана процесс шел под высоким давлением. Очевидно, именно в таких местах с повышенной температурой из неорганических соединений образовывались простейшие органические вещества, которые затем начали концентрироваться. Таким образом образовалось что-то вроде клеточной мембраны. В этих скоплениях органических веществ происходили совсем другие химические процессы, чем в окружающем среде. На определенном этапе скопления органических веществ стали способными к самовоспроизведению и по сути превратились в первых живых существ.
Yci живые существа имеют единство химического состава, которая проявляется как в одинаковом наборе химических элементов, так и в наличии универсальных органических соединений (липидов, углеводов, белков и нуклеиновых кислот). Общий план молекулярного строения организмов доказывает единство материального мира и дает основания считать, что все ныне существующие виды существ происходят от первых примитивных организмов, которые появились на Земле более 3,5 млрд. лет назад.
В составе веществ, образующих клетки всех живых организмов (бактерий, растений, животных, человека), обнаружено более 70 химических элементов. Их принято делить на две большие группы: макро- и микроэлементы.
Макроэлементы содержатся в клетках в больших количествах. Это углерод, водород, кислород и азот, которые в сумме составляют 98% всего содержимого клетки.
К макроэлементам также относят магний, калий, кальций, натрий, фосфор, серу и хлор. Суммарное содержание их в клетке составляет 1,9%. Таким образом, на долю всех остальных элементов приходится около 0,1%. Эти элементы называют микроэлементами. К ним относятся железо, цинк, марганец, бор, медь, кобальт, иод, бром, фтор и др.
Как можно отметить, в клетках живых организмов, в том числе и человека (рис. 31), нет каких-либо особых химических элементов, характерных только для живой природы, т. е. на атомном уровне различий между живой и неживой природой нет. Эти различия начинаются лишь на уровне сложных веществ — на молекулярном уровне. Так, наряду с неорганическими веществами (водой и минеральными солями) клетки живых организмов содержат вещества, характерные только для них, — органические вещества (белки, жиры, углеводы, нуклеиновые кислоты, витамины, гормоны и др.).

Рис. 31.
Элементный состав тела человека
Относительный состав клеток живых организмов обобщенно можно представить так: вода— 70—80%, минеральные соли — 1, белки — 10—20, нуклеиновые кислоты — 1—6, жиры — 1—5, углеводы — 1—2% .
В то время как неорганические вещества встречаются и в неживой природе, органические соединения характерны только для живых организмов, долгое время служивших единственным источником их получения.
Основу цепочки природных взаимопревращений органических веществ, в состав молекул которых входит кислород, т. е. кислородсодержащих органических соединений, составляет уже знакомая вам реакция фотосинтеза:
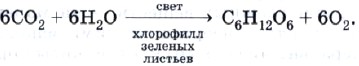
Растворы, содержащие углеводы (например, глюкозу), под действием особых веществ природного происхождения — ферментов — превращаются в этиловый спирт. Такой процесс называют спиртовым брожением:
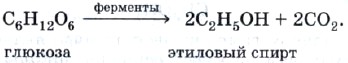
Получение этилового спирта — одна из древнейших химических реакций, открытых и используемых человечеством.
Со спиртами мы уже встречались не раз. Впервые вы познакомились с ними при изучении алкенов. Этиловый спирт С2Н5ОН — это продукт реакции гидратации этилена, а также исходное вещество для лабораторного способа получения этилена реакцией дегидратации. При изучении этилена вы познакомились еще с одним представителем спиртов — двухатомным спиртом этиленгли-колем НОСН2—СН2ОН, образующимся в результате окисления этилена раствором перманганата калия.
Нетрудно заметить, что особенность химического строения спиртов заключается в наличии в составе их молекулы особой функциональной группы атомов — гидроксильной группы —ОН.
| Функциональной называют группу атомов, которая определяет наиболее характерные свойства вещества и его принадлежность к определенному классу соединений. |
Число гидроксильных групп в молекуле спирта определяет его атомность. Знакомство со спиртами мы начнем с простейших — с предельных одноатомных спиртов, или алканолов.
Начинает гомологический ряд предельных одноатомных спиртов метиловый спирт, или метанол, СН3ОН.
Вторым членом гомологического ряда является хорошо знакомый вам из курса основной школы этиловый спирт, или этанол, С2Н5ОН.
Формуле третьего члена гомологического ряда алканолов С3Н7ОН будут соответствовать уже два пропиловых спирта, или пропанола. Дело в том, что, начиная со спиртов этого состава, появляется еще один вид изомерии, который называют изомерией положения функциональной группы. Формулы изомерных пропиловых спиртов:

Как вы помните, пропанол-2 можно получить гидратацией пропена, которая протекает в соответствии с правилом Марковникова.
Спирты состава С4Н9ОН существуют уже в виде четырех изомеров, различающихся не только положением функциональной группы:
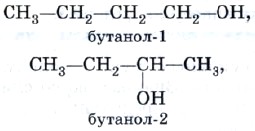
но и строением углеродного скелета:
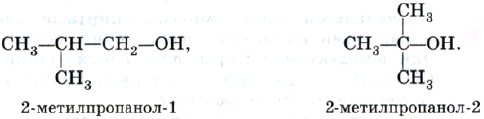
На этих примерах вы смогли познакомиться со способами образования названий предельных одноатомных спиртов. Названия одноатомных спиртов образуются от названий соответствующих (по числу атомов и строению углеродной цепи) углеводородов с прибавлением суффикса -ол. Положение гидроксильной группы в главной цепи молекулы указывают цифрой после суффикса -ол.
Отметим, что для спиртов характерен еще один вид изомерии, с которым вы уже встречались, — межклассовая изомерия: предельные одноатомные спирты изомерны простым эфирам. Например, изомерны этиловый спирт С2Н5ОН и диметиловый эфир СН3—0—СН3. Именно этот пример мы приводили в § 2.
Так как с представителями простых эфиров, как учащиеся непрофильных классов, вы больше не встретитесь, подчеркнем, что их состав может быть отражен общей формулой R—О—R'.
Уже первые члены гомологического ряда предельных одноатомных спиртов, несмотря на небольшие значения относительных молекулярных масс, представляют собой жидкости. Это объясняется образованием между молекулами особой химической водородной связи.
За счет водородной связи молекулы низших спиртов ассоциированы в жидкости (рис. 32):
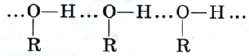
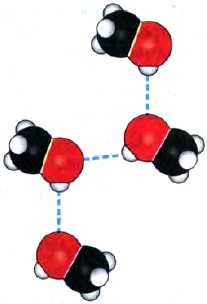
Рис. 32.
Водородные связи между молекулами метанола
Первые представители гомологического ряда алканолов прекрасно растворяются в воде, так как образуют водородные связи с молекулами воды (рис. 33).
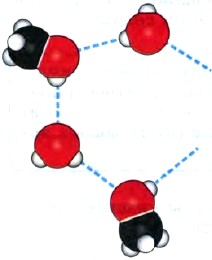
Рис. 33.
Водородные связи между молекулами воды и метанола
Познакомимся с химическими свойствами предельных одноатомных спиртов.
Как и все органические соединения, спирты горят:
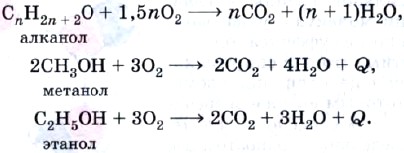
Последнюю реакцию применяют не только в хорошо известных вам спиртовках, но также и в двигателях внутреннего сгорания. На рисунке 34 изображена автозаправочная станция в Бразилии, которая предлагает в качестве топлива на выбор бензин, смесь бензина с этиловым спиртом и просто этиловый спирт с добавкой метанола, чтобы водители его не пили. Машины с двигателями, работающими на этаноле, используются в Бразилии уже более 10 лет.

Рис. 34.
Автозаправочная станция в Бразилии (топливо — смесь бензина и этанола)
Наличие в молекулах спиртов гидроксильной группы определяет общие свойства представителей этого класса соединений.
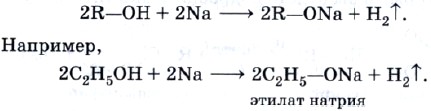
Спирты взаимодействуют с металлическим натрием, образуя соли с общим названием — алкоголяты:
Спирты вступают в реакцию дегидратации:
а) внутримолекулярная дегидратация — это хорошо знакомый вам лабораторный способ получения этилена:
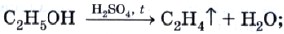
б) межмолекулярная дегидратация приводит к образованию уже знакомых вам простых эфиров:
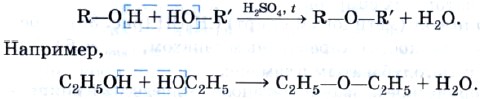
Оксидом меди (II) спирты окисляются в соответствующие альдегиды (рис. 35):
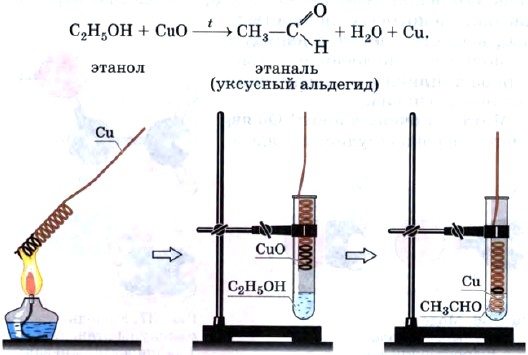
Рис. 35.
Окисление этанола до этаналя
С карбоновыми кислотами спирты вступают в реакцию этерификации, образуя при этом сложные эфиры, с которыми вы будете подробно знакомиться в § 13:
Рассмотрим отдельных представителей одноатомных и многоатомных спиртов.
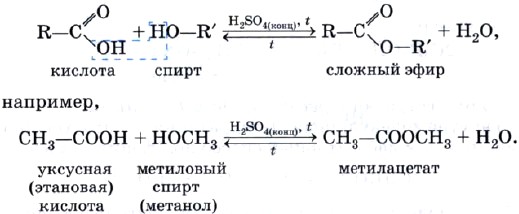
Метанол (метиловый спирт) СН3ОН (рис. 36) — бесцветная жидкость с характерным запахом, tкип = 64,7 °С, горит чуть голубоватым пламенем.
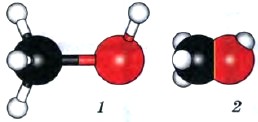
Рис. 36.
Модель молекулы метанола: 1 — шаростержневая; 2 — масштабная
Историческое название метанола — древесный спирт — объясняется одним из старых способов его получения — перегонкой дерева. Метанол — прекрасный растворитель, его используют также для производства формальдегида, некоторых лекарственных веществ. Метанол наряду с этанолом можно добавлять в моторное топливо для увеличения октанового числа.
Метанол очень ядовит! Он является нервно-сосудистым ядом.
При попадании в организм от 5 до 10 мл этого вещества наступает паралич зрения вследствие поражения сетчатки глаз, доза в 30 мл и более вызывает смерть.
Этанол (этиловый спирт) С2Н5ОН (рис. 37) — бесцветная жидкость с характерным запахом, tкип = 78,3 °С, смешивается с водой в любых соотношениях.
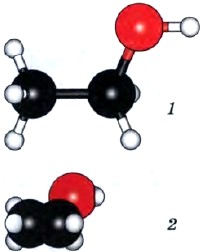
Рис. 37.
Модель молекулы этанола: 1 — шаростержневая; 2 — масштабная
При попадании в организм человека этилового спирта происходит снижение болевой чувствительности и блокировка процессов торможения в коре головного мозга — наступает состояние опьянения. На этой стадии действия этанола увеличивается водоотделение в клетках и, следовательно, ускоряется мочеотделение, в результате чего происходит обезвоживание организма. Кроме того, этанол вызывает расширение кровеносных сосудов. Усиление потока крови в кожных капиллярах приводит к покраснению кожи и ощущению теплоты.
В больших количествах этанол угнетает деятельность головного мозга (стадия торможения), вызывает нарушение координации движений. Промежуточный продукт окисления этанола в организме — ацетальдегид — ядовит и вызывает тяжелые отравления. Систематическое употребление этилового спирта и содержащих его напитков приводит к стойкому снижению продуктивности работы головного мозга, гибели клеток печени и замене их соединительной тканью — циррозу печени.
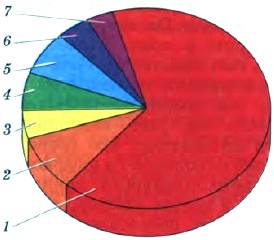
Рис. 38.
Доля применения этанола в различных областях промышленности:
1 — растворитель; 2 — получение диэтилового эфира; 3 — получение сложных эфиров; 4 — получение уксусного альдегида; 5 — получение уксусной кислоты; 6 — горючее для двигателей; 7 — прочее
Помимо производства алкогольной продукции, этанол находит широкое применение в различных отраслях промышленности (рис. 38, 39).
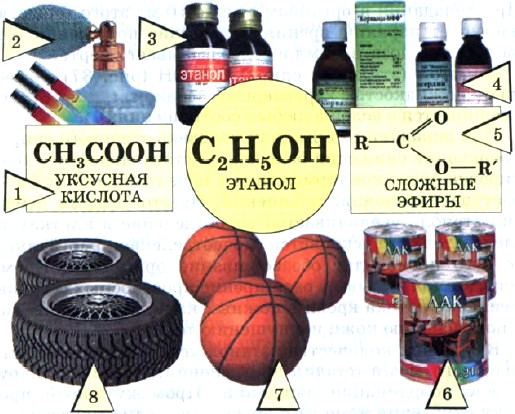
Рис. 39.
Применение этанола:
1 — производство уксусной кислоты; 2 — косметика и парфюмерия; 3 — медицинские препараты; 4 — лекарственные средства; 5 — производство сложных эфиров; 6 — лаки; 7,8 — синтетические каучуки
Глицерин — это представитель трехатомных спиртов (рис. 40). Его формула
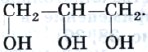
Рис. 40. Масштабная модель молекулы глицерина
В отличие от уже знакомого вам двухатомного спирта этиленгликоля, глицерин не ядовит. Он неограниченно растворим в воде, более того, очень гигроскопичен. Если оставить глицерин в открытом сосуде, его масса увеличивается до 40% за счет поглощения влаги из воздуха. Это свойство широко используют в парфюмерной промышленности: глицерин входит в состав кремов, помад, зубных паст, предотвращая их от высыхания и способствуя увлажнению и смягчению кожи.
Глицерин используют как пищевую добавку при изготовлении кондитерских изделий и напитков. При производстве пластмасс глицерин применяют в качестве пластификатора — компонента, придающего материалу гибкость и эластичность. В кожевенном производстве и текстильной промышленности глицерин используют для предохранения кож от высыхания и придания тканям мягкости и шелковистости.
Значительное количество глицерина используют для изготовления взрывчатых веществ, в частности тринитрата глицерина. Несмотря на взрывоопасность этого вещества, в очень малых дозах его применяют в медицине в качестве сосудорасширяющего средства при сердечно-сосудистых заболеваниях.
Качественной реакцией на многоатомные спирты является их взаимодействие со свежеполученным осадком гидроксида меди (II), который растворяется с образованием ярко-синего раствора (рис. 41).
Цель: развитие умений у обучающихся проводить учебное теоретическое исследование на основании предложенной проблемы и имеющегося у обучающихся теоретического материла.
Данная разработка предназначена для развития исследовательских умений в рамках классно-урочной системы на уроке химии. Технологическая карта урока построена по технологии модульного урока, в каждом элементе поставлена цель перед обучающимися, показан алгоритм деятельности в течение урока. Новизна предложенных материалов заключается в том, что обучающиеся пробуют себя в роли исследователей, учатся оформлять полученную информацию, сравнивать её, обобщать и делать выводы. Подобная форма урока позволяет эффективно организовать самостоятельную работу на деятельностной основе.
Содержимое разработки
Предмет: химия, класс: 10 (базовый уровень).
Тип урока: изучение нового материала
Учебный материал с указанием заданий
Руководство деятельностью
учащихся по усвоению
учебного материала
Цель: провести учебное теоретическое исследование по химическому анализу живой и неживой природы
Дом. задание: стр.63-64, записи в тетради, результаты учебного исследования
Уясните цель урока, запишите д/з
Цель: определить объект и предмет исследования, сформулировать гипотезу (предположение) и задачи исследования
Объект: химическая организация живой и неживой природы
Предмет: сходство и отличие химической организации живой и неживой природы
Гипотеза: химическая организация живой и неживой природы имеет сходство (отличие) на атомном уровне и отличие (сходство) на молекулярном уровне. или отличий не существует
1. Проанализировать информацию стр.63-64 учебника.
2. Проанализировать информацию предложенную учителем(справочный материал, приложение 1)
3. Сделать выводы и подобрать факты доказательства своих утверждений.
4.Составить таблицу, обобщающие информацию :
Состав, химическое строение веществ
- какие химические элементы называют макро-и микро элементами;
- почему живая природа в основном состоит из атомов С,Н,О, N ;
- почему х.э. одной подгруппы (аналоги) оказывают разное биологическое действие на объекты живой природы, найти примеры
Запишите в тетрадь объект и предмет исследования, сформулируйте гипотезу на своё усмотрение
Цель: сделать вывод по выдвинутой гипотезе (подтвердили или опровергли) почему.
Запишите полный вывод по результатам исследования
Цель: оцените свою самостоятельную работу на уроке по уровням:
Высокий, достаточный, низкий.
В, Д, или Н
форма: учебное исследование
Элементарный состав: В состав живой и неживой природы входят одни и те же химические элементы. Однако их количественное содержание отличается. В живых организмах 98% их химического состава, приходится на четыре элемента — углерод, кислород, азот, водород. В составе живых организмов почти в 10 раз больше углерода, в два раза кислорода, в три раза – азота. В то же время весьма распространенные в природе элементы – Al, Si, Ti – содержатся в организмах в очень маленьких количествах. Это объясняется тем, в виде каких веществ находятся элементы в живой и неживой природе. Элементы углерод, водород, кислород, азот участвуют в образовании сложных органических молекул, из которых состоят живые организмы. В состав неживой природы входят большей частью минеральные вещества, одним из главных компонентов является оксид кремния (поэтому кремния в неживой природе в 220 раз больше!).Макроэлементы – те химические элементы, которые содержатся в клетках в больших количествах. Это – С, Н, О, N,(98%) также сюда можно отнести Mg, K, Ca, Na, P, S, Cl(1,9% ). Микроэлементы – те, содержание которых в организмах мало: Fe, Al, Zn , B, Cu, Co, I, Br, F, Mn и др. (0,1%)
Основные критерии отбора х.э. в живой природе:
Малый размер атомов;
Небольшая относительная атомная масса;
Способность образовывать прочные ковалентные одинарные и кратные связи.
Особенности атома углерода
Высокий заряд ядра
Способность образовывать ковалентные связи со всеми элементами периодической системы и своими собственными атомами
Особенности атома водорода
Образует прочные химические связи со всеми пятью элементами (органогенами)
Образует однородную по свойствам внешнюю часть органических молекул
Образует водородные связи, которые обуславливают уникальные свойства
От чего зависит токсичность х.э.:
заряда атомного ядра,
возрастает токсичность элементов.
Углерод – основа жизни
Соединения свинца - яды, вызывающие рак почек и желудочно-кишечного тракта
Магний участвует в образовании костной ткани, в белковом обмене, регулирует кровяное давление
Барий даже в небольших количествах опасен для организма, поражается нервная система, сосуды, костный мозг, печень.
Элементы-аналоги в природе вступают в конкуренцию и могут взаимозаменяться в живых организмах, оказывая тем самым отрицательное влияние на биохимические процессы.
Например, Ca-Ba, Zn-Hg, Fe-Ni (Co), S-Se, Ni-Cd, Zn-Cd, Al-Ca, Al-Fe, Mg-Mn, K-Ti, Ca-Sr, Ni-Co, все галогены между собой.
Молекулярный уровень
Как бы сложно или просто не было строение любого живого организма, они все состоят из одинаковых химических элементов и одинаковых молекулярных соединений. В составе растительных и животных организмов найдено до 70 химических элементов, примерно столько же распространены и в минеральном мире. Но в неживой природе преобладают вещества с атомными и ионными кристаллическими решетками. В живой природе – молекулярные - нуклеиновые кислоты, белки, углеводы и другие.
На молекулярном уровне происходят различные процессы жизнедеятельности живых организмов: обмен веществ, превращение энергии. На этом уровне осуществляется передача наследственной информации, образуются отдельные органоиды и происходят другие процессы. Структура синтезируемых макромолекул обладает видовой и индивидуальной специфичностью.
Вывод: все живые организмы имеют сходную химическую организацию, отличающую их от неживой природы. Главными веществами живой природы являются нуклеиновые кислоты, белки, жиры и углеводы.
Читайте также:

