Днк диагностика в онкологии реферат
Обновлено: 08.07.2024
Рак — одна из наиболее частых и серьезных болезней, наблюдаемых в клинической медицине. Статистика показывает, что некоторые формы рака встречаются у более чем одной трети людей, вызывая более 20% всех смертей, и в развитых странах требуют более 10% общих расходов на медицинское обслуживание. Раковые опухоли при отсутствии лечения всегда приводят к летальному исходу.
Ранняя диагностика и раннее лечение жизненно необходимы, и немаловажная цель исследования рака — выявление людей с повышенным риском раковых опухолей до их развития.
В дальнейших статьях на нашем сайте МедУнивер попробуем разобраться, каким образом молекулярно-генетические исследования показывают, что рак — в основном генетическая болезнь. Во-первых, опишем типы генов, вовлеченных в развитие рака, и механизмы, благодаря которым дисфункция этих генов может заканчиваться болезнью.
Во-вторых, рассмотрим множество наследуемых онкологических синдромов и покажем, как понимание их патогенеза высветило основу более частых спорадических форм рака. Мы также изучим некоторые специальные проблемы, возникающие в медицинской генетике и генетическом консультировании в связи с наследуемыми синдромами.
В-третьих, покажем, как генетика и геномика изменили наши представления о причинах рака и методах его диагностики и лечения. Геномика за счет идентификации конкретных делеций и дупликаций сегментов генома раковых клеток и полного анализа экспрессии генов и мутаций в раковых клетках действительно изменила диагностику и лечение рака.
Рак — не одно заболевание, это название используют для обозначения злокачественных новообразований, характеризующихся неконтролируемым клеточным ростом, приводящим к их развитию. Новообразование, чтобы быть раком, должно также быть злокачественным.
Это означает, что его рост больше не контролируется, и опухоль способна прорастать смежные ткани или распространяться (метастазировать) в более отдаленные участки, или и то, и другое одновременно. Опухоли, не способные к прорастанию или метастазированию, не относятся к раковым и называются доброкачественными опухолями, хотя их размер и расположение могут вызывать беспокойство, но в целом они благоприятны для пациента.
Существует три основных формы злокачественных новоообразований: саркомы, когда опухоль возникает в мезенхимальной ткани, например в костях, мышцах, соединительной ткани или в тканях нервной системы; карциномы, возникающие в эпителиальной ткани, скажем, в эпителии клеток кишечника, бронхов или протоках грудной железы; и злокачественные неоплазии гемопоэтической и лимфоидной ткани, например лейкозы и лимфомы, захватывающие костный мозг, лимфатическую систему и периферическую кровь.
В пределах каждой из этих основных групп опухоли классифицируются по их расположению, типу ткани, гистологическим проявлениям и степени злокачественности.
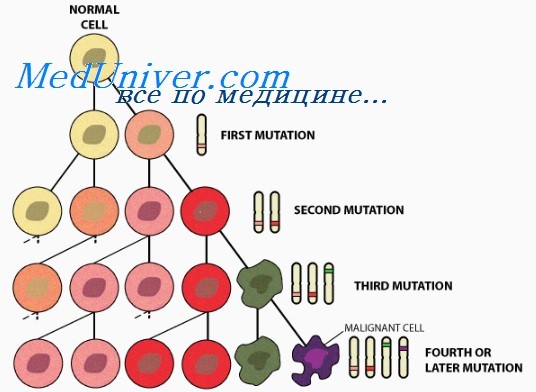
Генетические основы рака
• Независимо от того, появился рак спорадически, в результате соматической мутации или у многих членов одной семьи как наследственный признак, это генетическое заболевание.
• Онкоген — мутантный аллель протоонкогена, класса нормальных генов, кодирующих белки клетки, обеспечивающие рост и выживание клеток. Онкогены облегчают злокачественное перерождение, стимулируя пролиферацию или тормозя апоптоз. Онкогены кодируют такие белки, как:
- белки сигнальных путей пролиферации клеток;
- факторы транскрипции, управляющие экспрессией обеспечивающих рост генов;
- ингибиторы механизмов программируемой смерти клетки.
• Развитие опухоли. После появления рак развивается, накапливая генетические поломки, благодаря мутациям или эпигенетическому подавлению генов ХКЦ, кодирующих механизмы репарации поврежденной ДНК и поддерживающих цитогенетически нормальное состояние. Другое последствие генетических дефектов — изменение экспрессии генов, приводящее к васкуляризации и распространению опухоли инвазивным ростом и метастазированием.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Для цитирования: Зайцев В.Г., Скворцов В.В. Перспективы определения ДНК в сыворотке или плазме крови для диагностики и мониторинга онкологических заболеваний. РМЖ. 2009;13:864.
В последние десятилетия онкологические заболевания стали одной из важнейших причин смертности людей во всем мире, ежегодное количество смертей от рака превышает половину от числа вновь выявленных случаев заболевания [19]. Частота случаев рака удвоилась глобально между 1975 и 2000 г., при этом в 2000 г. из всех случаев с установленными причинами смерти рак был ответственен за 12%.
С 2000 по 2008 г. произошло почти 20%–ное увеличение онкологической заболеваемости [31]. Положение в России не менее драматично, чем во всем остальном мире [3,4]. Во многих случаях мы имеем слишком малые возможности для адекватной ранней диагностики рака, оперативного лабораторного контроля эффективности лечения и прогноза развития заболевания, основанного на количественных лабораторных показателях. Несмотря на большое количество исследований в этой области прогресс в области широкого использования анализа биомаркеров для различных видов рака все еще недостаточен [8,29]. Одна из диагностических перспектив связана с использованием в качестве биомаркера циркулирующей ДНК (цДНК), которая может быть обнаружена в плазме (сыворотке) крови человека.
ДНК в плазме (сыворотке)
крови человека
Впервые ДНК в образцах плазмы крови здоровых доноров была обнаружена еще в 1948 г. [16]. Среднее содержание суммы ДНК и РНК в 10 образцах составила 5,4 мкг/мл, отдельно концентрация ДНК не определялась. Современные исследования дают цифры содержания цДНК порядка единиц и десятков нг/мл. Так, Власов с соавт. [30] указывают, что содержание в плазме крови здоровых людей циркулирующих свободных молекул ДНК составляет от 1,8 до 35 нг/мл, а Леон с соавт. [14] предлагают считать нормальным диапазоном концентраций цДНК 0–50 нг/мл. Примеры определения уровня цДНК у здоровых людей суммированы в таблице 1. Однако надо иметь в виду, что получаемые величины могут сильно отличаться в зависимости от используемых методов выделения и детекции ДНК. Так, просто использование двух разных методов выделения цДНК из одних и тех же образцов плазмы может приводить к результатам, отличающимся в 1,9–5,2 раза [18].
Низкий уровень циркулирующих нуклеиновых кислот, по логике вещей, должен поддерживаться нуклеазами, однако содержание ДНК–азы I в плазме 3,2–18,4 нг/мл, что кажется недостаточным для эффективного контроля [30]. Видимо, у здоровых людей низкое содержание циркулирующей ДНК может поддерживаться при участии ДНК–азы периферических сосудов.
Начиная с работы Тана с соавт. [27], опубликованной в 1966 г., многие исследователи изучали возможность использования цДНК в качестве биомаркера при самых разнообразных заболеваниях – системной красной волчанке, инфаркте миокарда, преэклампсии, инсульте, синдроме Дауна и т.д. [15,28]. С 1977 г., после публикации работы [14], особенно интенсивно развиваются исследования применимости цДНК в лабораторной медицине онкологических заболеваний.
Источники циркулирующей ДНК
Три основных процесса могут приводить к появлению в крови цДНК клеток организма: (1) некроз клеток, например лейкоцитов; (2) апоптоз клеток, в т.ч. опухолевых; (3) высвобождение ДНК из неповрежденных клеток (как нормальных, так и опухолевых). Важно отметить значимость последнего источника цДНК. В свое время было убедительно продемонстрировано, что ни апоптозом, ни некрозом нельзя полностью объяснить присутствие ДНК в плазме крови [7,26]. По–видимому, лишь незначительные или следовые количества цДНК могут иметь происхождение из некротизированных клеток. В то же время существенная часть цДНК представлена двухцепочечными молекулами длиной от 180 до 1000 пар нуклеотидов (пн), что весьма характерно для фрагментов, образующихся в процессе развития апоптоза клеток [9,11].
С другой стороны, достаточно давно известно, что в культуре как нормальные, так и трансформированные клетки способны выделять и ДНК, и РНК в окружающую среду [6,13]. Интересно, что преимущественно вовне выделяются только что синтезированные молекулы нуклеиновых кислот, причем часть из них секретируется в виде нуклеопротеинов или в форме гетеродуплексов ДНК–РНК [23]. В сыворотке крови человека по крайней мере часть молекул цДНК присутствует также в форме аналогичных нуклеопротеинов или комплексов с РНК [22]. В настоящее время происхождение части цДНК в плазме (сыворотке) крови человека путем высвобождения из живых клеток не вызывает сомнения [26].
Опухолевая ДНК
в плазме (сыворотке) крови
Содержание цДНК в плазме (сыворотке) крови пациентов, страдающих от онкологических заболеваний, подвержена очень высокой вариабельности. В разных исследованиях была обнаружена неодинаковая распространенность повышенных уровней цДНК у пациентов с раковыми заболеваниями: 27% [24], 50% [14], 66% [21]. При этом при одних формах рака содержание цДНК обычно было выше, чем у здоровых доноров, при других, например раке легких, обычно укладывалось в пределы нормы (табл. 2). Проведение курса радиотерапии приводило к значительному снижению содержания цДНК у 66–90% пациентов с лимфомами, раком легких, яичников, матки и цервикальными опухолями и лишь у 16–33% пациентов с глиомой, колоректальными опухолями или раком молочной железы [14]. Таким образом, кажется, что определение цДНК может быть хорошим маркером онкологических заболеваний. Однако при этом важно помнить, что повышение уровня цДНК не является специфичным именно для рака, а может наблюдаться и при ряде иных заболеваний человека.
Как же выяснить, является ли присутствующая в плазме (сыворотке) крови цДНК опухолевой? Принципиально можно предложить четыре основных подхода: (1) выявление ДНК со сниженной стабильностью цепей, характерной для опухолевой ДНК; (2) обнаружение маркеров специфических онкогенов; (3) обнаружение специфических мутаций опухолевых супрессоров в цДНК; (4) выявление специфических микросателлитных маркеров [7].
Оценка нестабильности цепей была первым методом, позволившим обнаружить в плазме крови цДНК специфически опухолевого происхождения [25], однако эти исследования были выполнены на ограниченной группе пациентов (37 человек). Этот метод, сыгравший такую важную роль на начальном этапе исследований, сейчас представляет небольшой интерес, поскольку снижение стабильности молекул цДНК не является признаком, абсолютным только для опухолевых заболеваний. Аналогично неспецифичной оказалась и повышенная устойчивость опухолевой ДНК к некоторым видам ДНК–аз.
Онкогены представляют собой гены, белковые продукты которых могут приводить к опухолевой трансформации клеток сами по себе или в комбинации с другими факторами [1]. Известно несколько десятков онкогенов, которые обычно ассоциированы с определенными формами опухолей. Так, специфические точечные мутации в генах семейства ras были выявлены в цДНК от пациентов с гематопоэтическими опухолями, колоректальным раком и раком поджелудочной железы, причем в некоторых случаях еще до появления клинических признаков заболевания [7].
Опухолевые супрессоры в норме кодируют белки, предотвращающие неконтролируемую пролиферацию клеток или вызывающие апоптоз в клетках с сильно поврежденным геномом. Инактивация этих механизмов в результате мутаций в генах опухолевых супрессоров ведет к автономной пролиферации как основному компоненту опухолевой трансформации и к увеличению генетической гетерогенности как необходимому условию последующей прогрессии опухоли. Чаще всего мутации затрагивают такой ген опухолевого супрессора, как p53 [1].
Микросателлиты в эукариотическом геноме представляют собой множественные (часто – более сотни) повторы очень коротких (из 2–6 нуклеотидов) участков последовательности ДНК. Микросателлиты более или менее случайно разбросаны по геному, проявляют заметную нестабильность и могут легко мутировать, изменяя число своих повторов в геноме [2]. Определенные формы микросателлитной нестабильности, – например утрата генетической гетерозиготности (Loss of Heterozygosity – LOH), т.е. утрата участка хромосомы, несущей соответствующий аллель, или, наоборот, появление новых аллелей, – могут встречаться в цДНК пациентов с опухолями головы, шеи, легких и почек [7].
Наиболее чувствительным является определение различных классов генетических опухолевых маркеров. Например, Силва с соавт. обнаружили, что у 66% пациенток с раком молочной железы цДНК содержит по крайней мере одну из микросателлитных мутаций, или участки избыточного метилирования гена опухолевого супрессора p53, или аберрантное метилирование в гене p16INK4a [21]. Различное сочетание микросателлитных маркеров, онкогенов и изменений в генах опухолевых супрессоров являются полиморфными маркерами самых разнообразных вариантов рака: поджелудочной железы, толстого кишечника, молочной железы, печени, мелкоклеточного и немелкоклеточного рака легких, миелодиспластического синдрома, карциномы головы, шеи и почек. Таким образом, легко видеть, что выделенная из плазмы или сыворотки крови цДНК может быть ценным материалом для обнаружения генетических маркеров опухолей без проведения биопсии и даже без обнаружения локализации самой опухоли.
Инвазия и метастазирование
опухолей и циркулирующая ДНК
Как известно, процессы быстрого инвазивного роста и метастазирования злокачественных опухолей сопровождаются интенсивным разрушением тканей, окружающих опухоль и(или) расположенных в месте образования метастазов. Разрушение нормальных клеток может идти как путем некроза, так и апоптоза, индуцируемого, в частности, секретируемыми опухолевыми клетками биорегуляторами [17,32]. Вероятно, в роли такого биорегулятора может выступать и выделяемая опухолью ДНК. Во всяком случае, ее уровень при некоторых формах рака имеет связь со степенью инвазивности и метастатической активности рака. Например, у пациенток с раком молочной железы высокая скорость роста карциномы протоков, высокий индекс пролиферации и метастазирование опухоли в лимфатические узлы коррелировали с более высоким уровнем цДНК плазмы крови [21].
В недавней статье было проведено исследование значимости определения апоптотического индекса (АИ) при инвазивном раке мочевого пузыря (РМП) (45 пациентов). АИ представляет собой показатель, характеризующий интенсивность появления в сыворотке крови цДНК в результате апоптоза клеток, и определяется как соотношение концентраций фрагментов ДНК, образование которых происходит преимущественно при апоптозе (PTGS2; 124 пн) и при некрозе (Reprimo; 271 пн) клеток. Для оценки концентраций использовали количественный ПЦР–анализ. Контрольной группой служили пациенты с доброкачественной гиперплазией простаты. Оказалось, что при раке повышается содержание как некротических, так и – в существенно большей степени?– апоптотических фрагментов ДНК. Следовательно, значение АИ также увеличивается. Хотя уровень цДНК и величина АИ не коррелировали с клинико–патологическими параметрами, тест определения АИ для диагностики инвазивного РМП характеризовался очень высокой чувствительностью (96%) и умеренной специфичностью (62%). Но особенно значимым оказался тот факт, что повышение АИ оказалось независимым прогностическим фактором смертности, специфически обусловленной развитием РМП [9].
Наличие в организме пациента метастазов первичной опухоли приводит к дополнительному повышению содержания цДНК в сыворотке крови: различия между пациентами с метастазами и без них были статистически достоверны [14]. В отношении метастазирования есть и еще один интересный момент. Существуют данные, что внеклеточная ДНК, выделенная одними клетками, может изменять метаболическое состояние и биологическую активность других клеток в организме [10]. Более того, известен следующий примечательный факт: ДНК, высвобождающаяся из культивируемых клеток лейкемии или глиомы, оказалась способной при добавлении к мышиным лимфоцитам усиливать включение радиоактивно меченного тимидина во вновь синтезируемую ДНК этих клеток [5]. Не значит ли это, что ДНК, секретированная опухолевыми клетками, способна стимулировать опухолевую трансформацию нормальных клеток или – по крайней мере – сенсибилизировать здоровые клетки к последующему онкогенезу? Не может ли такой бесклеточный механизм быть одним из путей метастазирования? Этот вопрос на сегодняшний день остается неразрешенным. Но, как бы то ни было, похоже, что метастатическая активность первичных опухолей и появление вторичных неопластических локусов достаточно тесно взаимосвязаны с повышенным уровнем цДНК в крови больного.
Заключение
Разумеется, в одной статье невозможно дать исчерпывающей информации о столь бурно развивающейся области исследований, но изложенное можно резюмировать следующим образом: в отношении рака использование анализа цДНК возможно для решения всех четырех задач лабораторной медицины – скрининга, диагностики, мониторинга и прогноза. Для скрининга можно использовать определение уровня цДНК. В области диагностики наилучших результатов можно достигнуть, используя тесты на обнаружение специфических опухолевых маркеров в молекулах цДНК. Оценка содержания цДНК и величины апоптотического индекса может помочь в прогнозе течения заболевания и в мониторинге эффективности лечения.
Таким образом, даже простое определение уровня цДНК способно в ряде случаев позволить заподозрить наличие опухолевого процесса или оценить степень его выраженности или риск метастазирования. Но еще важнее то, что использование цДНК, которая может быть получена из образцов плазмы или сыворотки крови пациентов, для проведения последующих чувствительных и специфичных тестов может сыграть важную роль в улучшении методов диагностики, мониторинга и прогноза течения заболевания у пациентов с различными формами рака. Особенно стоит подчеркнуть, что такие диагностические тесты могут быть не менее информативными, чем биопсия, но при этом исследование цДНК гораздо менее травматично, более просто и доступно и гораздо лучше подходит для оценки состояния пациента в динамике.

Молекулярная диагностика стала неотъемлемым компонентом современной клинической онкологии. К наиболее известным направлениям этой области медицины относятся усилия, направленные на диагностику наследственных опухолевых синдромов, а также выявление соматических мутаций, ассоциированных с чувствительностью новообразований к ингибиторам протеинкиназ. Развитие знаний о механизмах развития неоплазм, а также создание новых технологий формируют новые тенденции в молекулярной диагностике рака. Наиболее заметным явлением как в биомедицине вообще, так и в онкологии в частности стало внедрение секвенирования нового поколения (next generation sequencing, NGS). Использование NGS позволяет многократно повысить эффективность и доступность диагностики наследственного рака, а также выполнять мутационное профилирование опухолей с целью персонализированного подбора терапии. Опухоли значительно видоизменяют свои свойства в процессе лечения, поэтому мониторинг биологического портрета новообразования представляет крайне важную задачу. В зависимости от результатов мониторинга и динамики молекулярного портрета трансформированных клеток появляется возможность назначения новых лекарственных препаратов. Важным инструментом в этом отношении является так называемая жидкостная биопсия, позволяющая анализировать существенные характеристики опухоли без применения инвазивных процедур. Большую популярность получили персонализированные ex vivo модели карцином. Они подразумевают культивирование опухолевых клеток и выполнение тестов на лекарственную чувствительность с целью индивидуального подбора противоопухолевой терапии.
Ключевые слова
Полный текст
Введение
Секвенирование нового поколения
В настоящее время в клинической диагностике используют несколько коммерческих генных панелей, предназначенных для обнаружения наследственного рака. Они, как правило, включают гены как с высокой пенетрантностью, так и среднепенетрантные. Помимо этого, разработчики NGS-наборов предлагают диагностировать не только гены с твердо доказанной медицинской значимостью, но и недавно идентифицированные гены-кандидаты. Это приводит к некоторой неопределенности толкования результатов мультигенных тестов: если выявление инактивирующих мутаций в генах BRCA1 или BRCA2 не вызывает затруднений в интерпретации итогов NGS, то идентификация, например, мутации в гене BRIP1 может свидетельствовать как в пользу диагноза наследственного рака молочной железы, так и в пользу генетического дефекта с не в полной мере доказанной значимостью. Тем не менее в среднесрочной перспективе можно ожидать создания систем популяционного скрининга для определения носительства мутаций, предрасполагающих к развитию рака [4, 12, 15–17].
Другой сферой применения мультигенных тестов в онкологии является анализ соматических мутаций в опухолях. Количество известных генов-мишеней, ассоциированных с чувствительностью к тем или иным лекарственным препаратам, относительно невелико — оно измеряется в лучшем случае десятками, а при использовании максимально расширенных критериев — сотнями. Вероятность обнаружения каждого отдельного события в каждой конкретной опухоли обычно ничтожно мала: например, мутации в гене EGFR, характерные для карцином легкого, встречаются лишь в единичных случаях других разновидностей новообразований. Однако если соединить все перспективные для выбора лечения генные мутации в едином пуле и подвергнуть анализу всех пациентов, то число индивидуумов, у которых удастся выявить мишень для терапии [18–23], будет значимо. Разработка мультигенных панелей для диагностики определенных мутаций представляет нетривиальную задачу. Значительное количество предиктивных мутаций приходится на транслокации с варьирующими точками разрыва. В качестве примера можно привести перестройки в генах ALK, ROS1, NTRK1, NTRK2, NTRK3 и т. д. Для идентификации подобных событий необходимо секвенировать интроны на матрице ДНК, а также проанализировать последовательности РНК (кДНК). Еще большей проблемой является интерпретация результатов. Если достаточно частые мутации, например внутригенные делеции экзона 19 в гене EGFR или замены в кодоне 600 гена BRAF, обладают очевидной предиктивной значимостью, многие другие события, в частности редкие аминокислотные замены, далеко не всегда ассоциированы с особенностями лекарственной чувствительности опухоли [4, 21–25]. Помимо анализа индивидуальных мутаций определенную ценность может представлять примерная оценка общего количества соматических событий. Большое количество соматических генных нарушений ассоциировано с увеличенной антигенностью опухоли и, следовательно, с более высокой вероятностью ответа на иммунную терапию [26]. В мире существует несколько сервисов, специализирующихся на NGS-анализе опухолей. Они не только выполняют само NGS-исследование, но и интерпретируют его результаты. Опубликованы работы, оценивающие клиническую эффективность терапии, назначенной на основании данных мультигенного секвенирования. В целом подобный подход позволяет добиться положительного эффекта у отдельных пациентов [27–29].
Мониторинг молекулярного портрета опухоли в процессе лечения
Вне зависимости от сценария, по которому опухоль ускользает от системного лечения, следует признать, что терапия не может основываться лишь на анализе первичного новообразования — представляется крайне необходимым постоянно следить за динамикой свойств опухоли на протяжении всей истории болезни [30]. Необходимо учитывать, что уже в настоящее время существует целый ряд алгоритмов назначения лечения в зависимости от изменений молекулярного портрета опухоли. В ходе эндокринной или HER2-специфической терапии при раке молочной железы может меняться статус соответствующих рецепторов, что делает нецелесообразным продолжение приема таргетного средства. Лечение ингибиторами ароматазы иногда приводит к активации онкогена HER2 посредством точковой мутации — соответственно, для подобной изоформы HER2-рецептора необходимы эффективные препараты [33, 34]. Лечение гефитинибом или эрлотинибом опухолей легкого примерно в половине случаев сопровождается появлением мутации Т790М в гене, кодирующем рецептор эпидермального фактора роста (EGFR). Для инактивации Т790М-мутированного белка EGFR разработан специальный препарат — осимертиниб [35]. Наиболее наглядным примером повторного анализа опухоли в процессе лечение является исследование операционного материала, полученного после неоадъювантной терапии. В данном случае пациенты не подвергаются отдельным интервенционным мероприятиям, направленным на получение репрезентативных фрагментов новообразования. Куда более сложной представляется задача мониторинга метастатических очагов карцином, которые служат объектом для воздействия системной терапии на протяжении длительных промежутков времени. В некоторых случаях, например при таргетной терапии рака легкого, допускается выполнение серийных биопсий [36–38]. Эти инвазивные процедуры сопряжены со значительными рисками для пациента и высокой нагрузкой на систему здравоохранения в целом. Существенно, что в большинстве случаев прогрессирование заболевания сопровождается появлением нескольких метастатических очагов, при этом каждый из них может иметь собственную траекторию молекулярной эволюции. Выполнение серийных биопсий всех опухолевых узлов представляется абсолютно неприемлемым сценарием обследования больного. Значительные усилия направлены на разработку методов неинвазивного мониторинга биологического статуса новообразования [30].
Большую известность получила технология так называемой жидкостной биопсии. Известно, что у онкологических пациентов в периферической крови и других жидкостях могут содержаться фрагменты опухоли — циркулирующие трансформированные клетки, опухолеспецифические (тканеспецифические) белки, фрагменты ДНК, микроРНК и т. д. Анализ опухолеспецифических последовательностей ДНК — наиболее перспективная технологическая платформа для жидкостной биопсии, так как многие молекулярно-генетические методики — полимеразная цепная реакция, NGS и т. д. — позволяют выявлять единичную мутированную копию гена в присутствии избытка нормальной ДНК. Серийный анализ образцов плазмы не вызывает затруднений для пациента. Считается, что жидкостная биопсия позволяет получить интегральное представление о биологическом статусе всех опухолевых очагов, присутствующих в организме [39–41]. В настоящее время жидкостная биопсия уже используется в практической онкологии для анализа мутаций EGFR Т790М у пациентов, получающих лечение гефитинибом, эрлотинибом или афатинибом. На основе результатов данного теста принимают решение о целесообразности назначения ингибитора EGFR третьего поколения — препарата осимертиниба [42, 43]. Ожидается, что в среднесрочной перспективе сфера использования жидкостной биопсии заметно расширится.
Персонализированные ex vivo модели опухолей
Этот раздел целесообразно начать с примера, отражающего современные подходы к лечению инфекционных заболеваний. В настоящее время рутинным способом обследования пациентов с признаками инфекции является посев. Эта процедура позволяет не только установить спектр патогенных микроорганизмов, но и выполнить тесты на их чувствительность к антибиотикам. Примерно такой же по своей идее подход может применяться по отношению к онкологическим пациентам. Существуют методы культивирования опухолевых клеток ex vivo. Подобная технология, по крайней мере в теории, может позволить выполнить ряд тестов, направленных на персонализированный подбор противоопухолевой терапии [44]. Получение ex vivo индивидуальных клонов опухолей — достаточно сложный процесс. Наиболее простым подходом считается культивирование опухолевых клеток in vitro. В подавляющем большинстве случаев эти клетки прекращают деление уже в течение нескольких пассажей, поэтому многие тесты ориентированы преимущественно на работу с так называемыми краткосрочными культурами. Для отдельных пациентов удается получить так называемую долгосрочную культуру — как правило, это связано с тем, что при пассировании опухолевых клеток происходят дополнительные генетические события, обеспечивающие иммортализацию клеточной линии. Существует огромное количество различных лабораторных приемов для повышения эффективности процесса получения клеточных культур. Они включают использование различных питательных средств, вспомогательных факторов роста, биохимических добавок, подложек и т. д. Тем не менее многие разновидности новообразований с трудом подвергаются перевивке в культуру — в наибольшей мере это ограничение присуще карциномам с относительно благоприятным течением, в частности опухолям молочной железы, новообразованиям простаты и т. д. [44–47].
Дополнительная информация
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Рис. 1. Рак толстой кишки: утрата типичной гистологической структуры в ходе неопластического процесса
Помимо установления самого факта злокачественной трансформации для назначения индивидуализированной терапевтической схемы важно как можно раньше определить гистологический тип опухоли и оценить стандартные маркеры агрессивности (степень дифференцировки, митотическая активность и т. д.). В пределах одного органа патологический процесс может развиваться по совершенно разным сценариям, вовлекать разнообразные клетки и структуры. Например, среди злокачественных новообразований легкого насчитывают, по современным представлениям, более шести гистологических типов, для каждого из которых необходимы свои терапевтические подходы (рис. 2) [1]. Мелкоклеточный рак легкого отличается стремительным течением, ранним метастазированием и очень плохим прогнозом. Карциноидные опухоли, происходящие из клеток диффузной нейроэндокринной системы, имеют наилучший прогноз; это единственный тип карцином легкого, который, как ныне считается, никак не связан с курением. Саркома легких — агрессивная опухоль, развившаяся из клеток соединительнотканных структур легкого. Аденокарциномы состоят преимущественно из железистых клеток и имеют периферическую локализацию. Опухоли этого типа зачастую развиваются у некурящих людей. Они могут нести активирующие мутации в генах EGFR, ALK и ROS1, которые являются терапевтической мишенью для действия таргетных препаратов — ингибиторов тирозинкиназ.
Рис. 2. Гистологические типы рака легкого: мелкоклеточный рак (14%); плоскоклеточный (эпидермоидный) рак (20%); аденокарцинома (38%); крупноклеточный рак (3%); карциноид (5%); мезенхимальные, в том числе саркомы и лимфомы (5%); опухоли смешанных типов — плоскоклеточный и аденокарцинома, аденокарцинома и мелкоклеточный и т.д. (15%)
Чтобы безошибочно установить гистологический тип опухоли в затруднительных ситуациях, вызванных, к примеру, маленьким размером образца или утратой опухолевыми клетками способности к образованию специфических структур (низкая степень дифференцировки), или выявить некоторые специфические характеристики новообразования, морфологи используют иммуногистохимическое окрашивание (ИГХ). Этот метод сформировался еще в середине 1980-х годов [2] и сразу стал одним из наиболее востребованных в клинической онкологии (рис. 3). Появление такого диагностического теста, например, существенно изменило роль патоморфологического исследования в лечении рака молочной железы: именно от результатов ИГХ-анализа на рецепторы к эстрогенам (ER) и прогестерону (PgR), которые синтезируется опухолевыми клетками при этом заболевании, зависит назначение эндокринной терапии. В настоящее время антагонисты эстрогенов, замедляющих деление клеток рака молочной железы, принимают примерно 70% пациенток [3]. С помощью ИГХ можно также обнаружить увеличение синтеза онкобелка HER2/neu (от англ. human epidermal growth factor receptor — рецептор эпидермального фактора роста, или трансмембранная рецепторная тирозинкиназа). Опухоли, вырабатывающие HER2/neu, оказались чувствительными к терапевтическим ингибиторам этой тирозинкиназы, и назначение соответствующих лекарственных препаратов (например, трастузумаба) основано на результатах тестов, в числе которых и ИГХ-анализ [4].
Рис. 3. Схема иммуногистохимического (ИГХ) метода и примеры его применения. Первичные антитела связываются с искомым антигеном (гормоном или его рецептором) и становятся видны в световой микроскоп благодаря соединению с вторичными антителами, мечеными ферментом, при этом пероксидазная активность выявляется с помощью 3,3-диаминобензидина (DAB). Справа приведены примеры оценки рецепторного статуса карцином молочной железы: ИГХ-реакция с антителами к рецепторам эстрогенов (а — негативная реакция, б — ядерное окрашивание, 100% клеток) и с антителами к HER2/neu (в — мембранное окрашивание, оценка 3+)
Рис. 4. Низкодифференцированная аденокарцинома легкого (а, среди фиброзной ткани отдельно расположенные опухолевые клетки) и положительная ИГХ-реакция с антителом к TTF-1 в ядрах опухолевых клеток (б)
В клиническом исследовании изучали эффективность EGFR-ингибитора (гефитиниба) на самом первом этапе лечения пациентов с мутацией EGFR [6]. Чтобы включить в исследование 25 больных, нам потребовалось проанализировать образцы тканей более 500 пациентов с раком легкого, что связано с низкой частотой этой мутации, которая в общей выборке больных не превышает 6–7%. Результаты исследования поражают воображение: эффект от препарата наблюдался у всех без исключения пациентов, в то время как аналогичный показатель при назначении стандартной терапии обычно не составляет 20–30% (рис. 5).
Рис. 5. Снижение размеров опухолевых очагов (%) в ответ на применение EGFR-ингибитора (гефитиниба) у пациентов с активирующими мутациями в гене EGFR: делецией 19-го экзона (19del) и заменой в 21-м экзоне (L858R) [6]
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект 16-04-00921).
Литература
1. Wistuba I., Brambilla E., Noguchi M. Chapter 17: Classic Anatomic Pathology and Lung Cancer // IASLC Thoracic Oncology. Pass H. I., Ball D., Scagliotti G. V. (eds) Aurora, Colorado, 2014; 217–240.
2. Taylor C. R., Burns J. The demonstration of plasma cells and other immunoglobulin-containing cells in formalin-fixed, paraffin-embedded tissues using peroxidase-labelled antibody // J. Clin. Pathol. 1974; 27(1): 14–20.
3. Pertschuk L. P., Tobin E. H., Gaetjens E. et al. Histochemical assay of estrogen and progesterone receptors in breast cancer: correlation with biochemical assays and patients’ response to endocrine therapies // Cancer. 1980; 46(12 Suppl): 2896–2901.
4. Pegram M. D., Lipton A., Hayes D. F. et al. Phase II study of receptor-enhanced chemosensitivity using recombinant humanized anti-p185HER2/neu monoclonal antibody plus cisplatin in patients with HER2/neu-overexpressing metastatic breast cancer refractory to chemotherapy treatment // J. Clin. Oncol. 1998; 16: 2659–2671.
5. Stenhouse G., Fyfe N., King G. et al. Thyroid transcription factor 1 in pulmonary adenocarcinoma // J. Clin. Pathol. 2004; 57(4): 383–387. DOI: 10.1136/jcp.2003.007138.
6. Moiseyenko V. M., Procenko S. A., Levchenko E. V. et al. High efficacy of first-line gefitinib in non-Asian patients with EGFR-mutated lung adenocarcinoma // Onkologie. 2010; 33(5): 231–238. DOI: 10.1159/000302729.
7. Birner P., Prager G., Streubel B. Molecular pathology of cancer: how to communicate with disease // ESMO Open. 2016; 1(5): e000085. DOI: 10.1136/esmoopen-2016-000085.

Александр Олегович Иванцов, доктор медицинских наук
— Чтобы ответить на этот вопрос, стоит разобраться как развивается опухоль. Она имеет автономный характер роста. Что это значит? В норме количество клеток в организме человека регулируется балансировкой двух противоположных процессов – клеточного деления и клеточной гибели. При росте опухоли прибавление клеточной массы опережает клеточную гибель. Это возможно по двум причинам – либо активируются процессы пролиферации, т.е. деления клетки, либо угнетается апоптоз, т.е. запрограммированная клеточная гибель. Автономность опухоли состоит в том, что ее клетки не способны реагировать на внешние сигналы организма, и, как следствие, она продолжает рост.
Если изменения нуклеотидной последовательности ДНК происходят в значащих фрагментах ДНК (прим. – экзонах), то они могут привести к развитию опухоли. К развитию рака приводят в основном мутации, нарушающие баланс деления и гибели клеток, то есть мутации в генах, контролирующих именно эти процессы. Мутации могут возникать случайно, например, в процессе удвоения ДНК в результате деления клетки. А могут возникать под влиянием мутагенов: например, воздействия ультрафиолетового или рентгеновского излучения, высокой температуры, некоторых химических веществ. На последний вопрос, можно ответить, что патогенность мутации можно предположить в первую очередь по функции гена, который она затрагивает, по её структурным характеристикам (насколько сильно она нарушает или изменяет работу этого гена), и подтвердить путем функциональных исследований (например, на клеточных культурах).
— Что такое онкогены?
— Онкогеном называется ген, который в норме не оказывает влияние на процессы деления и гибели клеток, а в опухоли активизируется, вследствие чего раковые клетки приобретают способность к неконтролируемому размножению. Кроме того, в настоящее время известно о роли антионкогенов. В норме они подавляют процесс деления клеток или способствуют их гибели, а в опухоли этот сдерживающий эффект подобных генов отсутствует, тем самым провоцируется рост опухолевых масс. Современная наука полагает, что для возникновения трансформированного клеточного клона необходимо как минимум пять-девять мутаций в разных онкогенах и антионкогенах.
— Эти мутации можно выявить с помощью генетического исследования?

— Кому и чем могут помочь генетические исследования? Верно ли, что от генетического исследования может зависеть успех лечения? Кому стоит пройти генетическое исследование на мутации?
— Сфера медицинского применения ДНК- и РНК-тестов в современной онкологии постоянно расширяется. Сейчас это тестирование позволяет диагностировать наследственные опухолевые синдромы, выявить предиктивные мутации, осуществить анализ экспрессионных характеристик опухоли. Также совершенствуются технологии, которые позволяют уточнять диагноз опухолей с невыявленным первичным очагом, эффективно контролировать течение заболевания и изменения свойств опухоли (жидкостная биопсия), выполнять различные биологические тесты с опухолевыми клетками.
Индивидуализация лечения онкологического пациента во многих случаях напрямую зависит от результатов генетического тестирования. Эмпирический подход, сопряжённый со случайным перебором биологически активных химикатов, постепенно замещается научно-обоснованным, молекулярно-направленным поиском специфических противоопухолевых средств, направленных на активацию или инактивацию ключевых биохимических компонентов опухолевой трансформации.
Например, еще недавно клиническое деление всех первичных опухолей легкого на мелкоклеточный и немелкоклеточный рак было достаточным для определения стратегии лечения. Ситуация изменилась с открытием активирующих мутаций в гене, который кодирует рецептор эпидермального фактора роста — EGFR, сделавших этот онкогенный белок избирательной мишенью для воздействия препаратов ингибиторов EGFR. Мутации EGFR, как правило, встречаются у пациентов с аденокарциномой легкого. Тест на мутацию EGFR позволяет практически со 100%-й достоверностью отобрать тех больных, у которых гарантирован положительный результат применения гефитиниба, эрлотиниба или афатиниба.
— Может ли генетическое исследование помочь здоровому человеку предупредить рак или выявить его на ранней стадии?
Генетическое исследование при подозрении на наследственный раковый синдром носит комплексный характер. Оно начинается со сбора онкологического анамнеза ‒ уделяется внимание случаям злокачественных заболеваний у кровных родственников. В результате составляются родословные, позволяющие заподозрить наследственную патологию. На заключительном этапе проводится анализ ДНК, что позволяет установить наличие в генотипе больного, а также членов его семьи, подозреваемые мутации.
— Какие виды мутаций ученые уже выявили? Существует ли для каждого вида таргетный препарат? Как именно работает таргетный препарат?
— Много разных видов мутаций при разных опухолях известны, но наибольший интерес представляют мутации в онкогенах, в частности, в рецепторных протеинкиназах, для блокировки которых разрабатываются специфические препараты. Мутации в протеинкиназах изменяют конформацию белковых молекул и, таким образом, формируют идеальное терапевтическое окно. Таргетный препарат избирательно воздействует на клетки опухоли, содержащие молекулярную мишень, и этим выгодно отличается от химиотерапии. Известно об успешном использовании ингибитора тирозинкиназы ALK – кризотиниба – у больных с ALK-транслоцированными карциномами легкого. Успешным оказалось и применение специфических ингибиторов мутированного белка BRAF – вемурафениба и дабрафениба для лечения больных меланомой. Другой пример: ген BRCA1 кодирует фермент репарации ДНК. BRCA1-дефицитные клетки демонстрируют неспособность эффективно удалять сшивки ДНК, индуцированные препаратами платины. В наследственных BRCA1-ассоциированных раках отмечается наибольшая эффективность цисплатина, т.к. в опухолевых клетках наблюдается соматическая утрата оставшегося BRCA1-аллеля, в то время как нормальные клетки носительниц мутаций BRCA1 сохраняют интактную копию данного гена. Этим обусловлено уникальное терапевтическое окно и это объясняет высокую эффективность цисплатина при лечении BRCA1-ассоциировнного рака молочной железы, яичника. Конечно, по разным причинам, не для всех мутаций есть такие препараты, но их спектр и количество неуклонно возрастает.
— В настоящее время проводятся исследования в двух направлениях: диагностика наследственных раковых синдромов и индивидуализация подбора лекарственных препаратов на основе молекулярных характеристик опухоли. Тем самым повышается клиническая эффективность применения дорогостоящих лекарственных препаратов, снижается частота и тяжесть побочных эффектов, и в некоторых случаях предотвращается неблагоприятный исход заболевания.
Читайте также:

