Дисперсные системы истинные растворы реферат
Обновлено: 03.07.2024
Чистые вещества в природе встречаются очень редко. Смеси разных веществ в различных агрегатных состояниях могут образовывать гетерогенные и гомогенные системы — дисперсные системы и растворы.
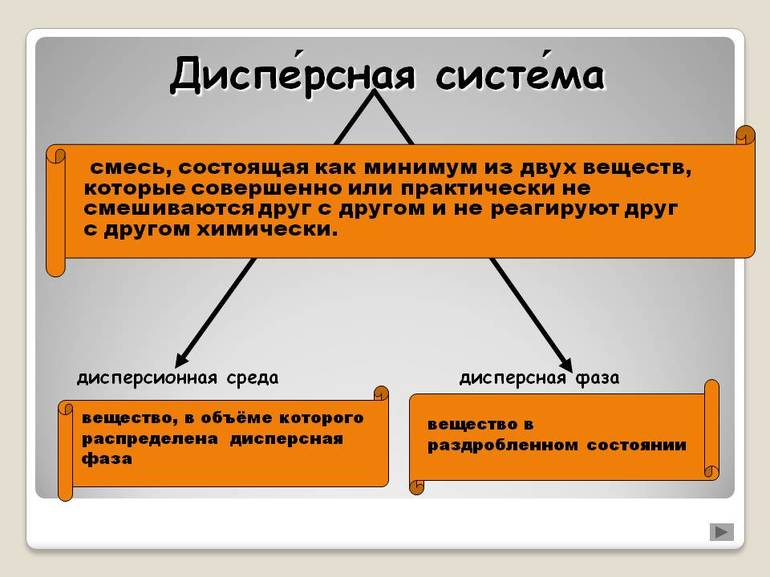
| Дисперсными называют гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объеме другого. |
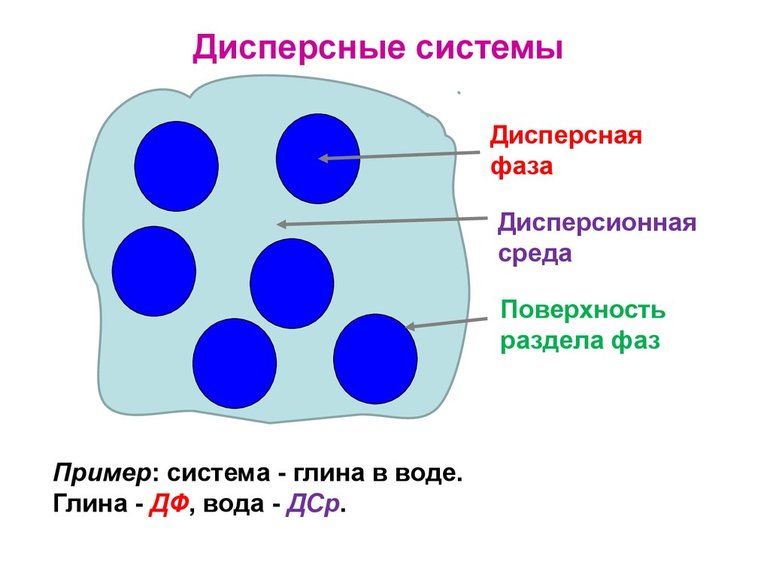
То вещество, которое присутствует в меньшем количестве и распределено в объеме другого, называют дисперсной фазой. Она может состоять из нескольких веществ.
Вещество, присутствующее в большем количестве, в объеме которого распределена дисперсная фаза, называют дисперсионной средой. Между ней и частицами дисперсной фазы существует поверхность раздела, поэтому дисперсные системы называют гетерогенными (неоднородными).
И дисперсионную среду, и дисперсную фазу могут представлять вещества, находящиеся в различных агрегатных состояниях — твердом, жидком и газообразном.
В зависимости от сочетания агрегатного состояния дисперсионной среды и дисперсной фазы можно выделить 8 видов таких систем (табл. 11).
Таблица 11
Примеры дисперсных систем


По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делят на грубодисперсные (взвеси) с размерами частиц более 100 нм и тонкодисперсные (коллоидные растворы или коллоидные системы) с размерами частиц от 100 до 1 нм. Если же вещество раздроблено до молекул или ионов размером менее 1 нм, образуется гомогенная система — раствор. Она однородна (гомогенна), поверхности раздела между частицами дисперсной фазы и средой нет.
Уже беглое знакомство с дисперсными системами и растворами показывает, насколько они важны в повседневной жизни и в природе (см. табл. 11).
Судите сами: без нильского ила не состоялась бы великая цивилизация Древнего Египта; без воды, воздуха, горных пород и минералов вообще бы не существовала живая планета — наш общий дом — Земля; без клеток не было бы живых организмов и т. д.
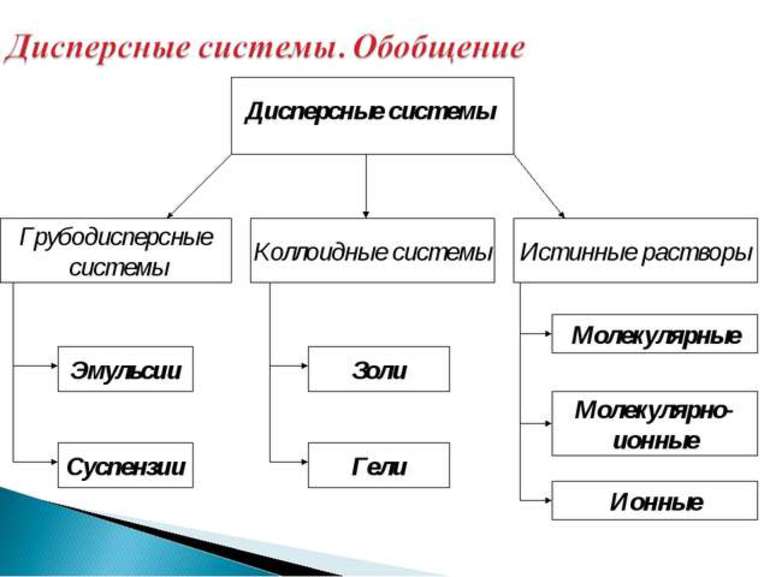
Классификация дисперсных систем и растворов представлена на схеме 2.
Схема 2
Классификация дисперсных систем и растворов

Взвеси
Аэрозоли играют важную роль в природе, быту и производственной деятельности человека. Скопления облаков, обработка полей химикатами, нанесение лакокрасочных покрытий при помощи пульверизатора, распыление топлива, выработка сухих молочных продуктов, лечение дыхательных путей (ингаляция) — примеры тех явлений и процессов, где аэрозоли приносят пользу.
Аэрозоли — туманы над морским прибоем, вблизи водопадов и фонтанов, возникающая в них радуга доставляет человеку радость, эстетическое удовольствие.
Для химии наибольшее значение имеют дисперсные системы, в которых средой является вода.
Коллоидные системы
Коллоидные системы — это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм. Эти частицы не видны невооруженным глазом, и дисперсная фаза и дисперсионная среда в таких системах отстаиванием разделяются с трудом.
Их подразделяют на золи (коллоидные растворы) и гели (студни).
1. Коллоидные растворы, или золи. Это большинство жидкостей живой клетки (цитоплазма, ядерный сок — кариоплазма, содержимое органоидов и вакуолей) и живого организма в целом (кровь, лимфа, тканевая жидкость, пищеварительные соки, гуморальные жидкости и т. д.). Такие системы образуют клеи, крахмал, белки, некоторые полимеры.
Частицы дисперсной фазы коллоидных растворов нередко не оседают даже при длительном хранении из-за непрерывных соударений с молекулами растворителя за счет теплового движения. Они не слипаются и при сближении друг с другом из-за наличия на их поверхности одноименных электрических зарядов. Но при определенных условиях может происходить процесс коагуляции.
Коагуляция — явление слипания коллоидных частиц и выпадения их в осадок — наблюдается при нейтрализации зарядов этих частиц, когда в коллоидный раствор добавляют электролит. При этом раствор превращается в суспензию или гель. Некоторые органические коллоиды коагулируют при нагревании (клей, яичный белок) или при изменении кислотно-щелочной среды раствора.
Функция "чтения" служит для ознакомления с работой. Разметка, таблицы и картинки документа могут отображаться неверно или не в полном объёме!
Министерство общего и профессионального образования Российской Федерации.
Студент МСФ С-110 Проверил:
Бродовская Г.Ф.г. Омск, 2000
1. Дисперсные системы. Истинные растворы:
Кристаллы любого вещества, например сахара или хлорида натрия, можно получить разного размера – крупные и мелкие. Каков бы ни был размер кристаллов, все они имеют одинаковую для данного вещества внутреннюю структуру – молекулярную или ионную кристаллическую решетку.
При растворении в воде кристаллов сахара и хлорида натрия образуются соответственно молекулярные и ионные растворы. Таким образом, одно и то же вещество может находиться в различной степени раздробленности: макроскопически видимые частицы (>0,2 мм, разрешающая способность глаза), микроскопически видимые частицы (от 0,2-0,1мм до 400-300нм, разрешающая способность микроскопа при освещении белым светом) и в молекулярном (или ионном) состоянии.
Если толщина плёнок, поперечник волокон или частиц (корпускул) меньше разрешающей способности оптического микроскопа то они не могут быть обнаружены с его помощью. Такие невидимые в оптический микроскоп частицы называют коллоидными, а раздробленное (диспергированное) состояние веществ с размером частиц от 400-300нм до 1нм – коллоидным состоянием вещества.
Дисперсные (раздробленные) системы являются гетерогенными. Они состоят из сплошной непрерывной фазы – дисперсионной среды и находящихся в этой среде раздробленных частиц того или иного размера и формы – дисперсной фазы.
Поскольку дисперсная (прерывная) фаза находится в виде отдельных небольших частиц, то дисперсные системы, в отличие от гетерогенных со сплошными фазами, называют микрогетерогенными, а коллоиднодисперсные системы называют также ультрамикрогетерогенными, чтобы подчеркнуть, что в этих системах граница раздела фаз не может быть обнаружена в световом микроскопе.
Когда вещество находится в окружающей среде в виде молекул или ионов, то такие растворы называют истинными, т.е. гомогенными однофазными растворами.
Обязательным условием получения дисперсных систем является взаимная нерастворимость диспергируемого вещества и дисперсионной среды. Например, нельзя получить коллоидные растворы сахара или хлорида натрия в воде, но они могут быть получены в керосине или в бензоле, в которых эти вещества практически нерастворимы.
Дисперсные системы классифицируют по дисперсности, агрегатному состоянию дисперсной фазы и дисперсионной среды, интенсивности взаимодействия между ними,
Дисперсные системы – образования, состоящие из двух или более фаз, которые практически не смешиваются и не реагируют друг с другом. Вещество, которое мелко распределено в другом веществе (дисперсионная среда) называют дисперсной фазой.
Существует классификация дисперсных систем по размеру частиц дисперсной фазы. Выделяют, молекулярно-ионные ( 100 нм) системы.
Различают гомогенные и гетерогенные дисперсные системы. Гомогенные системы по-другому называют истинными растворами.
Растворы
По агрегатному состоянию растворы делят на газообразные (воздух), жидкие, твердые (сплавы). В жидких растворах существует понятие растворителя и растворенного вещества. В большинстве случаев растворителем служит вода, однако это могут быть и неводные растворители (этанол, гексан, хлороформ).
Способы выражения концентрации растворов
Для выражения концентрации растворов используют: массовую долю растворенного вещества ( , %), которая показывает, сколько граммов растворенного вещества содержится в 100 г раствора.
![]()
Молярная концентрация (СМ, моль/л) показывает, сколько моль растворенного вещества содержится в одном литре раствора. Растворыс концентрацией 0,1 моль/л называют децимолярными, 0,01 моль/л – сантимолярными, а с концентрацией 0,001 моль/л – миллимолярными.
![]()
Нормальная концентрация (СН, моль-экв/л) показывает число эквивалентов растворенного вещества в одном литре раствора.
Моляльная концентрация (Сm, моль/1кг H2O) – число моль растворенного вещества, приходящееся на 1 кг растворителя, т.е. на 1000 г воды.
Мольная доля растворенного вещества (N) – это отношение числа моль растворенного вещества к числу моль раствора. Для газовых растворов мольная доля вещества совпадает с объемной долей ( φ).
Растворимость
По растворимости растворы и вещества делят на 3 группы: хорошо растворимые (сахар), малорастворимые (бензол, гипс) и практически нерастворимые (стекло, золото, серебро). Абсолютно нерастворимых веществ в воде нет, нет приборов, с помощью которых возможно вычислить количества вещества, которое растворилось. Растворимость зависит от температуры (рис. 1), природы вещества и давления (для газов). При повышении температуры, растворимость вещества увеличивается.

Рис. 1. Пример зависимости некоторых солей в воде от температуры
С понятием растворимости тесно связано понятие насыщенного раствора, поскольку растворимость характеризует массу растворенного вещества в насыщенном растворе. Пока вещество способно растворяться раствор называют ненасыщенным, если вещество перестает растворяться – насыщенным; на некоторое время можно создать пересыщенный раствор.
Давление пара растворов
Пар, находящийся в равновесии с жидкостью называется насыщенным. При заданной температуре давление насыщенного пара над каждой жидкостью – величина постоянная. Поэтому каждой жидкости присуще давление насыщенного пара. Рассмотрим это явление на следующем примере: раствор неэлектролита (сахарозы) в воде – молекулы сахарозы значительно больше молекул воды. Давление насыщенного пара в растворе создает растворитель. Если сравнить между собой давление растворителя и давление растворителя над раствором при одинаковой температуре, то в растворе число молекул, перешедших в пар над раствором меньше, чем в самом растворе. Отсюда следует, что давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем при той же температуре.
Если обозначить давление насыщенного пара растворителя над чистым растворителем p0, а над раствором – p, то относительное понижение давления пара над раствором будет представлять собой (p0-p)/p0.
На основании этого Ф.М. Рауль вывел закон: относительное понижение насыщенного пара растворителя над раствором равно молярной доле растворенного вещества : (p0-p)/p0 = N (молярная доля растворенного вещества).
Криоскопия. Эбулиоскопия. Второй закон Рауля
Понятия криоскопии и эбулиоскопии тесно связаны с температурами замерзания и кипения растворов, соответственно. Так, температура кипения и кристаллизация растворов зависят от давления пара над раствором. Любая жидкость кипит при той температуре, при которой давление ее насыщенного пара достигает внешнего (атмосферного давления).
При замерзании кристаллизация начинается при той температуре, при которой давление насыщенного пара над жидкой фазой равно давлению насыщенного пара над твердой фазой. Отсюда – второй закон Рауля: понижение температуры кристаллизации и повышение температуры кипения раствора пропорционально концентрациям растворенного вещества. Математическое выражение этого закона:
где К и Е криоскопическая и эбулиоскопическая константы, зависящие от природы растворителя.
Примеры решения задач
| Задание | Какое количество воды и 80%-го раствора уксусной кислоты следует взять для получения 200 г 8%-го раствора? |
| Решение | Записываем формулу для нахождения массовой доли: |
![]()
Пусть масса 80% раствора уксусной кислоты равна х г. Найдем массу растворенного в нем вещества:
mр.в-ва(CH3COOH) =mр-ра × /100%
Найдем массу растворенного вещества в растворе 8%-й уксусной кислоты:
Масса 80% раствора уксусной кислоты равна 20 (г).
Найдем необходимое количество воды:
m(H2O) = 200 (г) – 20 (г) = 180 (г)
| Задание | Смешали 200 г воды и 50 г гидроксида натрия. Определите массовую долю гидроксида натрия в растворе. |
| Решение | Записываем формулу для нахождения массовой доли: |
![]()
Найдем массу раствора гидроксида натрия:
mр-ра (NaOH) = 200 +50 = 250 (г)
Найдем массовую долю гидроксида натрия:
(NaOH)= 50/250 × 100% = 20%
| Задание | Определите массу 10%-го раствора карбоната натрия, которую нужно добавить к 1020 г 2%-го раствора, чтобы получить 3%-й раствор. |
| Решение | Записываем формулу для нахождения массовой доли: |
![]()
Найдем массу растворенного карбоната натрия в его 2%-м р-ре:
m(Na2CO3) в 2%-м р-ре = mр-ра(Na2СO3)2% × /100%
Ключевые слова конспекта: Дисперсные системы: дисперсная фаза и дисперсионная среда. Классификация дисперсных систем по агрегатному состоянию и размеру частиц дисперсной фазы. Грубодисперсные системы: эмульсии, суспензии, аэрозоли. Тонкодисперсные системы: золи и гели. Синерезис и коагуляция.
В природе индивидуальные вещества почти не встречаются, а образуют различные смеси, в том числе и дисперсные системы (от лат. dispersus — рассеянный, рассыпанный). Но можно ли чистый горный воздух назвать такой системой? Очевидно, нет, потому что у него отсутствует такой важный признак, как гетерогенность (от лат. heterogenes — неоднородный по составу), т. е. поверхность раздела фаз веществ системы.
Агрегатные состояния дисперсной фазы и среды в двухкомпонентной дисперсной системе позволяют выделить восемь типов дисперсных систем.
- Если размер частиц дисперсной фазы составляет от 1 до 100 нм, систему называют тонкодисперсной, или коллоидной системой.
- Если размер частиц дисперсной фазы превышает 100 нм, систему называют грубодисперсной системой.
В свою очередь, грубодисперсные системы делятся на эмульсии, суспензии и аэрозоли.

К эмульсиям относятся жиросодержащие продукты питания: молоко, сливки, сметана, сливочное масло, маргарин, майонез и др. Нерастворимые в воде жидкие растительные и твёрдые животные жиры, попадая в организм, под действием желчи разрушаются на мелкие капельки, образуя водную эмульсию. Эта эмульсия с помощью ферментов (например, липазы) гидролизуется до глицерина и жирных кислот, которые транспортируются в кровь.
В медицине широко применяются эмульсии, позволяющие оказать энергетическую поддержку ослабленному организму, которые готовят на основе растительного масла (оливкового, соевого или хлопкового). В фармацевтической и косметической промышленности эмульсиями являются многие лекарственные и косметические препараты. В сельском хозяйстве для борьбы с вредителями используют эмульсии пестицидов. В металлообработке эмульсии используются в качестве охлаждающих и смазочных жидкостей.
В суспензиях частицы фазы отражают видимый свет, а потому визуально они воспринимаются как мутные системы.
Если вы помогали проводить ремонт дома, хотя бы косметический, то суспензии вы использовали часто. Это вододисперсионные краски, цементный раствор, бетон (строительные растворы). Широко распространены суспензии среди косметических и гигиенических средств: кремы, мази, зубные пасты.
В медицинской практике для лечения кожных заболеваний используют суспензии, содержащие кальциевые, магниевые, цинковые и другие препараты, а также пасты — предельно концентрированные суспензии. В сельском хозяйстве ядохимикаты, пестициды, минеральные удобрения применяют в основном в виде суспензий.
В быту обычной практикой стало применение таких грубодисперсных систем, как аэрозоли.
Аэрозоли с жидкой дисперсной фазой называются туманами, а с твёрдой — дымами. К естественным туманам относятся некоторые виды облаков, в том числе пылевые. Разновидностью дыма является смог, который появляется в результате выбросов промышленных предприятий, авто– и авиатранспорта и пр.
Аэрозоли возникают при распылении различных пестицидов, освежителей воздуха, парфюмерных жидкостей и т. д.
Аэрозоли также широко распространены в различных сферах производства: порошковая металлургия, технология лакокрасочного производства и т. д.
Промежуточное положение между истинными растворами (молекулярными, ионными, молекулярно-ионными), т. е. растворами, в которых размер растворённых частиц меньше 1 нм, и грубодисперсными системами занимают тонкодисперсные системы, или коллоидные растворы.
К природным коллоидным системам относятся: почва, глина, природные воды, многие минералы и драгоценные камни.
Живые организмы представляют собой совокупность множества коллоидных систем, которые можно разделить на золи и гели.
К золям относится большинство жидкостей организма: кровь, лимфа, плазма крови, пищеварительные соки, слюна и др. Коллоидными растворами является содержимое клеток (цитоплазма, клеточный сок вакуолей, ядерный сок). В качестве дисперсной фазы в них выступают молекулы белков, жиров, холестерина, гормонов.
В золях можно наблюдать явление коагуляции, т. е. процесс укрупнения частиц дисперсной фазы и выпадение их в осадок.

Более плотные коллоидные системы живых организмов относятся к гелям.
Гели — это коллоидные системы с соприкасающимися частицами.
Со временем структура гелей нарушается — из них самопроизвольно выделяется вода. Это явление называется синерезисом. На его основе можно судить о качестве и сроках годности пищевых, медицинских и косметических продуктов.
Биологический синерезис происходит при свёртывании крови, в результате чего растворимый белок фибриноген превращается в нерастворимый — фибрин, образующий тромб, который закупоривает кровеносный сосуд. В этом случае коллоидный раствор белка превращается в гель, который уплотняется в результате синерезиса.
Визуально коллоидные и истинные растворы различают с помощью эффекта Тиндаля. При пропускании луча света через коллоидный раствор в нём возникает светящаяся дорожка из-за рассеивания света частицами дисперсной фазы. Частицы истинного раствора настолько малы, что не рассеивают свет. Подобное эффекту Тиндаля явление можно наблюдать при рассеивании лучей солнечного света частицами аэрозольного коллоида — воздуха.
Крайне редко в природе встречаются вещества в идеально чистом виде и состоянии. Обычно это разбавленная гомогенная субстанция, состоящая из различных атомов и молекул. Причем это необязательно 2 элемента, встречаются соединения с тремя и более. Когда одна структура находится в другой, равномерно распределяется, но не растворяется в ней, — это дисперсные системы.
- Понятие и определение
- Классификация по агрегатному состоянию
- Существующие виды
- Взвеси и их особенности
- Коллоидные системы
- Высокомолекулярные вещества
- Ключевые свойства
Понятие и определение
Дисперсные системы представляют собой гетерогенные структуры, внутри которых одно или более веществ распределяются в другом. Они никак не контактируют друг с другом, химические или иные реакции полностью отсутствуют. Нет и смешения. Фактически каждый элемент является самостоятельным, и если его извлечь, он сохраняет свое изначальное состояние.
То вещество, которого больше всего в соединении, называется дисперсной средой, второстепенное — фазой. Частицы между собой не взаимодействуют, даже имеется некая прослойка, которая разделяет их. Поэтому системы являются гетерогенными или неоднородными.
Примеры дисперсных систем встречаются в природе постоянно — морская вода, почва, большинство продуктов питания и т. д. Они могут иметь любое агрегатное состояние. Иногда в среде находится сразу несколько фаз. Тогда их выделяют с помощью центрифуги или методом сепарирования.
Классификация по агрегатному состоянию
Классификация дисперсных систем осуществляется в соответствии с агрегатными состояниями вещества. Их имеется три вида: жидкое, твердое и газообразное. Поэтому разделение происходит на 9 основных категорий, примеры и описание которых можно посмотреть в таблице ниже.
| Вид | Среда | Фаза | Пример |
| Газ х 2 | Газ | Газ | Отсутствуют |
| Жидкость+газ | Газ | Жидкость | Туман, облако |
| Твердое тело (далее ТТ)+газ | Газ | ТТ | Дым, пыль |
| Газ+жидкость | Жидкость | Газ | Любая пена |
| Жидкость х 2 | Жидкость | Жидкость | Молоко |
| ТТ+жидкость | Жидкость | ТТ | Известь, ил |
| Газ+ТТ | ТТ | Газ | Пемза |
| Жидкость+твердое тело | ТТ | Жидкость | Грунт |
| ТТ+ТТ | ТТ | ТТ | Любые композиционные материалы, такие как бетон или цемент |
Каждый тип классификации, в свою очередь, имеет свое название. К примеру, газообразные соединения называются преимущественно аэрозолями, за редким исключением. Жидкие вещества — газовые эмульсии или суспензии. Взаимодействия, когда средой является твердое тело, определяются, как сплавы, капиллярные системы или пористые субстанции.
Существующие виды
Фазные частицы могут взаимодействовать между собой. При этом среда остается стабильной, химические реакции с ней отсутствуют. В зависимости от типа интерактивности, формируются виды дисперсных систем:
- Свободнодисперсные. Основное и главное свойство такой системы — текучесть. Поэтому сюда относят любые аэрозоли и растворы.
- Связнодисперсные. Это твердые или полутвердые системы. К ним относятся все концентрированные пасы или аморфные вещества.
Некоторые субстанции могут быть одновременно двумя видами. Отдельные золи при нормальной температуре являются достаточно текучими, чтобы определить их, как свободнодисперсные. Однако, если градус уменьшается, молекулы соединяются друг с другом сильнее, приобретая характеристики твердого тела. Поэтому переходят в связнодисперсную форму.
Взвеси и их особенности
Те дисперсные системы, фазы в которых можно легко определить невооруженным глазом, называются взвесями. Их характерная черта — непрозрачность. Если необходимо отделить среду и второстепенное вещество, можно воспользоваться рядовыми фильтрами, или процедурой отстаивания. Категорию разделяют на несколько видов:
- Эмульсии. В жидком агрегатном состоянии находится фаза и среда, они не взаимодействуют друг с другом и не растворяются. Многие получаются посредством гомогенизации. К ним относят большинство лекарственных препаратов или молоко.
- Суспензии. Здесь средой является жидкость, а фазой — твердая структура. Получают посредством пересыпания в жидкость порошка. Структура получается текучая, т. к. фаза крайне мелкая. Если оставлять структуру в неподвижном состоянии, выпадает осадок. Почти все строительные растворы относятся к категории.
- Аэрозоли. Взвесь в этом случае располагается в газе. Примеров множество, встречаются как в природе, так и в быту. Например, грозовые или обычные облака, туманы и некоторые виды осадков. Большинство химикатов, производимых для обработки сельскохозяйственных структур, тоже являются аэрозолями.
Взвеси важны в деятельности человека, равно как природных процессах. Почти все производство построено на применении растворов (удобрения, металлы, бумага и пр.). В окружающем мире естественные соединения с водой тоже встречаются постоянно, например, почвообразование или насыщение грунта полезными веществами. В жизнедеятельности всех живых существ они тоже принимают непосредственное участие.
Коллоидные системы
В отличие от взвесей, коллоидные системы невозможно разделить без использования современной техники или специальных препаратов. Без нужного инструмента и невооруженным глазом они выглядят, как однородная субстанция. Из-за этого определить дисперсность становится сложно. Подразделяются на два типа:

Если взвеси играют большую роль в природных процессах, то коллоидные системы являются неотъемлемой частью химии. Чаще всего они добываются посредством смешивания в специальном оборудовании. Без подобной структуры не удалось бы создать множество лекарственных препаратов, удобрений и других полезных материалов.
Высокомолекулярные вещества
Растворы высокомолекулярных веществ бывают двух видов: истинные и коллоидные. Все зависит от разных качеств, таких как тип фазы, среды, температуры и иных условий. У них есть ряд свойств:
- Процессы смешения происходят естественно и крайне медленно.
- Сначала происходит набухание, а затем смешивание.
- Полимерные и истинные растворы отличаются существенно. Те законы, которые характерны для одних (Рауля, Вант-Гоффа), несвойственны другим.
- По всей полученной субстанции свойства могут различаться из-за разного направления и/или размеров молекул.
- Повышенная вязкость.
Отдельные полимерные растворы образуются самопроизвольно. Когда процесс набухания образуется неорганическим способом, дисперсная система перестает существовать, поскольку фаза полностью растворяется в среде, образуется химическая реакция. Если же он органический, то появляется студень.
Ключевые свойства

Свойства дисперсных систем определяются по одному основному фактору — при их возникновении образуется четкая межфазная граница. Также появляется некоторое значение поверхностной энергии, которая не комбинируется, рассматривается в отдельном порядке по отношению к среде и фазе.
В природе и продуктах жизнедеятельности человека встречаются грубодисперсные системы. Здесь фазу и среду легко можно отличить под стандартным микроскопом, а то и вовсе невооруженным глазом. Но если рассматривать ее в целом, то она представляет собой сложную совокупность коллоидных веществ.
- Степень (количество фаз).
- Молекулярный вес.
- Размеры частиц.
- Агрегатное состояние.
- Лиофобная/лиофильная группа.
В жизни человека рассматриваемые системы встречаются постоянно. Такое явление может быть как природным и естественным, так и выводимым в искусственном виде. Многочисленные лекарственные смеси, различные минеральные или химические удобрения, а также производственные процессы построены на дисперсности.
Читайте также:

