Цитогенетический анализ геномных мутаций и хромосомных аберраций реферат
Обновлено: 05.07.2024
Своевременное проведение хромосомного анализа имеет большое значение для выявления причин возникновения и прогнозирования многих наследственных и врожденных пороков развития. В лабораториях медицинской цитогенетики для анализа хромосомных аномалий используются классические методы цитогенетического анализа. Однако, в ряде случаев разрешающей способности этих методов оказывается недостаточно для успешного проведения диагностики хромосомных аномалий. В современной медико-генетической практике классические генетические методы дополнены высокотехнологичными методами, один из которых – флюоресцентная гибридизация in situ, или так называемый FISH-метод. В настоящее время редкое исследование, требующее анализа хромосом, обходится без использования FISH. Метод применяется очень широко – от локализации гена до расшифровки сложных перестроек между несколькими хромосомами. Современные методы способствуют повышению уровня генетического консультирования, а также эффективной профилактике хромосомных заболеваний.

1. Балева Л.С. Бондаренко Н.А., Демидова И.А. и др. Микроделеция хромосомы у ребенка, родившегося от облученных родителей: применение молекулярно-цитогенетической диагностики // Российский вестник перинатологии и педиатрии. – 2012. – Т. 57, № 1. – С. 66-69.
2. Берешева А.К., Юров И.Ю., Колотий А.Д. и др. Мозаичная форма синдрома Шерешевского – Тернера с кольцевой хромосомой Х у девочки 8 лет: применение методов молекулярно – цитогенетической диагностики / / Российский вестник перинатологии и педиатрии. – 2011. – № 5. – С. 30-37.
3. Демидова И.А., Ворсанова С.Г., Юров И.Ю. и др. Цитогенетические и молекулярно-цитогенетические исследования недефференцированных форм умственной отсталости у детей // Российский вестник перинатологии и педиатрии. – 2009. – № 1. – С. 69-75.
4. Демидова И.А., Ворсанова С.Г., Юров И.Ю. и др. Исследование низкопроцентного мозаицизма гоносом у двух детей с задержкой полового и физического развития: необходимость применения молекулярно-цитогенетических методов // Российский вестник перинатологии и педиатрии. – 2010. – № 6. – С. 36-40.
5. Бочков Н.П., Пузырев В.П., Смирнихина С.А. Клиническая генетика. – М.: ГЭОТАР-Медиа, 2011. – 592 с.
6. Колотий А.Д., Ворсанова С.Г., Юров И.Ю. и др. Выявление микроанамалий хромосом у детей с недифференцированными формами умственной отсталости: оригинальный алгоритм анализа хромосом высокого разрешения методами молекулярной цитогенетики // Фундаментальные исследования. – 2013. – № 6. – С. 1411-1419.
7. Колотий А.Д., Ворсанова С.Г., Юров И.Ю. и др. Цитогенетические и молекулярно-цитогенетические исследования в диагностике мозаичных форм хромосомных аномалий у детей / / Российский вестник перинатологии и педиатрии. – 2011. – №2. – С. 23-29.
8. Кравцова Н.А., Кравцов Ю.А., Антоненко Ф.Ф. Психологические аспекты нарушений половой дифференцировки у детей // Тихоокеанский медицинский журнал. – 2005. – № 3. – С. 61-63.
9. Минайчева Л.И., Назаренко Л.П., Лебедев И.Н., Кашеварова А.А. Применение молекулярно-цитогенетических методов в клинической практике // Вопросы диагностики в педиатрии. – 2009. – Т. 1. – № 2. – С. 32-34.
11. Рудько Г.Г., Алтынник Н.А., Потапова Н.В. и др. Случай диагностики трисомии по кольцевой хромосоме 14 при расширении воротникового пространства плода // Пренатальная диагностика. – 2012. – Т. 11, № 3. – С. 254-257.
12. Benn P., Chapman A.R. Ethical and practical challenges in providing noninvasive prenatal testing for chromosome abnormalities: an update // Curr. Opin Obstet Gynecol. – 2016. – V. 28, № 2. – P. 119-24.
13. Faraut T., Mermet M.A., Demongeot J., Cohen O. Cooperation of selection and meiotic mechanisms in the production of imbalances in reciprocal translocations // Cytogenet. Cell Genet. -2000. – V. 88. – P. 15–21.
14. Gonzales P.R., Carroll A.J., Korf B.R. Overview of Clinical Cytogenetics. // Curr. Protoc. Hum. Genet. – 2016. – V. 89, № 8.1. – С. 1-8.
15. Kemp T., Smith L., Akerman S. Gonadal pathology in a girl with 45,X/46,XY mosaicism // S. Afr. Med J. – 2015. – V. 105, № 12. – P. 1001-1003.
16. Morozkin E.S., Loseva E.M., Karamysheva T.V. et al. Amethod for generating selective DNAprobes for the analysis of C-negative regions in human chromosomes // Cytogenet. Genome Res. – 2011. – V. 135, № 1. – P. 1–11.
17. Mangelschots K., Van Roy B., Speleman F. et al. Reciprocal translocation between the proximal regions of the long arms of chromosomes 13 and 15 resulting in unbalanced offspring: characterization by fluorescence in situ hybridization and DNA analysis // Hum. Genet. – 1992. – V. 89. – P. 407–413.
18. Speicher M.R., Carter N.P. The new cytogenetics: blurring the boundaries with molecular biology // Nat. Rev. Genet. – 2005. – V. 6. – P. 782–792.
20. Vorsanova S.G., Yurov Y.B., Ulas V.Y. et al. Cytogenetic and molecular-cytogenetic studies of Rett syndrome (RTT): aretrospective analysis of a Russian cohort of RTT patients (the investigation of 57 girls and three boys) // Brain. Dev. – 2001. – V. 23. – P. 196–201.
Точная идентификация наследственных заболеваний часто затруднена, прежде всего из-за отсутствия при большинстве наследственных болезней патогномоничных признаков. Сложности в диагностике врожденных и наследственных нарушений связаны со сходством их клинических признаков, которые обусловлены мутациями различных генов. Диагностику наследственных заболеваний также затрудняет фенотипический полиморфизм нарушений, когда при одной и той же унаследованной генной мутации могут развиться как ее ярко выраженные, так и стертые или даже различные клинические формы. Трудности диагностики наследственных заболеваний также связаны с существованием некоторых генетических явлений, оказывающих существенное влияние на формирование клинического фенотипа, таких как, мозаицизм, экспансия аллелей, однородительское наследование (дисомия и изодисомия) и геномный импринтинг [5, 18, 20].
Важнейшая роль в диагностике наследственных болезней принадлежит лабораторным исследованиям: цитогенетическим, молекулярно-генетическим, биохимическим и др. Существенная доля пациентов, обратившихся к врачу-генетику, нуждается в уточнении диагноза с помощью специальных методов исследования. В современной медико-генетической практике классические генетические методы дополнены высокотехнологичными методами, такими как, молекулярно-генетические и молекулярно-цитогенетические, методы иммунологического анализа [10, 11].
Хромосомные болезни – это обширная группа врожденных патологических состояний, проявляющихся аномалиями развития и обусловленных нарушениями числа или структуры хромосом в соматических клетках или половых клетках. Клиническая симптоматика хромосомной патологии разнообразна, однако одним из ведущих симптомов является задержка нервно-психического развития [5].
Своевременное проведение хромосомного анализа имеет большое значение для выявления причин возникновения и прогнозирования многих наследственных и врожденных пороков развития. В России, в практическом здравоохранении исследования кариотипа проводятся с 1966 года. В лабораториях медицинской цитогенетики для анализа хромосомных аномалий используются классические методы цитогенетического анализа, базирующиеся на дифференциальном окрашивании хромосом. Эти методы позволяют выявлять все численные нарушения и значительную часть структурных хромосомных перестроек. Однако в ряде случаев разрешающей способности этих методов оказывается недостаточно для успешного проведения диагностики хромосомных аномалий, например, для точного определения границ точек разрывов при инверсиях и транслокациях, для определения происхождения дополнительного хромосомного материала при несбалансированных транслокациях [1, 13, 16].
Возможности цитогенетического анализа значительно расширились благодаря появлению и развитию новых высокоинформативных молекулярно-цитогенетических методов, главный из которых – флюоресцентная гибридизация in situ – FISH-метод (от англ. fluorescent in situ hybridization). Метод позволят проводить гибридизацию метафазных или интерфазных хромосом с различными ДНК-зондами. Зонды – клонированные последовательности или выделенные участки ДНК, комплементарные участку ДНК исследуемого кариотипа и меченные флюоресцирующими веществами. Наиболее часто используют высокоповторяющиеся последовательности ДНК центромерных или перицентромерных районов, однако в ряде случаев возникает необходимость в применении уникальных ДНК-последовательностей, таких как, космидные клоны, YAС – пробы, анонимные последовательности и др., что обеспечивает детальное исследование генетической структуры хромосомных перестроек, например маркерных хромосом, а также анализ точек разрывов хромосом в различных типах транслокаций, делеций, дупликаций, инверсий, инсерций, дицентрических и кольцевых хромосом [10, 14].
Принцип метода заключается в следующем: 1 – для изучаемой хромосомы или ее участка готовят однонитевой участок ДНК, к которому присоединяются метки – биотин или дигоксигенин (такой участок ДНК называется ДНК-зондом); 2 – на микроскопическом препарате in situ при обработке щелочью хромосомная ДНК денатурирует, т.е. разрываются водородные связи между двумя нитями ДНК; 3 – препарат обрабатывают ДНК-зондом. Поскольку нити ДНК взаимокомплементарны, зонд присоединяется к соответствующему участку хромосомы. В этом участке восстанавливается двойная спираль (ренатурация ДНК). Причем можно одновременно использовать множественные зонды к разным локусам; 4 – полученный препарат обрабатывают химическими соединениями, которые способны избирательно присоединяться к биотину или дигоксигенину; 5 – к полученным комплексам присоединяют флюоресцентные красители (двухцветная или трехцветная флюоресцентная гибридизация и т.д.); 6. – с помощью люминесцентного микроскопа окрашенные хромосомы можно увидеть на фоне неокрашенных [5, 9].
Метод FISH применяется очень широко – от локализации гена до расшифровки сложных перестроек между несколькими хромосомами. Метод можно применять для диагностики анеуплоидий в интерфазных ядрах – интерфазная цитогенетика. Метод экономичен и занимает меньше времени, чем кариотипирование дифференциально окрашенных хромосом. Неоспоримое преимущество интерфазной цитогенетики – отсутствие необходимости в приготовлении препаратов метафазных хромосом и культивировании клеток. Это снимает многие вопросы, связанные с возникновением артефактов, присущих длительным культурам клеток (полиплоидизация in vitro, возникновение и клональная селекция клеток с аберрациями кариотипа, изменение пропорций клеточных клонов при хромосомном мозаицизме) [5].
FISH на интерфазных хромосомах служит быстрым методом пренатальной диагностики трисомий по 21, 18 или 13 хромосомам или аберраций половых хромосом [12]. Например, можно получить информацию о количестве 21-х хромосом в клетках амниотической жидкости (пренатальная – дородовая диагностика синдрома Дауна у плода) – специфический ДНК – зонд для 21-ой хромосомы покажет в ядрах этих клеток или две светящиеся точки, что соответствует двум 21-м хромосомам, или три – что выявит трисомию по 21-ой хромосоме [17]. Методы молекулярной цитогенетики позволили повысить верификацию хромосомных болезней. При использовании обычных цитогенетических анализов – доля невыявленных случаев составила 10 %, при использовании FISH – технологии – снизилась до 0,9 – 1,5 % [18, 19].
Исследования, проведенные Л.С. Балевой, свидетельствуют о том, что выявление субтеломерных и теломерных перестроек с помощью молекулярно-цитогенетических методов в комплексе с классической цитогенетической диагностикой может вносить значительный вклад в диагностику недифференцированных форм умственной отсталости у детей. Частота таких перестроек, по данным разных авторов, составляет от 0,5 до 7,4 %. Корреляция теломерных и субтеломерных аномалий хромосом с определенной клинической картиной может способствовать вычленению новых хромосомных синдромов из большой группы недифференцированных форм умственной отсталости [1].
Проведено цитогенетическое и молекулярно-цитогенетическое исследование у 3593 детей с недифференцированными формами умственной отсталости, множественными врожденными пороками и/или микроаномалиями развития. В результате цитогенетического анализа авторы, помимо хромосомных аномалий, выявили хромосомные варианты и инверсии околоцентрамерного гетерохроматина хромосом 1, 9, 13-17, 21, 22 и Y. Количественная FISH с применением ДНК проб, специфически маркирующих вариабельные участки гетерохроматина хромосом, подтвердила цитогенетические данные и позволяет оценить непосредственно содержание ДНК в данном хромосомном участке и считается прямым методом исследования. До сих пор нет единого взгляда на роль вариантов околоцентромерного гетерохроматина в развитии той или иной патологии. Авторы предположили, что возможно при соответствующих обстоятельствах эти участки могут оказывать влияние на нарушение функциональной активности генов, находящихся от них в непосредственной близости, – так называемый эффект положения генов [3].
Структурные хромосомные аномалии в виде делеций и дупликаций небольшого размера составляют значительную долю хромосомной патологии среди детей с задержкой развития, аутизмом, пороками и аномалиями развития. А.Д. Колотий привела результаты лабораторной диагностики хромосомных микроперестроек у 14-ти детей с недифференцированными формами умственной отсталости, пороками и/или малыми аномалиями развития. При проведении цитогенетического исследования методами дифференциального окрашивания хромосомная патология у этих детей не была выявлена. Данные случаи сложны для цитогенетической диагностики, поскольку могут быть связаны с микроаномалиями кариотипа, выявление которых возможно только с применением молекулярно-цитогенетических методов исследования. Применение специального алгоритма анализа хромосомных нарушений, включающего гибридизацию на хромосомах in situ позволило выявить микроаномалии кариотипа и определить этиологические причины хромосомной патологии у всех 14 детей. Применение современных диагностических технологий позволяет не только повысить эффективность молекулярно-цитогенетической диагностики за счет выявления микронарушений генома у детей с нарушениями психики, но также выявлять новые нозологии из недифференцированных (идиопатических) форм умственной отсталости [7].
Хромосомный мозаицизм чаще наблюдается при численных хромосомных аномалиях в отличие от структурных, что было установлено многими исследованиями. Результаты исследования Колотий А.Д. показали, что после цитогенетического анализа хромосомный мозаицизм наблюдался у 3,4 % от всех изучаемых больных. После проведения молекулярно-цитогенетического исследования доля случаев с хромосомным мозаицизмом составила 5,9 %. Установлено, что выявление возможного мозаицизма молекулярно-цитогенетическими методами диагностики требуется пациентам со стертой клинической картиной таких хромосомных синдромов, как Дауна, Эдвардса, Шерешевского-Тернера, трисомии Х, а также девочкам с дисгенезией гонад при нормальном кариотипе, определенном цитогенетическим методом. Своевременная эффективная диагностика мозаичных форм хромосомных аномалий способствует лечебной коррекции, особенно при мозаичных формах аномалий половых хромосом [6, 8, 15].
В работе Минайчевой Л.И. отражено применение молекулярно-цитогенетического метода в клинической практике. Беременная женщина 30 лет обратилась в Генетическую клинику института для проведения эхографического исследования плода на 21 неделе гестации. При обследовании был выявлен порок развития сердечно-сосудистой системы. Для исключения хромосомной патологии было проведено инвазивное вмешательство (кордоцентез) и получен плодный материал. Стандартный цитогенетический анализ (G-окраска) не выявил структурных и числовых нарушений – 46, XY. При осмотре врачом-генетиком в возрасте 3-х месяцев выявлены множественные стигмы дизэмбриогенеза – эпикант, короткий нос с открытыми вперед ноздрями, широкая верхняя челюсть, микрогнатия, оттопыренные уши, отмечалась мышечная гипотония и прогрессирующая деформация позвоночника, что позволило заподозрить наличие генетической патологии и провести дополнительное обследование с использованием молекулярно-цитогенетических методов. Методом FISH была выявлена микроделеция в хромосоме 7 в критической области синдрома Вильямса. Верификация диагноза у пациента в достаточно раннем возрасте позволила скорректировать план наблюдения и разработать индивидуальный комплекс профилактических, лечебных и реабилитационных мероприятий [9].
Таким образом, флюоресцентная гибридизация in situ в настоящее время является одним из наиболее эффективных и широко используемых методов молекулярной цитогенетики, позволяет установить и уточнить диагноз хромосомной патологии, что способствуют повышению уровня генетического консультирования, а также эффективной профилактике хромосомных заболеваний.
Цитогенетический метод изучения наследственности человека. Хромосомные болезни. Наследование, сцепленное с полом
Цитогенетический метод
Классификация хромосом человека
Генетические карты
Хромосомные болезни (синдромы)
Кариотипы, кариограммы
Тестовые задания
Цитогенетический метод
С помощью данного метода можно изучать наследственный материал клетки: совокупность хромосом в целом (кариотипирование) или наличие и количество Х-хромосом (определение полового хроматина — число глыбок полового хроматина или телец Барра). Исследование проводится с помощью светового микроскопа (изготовление и изучение микропрепаратов).
Кариотипирование
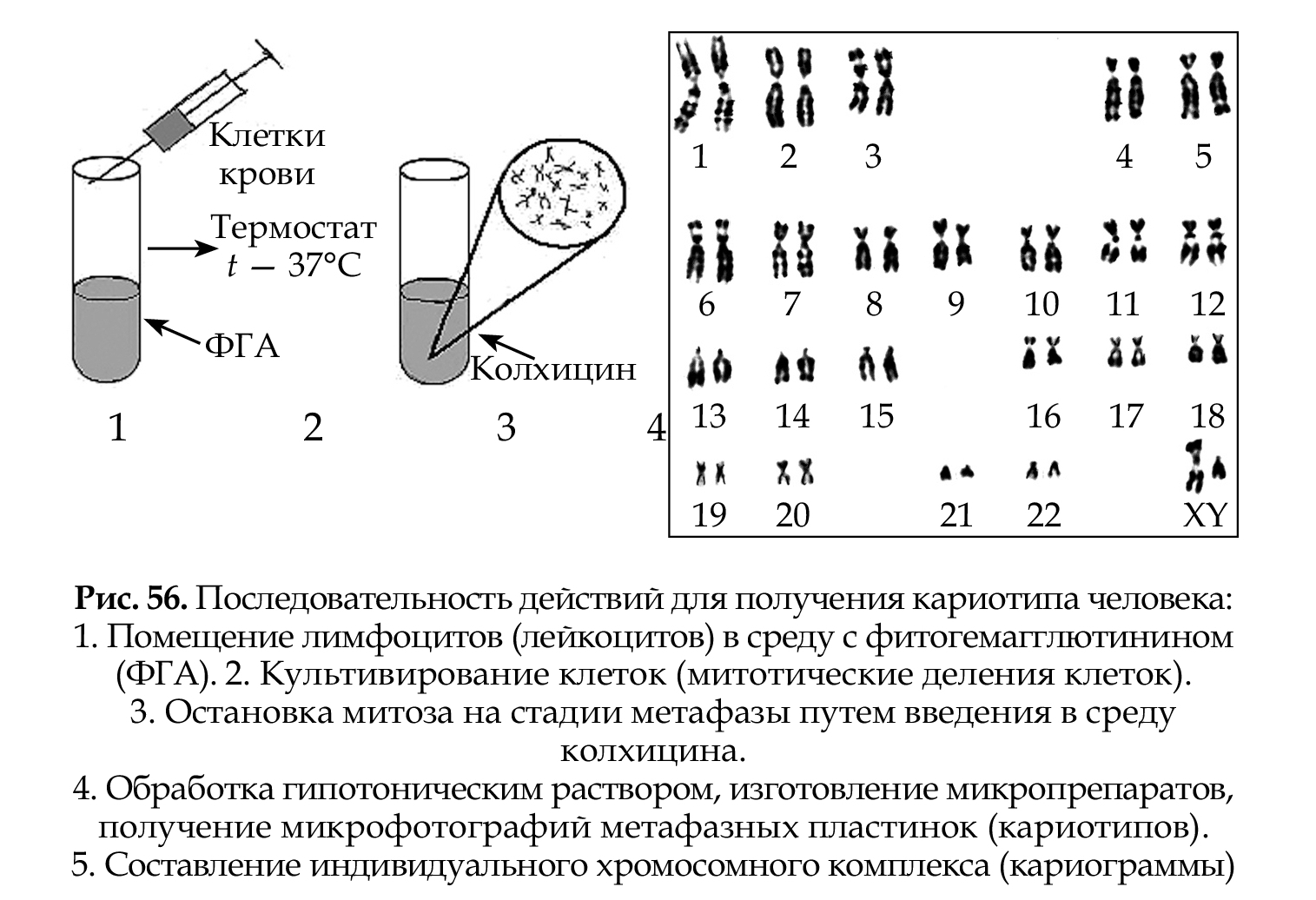
На рис. 56 представлена последовательность действий для получения кариотипа человека.
Половой хроматин
В клетках мужчин (кариотип 46, XY) Х-хромосома всегда выполняет ак-тивную функцию, а у женщин (46, XX) одна Х-хромосома является активной, а другая Х-хромосома находится в неактивном, спирализованном состоянии. Она выявляется в виде компактной темной глыбки в интерфазном ядре соматических клеток нормальных женщин и называется тельцем Барра или половым Х-хроматином. Инактивация одной из двух Х-хромосом происходит в эмбриогенезе, причем закономерности в инактивации отцовской или материнской хромосомы нет (гипотеза Лайон). При любом числе Х-хромосом в активном состоянии будет только одна, следовательно, половой Х-хроматин в норме выявляется только у женщин и отсутствует у мужчин.
Зная число глыбок полового хроматина, можно определить число Х-хромосом по формуле п + 1, где п — число глыбок, а 1 — активная Х-хромосома; и наоборот, зная число Х-хромосом, можно определить число телец Барра по формуле п -1, где п — число Х-хромосом, а 1 — активная Х-хромосома (табл. 12).
У мужчин в норме выявляется Y-половой хроматин (он представляет длинное плечо Y-хромосомы), который обнаруживается с помощью люминисцентной микроскопии и выглядит в виде яркого пятна диаметром 0,3-1 мкм.
Изменение числа глыбок полового хроматина происходит при геномных мутациях (изменение числа X- и Y-хромосом). Определение полового хроматина используется как экспресс-метод при пренатальном и постнатальном определении пола и диагностике хромосомных болезней (см. табл. 12).

Классификация хромосом человека
Хромосомный набор (кариотип) соматической клетки характеризуется формой хромосом, их количеством, размерами, характерными для каждого вида. Препараты хромосом можно приготовить извсех тканей и клеточных суспензий, содержащих делящиеся клетки. Наиболее часто препараты метафазных хромосом готовят из лимфоцитов периферической крови, которые предварительно культивируют в присутствии стимулятора митозов — митогена фитогемаг- глютинина (ФГА), так как клетки периферической крови не делятся.
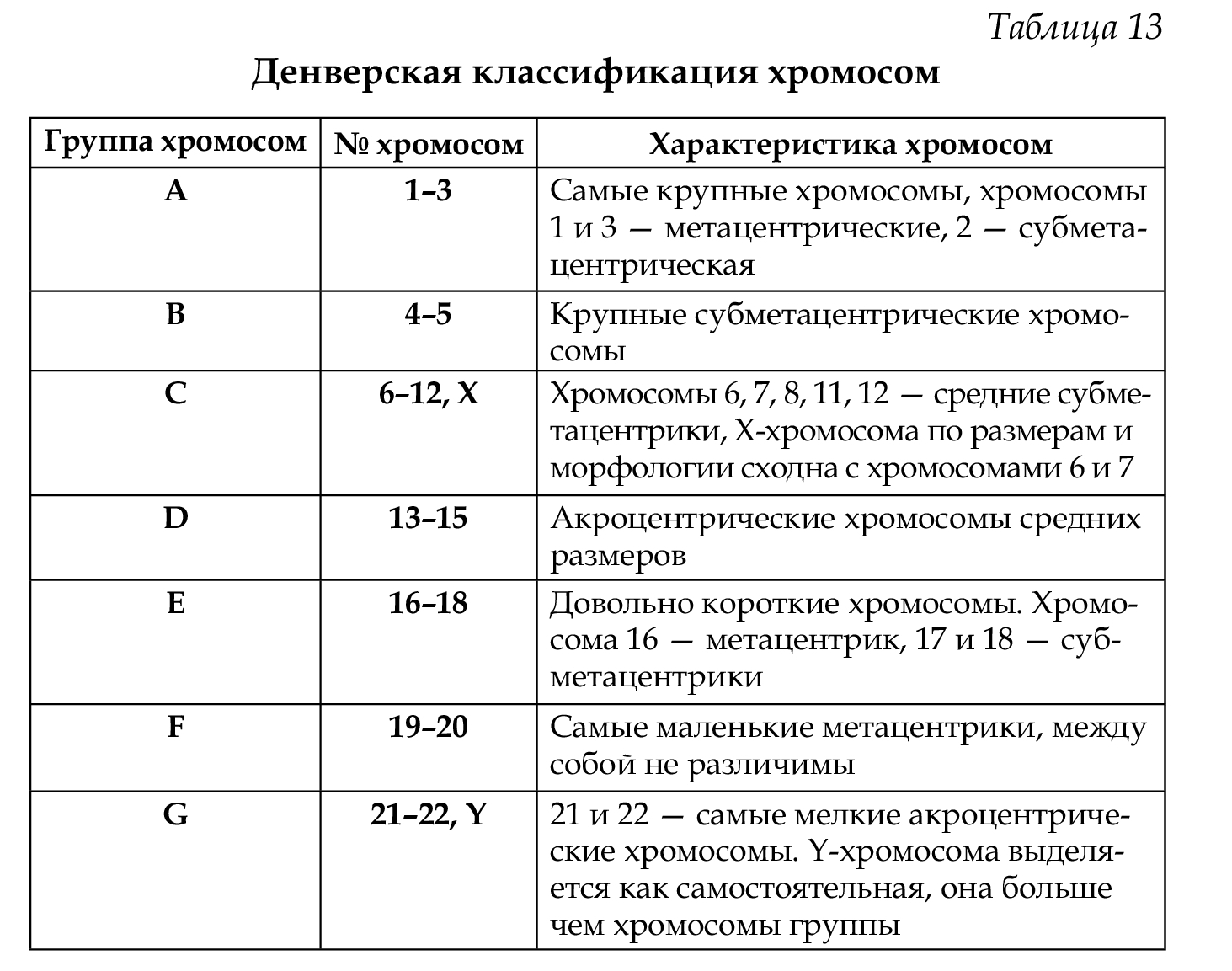
Классификация и номенклатура равномерно окрашенных хромосом (стандартное окрашивание) была разработана на международных совещаниях в Денвере (1960), Лондоне (1963) и Чикаго (1966). Согласно рекомендациям этих конференций, хромосомы располагаются в порядке уменьшения их длины от 1 до 23 хромосомы. Они разделены на 7 групп, которые обозначены буквами английского алфавита от А до G. Все пары хромосом предложено нумеровать арабскими цифрами: группа А 1-3, В 4-5, С 6-12 и Х-хромосома, D 13-15, Е 16-18, F 19- 20, G 21-22, Y-хромосома (табл. 13). При этом хромосомы различных групп хорошо отличаются друг от друга (критерии: размер и форма — метацентрические, субметацентрические, акроцентрические), в то время как внутри группы их сложно различить, за исключением хромосом группы А (рис. 64,65).
Важным параметром является центромерный индекс, который отражает в процентах длину короткого плеча к длине всей хромосомы, например, хромосома № 1 — 48,3%, хромосома № 22 — 22,1%.
Парижская классификация хромосом
В начале 70-х годов XX века был разработан метод дифференциальной окраски хромосом, выявляющий характерную сегментацию, который позволил индивидуализировать каждую хромосому (рис. 58). Различные типы сегментов обозначают по методам, с помощью которых они выявляются наиболее отчетливо (Q-сегменты, G-сегменты, Т-сегменты, S-сегменты). Каждая хромосома человека содержит свойственную только ей последовательность полос, что позволяет идентифицировать каждую хромосому. Хромосомы спирализованы максимально в метафазе, менее спирализованы в профазе и прометафазе, что позволяет выделить большее число сегментов, чем в метафазе.


Классификация хромосом человека
Хромосомная теория наследственности была сформулирована Т. Морганом, основные положения которой сводятся к следующему:
• гены находятся в хромосомах, каждый ген занимает в хромосоме определенное место (локус);
• гены в хромосомах располагаются линейно;
• каждая хромосома представляет собой группу сцепления генов;
• число групп сцепления у каждого вида равно гаплоидному набору хромосом;
• между гомологичными хромосомами в процессе кроссинговера происходит обмен аллельными генами, что приводит к формированию новых сочетаний аллелей в группах сцепления;
• расстояние между генами в хромосоме пропорционально проценту кроссинговера между ними.
Изучение сцепленного наследования явилось основой для составления генетических карт сцепления у разных организмов. Методы классической генетики, цитогенетики и молекулярной генетики позволили подойти к составлению современных генетических карт
Генетическая карта — это система элементов генома, упорядоченная на основе хромосомной принадлежности и взаимного расположения генов в пределах отдельных хромосом, т. е. она определяет принадлежность генов к хромосоме и их расположение относительно друг друга. Возможность ее построения обусловлена линейным характером локализации генов в хромосомах и относительной стабильностью их расположения.
Выделяют следующие генетические карты: карты сцепления, цитологические карты, цитогенетические карты индивидуальных хромосом, рестрикционные и секвенсовые карты. Они различаются единицами измерения (морганида, пара нуклеотидов — п. н., мегабаза — 1 млн оснований) и набором элементов генома.
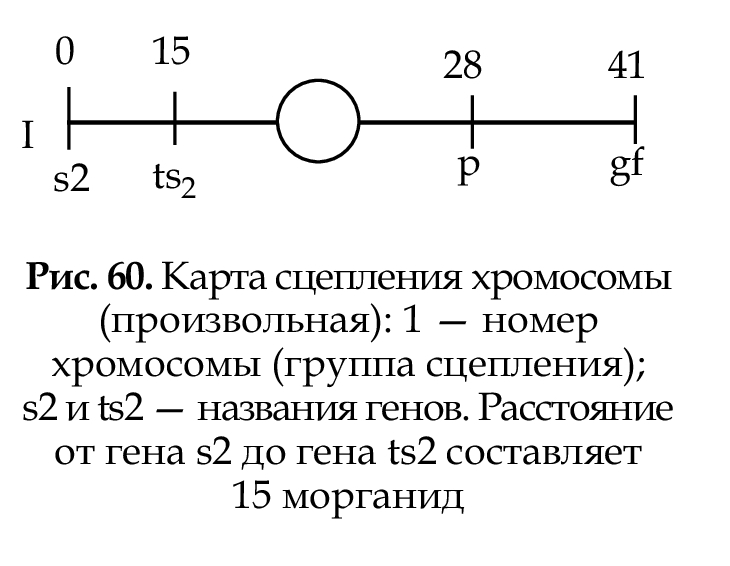
Карта сцепления — схема расположения генов, находящихся в одной группе сцепления, т. е в одной хромосоме (рис. 60). За единицу расстояния между генами принята морганида, которая отражает частоту кроссинговера.Одна морганида — расстояние между генами, при котором кроссинговер происходит в 1% гамет (1 морганида = 1% кроесинговера. При составлении картсцепления указываются: номер хромосомы; полное или сокращенное название генов;
расстояние в морганидах от одного из концов хромосомы, принятого за нулевую точку; место центромеры.
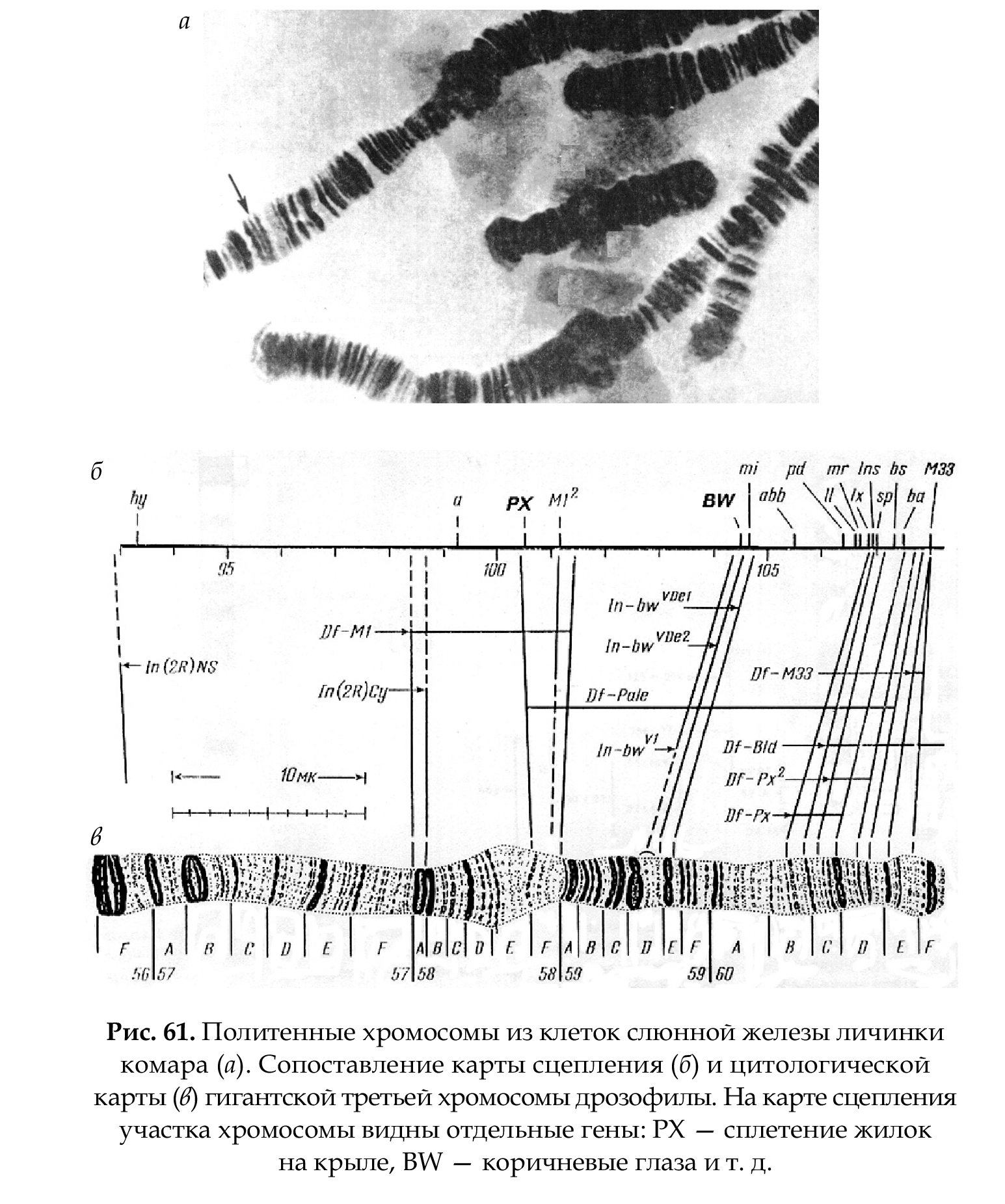
Цитологическая карта составляется на основании из- учения политенных хромосом (рис. 61 а, б), что позволяет сопоставить структуру синтезируемого белка с определенным участком хромосомы (геном), так как транскрибируемый участок определяется под ми- кроскопом в виде пуфа. Это позволяет определить локализацию гена. Изучение политенных хромосом имеет экспери- ментальный характер, так как у человека их нет.
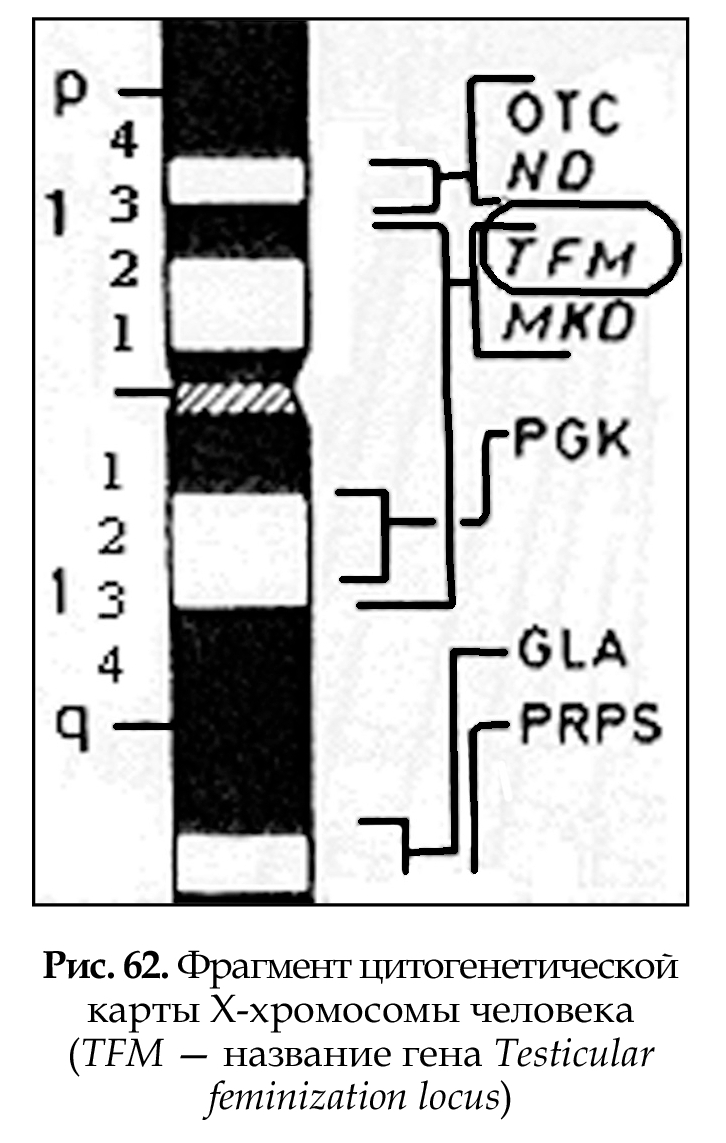
Цитогенетические карты хромосом (рис. 62) составляются на основе дифференциальной окраски (темные и светлые полосы) и картирования генов в отдельных локусах хромосом (основа Парижской классификации). Современные методы окрашивания позволяют выявить до 1000 полос. В среднем на хромосому человека приходится 50 полос. Каждая полоса содержит 3 х 106 пар нуклеотидов, что соответствует нескольким сотням генов (районы и сегменты). Картирование генов в хромосомах является результатом современных молекулярно-генетических методов исследования.
Различные хромосомы и их участки картированы с разной степенью детализации: на Х-хромосоме картировано 400 генов, на хромосоме № 1 — 200 генов. Плотность расположения уже картированных генов в разных хромосомах неравномерна: в 19 хромосоме — 178 генов, в 13 хромосоме — 40 генов, хотя 19 хромосома вдвое меньше, чем 13. На хромосомах № 2 и № 7 примерно одинаковое количество генов, около 175. Каждый картированный ген становится точкой отсчета в геноме, т. е. молекулярным маркером. Генетическое картирование необходимо для определения нуклеотидной последовательности гена и прилегающих к нему участков.
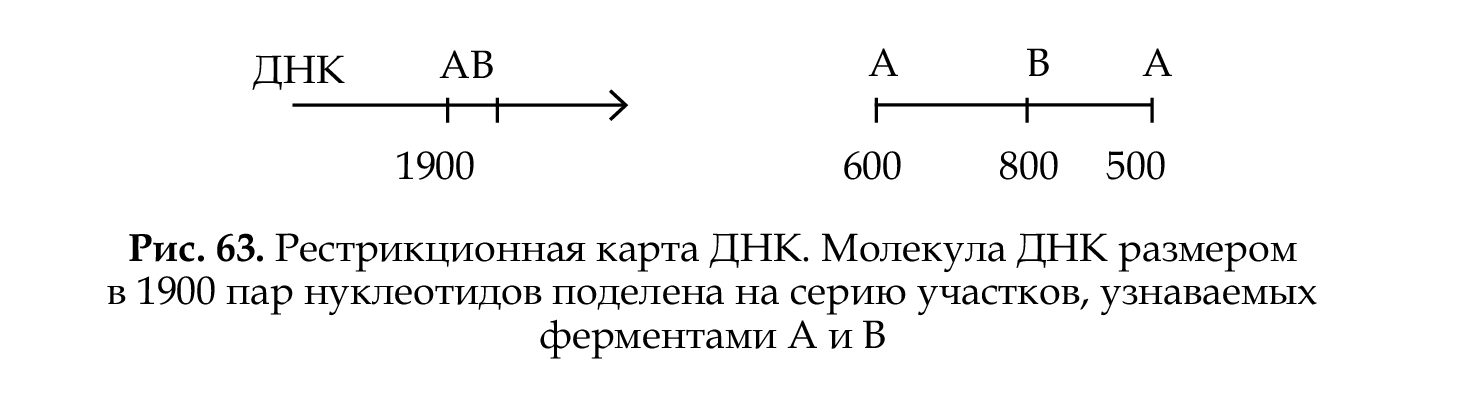
Рестрикционные карты ДНК представляют собой участки ДНК с определенной нуклеотидной последовательностью. Для их получения необходимо выделить ДНК, разрезать в определенных точках рестриктазами, локализовать точки разрыва — сайты расщепления. Карта ДНК, полученная в результате локализации точек разрыва, называется физической рестрикционной картой (рис. 63). Рестрикционная карта ДНК представляет собой линейную последовательность сайтов расщепления, находящихся на определенном расстоянии друг от друга. Расстояние между сайтами рестрикции измеряют в нуклеотидных парах ДНК.
Секвенсовые карты содержат данные о последовательности всех нуклеотидов в целой молекуле ДНК, а не в отдельных ее фрагментах.

СОВРЕМЕННЫЕ ПОДХОДЫ К АНАЛИЗУ ГЕНОМНЫХ И ХРОМОСОМНЫХ МУТАЦИЙ В ГАМЕТОГЕНЕЗЕ И ЭМБРИОГЕНЕЗЕ ЧЕЛОВЕКА
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке "Файлы работы" в формате PDF
Хромосомные аномалии могут возникать на любой стадии онтогенеза. Последствия несбалансированных нарушений генома для развивающегося организма особенно драматичны, когда такие нарушения происходят еще в гаметах, во время оплодотворения или на ранних стадиях дробления. При этом хромосомные аномалии, характерные для про- и преэмбрионального периодов развития человека, имеют свои качественные и количественные особенности. Последние обусловлены специфическими пространственными и временными особенностями созревания мужских и женских гамет, различной эффективностью презиготической селекции генетически неполноценных гамет в оогенезе и сперматогенезе, а также селекции несбалансированных геномов до имплантации и в процессе дальнейшего развития.
Одна из основных задач цитогенетики развития — определить характер аномалий кариотипа, установить возможные пути их происхождения и попытаться выяснить каким образом дисбаланс целых хромосом или их фрагментов влияет на процессы раннего онтогенеза.
Геномные мутации - это мутации, которые приводят к добавлению либо утрате одной, нескольких или полного гаплоидного набора хромосом. Разные виды геномных мутаций называют гетороплоидией (ненормальное соотношение числа хромосом) и полиплоидией (кратное увеличение числа хромосом). Хромосомные мутации (аберрации) характеризуются изменением структуры отдельных хромосом. При них последовательность нуклеотидов в генах обычно не меняется, но изменение числа или положения генов при аберрациях может привести к генетическому дисбалансу, что пагубно сказывается на нормальном развитии организма. Виды таких аберраций: делеция, дупликация и инверсия. Делеция (от лат. deletio — уничтожение) — хромосомные перестройки, при которых происходит потеря участка хромосомы. Инверсия —хромосомные перестройки, при которых происходит поворот участка хромосомы на 180°. Дупликация (лат. duplicatio — удвоение) — разновидность хромосомных перестроек, при которой участок хромосомы оказывается удвоенным. Может произойти в результате неравного кроссинговера, ошибки при гомологичной рекомбинации, ретротранспозиции.
В основе классификации хромосомной патологии лежат 3 принципа, позволяющие точно охарактеризовать форму хромосомной патологии и ее варианты у обследуемого.
Первый принцип – характеристика хромосомной или геномной мутации с учетом конкретной хромосомы.
Второй принцип – определение типа клеток, в которых возникла мутация Гаметические мутации ведут к полным формам хромосомных болезней.
Третий принцип – выявление поколения, в котором возникла мутация.
На более поздних стадиях эти величины снижаются. Так, между 3-4-м месяцами беременности аномалии кариотипа у спонтанных абортусов составляют уже 15-20 %, а к 5-му месяцу — только 3 %. К моменту рождения общая частота спонтанных хромосомных аномалий находится в пределах 0,5-0,9 %.
Таким образом, подавляющее большинство зародышей с хромосомными и геномными мутациями погибает до 20-й недели беременности [282, 694]. Эти представления легли в основу расчетов вероятности аномалий кариотипа в зависимости от срока развития плода. Результаты морфологического и цитогенетического анализа спонтанных абортусов и данные экспериментальной цитогенетики убеждают в том, что гибель плодов с несбалансированным кариотипом особенно высока во время нейруляции и начале активного органогенеза, то есть до 12-й недели беременности. К концу первого триместра частота спонтанных хромосомных аберраций быстро снижается и далее остается почти неизменной вплоть до рождения.
Следовательно, спонтанное прерывание беременности, особенно в ранние сроки, нередко обусловлено хромосомными аномалиями. Наиболее обширный спектр хромосомных аберраций выявлен на ранних, доимплантационных стадиях развития. При цитогенетическом анализе дробящихся зародышей обнаружены практически все известные хромосомные аномалии, включая и такие, которые не встречаются или крайне редки на постимплантационных стадиях эмбриогенеза (гаплоидия, тетраплоидия, различные типы моносомий). Это означает, что зародыши с такими нарушениями кариотипа нежизнеспособны и элиминируются во время или вскоре после имплантации.
Ранние работы по анализу спонтанных хромосомных аберраций у зародышей более поздних стадий развития, в частности, у абортированных плодов проводились с применением способов хромосомного анализа, с помощью которых были диагностированы, в основном, численные аномалии кариотипа. Методы дифференциальной окраски, дающие более полное представление о кариотипе благодаря идентификации не только всех хромосом набора, но и большинства структурных перестроек, подтвердили высокий уровень хромосомных и геномных мутаций у абортусов I и II триместров беременности. Частоты и типы хромосомных аномалий, определенные разными группами исследователей, поразительно совпадают и свидетельствуют о специфике как в отношении типов хромосомных аномалий, так и хромосом, принимающих в них участие.
Результаты кариотипирования абортусов, а также новорожденных с пороками развития позволяют не только оценить популяционные частоты различных хромосомных аномалий, но и составить прогноз их развития в зависимости от типа патологии.
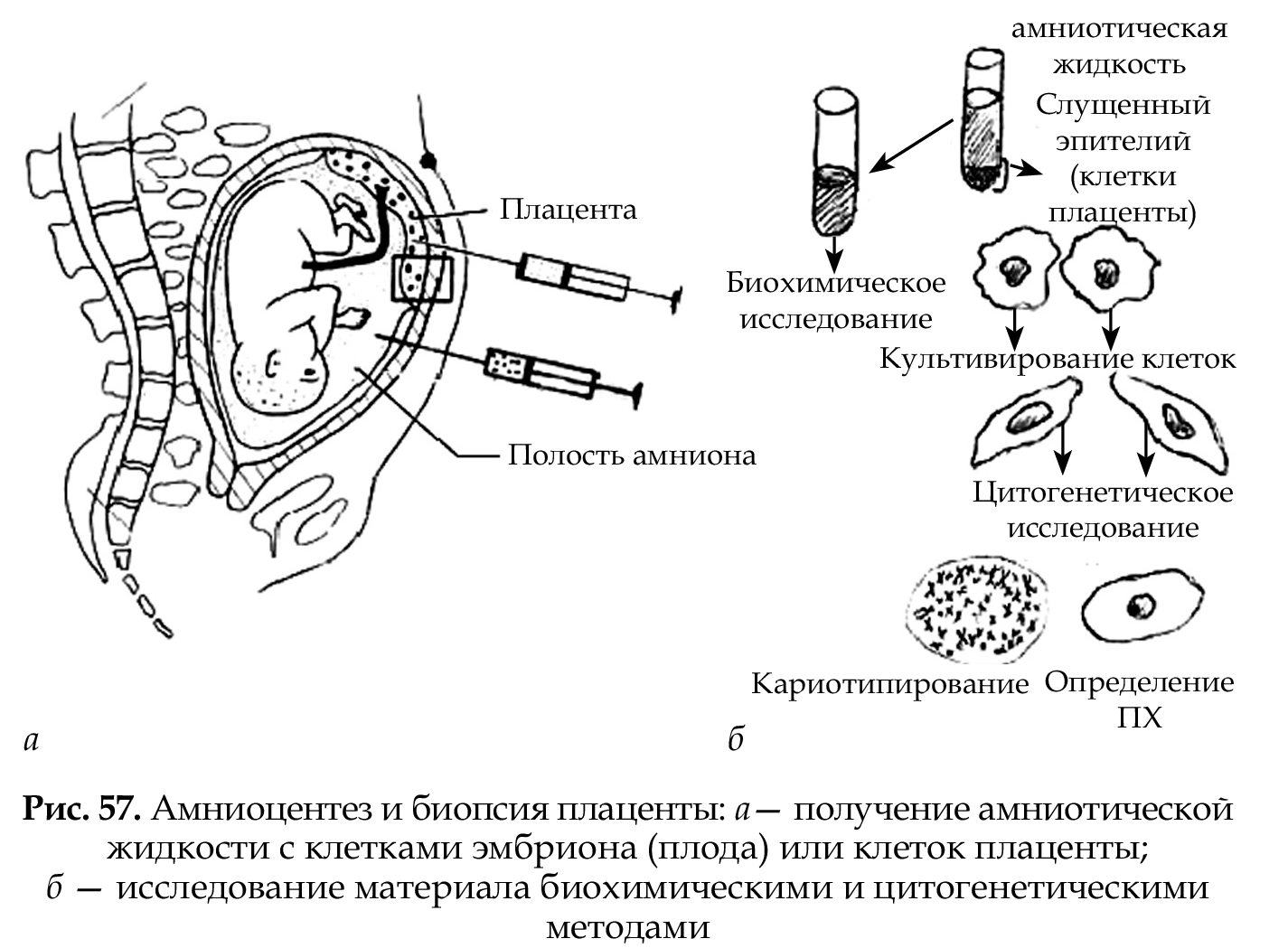
Подавляющее большинство исследований спонтанных выкидышей проведено на препаратах культивированных фибробластов кожи плода, в меньшей степени — на культурах клеток хориона и плаценты, в то время как суждение о кариотипе новорожденных основано исключи-тельно на анализе ФГА-стимулированных лимфоцитов периферичес-кой крови. Это означает, что фактически о хромосомном наборе целого организма в этих исследованиях судили по кариотипу клеток одной ткани. Между тем, анеуплоидия может затрагивать только часть клеток или быть ограниченной только одной тканью. Если для спонтанных абортусов, мертворожденных или даже для новорожденных с пороками развития ошибочное заключение о кариотипе не столь существенно, то последствия диагностических ошибок при кариоти- пировании развивающегося плода могут быть весьма серьезными. В связи с этим, принципиально важным является вопрос о прогностической значимости для развивающегося плода его кариотипа, установленного по клеткам хориона/плаценты. Одним из подходов к оценке значимости хромосомного дисбаланса для прогноза развития плода, выявленного в цитотрофобласте, является сравнительный анализ частоты и спектра хромосомных аберраций на разных стадиях развития.
Мозаицизм Х/ХХ представляет одну из самых серьезных проблем пренатальной диагностики. Высокая частота моносомии Х в клетках цитотрофобласта диктует необходимость дополнительных исследований кариотипа амниоцитов или, что предпочтительнее, лимфоцитов пуповинной крови. Однако даже незначительная доля клеток с кариотипом 45,Х в лимфоцитах плода не является гарантией рождения здоровой девочки.
Многие типы хромосомных аномалий, такие как моносомии ауто- сом, гаплоидия, тетраплоидия встречаются только на доимплантаци- онных стадиях развития; спектр численных хромосомных аберраций на разных стадиях постимплантационного развития в целом соответствует таковому у мертворожденных или живорожденных; некоторые трисомии, считающиеся летальными (Тс2, Тс3), представлены полными формами только в экстраэмбриональных тканях, другие (Тс7, Тс20, Тс22) могут быть как ограничены плацентой, так и встречаться в отдельных тканях или органах плода; большинство сублетальных трисомий (Тс13, 18, 21) представлено в виде полных форм как в эм-бриональных, так и в экстраэмбриональных тканях; совместимость с внутриутробным развитием и даже с живорождением многих типов трисомий, особенно их мозаичных форм, указывает на необходимость пересмотра существующей классификации летальных и сублетальных трисомий.
Литература:
Баранов В.С., Кузнецова Т. В.. Цитогенетика эмбрионального развития человека: Научно-практические аспекты . — СПб: Издательство Н-Л,2006. — 640 с.. 2006
Перинатальная патология учеб. пособие / М.К. Недзьведь [и др.] ; под ред. М.К. Недзьведя. – Минск: Выш. шк., 2012. – 575 с
Патологическая анатомия: учеб. / Струков А. И., Серов В.В: Литтерра, 2010
Биология: медицинская биология, генетика и паразитология: учебник для вузов/ А. П. Пехов. – 3 изд., ГЭОТАР-МЕДИА, 2014
Клиническая генетика: учебник/ Бочков Н. П., Пузырев В. П., Смирнихина С. А. – 4 издани: ГЭОТАР-Медиа, 2013-592с.

В основе практически всех генетических исследований лежит понятие вариации. Это понятие включает в себя все типы изменений последовательностей ДНК (мутаций), наблюдаемых на хромосомном или генном уровнях. С одной стороны, вариации генома служат объяснением межиндивидульного разнообразия, с другой, мутации могут приводить к патогенным изменениям жизнедеятельности организма, являясь, таким образом, причиной наследственного заболевания. Следует также ввести несколько терминов, использующихся для описания процесса мутационного изменения ДНК: локус – определенный участок хромосомы, содержащий специфические последовательности ДНК или гены, аллель – две или более альтернативных форм гена, расположенных в одном и том же локусе пары гомологичных хромосом. Если различие последовательности ДНК двух аллелей одного локуса наблюдается с частотой более 1 % в общей популяции, то данный тип вариации обозначается полиморфизмом. Изменение последовательности ДНК, имеющее меньшую частоту, как правило, называется мутацией. Известно два основных вида мутаций, связанных с наследственной патологией: хромосомные (геномные) – изменение числа и/или структуры хромосом (генома) в клетке и генные (изменение последовательности ДНК в конкретном гене). Исходя из данной классификации, можно выделить направления генетических исследований нарушений последовательности ДНК, приводящих к наследственным заболеваниям, которые изучает медицинская генетика, а именно, поиск изменений последовательностей нуклеиновых кислот и белков на молекулярном уровне (молекулярная генетика) и изучение изменений числа, структуры и организации хромосом (классическая и молекулярная цитогенетика).
Молекулярно-генетические исследования основаны на современных представлениях об особенностях молекулы ДНК и биохимических процессах транскрипции и трансляции. Основная их цель заключается в выявлении генных мутаций, приводящих к характерным фенотипическим проявлениям. Генные мутации представляют собой изменение расположения, потерю и приобретение ДНК относительно её линейной последовательности, обнаруживаемой в норме. Наиболее частые типы генных мутаций являются замена, потери и/или вставки одного нуклеотида. Последние обозначаются аббревиатурой SNP (single nucleotide polymorphsims) и проявляются наиболее часто в геноме человека. В среднем, SNP, ведущие к вариации между аллелями у одного индивидуума, встречаются в каждых 1500 пар нуклеотидов. Однако, большинство из них расположены в некодирущих последовательностях и, в основном, не имеют фенотипических последствий. Если изменение последовательности ДНК происходит в гене, кодирующем белок, то оно с высокой долей вероятности будет связано с нарушениями жизнедеятельности организма. Существует следующая классификация генных мутаций:
Миссенс мутации – замена одного нуклеотида на другой или несинонимические изменения последовательности ДНК. Теоретически можно выделить два типа подобных мутаций: консервативные и неконсервативные. Консервативные миссенс мутации приводят к замене одного кодона на равнозначный (кодоны, кодирующие один и тот же аминокислотный остаток) или на кодон другого аминокислотного остатка, который не изменяет физико-химические свойства белка, кодированного соответствующим геном. Неконсервативные миссенс мутации, как правило, изменяют биохимические свойства белка и, следовательно, приводят к нарушению его функциональной активности.
Нонсенс мутации – изменения кодирующей последовательности ДНК, приводящие к образованию стоп-кодона, вследствие чего синтезируется белок, в котором отсутствует какая-то часть его последовательности.
Мутация сдвига рамки считывания – любые изменения последовательности ДНК гена (в основном, потери или вставки нуклеотидов), которые приводят к сдвигу считывания последовательности в ходе транскрипции. Результатом этого является синтез совершенно нового белка или образование матричной РНК, не несущей в себе никакой информации относительно аминокислотной последовательности.
Непатогенные изменения последовательности ДНК – вариации последовательности ДНК, включающие консервативные миссенс мутации, или так называемые синонимические мутации, которые не изменяют закодированную информацию в ДНК гена или не воздействуют на функциональную активность белковых макромолекул.
Хромосомные (геномные) мутации (аномалии) связаны либо с различными структурными перестройками хромосом, либо с изменением их числа (n). Численные изменения в наборе хромосом (кариотипе) могут быть двух типов: полиплоидии – умножение полного хромосомного набора (3n, 4n и т.д.) или генома, кратное гаплоидному числу хромосом; анеуплоидии – увеличение или уменьшение числа хромосом в наборе, некратное гаплоидному. Эти количественные изменения кариотипа обусловлены, как правило, нарушениями мейоза или митоза. Численные хромосомные аномалии в виде анеуплоидии делятся на моносомию (потерю хромосомы или её части – частичная моносомия) и трисомию или полисомию (приобретение одной/нескольких хромосом или её части – частичная трисомия). Данные изменения кариотипа связаны с комплексом врожденных пороков развития и, как правило, с заболеваниями, сопровождающимися умственной отсталостью, или тяжелыми психическими расстройствами. В настоящее время описаны случаи изменений хромосомного набора с участием половых хромосом и некоторых аутосом при шизофрении и аутизме. Например, до 5–15 % детей с аутистическими расстройствами имеют хромосомные аномалии. Это позволяет рассматривать хромосомный дисбаланс в организме в качестве одной из возможных причин отдельных случаев нервных и психических болезней.
Структурные изменения могут затрагивать всю хромосому, а также сопровождаться изменением количества генетического материала в ядре или его перемещением. Сбалансированные хромосомные аномалии представляют собой перестройки, за счет которых выявляется кариотип с измененным набором расположения генов в пределах хромосом или между хромосомами, который отличается от традиционного (нормального). В большинстве случаев носители сбалансированных хромосомных аномалий фенотипически нормальны, но для их потомства возникает большой риск иметь несбалансированный кариотип. Следует отметить, что в отдельных случаях носители сбалансированного кариотипа могут иметь различные врожденные пороки и/или микроаномалии, а также нарушения нервного и психического развития. Если при структурных хромосомных мутациях наблюдается потеря или приобретение генетического материала, то они являются несбалансированными хромосомными аномалиями.
Цитогенетически структурные хромосомные (геномные) перестройки классифицируют по принципу линейной последовательности расположения генов: делеции (потеря хромосомных участков), дупликации (удвоение хромосомных участков), инверсии (перевертывание на 180° относительно нормальной последовательности хромосомных участков), инсерции (вставки хромосомных участков) и транслокации (изменение расположения хромосомных участков). В последнее время в литературе хромосомные микроаномалии и перестройки могут обозначаться, как геномные.
Изменения генома (хромосом), приводящие к редким заболеваниям, могут включать как крупные микроскопически видимые перестройки (более 5 млн пн), так и вариации числа копий последовательностей ДНК (CNV) и однонуклеотидные полиморфные изменения последовательности ДНК (SNP). Как уже было сказано выше, в настоящее время для определения причины заболевания на геномном уровне используются различные технологии, наиболее распространенными из которых являются полногеномные методы, в частности, молекулярное кариотипирование (arrayCGH). Однако патогенность выявленных вариаций генома можно определить только при помощи использования инновационных биоинформатических технологий. Большой массив информации, собранный на интернет-ресурсах, позволяет уточнить функциональные особенности (онтологию) как отдельного гена, так и целой генной сети за счёт анализа последовательности кодируемого белка и моделирования молекулярных процессов, инициированных геномным изменением.
Таким образом, с хромосомными болезнями связаны аномалии микроскопически видимых численных или структурных нарушений хромосом, геномные же болезни связаны как с микроаномалиям хромосом, так и с вариациями числа копий последовательностей ДНК (CNV).
Большое значение имеет изучение хромосомных мутаций, под действием факторов внешней среды. Показано, что хромосомы человека отличаются высокой чувствительностью к действию радиации и химических веществ, которые принято называть мутагенными факторами (мутагенами). При анализе воздействия этих факторов следует различать нарушения в соматических и половых клетках. Первые затрагивают непосредственно жизнедеятельность исследуемого организма, тогда как вторые проявляются в последующих поколениях. Мутации хромосом в зародышевых клетках ведут к образованию аберрантных гамет, в результате которых возможна гибель зигот, эмбрионов на ранних стадиях внутриутробного развития, а также рождение детей со специфическими или неспецифическими хромосомными аномалиями, которые проявляются в виде определенной клинической картины или определенного фенотипа. Мутации хромосом в соматических клетках ведут к образованию неспецифичных хромосомных аномалий в виде хромосомных или хроматидных пробелов, разрывов, обменов в кариотипе, не ведущих к определенному фенотипу, характерному для конкретного заболевания. Подобные мутации не наследуются. Следует отметить, что при изучении такого рода воздействия мутагенных факторов представляется возможным оценить качественно и количественно действие ионизирующей радиации, химических веществ, вирусов, но полученные данные не могут быть перенесены на половые клетки, где результатом действия являются специфические хромосомные аномалии, влияющие на фенотип.
Хромосомные аномалии могут проявляться в так называемых мозаичных формах, к которым приводит неправильное деление клеток на различных стадиях эмбрионального и постнатального развития. Это позволяет разделить хромосомные аномалии на мозаичные и регулярные (аномальный кариотип наблюдается во всех клетках организма). Хромосомный мозаицизм представляет собой наличие нескольких популяций клеток с различным друг от друга хромосомным набором. Как правило, при мозаичных формах хромосомных аномалий наблюдают отсутствие отдельных клинических признаков определенного хромосомного синдрома и более легкое течение заболевания, но некоторые симптомы практически всегда присутствуют. Мозаичные структурные хромосомные аномалии наблюдаются достаточно редко, поэтому, когда речь идет о мозаичных хромосомных аномалиях, имеются в виду, в основном, численные аномалии, мозаичные формы которых имеют достаточно высокую популяционную частоту. Следует также отметить феномен тканеспецифического хромосомного мозаицизма – клетки с аномальным хромосомным набором присутствуют только в определенной ткани организма.
Читайте также:

