Цепные фотохимические реакции роль фотохимических реакций в биологии и медицине реферат
Обновлено: 05.07.2024
Цепные реакции характеризуются возникновением в каждом элементарном акте активной частицы, что вызывает цепь превращений исходных веществ в продукты. (галогенирование, окисление, полимеризация, ядерные процессы). (прогоркание жиров, окисление красящих веществ в процессе созревания красных вин и ряд других.)
Активные частицы – это атомы, обладающие неспаренным электроном, свободные радикалы, несольватированные ионы, возбужденные молекулы, т. Е. частицы с некомпенсированной валентностью.
Цепные реакции могут быть неразветвленными и разветвленными. Любая цепная реакция состоит из трех основных стадий: зарождения, продолжения, обрава цепи.
1. Зарождение – образуются активные частицы. Причины: А) распад молекулы и молекул на радикалы. Б)добавки специальных веществ – инициаторов образования свободных радикалов.
2. Продолжение – состоит из большого числа повторяющихся элементарных реакций взаимодействия активных частиц с исходными веществами.
3. Обрыв цепи – (гобель активных частиц), путем захвата свободных радикалов стенками реакционных сосудов.
При определении скорости неразветвленных цепных реакций используют такие понятия, как звено и длина цепи.
Звено цепи – повторяющая совокупность элементарных реакций которые начинаются образованием активной частицы и заканчивается её регенерацией.
Длина цепи – число звеньев на стадии продолжения цепи.
Фотохимические реакции — химические реакции, которые инициируются воздействием электромагнитных волн, в частности — светом. Примерами фотохимических реакций являются фотосинтез в растениях, распад бромида серебра в светочувствительном слое фотопластинки, превращение молекул кислорода в озон в верхних слоях атмосферы, фотоизомеризация, фотохимически инициируемые перициклические реакции, фотохимические перегруппировки (напр. ди-π-метановая перегруппировка) и т.п.
При всех фотохимических процессах выполняется закон Гротгуса:
Химическое превращение вещества может вызвать только то излучение, которое поглощается этим веществом.
Взаимодействие света с веществом может идти по трём возможным направлениям:
1. Возбуждение частиц (переход электронов на вышележащие орбитали):
2. Ионизация частиц за счет отрыва электронов:
3. Диссоциация молекул с образованием свободных радикалов (гомолитическая) либо ионов (гетеролитическая):
41. Катализаторы и каталитические реакции, механизм каталитических реакций.
КАТАЛИЗ (от греч. katalysis - разрушение), изменение скорости хим. р-ции при воздействии в-в (катализаторов), к-рые участвуют в р-ции, но не входят в состав продуктов. Реакции в присутствии катализаторов называют каталитическими.
Катализ, увеличивающий скорость химической реакции, называются положительным катализом, а замедляющий – отрицательным. (ингибирование), а вещества его вызывающие – ингибиторы.
Катализаторы не изменяют состояние равновесия в системе, а лишь облегчают его достижение. (при положительном катализе).
Все каталитич. р-ции -самопроизвольные процессы, т. е. протекают в направлении убыли энергии Гиббса системы.
Катализ может быть гомогенным и гетерогенным. В случае гомогенного катализа катализатор и реагирующие вещества находятся в одной фазе – жидкой или газовой. При гетерогенном катализе реагирующие вещества и катализатор находятся в разных фазах, а химическая реакция протекает на границе раздела фаз. Возможен и гетерогенно-гомогенный катализ, когда реакция начинается на поверхности твердого тела катализатора, а продолжается в объеме реакционной среды.
В зависимости от механизма каталитического процесса различают кислотно-основной, окислительно-восстановительный, ферментативный, стереоселективный и некоторые другие виды катализа.
1. Кислотно-основной катализ – вещества, способные передавать или принимать протон или имеющие акцептор электронной пары, например атом АL.
2. Ферментативный катализ – имеют большое значение в пищевой промышленности, используются биологические катализаторы-ферменты. Ферменты – биокатализаторы, продукты жизнедеятельности живых организмов.
3. Каталитическая активность – ускорение химической реакции.
Увеличение скорсти, каталитических реакций происходит за счет снижения энергии активации, увеличения энтропии активации, увеличения энтропии активации и осуществления цепного механизма реакции.
Механизмы: 1. Стадийный: заключается в замене одной каталитической реакции на несколько стадий последовательного взаимодействия исходных веществ с катализатором с возможным образованием на каждой стадии активированного комплекса. Реакция типа А→В при катализе протекает следующим образом: А+К→(АК) ≠ →АК, АК+В→(АВК) ≠ →АВ+К.
2.Слитный механизм – происходит одновременное взаимодействие с катализатором всех исходных веществ и образование одного активированного комплекса.
Фотохимические процессы в принципе одинаковы у всех животных, как у беспозвоночных, так и у позвоночных. В палочках у человека содержится пигмент родопсин, а в колбочках - иодопсин. Родопсин представляет сложную молекулу, состоящую из липопротеина и ретиналя - альдегидной формы витамина А. При действии света происходит цикл фотохимических реакций, ведущих к расщеплению родопсина. Вслед за фотохимическими процессами происходят биоэлектрические изменения рецепторного потенциала, и далее возбуждение через биполярные нервные клетки переходит к ганглионарным клеткам, и по зрительному нерву достигает центральной нервной системы. В темноте происходит ресинтез родопсина. Процесс обновления наружных сегментов палочек осуществляется постепенно. Например, у некоторых обезьян - макак и резусов - каждая палочка обновляется за 9-12 дней. Эту функцию обновления, а также хранения витамина А и его производных выполняют пигментные клетки. Глаз предохраняет себя от избыточной освещенности путем изменения величины зрачка. Помимо этого сама сетчатка способна компенсировать увеличение яркости: существуют колбочки и палочки, функционирующие в разных диапазонах яркости, происходит перестройка рецептивных областей.
Если на сетчатку попадает мало света, то синтез родопсина интенсифицируется, и концентрация родопсина увеличивается. Это фотохимическая основа темновой адаптации глаза. Одновременно зрение переходит на палочковую систему с помощью горизонтальных клеток и рецептивные поля этих нейронов увеличиваются. Также размер зрачка увеличивается.
2.5.4 Промежуточный слой
Промежуточный слой сетчатки содержит как биполярные, так и горизонтальные и апокриновые клетки. Биполярные клетки имеют входы от рецепторов, и часть их передает сигналы непосредственно к ганглиозным клеткам. Кроме такой прямой передачи импульсов в ганглиозные клетки существует и другой путь. Благодаря наличию горизонтальных и амакриновых клеток информация от рецепторов может распространяться параллельно сетчатке. Уже здесь происходит обработка зрительной информации.
2.6 Зрительные пути
Зрительная информация передается в головной мозг по аксонам ганглиозных клеток сетчатки, образуя зрительный нерв. В его составе примерно 1 млн. волокон. Количество ганглиозных клеток более чем в 100 раз меньше числа фоторецепторных клеток.
Рис.17 Структура сетчатки
Таким образом, импульсы от фоторецепторов далее подходят к биполярным клеткам. Каждая такая клетка связана с несколькими палочками и колбочками. В свою очередь, одна ганглиозная клетка контактирует со многими биполярными клетками. Фоторецепторы, соединенные с одной ганглиозной клеткой, образуют рецептивное поле ганглиозной клетки. Причем, рецептивные поля ганглиозных клеток перекрывают друг друга, что связано с наличием горизонтальных и амакриновых клеток, соединяющих по горизонтали биполярные и ганглиозные клетки. Поэтому одна ганглиозная клетка может быть связана с десятками тысяч фоторецепторов. В сетчатке есть центробежные нервные волокна, которые могут регулировать количество нейронов, охваченных возбужден.
В мозге человека аксоны от левых половин сетчатки обеих глаз направляются к левой половине зрительной коры, а аксоны от правых половин сетчатки обеих глаз - к правой стороне зрительной коры. Аксоны, идущие от носовых половин обеих сетчаток, пересекаются. Место их пересечения называют зрительным перекрестом или хиозмой. После пересечения образуется зрительный тракт, который проходит через коленчатые тела, четверохолмие и другие мозговые структуры и поступает в корковый конец зрительного анализатора.
Перекрещиваются только внутренние волокна, начинающиеся от медиальной (носовой) половины сетчатки. Наружные или височные волокна проходят через плазму не перекрещенными. Каждый зрительный тракт содержит волокна от внутренней половины сетчатки глаза противоположной стороны и наружной половины
сетчатки глаза своей стороны. Таким образом, зрительный тракт содержит волокна от одноименных половин сетчатки обоих глаз - левых и правых. Следовательно, правый зрительный тракт проводит раздражение от левых половин полей зрения обоих глаз,
а левый - правых.
Височная носовая носовая височная
Рис.18 Зрительный анализатор. Нарушения полей зрения при поражении:
I - зрительного нерва; II - внутренних отделов зрительного перекреста;
III - левого наружного отдела зрительного перекреста: IV - левого зрительного тракта.
Нужно учесть, что преломляющие среды глаза проецируют на сетчатку обратное изображение видимого, а это значит, что предметы правого поля зрения воспринимаются левым половинами сетчатки и далее зрительные импульсы передаются по левому зрительному тракту.
В зрительной коре спроецированы все мельчайшие участки сетчатки, и именно в коре зрительные сигналы интерпретируются. Различные нейроны возбуждаются от различных раздражителей. Это могут быть цвет, контраст, движение, контуры предмета, разрывы в контуре. Некоторые нейроны реагируют на предъявление изображений лиц. И при участии как лобных, так и других отделов мозга осуществляется интерпретивная функция коры, в результате чего формируется зрительное восприятие мира.
От сетчатки импульсы подходят также к гипоталамусу, благодаря чему происходит согласование внутреннего циркадного ритма сна и бодрствования со сменой дня и ночи. Зрительные сигналы по таламическим путям достигают теменных зрительных ассоциативных зон. Ганглиозные клетки сетчатки связываются с вестибулярным аппаратом и с мозжечком.
3.1 Глаза ребенка выполняют значительную зрительную работу. От того, как соблюдаются правила гигиены, зависит и утомление органов зрения, и сохранение их полноценной функции на будущее.
Ученые связывают нарушение зрения с общим состоянием организма, поэтому занятия физической культурой крайне необходимы детям. Ведущие ученые рекомендуют привлекать детей к занятиям в основной группе по физической культуре. Эти дети могут сдавать нормы ГТО, посещать уроки физкультуры, заниматься в спортивных секциях, участвовать в соревнованиях, что имеет не только оздоровительное, но и психологическое значение. Разумеется, физические нагрузки должны дозироваться с учетом возраста и подготовленности ребенка.
Кроме того, для учащихся младших классов рекомендуется включать в занятия физической культурой (например, в уроки физкультуры) специальные упражнения (2—3) для глаз, например, такие: при исходной позиции ноги на ширине плеч. руки в стороны, круговые движения руками вперед и назад. В это время следить за кончиком большого пальца. Повторить 3—4 раза. Второе упражнение такое. Исходная позиция: сидя на стуле, скамейке, зажмурить и открыть глаза. Выполняется в среднем темпе, повторить 3—4 раза.
Каждый учащийся уже в начальной школе должен овладеть рядом важных навыков. Из них самый трудный для усвоения: соблюдение необходимого расстояния от глаз до рабочей поверхности (тетради, книги). Овладение правилами самоконтроля и применение их. Кроме того, в начальной школе ребенок должен выработать навыки:
заниматься при достаточном и правильном освещении;
соблюдать ритм зрительной работы, гигиену просмотра телевизионных передач;
выполнять гимнастику для глаз и уметь давать глазам отдых.
3.2. К сожалению, есть семьи, где этим нормам не уделяется внимание или даже поощряется, когда дети подолгу смотрят телевизор, дети заняты и не мешают взрослым.
Рассматриваемый нами вопрос, как никакой другой, требует единства требований к детям со стороны школы и семьи. Учителю полезно рассказать родителям о рекомендациях, которые он дал детям; пояснить, что длительный просмотр телепередач приводит к утомлению нервной системы, зрения, отнимает время от прогулок, двигательной активности.
Гигиенические исследования показывают, что некоторые школьники просиживают перед телевизором до 14 и даже до 30 и более часов в неделю.
Вот почему о просмотре телевизионных передач нужно упоминать, когда речь идет о рациональном отдыхе детей, о причинах детской нервозности, о несоблюдении режима дня. Но более всего просмотр телепередач связан с гигиеной зрения.
3.3. Рекомендуется проводить с учащимися следующую целенаправленную воспитательную работу но охране зрения.
В 1 классе охране зрения служит прежде всего воспитание правильной посадки во время занятий; советы родителям об организации рабочего места ребенка дома (мебель, соответствующая росту ребенка, достаточное освещение); рекомендации о перерывах во время зрительной работы.
1. При помощи глаз мы узнаем о цвете, форме, размерах предметов. Глаза помогают нам познавать окружающий нас мир, учиться, выполнять различную работу. Человеку с плохим зрением труднее стать летчиком, моряком, достичь успехов в спорте, на сцене. Зрение нужно беречь.
2. Зрение портится во время работы при плохом освещении, при малом расстоянии от глаз до книги (тетради), чтении лежа, длительном просмотре телевизионных передач.
3. Для того чтобы сберечь зрение, нужно заниматься при достаточном освещении, свет должен падать слева, должны соблюдаться: необходимое расстояние от глаз до книги и правильная посадка во время занятий, выполняться простейшая гимнастика для глаз.
Заслуживает одобрения следующий прием, который используют многие педагоги; стол учителя ставят у доски, на столе лампа.
Один из учеников показывает все упомянутые приемы самоконтроля, а класс проверяет и дает им оценку, затем эти приемы дети проделывают сами, сидя за партами.
Список литературы Семенов Э. В. Физиология и анатомия. Москва 1997г. Коростелев Н. Б. Воспитание здорового школьника. Москва 1986г. Судаков К. В. Избранные лекции по нормальной физиологии. Москва 1992г. Анатомия человека. В 2 т. /Под ред. М. Р. Сапина. Москва 1993г.
Российский Открытый Университет
Психолого-педагогический факультет
Фотохимическими называют реакции, протекающие под действием света. Поскольку любые химические реакции обусловлены процессами, происходящими с валентными электронами, то очевидно, что химическое действие света определяется его взаимодействием с электронами, находящимися на внешних: слоях электронных оболочек атомов. Поскольку количество поглощенной энергии пропорционально произведению потока излучения Фе на время, в течение которого тело подвергается освещению (т. е. доза излучения), то очевидно, что различные световые потоки производят одинаковое фотохимическое действие, если Ф1Dt1 = Ф2Dt2. Это положение представляет собой основной закон фотохимии и называется законом Бунзена и Роско.
Число j, показывающее, какая часть фотонов N из общего числа фотонов, поглощенных телом NП, вызвала фотохимические процессы, называют квантовым выходом реакции j = N/NП. Если каждый поглощенный фотон вызывает реакцию, то квантовый выход равен 100%. Однако обычно он не превышает нескольких процентов или долей процента. Например, квантовый выход реакции инактивации ферментов составляет примерно 0,1–0,01%.
Следует различать первичные и вторичные фотохимические реакции, так как многие из прореагировавших с фотонами молекул дают начало другим реакциям, происходящим с соседними молекулами. Эйнштейн показал, что каждой прореагировавшей молекуле соответствует только один поглощенный фотон, а следовательно, число прореагировавших молекул в первичной фотохимической реакции пропорционально числу поглощенных фотонов.
ТИПЫ ФОТОХИМИЧЕСКИХ РЕАКЦИЙ
Фотоприсоединение.К возбужденному атому или молекуле присоединяются нейтральные молекулы. Обозначим вступающие в реакцию молекулы А и В, а возбужденные молекулы соответственно А* и В*.
К этому типу реакций относятся:
а) фотодимеризация или фотополимеризация, протекающие по схеме A + A + hn ®A + A*® AA*;
б) фотооксидирование A + O2 + hn ®A* + O2 ® OAO;
в) фотогидратация A + H2O + hn ® A* + Н2О®НАОН и др.
Фотораспад.Он происходит с разрывом химических связей на радикалы, ионы или нейтральные молекулы
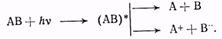
К числу широко известных реакций фотораспада относится реакция разложения бромистого серебра в фоточувствительных материалах. Под действием фотона из молекулы бромистого серебра удаляется электрон, и соединяющая молекулу ионная связь разрывается, в результате чего образуются мельчайшие частички металлического серебра, создающие так называемое скрытое изображение. Видимое изображение получается после обработки фотоматериала в проявителе, который вызывает усиленное выделение металлического серебра в местах скрытого изображения.
Фотосинтез. Это фотохимическая реакция синтеза органических веществ из углерода неорганических соединений и воды с образованием свободного молекулярного кислорода, протекающая в растениях и бактериях с участием хлорофиллов и некоторых других пигментов (каротиноиды, каротинолы и др.), которые играют роль катализаторов. В растениях углерод, поглощается в виде СО2. Фотоны разрывают прочную связь между кислородом и углеродом в молекуле СО2, и при этом образуются углеводороды, способные к дальнейшему окислению в организме животных. В простейшем случае, когда в растениях конечными продуктами фотосинтеза являются углеводороды, этот процесс, минуя промежуточные стадии, можно представить следующей реакцией: CO2 + H2O + hn ®СН2О + О2 + 469 кДж/моль.
Продукты этой реакции – кислород и углевод, из которого образуется глюкоза (СН2 = 1 êбСбН12О6). Реакция фотосинтеза обратна реакции, происходящей при дыхании, т.е. образованию СО2 и Н2О из органических соединений и кислорода.
Фотосинтез отличается от остальных фотохимических процессов тем, что он приводит к аккумулированию энергии света в виде свободной энергии химических связей в СН2О и в дальнейшем в глюкозе, так как свободная энергия СН2О больше свободной энергии СО2 и Н2О на 469 кДж/моль. Фотосинтез поэтому является единственным процессом, посредством которого органический мир пополняет свои запасы свободной энергии за счет энергии солнечного излучения, в то время как в процессах жизнедеятельности эта свободная энергия непрерывно растрачивается. Существенное отличие фотосинтеза от других биохимических реакций, происходящих в темноте (например, от синтеза белка в клетках животных), заключается в том, что только при фотосинтезе сложные вещества получаются непосредственно из таких простых веществ, как вода и СО2. Во всех других процессах в клетке синтез одних веществ связан с распадом других, поскольку необходимая для синтеза энергия черпается за счет энергии распада этих веществ.
Механизм фотосинтеза достаточно сложен и рассматривается в специальных курсах. Вкратце суть его сводится к тому. что пигменты в хлоропластах растений поглощают фотоны и их молекулы переходят в возбужденное состояние; при этом часть энергии излучается в актах люминесценции и часть переходит в теплоту. Вслед за этим происходит ряд процессов, в которых энергия возбужденных молекул пигментов расходуется на переносы электронов, окисление молекул воды с выделением свободного молекулярного кислорода и накоплением восстановленных пиридиннуклеотидов и АТФ. Эти богатые энергией соединения вступают в ряд темповых реакций, приводящих к связыванию и восстановлению СО2. Считается, что на образование одной молекулы О2, т. е. на протекание вышеприведенной суммарной реакции, расходуется 8 фотонов, т.е. квантовый выход реакции j = 1 ê8
Существуют реакции фотосинтеза, протекающие и без выделения О2, например у некоторых микроорганизмов: 2H2S + CO2 + hn –*CH2O + H2O + 2S. Эта реакция характерна для пурпурных и зеленых серобактерий.
Фотоизомеризация и некоторые другие реакции.Напомним,, что изомерами называют химические соединения, обладающие одинаковым составом, но различающиеся по расположению в них) атомов или групп атомов в пространстве. Изомеры могут быть разных видов. В частности, в геометрических изомерах группы атомов по-разному расположены относительно двойной связи С = С. Таковы, например, изомеры 1,2-дихлорэтилена.

Обе изомерные формы различаются некоторыми физическими и химическими свойствами. Например, температуры кипения цис- и транс-изомеров 1,2-дихлорэтилена равны соответственно 60,1 и 48,4°С. Обычно один из изомеров менее устойчив и переходит в другой изомер под действием определенных физических факторов: нагревания, освещения и др. Одна из важных фотобиологических реакций изомеризации происходит в сетчатке глаза.
Фотохимические реакции лежат в основе многих фотобиологических процессов, первичным актом в которых является поглощение фотона, за которым следует длинная цепочка превращений примерно в следующей последовательности: переход хромофорных молекулярных групп в возбужденное состояние ® эмиграция энергии возбужденного состояния от одной группы молекул к другой ® первичный фотофизический процесс и появление первичных фотопродуктов ® промежуточные процессы ® образование первичных стабильных химических продуктов ® биохимические процессы ® конечный фотобиологический эффект. Рассмотрение всех этих сложнейших процессов составляет предмет одного из разделов биофизики – фотобиологии.
После поглощения кванта света в молекуле могут происходить разнообразные процессы. В начале 20 в. Альбертом Эйнштейном и немецким физиком Иоганном Штарком был сформулирован второй закон фотохимии. В соответствии с этим законом, первичный фотохимический акт происходит под действием одного кванта света – фотона. Поэтому этот закон называют также законом квантовой эквивалентности.
Работа состоит из 1 файл
ФОТОХИМИЧЕСКИЕ РЕАКЦИИ.docx
ФОТОХИМИЧЕСКИЕ РЕАКЦИИ – химические превращения, протекающие под действием света в видимой и ультрафиолетовой области спектра.
После поглощения кванта света в молекуле могут происходить разнообразные процессы. В начале 20 в. Альбертом Эйнштейном и немецким физиком Иоганном Штарком был сформулирован второй закон фотохимии. В соответствии с этим законом, первичный фотохимический акт происходит под действием одного кванта света – фотона. Поэтому этот закон называют также законом квантовой эквивалентности. (После открытия лазеров было обнаружено, что у этого закона есть исключения: в случае очень мощного лазерного излучения возможно одновременное поглощение двух фотонов.)
Второй закон фотохимии служит основой для расчета квантового выхода фотохимической реакции, который равен числу прореагировавших (или вновь образовавшихся) молекул, деленному на число поглощенных квантов. Квантовый выход, определяемый экспериментально, позволяет судить о механизме фотохимической реакции.
Молекула, поглотившая в первичном процессе квант света, приобретает избыточную энергию, поэтому такую молекулу называют возбужденной. В отличие от теплового воздействия, когда возбуждаются колебательные движения молекулы и возрастает ее кинетическая энергия, при поглощении фотона энергия передается электронам. С электронно возбужденной молекулой могут происходить самые разнообразные процессы. Некоторые из них не связаны с химическими превращениями и называются фотофизическими процессами. Так, возбужденное состояние может за очень короткое время (порядка 10–9 с) вернуться в основное состояние, отдавая избыточную энергию в виде кванта света (как правило, с меньшей энергией). Этот процесс называется флуоресценцией. Если же в результате столкновения возбужденной молекулы с другими молекулами происходит передача избыточной энергии, то интенсивность флуоресценции снижается – частично или полностью. Такие процессы с потерей энергии называются тушением флуоресценции. Возбужденное состояние может также перейти в более долгоживущее (от 0,001 с до нескольких минут) триплетное состояние, энергия которого ниже. Испускание света из этого состояния называется фосфоресценцией.
Возбужденная светом молекула может также вступать в различные химические реакции. Свойства электронно возбужденного состояния могут сильно отличаться от свойств основного состояния молекулы. Так как у каждой молекулы существует лишь одно основное, но несколько возбужденных состояний, фотохимия данного соединения может быть существенно богаче его химии в основном состоянии. В результате появляется возможность осуществлять необычные химические превращения, не свойственные веществам в основном состоянии.
Если после поглощения фотона преобладают фотофизические процессы, число химически прореагировавших молекул, приходящихся на один поглощенный квант, то есть квантовый выход реакции, будет меньше единицы. Например, при облучении красным светом водного раствора ферриоксалата калия (комплекса трехвалентного железа с анионом щавелевой кислоты – оксалатом состава К3[Fe(C2O4)3]) квантовый выход фотохимической реакции 2Fe(C2O4)33– ® 2Fe2+ + 5C2O42– + 2CO2 равен всего 0,01, но возрастает с увеличением энергии кванта света. Еще меньшие квантовые выходы наблюдаются при фотохимическом разложении (фотолизе) твердых тел. Например, даже на ярком солнечном свету полимерные пленки разрушаются довольно медленно, в течение многих недель, месяцев и даже лет.
В большинстве фотохимических реакций получаемая молекулой энергия превышает типичные энергии активации темновых (термических) реакций и может даже превосходить энергию разрыва химических связей. Тем не менее многие фотохимические реакции отличаются высокой избирательностью, что связано с особенностями электронного строения возбужденного состояния.
Рассмотрим некоторые фотохимические реакции. В результате реакции фотодиссоциации происходит разрыв химических связей с образованием свободных радикалов (См. также СВОБОДНЫЕ РАДИКАЛЫ). Примером могут служить реакции Cl2 ® 2Cl; CH3I ® CH3 + I; CH3–N=N–CH3 ® 2CH3 + N2 и другие. Образующиеся атомы и радикалы обладают высокой реакционной способностью и вступают в быстрые темновые реакции, часто цепные. В результате квантовый выход суммарной реакции может стать значительно больше единицы. Так, при облучении смеси Cl2 + H2 квантовый выход HCl может достигать сотен тысяч. Фотохимическое радикально-цепное присоединение сероводорода к алкенам используется для синтеза меркаптанов – соединений с сильным запахом, которые добавляют к природному газу для обнаружения его утечки. Очень важны реакции фотодиссоциации молекул кислорода и озона, идущие в верхних слоях атмосферы. С помощью реакций фотодиссоциации можно осуществлять различные процессы радикальной полимеризации. Подобные процессы применяются в производстве интегральных схем; с помощью фоторезистов на кремниевой подложке обозначаются участки, на которых в последующем образуются элементы будущей микросхемы. В зубоврачебной технике фотополимеризация используется для отверждения современных пломбировочных материалов.
Реакция фотодиссоциации используется в промышленно важном процессе получения e-капролактама – исходного вещества для производства капрона. Облучению видимым светом подвергают нитрозилхлорид, который при этом распадается: NOCl + h238 ® NO + Cl. Далее атомы хлора реагируют с циклогексаном: цикло-С6Н12 + Cl ® цикло-С6Н11 + НСl, а циклогексильные радикалы реагируют с NO или NOCl: цикло-С6Н11 + NO (NOCl) ® цикло-С6Н11NO ® цикло-С6Н10=N–OH. Образовавшийся при изомеризации нитрозоциклогексана циклогексанонооксим далее превращается в e-капролактам.
Фотохимический разрыв С–С-связи в стероидном соединении 7-дегидрохолестерине используется для синтеза витамина D3, который добавляют в корма животных. В сходной фотохимической реакции из эргостерина получают витамин D2; эта реакция протекает под действием солнечного света и в коже человека.
Реакции фотодиссоциации с разрывом химических связей могут идти в разнообразных полимерных материалах под действием видимого или ультрафиолетового света. Образующиеся при этом радикалы могут приводить к разрыву связей С–С в углеродных цепочках полимера. Эти процессы приводят к так называемой фотодеструкции полимеров, которые ускоряются под действием агрессивных компонентов атмосферы – кислорода, озона, оксида азота(IV). В результате ухудшаются механические свойства полимера. Они особенно заметны на полиэтиленовой пленке парника, которая в течение многих месяцев подвергалась действию прямых солнечных лучей. Поэтому очень важны меры по фотостабилизации полимеров; ее можно осуществить введением ингибиторов радикальных реакций. С другой стороны, для упаковочных полимерных материалов, наоборот, желательно быстрое их разрушение после использования, чтобы избежать загрязнения этими полимерами окружающей среды. Такие полимеры намеренно делают светочувствительными; под действием солнечных лучей они рассыпаются в тонкий порошок.
Возбужденные светом молекулы могут также вступать в реакции переноса электрона – фотоокисление и фотовосстановление. Так, возбужденные карбонильные соединения в присутствии восстановителя могут превращаться в спирты, а возбужденные молекулы красителей, реагируя с кислородом, превращаются в бесцветные соединения. На фотовосстановлении солей железа(III) органическими реагентами (щавелевая или лимонная кислота) основаны методы светокопирования чертежей: образующиеся при фотовосстановлении Fe3+ ионы Fe2+, реагируя с красной кровяной солью, дают синий осадок См. также ЛАЗУРЬ БЕРЛИНСКАЯ.
Под действием света могут идти реакции фотоприсоединения. Так, при возбуждении молекул с двойной связью возможен ее разрыв с образованием бирадикала, например, Н2С=СН2 ® Н2С.–.СН2. Присоединение к нему второй молекулы этилена дает циклобутан. Такое циклоприсоединение с участием двух молекул алкенов происходит только под действием ультрафиолетового света; при нагревании эта реакция не идет, поскольку она запрещена так называемым правилом Вудворда – Хоффмана. В карбонильных соединениях с двойной связью С=О также возможен ее частичный разрыв с образованием реакционноспособного бирадикала. К нему может присоединиться молекула алкена с образованием четырехчленного циклического соединения – оксетана. Оксетановый цикл входит в состав некоторых антибиотиков; подобные соединения часто могут быть получены только фотохимически.
Под действием света идут также разнообразные реакции фотоизомеризации. Например, транс-стильбен (1,2-дифенилэтилен) под действием света превращается в цис-стильбен. Цис-транс-изомеризация ретиналя (вещества, родственного ретинолу – витамину А) под действием света приводит в результате ряда последующих процессов к возникновению зрительного сигнала в сетчатке глаза.
Фотохимическим хлорированием бензола получают инсектицид гексахлорциклогексан. Фтотохимическим хлорированием, сульфохлорированием (одновременная реакция с SO2 и Cl2) и сульфоокислением алканов получают растворители, моющие средства и средства для химической чистки. Большое практическое значение имеют фотохимические реакции в зеленых растениях (фотосинтез).
Обратимые превращения веществ под действием света в ряде случаев приводят к интересному явлению – фотохромизму. Оно заключается в приобретении или изменении окраски под действием света. Обратная реакция может идти как в темноте, так и под действием света с другой длиной волны. Скорости прямой и обратной реакции могут быть различными. Часто прямая фотохимическая реакция идет сравнительно быстро, а обратная темновая – медленно. Фотохромизм наблюдается как у неорганических, так и у органических соединений. Механизм явления может быть разным. В случае кристаллических соединений действие света может сводиться к перемещению электронов или атомов из одних узлов кристаллической решетки в другие. Так, светозащитное фотохромное стекло содержит около 0,5% хлорида или бромида серебра, сплавленного с боросиликатами щелочных металлов. Под действием света происходит перенос электронов от ионов галогена к ионам серебра; образовавшиеся атомы серебра делают стекло непрозрачным. Обратная реакция может идти под действием света с другой длиной волны или в темноте. Такое стекло используется для изготовления солнечных очков, окон зданий и автомобилей; оно само регулирует пропускаемый световой поток, делая его оптимальным.
Кроме галогенидов серебра, фотохромными свойствами (в присутствии различных добавок) обладают также некоторые соли щелочных металлов – титанаты, силикаты, фосфаты. Смесь кристаллического иодида ртути(I) зеленого цвета и желтого иодида серебра представляет пример фотохромной системы, в которой изменение цвета сопровождается окислительно-восстановительной реакцией и изменением кристаллической структуры; в результате образуются красный иодид ртути(II) и черный порошок серебра: Hg2I2 + 2AgI ® 2HgI2 + 2Ag.
Фотохромизм органических соединений связан, как правило, с изменением структуры молекулы. Фотохромная изомеризация характерна для многих ароматических нитросоединений. Например, в о-нитротолуоле при облучении происходит внутримолекулярный перенос протона, в результате которого светло-желтая жидкость переходит в ярко-синюю R2CH–NO2 R2С=N+(O–)–OH.
Читайте также:

