Биохимические изменения в сердечных мышцах при патологии реферат
Обновлено: 02.07.2024
Для цитирования: Лысенко Л.М., Кузнецова О.А., Шилина Л.В. Патологические изменения сердечно-сосудистой системы у спортсменов на фоне синдрома физического перенапряжения. РМЖ. Медицинское обозрение. 2015;23(4):239.
Рост спортивных результатов, особенно в последнее десятилетие, повлек за собой увеличение объема нагрузок. Интенсификация спортивных тренировок стала рассматриваться как единственный залог достижения успехов. Как показано различными исследователями, плата за адаптацию к нагрузкам современного спорта достаточно высока.
Основным звеном, лимитирующим физическую работоспособность спортсмена, является система (ССС), которая наиболее интегрально отражает функциональные возможности организма. Адекватные физические нагрузки повышают экономичность функционирования ССС, чрезмерные нагрузки, равно как и недостаточная двигательная активность, особенно в сочетании с психоэмоциональным напряжением, ведут к развитию физического перенапряжения ССС. У спортсменов с интенсивными нагрузками, помимо стрессорных и физических воздействий, в патогенезе физического перенапряжения ССС в условиях Амурской области, возможно, дополнительную роль играет частая смена часовых поясов, в результате чего наступает десинхроноз суточных ритмов вегетативных функций организма (разница во времени при перелетах Благовещенск — Москва составляет 8 ч). Срыв адаптации ССС выражается в явлении миокардиодистрофии на почве физического перенапряжения, частота которой, по данным разных авторов, составляет у спортсменов от 7 до 17% [1–4].
В статье приведены результаты мониторирования функционального состояния ССС у 56 высококвалифицированных спортсменов в годичном тренировочном цикле подготовки в условиях Амурской области. По данным ЭКГ выявлен высокий процент нарушений ритма, проводимости и процессов реполяризации. В большинстве случаев благодаря коррекции нагрузок и восстановительному лечению выявленные нарушения носили преходящий характер. В 21% наблюдений нарушения процессов реполяризации имели стойкий характер и, вероятно, были проявлением ДМФП. Следовательно, необходимо продолжение исследований функционального состояния ССС спортсменов в условиях Амурской области с учетом феногенотипических и климатических особенностей адаптации.
Материалы и методы
Результаты исследования и обсуждение
Эхокардиография проведена у 56 наблюдаемых спортсменов. Аномалии развития (пролапс митрального клапана, ложные хорды, трабекулы, аномальное расположение хорд) выявлены у 26 (46%) человек, признаки дилатации полостей сердца — у 12%, признаки гипертрофии миокарда левого желудочка — у 12% наблюдавшихся. По данным эпидемиологических исследований, распространенность малых аномалий сердца у детей до 15 лет в Амурской области составляет 32,8%, однако в данной категории они составляли 46%.
Клинический случай
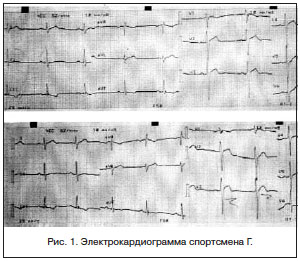
Спортсмен Г., 25 лет, кандидат в мастера спорта, вид спорта — самбо, рост 185 см, вес 76 кг. Перелетов Благовещенск — Москва — Благовещенск — 3. По результатам проведенного углубленного медицинского осмотра нуждался в дообследовании выраженной брадикардии, синдрома слабости синусового узла (СССУ). Сопутствующий диагноз: хронический гипертрофический ринит. Хронический тонзиллит, компенсированная форма. Острый катаральный отит слева. На момент осмотра жалоб не предъявлял.
УЗИ брюшной полости — признаки хронического холецистита. Рентгенография грудной клетки — без патологии. Общий анализ крови, мочи — в норме, биохимические анализы — в норме.
Эхокардиография: митральный клапан — ПСМК плотная, пролабирует 5 мм, Vmax — 1,0 , митральная регургитация (+). Трикуспидальный клапан — створки тонкие, движение в противофазу, Vmax — 0,7 , градиент давления — 2,5 Hg. Трикуспидальная регургитация (+). КДР — 45 мм, КДО — 92 мл, УО — 60 мл, КСР — 29 мм, КСО — 32 мл, ФВ — 65%. Аортальный клапан — фиброзное кольцо, створки тонкие, три, симметричные, Vmax- 1,2 , max градиент — 6 Hg, МПП интактна, ТМЖП — 12–13 мм, кинез правильный, большое количество эхоплотных включений в миокарде. ТЗСЛЖ — 12 мм.
Заключение: камеры сердца не расширены, ПМСК плотная, пролапс МК I степени, митральная регургитация (+), трикуспидальная регургитация (+). Неоднородность структур миокарда межжелудочковой перегородки. Умеренная гипертрофия миокарда ЛЖ. Диастолическая функция ЛЖ не нарушена. Сократительная способность ЛЖ сохранена. ФВ 65%.
Консультирован в кардиоцентре, где выставлен диагноз: миокардиодистрофия смешанного генеза (спортивная II ст. и ), МАРС — дополнительная хорда левого желудочка, вегетативная дисфункция синусового узла, наджелудочковая экстрасистолия. Транзиторная степени Мобитц 1–2 с паузами до 2,3 . НК 0. Хронический гипертрофический ринит. Хронический тонзиллит, компенсированная форма. Острый катаральный отит слева.
Получал следующее лечение: ангио- и церебропротекторы, антиоксиданты.
На фоне проводимого лечения гемодинамика была стабильной, АД 120/70 мм. рт. ст., ЧСС 52–58 уд./мин. Однако, согласно данным холтеровского мониторирования, у больного имеет место вегетативная дисфункция синусового узла (105 эпизодов степени с паузами до 2,3 ). Эпизоды синусовой брадикардии до 43 уд./мин, вероятно, описанные изменения у пациента связаны с перетренированностью и развившейся миокардиодистрофией смешанного генеза (спортивной и инфекционной на фоне заболевания ). Выписывается под наблюдение кардиолога по месту жительства.
Таким образом, регулярные наблюдения за показателями электрокардиографии способствуют своевременному выявлению миокардиодистрофии. Изменения в сердце у данного спортсмена, безусловно, связаны с физическими перегрузками и сопутствующими заболеваниями . Физическое перенапряжение может служить причиной целого ряда метаболических нарушений в организме: нейроэндокринной регуляции ССС, изменения соотношения катаболических и анаболических гормонов (снижение уровня тестостерона), не исключен, однако, и инфекционный генез заболевания. Появлению метаболических изменений, вероятно, способствовала имеющаяся врожденная аномалия сердца [5, 7, 8]. Однако при одном и том же уровне и типе тренировок у других спортсменов изменения не выявлены. В связи с этим нельзя исключить вклад генетического компонента в характер и степень этих изменений.
Выводы
Исследование функционального состояния ССС у спортсменов 1–2 разряда, кандидатов в мастера спорта и мастеров спорта в условиях Амурской области выявило по данным ЭКГ высокий процент нарушений функционального состояния сердца на этапах высокоинтенсивных тренировочных нагрузок.
аспекты мониторинга состояния ССС спортсменов Амурской области нуждаются в дальнейшем изучении с учетом феногенотипических и климатических особенностей адаптации.
- Агаджанян М.Г. Электрокардиографические проявления хронического физического перенапряжения у спортсменов // Физиология человека. 2005. Т. 31. № 6. С. 60–64.
- Гаврилова Е.А. Стрессорная кардиомиопатия у спортсменов: Автореф. дис. . докт. мед. наук. СПб. 2001. 48 с.
- Иорданская Ф.А., Юдинцева М.С. Диагностика и дифференцированная коррекция симптомов дезадаптации к нагрузкам современного спорта и комплексная система мер их профилактики // Теория и практика физической культуры. 1999. № 1. С. 24–27.
- Меерсон Ф.З. Первичное стрессорное повреждение миокарда и аритмическая болезнь сердца // Кардиология. 1993. № 4, 5. С. 50–64.
- Дембо А.Г., Земцовский Э.В. Спортивная кардиология: Руководство для врачей. Л.: Медицина, 1989. С. 464.
- Валанчюте А.Л., Лясаускайте В.В. Внезапная смерть молодых спортсменов: данные посмертной коронарографии // Архив патологии. 1994. Т. 26. № 2. С. 42–44.
- Гуревич Т.С. Синдром пролапса митрального клапана у спортсменов: Автореф. дис. . канд. мед. наук. СПб. 1992. 28 с.
- Мартынов А.И., Степура О.Б., Остроумова О.Д. и др. Пролапс митрального клапана. Ч. 1. Фенотипические особенности и клинические проявления // Кардиология. 1998. Т. 38. № 1. С. 72–80.
Для цитирования: Лысенко Л.М., Кузнецова О.А., Шилина Л.В. Патологические изменения сердечно-сосудистой системы у спортсменов на фоне синдрома физического перенапряжения. РМЖ. Медицинское обозрение. 2015;23(4):239.
Рост спортивных результатов, особенно в последнее десятилетие, повлек за собой увеличение объема нагрузок. Интенсификация спортивных тренировок стала рассматриваться как единственный залог достижения успехов. Как показано различными исследователями, плата за адаптацию к нагрузкам современного спорта достаточно высока.
Основным звеном, лимитирующим физическую работоспособность спортсмена, является система (ССС), которая наиболее интегрально отражает функциональные возможности организма. Адекватные физические нагрузки повышают экономичность функционирования ССС, чрезмерные нагрузки, равно как и недостаточная двигательная активность, особенно в сочетании с психоэмоциональным напряжением, ведут к развитию физического перенапряжения ССС. У спортсменов с интенсивными нагрузками, помимо стрессорных и физических воздействий, в патогенезе физического перенапряжения ССС в условиях Амурской области, возможно, дополнительную роль играет частая смена часовых поясов, в результате чего наступает десинхроноз суточных ритмов вегетативных функций организма (разница во времени при перелетах Благовещенск — Москва составляет 8 ч). Срыв адаптации ССС выражается в явлении миокардиодистрофии на почве физического перенапряжения, частота которой, по данным разных авторов, составляет у спортсменов от 7 до 17% [1–4].
В статье приведены результаты мониторирования функционального состояния ССС у 56 высококвалифицированных спортсменов в годичном тренировочном цикле подготовки в условиях Амурской области. По данным ЭКГ выявлен высокий процент нарушений ритма, проводимости и процессов реполяризации. В большинстве случаев благодаря коррекции нагрузок и восстановительному лечению выявленные нарушения носили преходящий характер. В 21% наблюдений нарушения процессов реполяризации имели стойкий характер и, вероятно, были проявлением ДМФП. Следовательно, необходимо продолжение исследований функционального состояния ССС спортсменов в условиях Амурской области с учетом феногенотипических и климатических особенностей адаптации.
Материалы и методы
Результаты исследования и обсуждение
Эхокардиография проведена у 56 наблюдаемых спортсменов. Аномалии развития (пролапс митрального клапана, ложные хорды, трабекулы, аномальное расположение хорд) выявлены у 26 (46%) человек, признаки дилатации полостей сердца — у 12%, признаки гипертрофии миокарда левого желудочка — у 12% наблюдавшихся. По данным эпидемиологических исследований, распространенность малых аномалий сердца у детей до 15 лет в Амурской области составляет 32,8%, однако в данной категории они составляли 46%.
Клинический случай
Спортсмен Г., 25 лет, кандидат в мастера спорта, вид спорта — самбо, рост 185 см, вес 76 кг. Перелетов Благовещенск — Москва — Благовещенск — 3. По результатам проведенного углубленного медицинского осмотра нуждался в дообследовании выраженной брадикардии, синдрома слабости синусового узла (СССУ). Сопутствующий диагноз: хронический гипертрофический ринит. Хронический тонзиллит, компенсированная форма. Острый катаральный отит слева. На момент осмотра жалоб не предъявлял.

УЗИ брюшной полости — признаки хронического холецистита. Рентгенография грудной клетки — без патологии. Общий анализ крови, мочи — в норме, биохимические анализы — в норме.
Эхокардиография: митральный клапан — ПСМК плотная, пролабирует 5 мм, Vmax — 1,0 , митральная регургитация (+). Трикуспидальный клапан — створки тонкие, движение в противофазу, Vmax — 0,7 , градиент давления — 2,5 Hg. Трикуспидальная регургитация (+). КДР — 45 мм, КДО — 92 мл, УО — 60 мл, КСР — 29 мм, КСО — 32 мл, ФВ — 65%. Аортальный клапан — фиброзное кольцо, створки тонкие, три, симметричные, Vmax- 1,2 , max градиент — 6 Hg, МПП интактна, ТМЖП — 12–13 мм, кинез правильный, большое количество эхоплотных включений в миокарде. ТЗСЛЖ — 12 мм.
Заключение: камеры сердца не расширены, ПМСК плотная, пролапс МК I степени, митральная регургитация (+), трикуспидальная регургитация (+). Неоднородность структур миокарда межжелудочковой перегородки. Умеренная гипертрофия миокарда ЛЖ. Диастолическая функция ЛЖ не нарушена. Сократительная способность ЛЖ сохранена. ФВ 65%.
Консультирован в кардиоцентре, где выставлен диагноз: миокардиодистрофия смешанного генеза (спортивная II ст. и ), МАРС — дополнительная хорда левого желудочка, вегетативная дисфункция синусового узла, наджелудочковая экстрасистолия. Транзиторная степени Мобитц 1–2 с паузами до 2,3 . НК 0. Хронический гипертрофический ринит. Хронический тонзиллит, компенсированная форма. Острый катаральный отит слева.
Получал следующее лечение: ангио- и церебропротекторы, антиоксиданты.
На фоне проводимого лечения гемодинамика была стабильной, АД 120/70 мм. рт. ст., ЧСС 52–58 уд./мин. Однако, согласно данным холтеровского мониторирования, у больного имеет место вегетативная дисфункция синусового узла (105 эпизодов степени с паузами до 2,3 ). Эпизоды синусовой брадикардии до 43 уд./мин, вероятно, описанные изменения у пациента связаны с перетренированностью и развившейся миокардиодистрофией смешанного генеза (спортивной и инфекционной на фоне заболевания ). Выписывается под наблюдение кардиолога по месту жительства.
Таким образом, регулярные наблюдения за показателями электрокардиографии способствуют своевременному выявлению миокардиодистрофии. Изменения в сердце у данного спортсмена, безусловно, связаны с физическими перегрузками и сопутствующими заболеваниями . Физическое перенапряжение может служить причиной целого ряда метаболических нарушений в организме: нейроэндокринной регуляции ССС, изменения соотношения катаболических и анаболических гормонов (снижение уровня тестостерона), не исключен, однако, и инфекционный генез заболевания. Появлению метаболических изменений, вероятно, способствовала имеющаяся врожденная аномалия сердца [5, 7, 8]. Однако при одном и том же уровне и типе тренировок у других спортсменов изменения не выявлены. В связи с этим нельзя исключить вклад генетического компонента в характер и степень этих изменений.
Выводы
Исследование функционального состояния ССС у спортсменов 1–2 разряда, кандидатов в мастера спорта и мастеров спорта в условиях Амурской области выявило по данным ЭКГ высокий процент нарушений функционального состояния сердца на этапах высокоинтенсивных тренировочных нагрузок.
аспекты мониторинга состояния ССС спортсменов Амурской области нуждаются в дальнейшем изучении с учетом феногенотипических и климатических особенностей адаптации.
- Агаджанян М.Г. Электрокардиографические проявления хронического физического перенапряжения у спортсменов // Физиология человека. 2005. Т. 31. № 6. С. 60–64.
- Гаврилова Е.А. Стрессорная кардиомиопатия у спортсменов: Автореф. дис. . докт. мед. наук. СПб. 2001. 48 с.
- Иорданская Ф.А., Юдинцева М.С. Диагностика и дифференцированная коррекция симптомов дезадаптации к нагрузкам современного спорта и комплексная система мер их профилактики // Теория и практика физической культуры. 1999. № 1. С. 24–27.
- Меерсон Ф.З. Первичное стрессорное повреждение миокарда и аритмическая болезнь сердца // Кардиология. 1993. № 4, 5. С. 50–64.
- Дембо А.Г., Земцовский Э.В. Спортивная кардиология: Руководство для врачей. Л.: Медицина, 1989. С. 464.
- Валанчюте А.Л., Лясаускайте В.В. Внезапная смерть молодых спортсменов: данные посмертной коронарографии // Архив патологии. 1994. Т. 26. № 2. С. 42–44.
- Гуревич Т.С. Синдром пролапса митрального клапана у спортсменов: Автореф. дис. . канд. мед. наук. СПб. 1992. 28 с.
- Мартынов А.И., Степура О.Б., Остроумова О.Д. и др. Пролапс митрального клапана. Ч. 1. Фенотипические особенности и клинические проявления // Кардиология. 1998. Т. 38. № 1. С. 72–80.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Инфаркт миокарда: причины появления, симптомы, диагностика и способы лечения.
Определение
Инфаркт миокарда (ИМ) – это омертвление участка сердечной мышцы вследствие недостаточного ее кровоснабжения с развитием характерной клинической картины.
Причины появления инфаркта миокарда
Сердце – полый мышечный орган, имеющий форму конуса. Стенки сердца состоят из трех слоев. Внутренний слой – эндокард – выстилает полости сердца изнутри, и его выросты образуют клапаны сердца. Средний слой – миокард – состоит из сердечной мышечной ткани. Наружный слой – перикард. Сердце человека имеет четыре камеры: два предсердия и два желудочка. В правое предсердие поступает кровь из тканей самого сердца и всех частей тела (по верхней и нижней полым венам). В левое предсердие впадают четыре легочные вены, несущие артериальную кровь из легких. Из правого желудочка выходит легочный ствол, по которому венозная кровь поступает в легкие. Из левого желудочка выходит аорта, несущая артериальную кровь в сосуды большого круга кровообращения. Кислород к миокарду сердца доставляется по коронарным артериям.
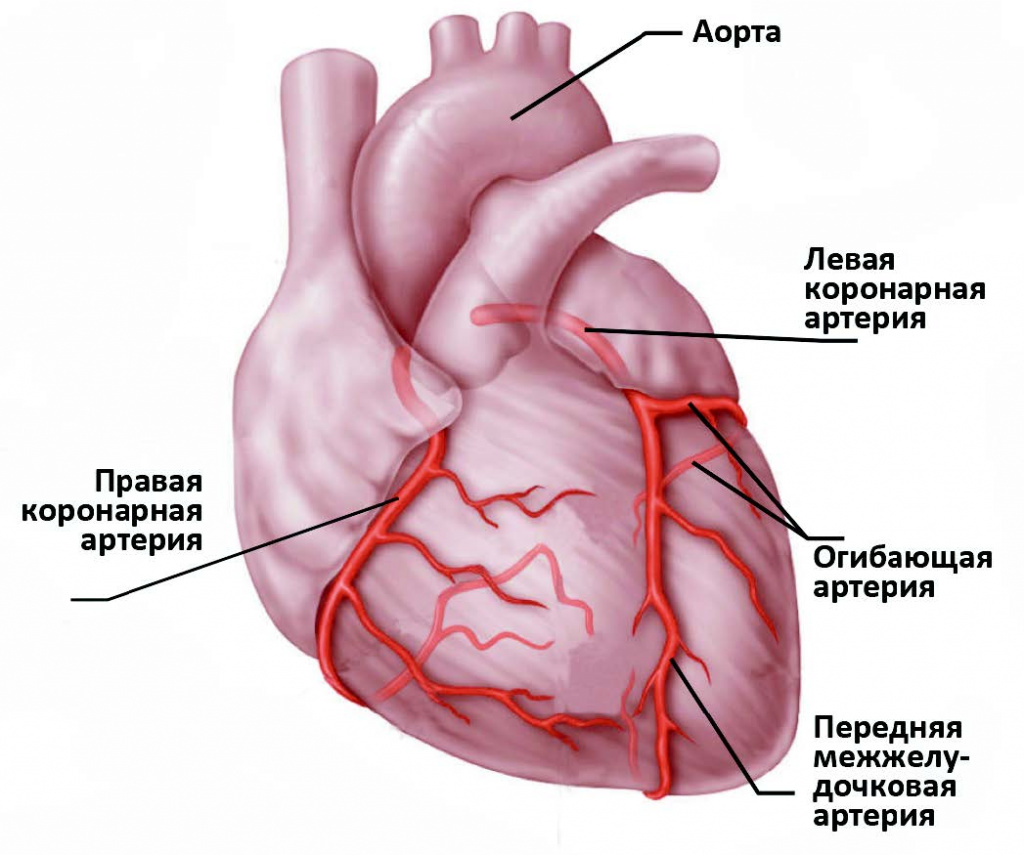
Сердце очень чувствительно к недостатку кровоснабжения (дефициту кислорода). В случае закупорки крупной коронарной артерии и при отсутствии эффективного альтернативного кровообращения по другим сосудам уже через 30 минут в пораженном участке начинается гибель кардиомиоцитов (мышечных клеток сердца).
Нарушение кровообращения вследствие атеросклеротического поражения коронарных артерий в 97-98% случаев имеет основное значение в возникновении инфаркта миокарда.
Атеросклерозом может поражаться как одна коронарная артерия, так и все три. Степень и протяженность сужения артерии могут быть различными. При повышении артериального давления склерозированный внутренний слой сосуда (эндотелий) легко повреждается, кровь проникает внутрь бляшки, активируется процесс свертывания крови и формируется тромб, который может частично или полностью закупорить сосуд.
Где может формироваться тромб:
- на месте разрыва уязвимой (нестабильной) атеросклеротической бляшки;
- на дефекте (эрозии) эндотелия коронарной артерии, не обязательно локализованном на поверхности атеросклеротической бляшки;
- в месте гемодинамически незначимого сужения коронарной артерии.
Развивающийся некроз миокарда может быть различных размеров, а некроз, проходящий через все слои сердца (трансмуральный) может стать причиной разрыва миокарда.
Образование очагов некроза в миокарде сопровождается изменением размера, формы и толщины стенки сердца, а сохранившийся миокард испытывает повышенную нагрузку и подвергается гипертрофии с увеличением объема и массы.
Такие сопутствующие состояния как: анемия, воспаление, инфекция, лихорадка, метаболические или эндокринные расстройства (в частности, гипертиреоз) могут спровоцировать или утяжелить ишемию миокарда.
К факторам риска развития инфаркта миокарда относятся:
- гиперлипидемия (нарушение нормального соотношения липидов крови);
- курение,
- сахарный диабет,
- артериальная гипертензия,
- абдоминальное ожирение,
- психосоциальные причины (стресс, депрессия и т.д.),
- низкая физическая активность,
- несбалансированное питание и потребление алкоголя.
Классификация инфаркта миокарда
I. Острый инфаркт миокарда.
- Острый трансмуральный инфаркт передней стенки миокарда.
- Острый трансмуральный инфаркт нижней стенки миокарда.
- Острый трансмуральный инфаркт миокарда других уточненных локализаций.
- Острый трансмуральный инфаркт миокарда неуточненной локализации.
- Острый инфаркт миокарда неуточненный.
- Повторный инфаркт передней стенки миокарда.
- Повторный инфаркт нижней стенки миокарда.
- Повторный инфаркт миокарда другой уточненной локализации.
- Повторный инфаркт миокарда неуточненной локализации.
- Гемоперикард.
- Дефект межпредсердной перегородки.
- Дефект межжелудочковой перегородки.
- Разрыв сердечной стенки без гемоперикарда.
- Разрыв сухожильной хорды.
- Разрыв сосочковой мышцы.
- Тромбоз предсердия, ушка предсердия и желудочка сердца.
- Другие текущие осложнения острого инфаркта миокарда.
- Коронарный тромбоз, не приводящий к инфаркту миокарда.
- Синдром Дресслера - постинфарктный склероз.
- Другие формы острой ишемической болезни сердца.
- Острая ишемическая болезнь сердца неуточненная.
Симптомы инфаркта миокарда
При инфаркте миокарда в результате нарушения кровообращения в пораженном участке сердца накапливаются продукты обмена, которые раздражают рецепторы миокарда и коронарных сосудов, что проявляется острой болью. Болевой приступ приводит к выбросу адреналина и норадреналина корой надпочечников.
Боль при типичном течении инфаркта миокарда является основным его признаком. Она возникает за грудиной, иногда может отдавать в левую руку, левое плечо, горло, нижнюю челюсть, в подложечную область.
По интенсивности и длительности такая боль в значительной степени превосходит обычный приступ стенокардии. Боль не снимается приемом нитроглицерина. Длительность болевого синдрома может быть различной - от 1 часа до нескольких суток. Иногда инфаркт миокарда сопровождается резкой слабостью, головокружением, головной болью, рвотой, потерей сознания. Больной выглядит бледным, губы синеют, наблюдается потливость.
В первые сутки развития инфаркта миокарда может регистрироваться тахикардия (учащенное сердцебиение), нарушение ритма, повышение температуры до 37-38℃.
Выделяют следующие клинические варианты:
- астматический - протекает как приступ бронхиальной астмы (присутствуют одышка, затрудненное дыхание, чувство нехватки воздуха);
- гастралгический – характеризуется болями в области желудка с распространением в загрудинное пространство, может быть отрыжка, икота, тошнота, многократная рвота, вздутие живота;
- аритмический – возникают нарушения ритма сердца, угрожающие жизни;
- церебральная – характеризуется нарушением мозгового кровообращения (наблюдаются тошнота, головокружение, нарушение сознания с развитием обморока);
- бессимптомный – инфаркт миокарда без типичного болевого приступа. В связи с несоблюдением постельного режима и отсутствием должного лечения протекает неблагоприятно.
Существуют четкие критерии диагностики инфаркта миокарда:
- клиническая картина инфаркта миокарда;
- картина инфаркта миокарда по данным ЭКГ;
- наличие новых участков миокарда со сниженным кровообращением или нарушение сократимости миокарда по данным инструментальных исследований;
- выявление тромбоза коронарных артерий по данным ангиографии.
-
определение уровня биохимических маркеров повреждения кардиомиоцитов в крови;
Высокочувствительное исследование тропонина-I применяется в современных алгоритмах диагностики острого инфаркта миокарда, а также повреждений миокарда в широком спектре иных клинических обстоятельств, таких как мониторинг состояния пациентов в критических состояниях, оценки периоперационного риска, прогноз кардиорисков у пациентов с сердечно-сосудистыми заболеваниями, контроль химиотерапии. Тест-системы вч TnI ARCHITECT (Abbott) одобрены также для оценки кардиорисков у условно-здоровых лиц при профилактическим скрининге
При выполнении физической работы в мышцах происходит глубокие изменения, обусловленные прежде всего интенсивностью процессов ресинтеза АТФ.
Использование креатинфосфата в качестве источника энергии приводит к снижению его концентрации в мышечных клетках и накоплению в них креатина.
Продолжительная мышечная работа небольшой мощности вызывает плавное снижение концентрации гликогена в мышцах. В данном случае распад происходит аэробно, с потреблением кислорода. Конечные продукты такого распада – углекислый газ и вода – удаляются из мышечных клеток в кровь. Поэтому после выполнения работы умеренной мощности в мышцах обнаруживается уменьшение содержания гликогена без накопления лактата.
Еще одно важное изменение, возникающее в работающих мышцах – повышение скорости распада белков. Особенно ускоряется распад белков при выполнении силовых упражнений, причем, это затрагивает в первую очередь сократительные белки миофибрилл. Вследствие распада белков в мышечных клетках повышается содержание свободных аминокислот и продуктов их распада – кетокислот и аммиака.
Другими характерным изменением, вызываемым мышечной деятельностью, является снижение активности ферментов мышечных клеток. Одной из причин уменьшения ферментативной активности может быть повышенная кислотность, вызванная появлением в мышцах молочной кислоты.
И наконец, мышечная деятельность может привести к повреждениям внутриклеточных структур – миофибрилл, митохондрий и других биомембран. Так нарушение мембран саркоплазматической цепи ведет к нарушению проведения нервного импульса к цистернам , содержащим ионы кальция. . Нарушения целостности сарколеммы сопровождается потерей мышцами многих важных веществ, которые уходят из поврежденной клетки в лимфу и кровь. Нарушается и работа ферментов, встроенных в мембраны. Нарушается работа кальциевого насоса и ферментов тканевого дыхания, расположенных на внутренней поверхности мембран митохондрий.
Биохимические сдвиги в головном мозге и миокарде.
Головной мозг. Во время мышечной деятельности в двигательных нейронах коры головного мозга происходит формирование и последующая передача двигательного нервного импульса. Оба эти процесса (формирование и передача нервного импульса) осуществляются с потреблением энергии в виде молекул АТФ. Образование АТФ в нервных клетках происходит аэробно. Поэтому при мышечной работе увеличивается потребление мозгом кислорода из протекающей крови. Другой особенностью энергетического обмена в нейронах является то, что основным субстратом окисления является глюкоза, поступающая с током крови.
В связи с такой спецификой энергоснабжения нервных клеток любое нарушение снабжения мозга кислородом или глюкозой неминуемо ведет к снижению его функциональной активности, что у спортсменов может проявиться в форме головокружения или обморочного состояния.
Миокард. Во время мышечной деятельности происходит усиление и учащение сердечных сокращений, что требует большого количества энергии по сравнении с состоянием покоя. Однако энергоснабжение сердечной мышцы осуществляется главным образом за счет аэробного ресинтеза АТФ. Лишь при ЧСС более 200 уд/мин, включается анаэробный синтез АТФ.
Во время интенсивной работы сопровождающейся увеличением концентрации лактата в крови, миокард извлекает из крови лактат и окисляет его до углекислого газа и воды.
При окислении одной молекулы молочной кислоты синтезируется до 18 молекул АТФ. Способность миокарда окислять лактат имеет большое биологическое значение. Это дает возможность организму дольше поддерживать в крови необходимую концентрацию глюкозы, что очень существенно для биоэнергетики нервных клеток, для которых глюкоза является почти единственным субстратом окисления. Окисление лактата в миокарде также способствует нормализации кислотно-щелочного баланса, так как при этом в крови снижается концентрация этой кислоты.
Читайте также:

