Белки хроматина гистоны и негистоновые белки реферат
Обновлено: 04.07.2024
Мы уже знаем, что хроматин состоит из ДНК и гистонов в равном весовом количестве и негистоновых белков (НГБ), которых в неактивных районах хромосомы всего 0,2 веса ДНК, а в активных — более чем 1,2 (в среднем НГБ мепьше, чем ДНК). Мы знаем также, что гистоны вместе с ДНК образуют нуклеосомы, и роль гистонов. очевидно, должна быть прежде всего структурная — поддерживать нуклеосомную организацию ДНК и также создавать высшие уровни ее укладки. Ho если роль гистонов так пассивна, почти механическая, то чем объяснить, что существуют варианты гистонов, которые синтезируются на разных стадиях развития морского ежа? Почему гистона H1 заметно меньше в активно работающих генах? Чем также объяснить химические модификации гистонов: перед образованием митотических хромосом в гистонах возрастает число присоединенных к ним фосфатных групп, а перед началом активной транскрипции — число ацетильных групп?
Все эти факты показывают, что гистоны играют существенную роль не только в организации хроматина, но и в происходящей на нем транскрипции. С гистонами или, точнее, с характером их связи с ДНК связана такая важная особенность ДНК, как ее повышенная чувствительность к действию нуклеаз (ферментов, разрывающих нить ДНК) именно в активных генах или в генах, готовых начать свою функцию. Похоже, что ДНК в районе таких генов менее связана с гистонами, более доступна атаке ферментов.
Негистоновые белки хроматина (НГБ) — очень разнородная группа белков, но каждый из них представлен в небольшом количестве. Выше уже рассказывалось, как новая техника использования антител против различных белков хроматина и флюоресцентных красителей позволила различить по меньшей мере две группы НГБ с различными свойствами и локализацией. Одни НГБ располагаются вдоль всей хромосомы — вероятно, это НГБ, связанные со структурой хромосом. Другие НГБ располагаются дискретно и связаны с отдельными генами. Они-то и могут быть специфически регулирующими белками, определяющими работу отдельных генов.
Итак, разнообразие НГБ, аналогия с прокариотами, у которых функции регуляции осуществляют негистоновые белки, и монотонность расположения гистонов вдоль всех ДНК позволяют думать, что именно среди НГБ и следует искать специфические регуляторы транскрипции. Поэтому в большинстве схем включения и выключения генов, которые фигурируют сегодня в литературе, специфическая роль отводится именно НГБ. Это не означает, что гистоны никак не участвуют в транскрипции, но им обычно отводится неспецифическая роль.
Гены могут находиться по меньшей мере в трех состояниях: неактивном и не подготовленном к активации, неактивном, но готовом к активации (компетентном) и, наконец, в активном, работающем состоянии. В действительности различных состояний, вероятно, больше, например гены могут транскрибироваться с большей или меньшей активностью. Участки хромосом, не готовые к активации, часто образуют плотно компактизованные (спирализованные) глыбки гетерохроматина. Возможно, что гетерохроматинизация создается гистонами, например их фосфорилированием. Ho для этого необходимо, чтобы гистоны были изменены именно в данном типе клеток и только в данном участке хромосомы: в других клетках эти гены могут оказаться как раз активными. А для такой строгой локализации необходимы белки, способные не только изменить гистоны (например, фосфорилировать их), но и отличить один участок хромосомы от других, т. е. в конечном счете отличить одну последовательность ДНК от другой. Такими способностями могут, очевидно, обладать только высокоспецифичные негистоновые белки.
Включение генов, превращение их из компетентных в активно транскрибирующиеся тоже требует определенной специфичности. Таким образом, существенную часть НГБ должны составлять именно такие высокоспецифичные регуляторные белки. Их должно быть много видов — может быть, тысячи. С другой стороны, каждый из них может присутствовать в очень небольшом количестве — может быть, несколько молекул на клетку. У нас пока нет методов, которые могли бы выявить все белки без исключения, и особенно самые малочисленные. Ho с каждым годом техника разделения и выявления белков приближается к этому пределу.
В заключение нам следует упомянуть еще об одной возможности регуляции — посредством не белков, а низкомолекулярных РНК. Исследованы они до сих пор недостаточно — мы знаем только те их виды, которых в клетке много. У РНК, если рассматривать их как кандидатов на роль высокоспецифичных регуляторов, есть важное достоинство. Даже короткая их последовательность, длиной в 20–30 нуклеотидов, может точно опознать тот ген, который имеет участок ДНК, комплементарный к этой РНК. Белок, способный на такое опознавание, должен быть во много раз больше и сложнее. Каким образом низкомолекулярные ядерные РНК осуществляют регуляторную функцию (если они ее осуществляют), совершенно неизвестно. Схемы, которые могут быть предложены, без фактов большой ценности не имеют. Поэтому гипотеза о РНК как о регуляторах генетической активности остается пока не более чем интересной идеей.
Глава 8. Белки-генераторы тока
Глава 8. Белки-генераторы тока Драчев и бактериородопсин Л. Драчев никогда специально не изучал ни биологии, ни химии. Даже в школе. В связи с военным временем и нехваткой учителей вместо этих предметов преподавали математику. Окончив физфак МГУ, он занялся ионосферой, а
Клетки, белки и гены
Клетки, белки и гены Жизнь есть способ существования белковых тел. Ф. Энгельс Наше тело является империей клеток, каждая из которых представляет собой миниатюрную фабрику для производства белков. Многие из этих важнейших макромолекул могут быть выделены из организма в
Не все гены кодируют белки
Не все гены кодируют белки Прежде всего, следует отметить, что кроме генов, кодирующих белки, в геноме имеются еще гены, на которых синтезируется РНК, которые не являются мРНК (то есть, не кодируют белок), но выполняют ряд самостоятельных важных функций в клетках. В
Не все гены кодируют белки
Не все гены кодируют белки Прежде всего, следует отметить, что кроме генов, кодирующих белки, в геноме имеются еще гены, на которых синтезируется РНК, которые не являются мРНК (то есть, не кодируют белок), но выполняют ряд самостоятельных важных функций в клетках. В
11. Белки в колесе
11. Белки в колесе Чтобы познакомиться с современными поисками решения проблемы живых часов, обратимся к исследованиям, проводившимся биологами в последние годы. В числе первых следует, пожалуй, назвать работу Патриции де Курси.В 1955 году де Курси получила диплом
Новые белки из старого конструктора
Новые белки из старого конструктора Большинство белковых молекул состоит из нескольких функциональных блоков (доменов). Например, белки, участвующие в передаче сигналов, часто содержат домены двух типов — регуляторные и каталитические. Первые реагируют на поступающие
Глава 11 Эти подвижные белки
Глава 11 Эти подвижные белки В начале предыдущей главы я упомянул, что органические компоненты пищи делятся на три группы. Я рассказал об одной из этих групп: углеводах. Далее логично было бы перейти к белкам, потому что их метаболизм в организме происходит параллельно с
Белки мембран.
Белки мембран. Мембранные белки отвечают за функциональную активность мембран и на их долю приходится от 30 до 70%. Белки мембран отличаются по своему положению в мембране. Они могут глубоко проникать в липидный бислой или даже пронизывать его – интегральные белки, разными
Белки
Белки Пищевая ценность белка обеспечивается наличием незаменимых аминокислот, углеводородные скелеты которых не могут синтезироваться в организме человека, и они соответственно должны поступать с пищей. Они также являются основными источниками азота. Суточная
Белки мышечной ткани
Белки мышечной ткани Выделяют три группы белков:1. миофибриллярные белки – 45 %;2. саркоплазматические белки – 35 %;3. белки стромы – 20 %.Миофибриллярные белки.К этой группе относятся:1. миозин;2. актин;3. актомиозин;а также так называемые регуляторные белки:4. тропомиозин;5.
Белки
Белки Белки имеют первостепенное значение в жизни организмов. Огромное разнообразие живых существ в значительной степени определяется различиями в составе имеющихся в их организме белков. Например, в организме человека их известно более 5 млн.Белки – это полимеры,
8. Органические вещества. Углеводы. Белки
8. Органические вещества. Углеводы. Белки Вспомните!Какие вещества называют биологическими полимерами?Каково значение углеводов в природе?Назовите известные вам белки. Какие функции они выполняют?Углеводы (сахара). Это обширная группа природных органических
Изменение количества и некоторых параметров полового хроматина у людей в процессе полного длительного алиментарного голодания и последующего питания С. Н. РЕЗИНА, Ю. Л. ШАПИРО (Москва)
Изменение количества и некоторых параметров полового хроматина у людей в процессе полного длительного алиментарного голодания и последующего питания С. Н. РЕЗИНА, Ю. Л. ШАПИРО (Москва) Половой хроматин — внутриядерное тельце, дающее Фельген-положительную реакцию и
Ну а белки?
Ну а белки? В шестидесятых годах я неоднократно пытался завести в доме и белок, но каждая такая попытка кончалась самым печальным образом. Через некоторое время белки слабели, задние конечности у них отнимались и несчастные животные в судорогах погибали. Поначалу я
Рассмотрим функции негистоновых белков, их значение для организма. Данная тема представляет особый интерес, заслуживает детального изучения.
Главные белки хроматина
Гистоновые и негистоновые белки непосредственно связаны с ДНК. Ее роль в составе интерфазных и митотических хромосом довольно велика - хранение и распространение генетической информации.
При осуществлении подобных функций необходимо обладать четкой структурной базой, позволяющей располагать длинные молекулы ДНК в четком порядке. Подобное действие позволяет контролировать периодичность протекания синтеза РНК, редупликации ДНК.
Ее концентрация в интерфазном ядре составляет 100 мг/мл. На одно ядро млекопитающих приходится примерно 2 м ДНК, локализуемой в сферическом ядре диаметром порядка 10 мкм.
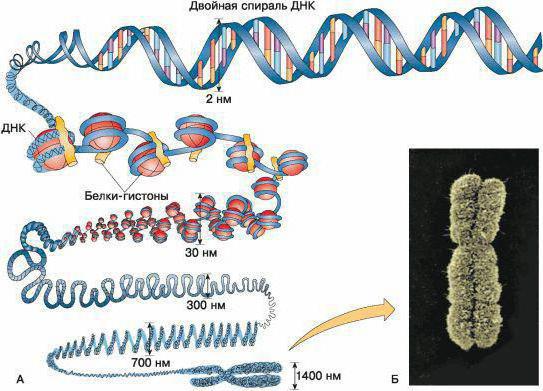
Группы белков
Несмотря на многообразие, принято выделять две группы. Функции гистоновых и негистоновых белков имеют определенные отличия. Около 80 процентов всех белков хроматина составляют гистоны. Они взаимодействуют с ДНК за счет ионных и солевых связей.
Несмотря на значительное количество, гистоны и негистоновые белки хроматина представлены несущественным разнообразием белков, в эукариотических клетках содержится порядка пяти-семи типов молекул гистона.
Негистоновые белки в хромосомах в основном специфичны. Они взаимодействуют только с определенными структурами молекул ДНК.

Особенности гистонов
Каковы функции гистоновых и негистоновых белков в хромосоме? Гистоны связываются в виде молекулярного комплекса с ДНК, они являются субъединицами такой системы.
Гистоны являются белками, характерными лишь для хроматина. Они имеют определенные качества, позволяющие им выполнять специфические функции в организмах. Это щелочные или основные белки, характеризующиеся достаточно высоким содержанием аргинина и лизина. Благодаря положительным зарядам на аминогруппах обусловливается электростатическая или солевая связь с противоположными зарядами на фосфатных структурах ДНК.
Такая связь является довольно лабильной, она легко разрушается, при этом происходит диссоциация на гистоны и ДНК. Хроматин считается сложным нуклеиново-белковым комплексом, внутри которого есть высокополимерные линейные молекулы ДНК, а также значительное количество молекул гистонов.
Свойства
Гистоны являются достаточно небольшими белками по молекулярной массе. Они имеют сходные свойства у всех эукариот и обнаруживаются сходными классами гистонов. К примеру, виды H3 и H4 причисляют к богатым аргинином, так как в их составе достаточное количество данной аминокислоты.
Разновидности гистонов
Такие гистоны считают консервативными, так как последовательность аминокислоты в них сходна даже у отдаленных видов.
H2A и H2B считают белками, в которых умеренное содержание лизина. Разные объекты внутри данных групп имеют некоторые вариации в первичной структуре, а также в последовательности расположения аминокислотных остатков.
Гистон H1 является классом белков, в которых аминокислоты располагаются в сходной последовательности.
У них обнаруживаются существеннее межтканевые и межвидовые вариации. В качестве общего свойства рассматривается значительное количество лизина, в результате чего именно эти белки можно отделять от хроматина в разбавленных солевых растворах.
Гистоны всех классов характеризуются кластерным распределением основных аминокислот: аргинина и лизина на концах молекул.
H1 отличается вариабельным N-концом, осуществляющим взаимосвязь с иными гистонами, а С-конец обогащен лизином, именно он вступает во взаимодействие с ДНК.
При жизнедеятельности клеток возможны модификации гистонов:
Подобные процессы приводят к изменению количества положительных зарядов, они являются обратимыми реакциями. При фосфорилировании сериновых остатков появляется избыточный отрицательный заряд. Такие модификации влияют на свойства гистонов, их взаимодействие с ДНК. Например, при ацетилировании гистонов наблюдается активация генов, а дефосфорилирование вызывает деконденсацию и конденсацию хроматина.
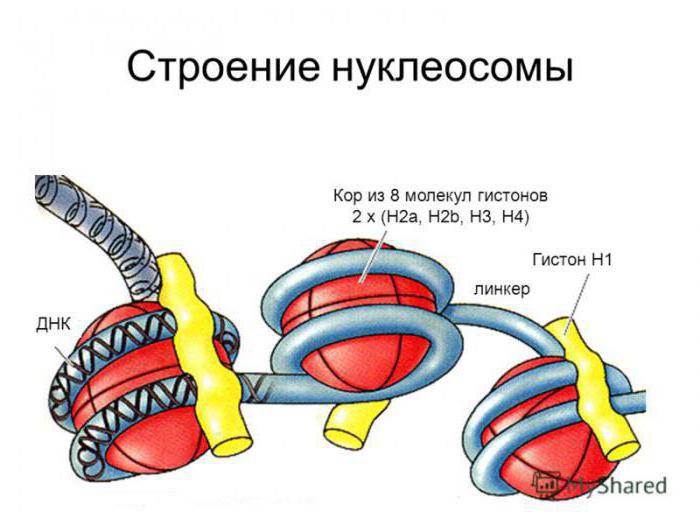
Особенности синтеза
Процесс происходит в цитоплазме, далее происходит транспортировка в ядро, связывание с ДНК при ее репликации в S-периоде. После прекращения синтеза клеткой ДНК в течение нескольких минут происходит распад информационных гистоновых РНК, процесс синтеза прекращается.
Подразделение на группы
Выделяют разные виды негистоновых белков. Деление их на пять групп является условным, оно основывается на внутреннем сходстве. Существенное количество отличительных свойств выявлено у высших и низших эукариотических организмов.
К примеру, вместо H1, характерного для тканей низших позвоночных организмов, обнаруживают гистон H5, который содержит большее количество серина и аргинина.
Встречаются и ситуации, связанные с частичным либо полным отсутствием у эукариот гистонных групп.
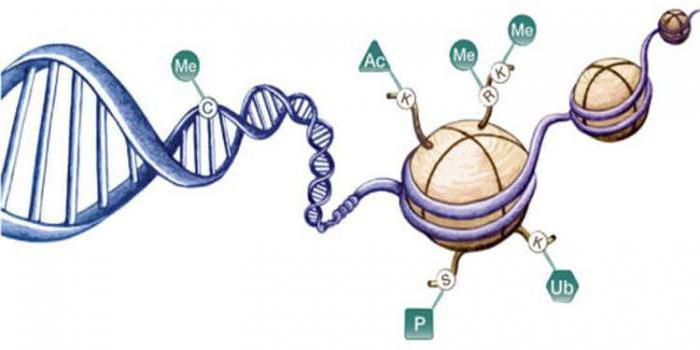
Функциональные возможности
Подобные белки были найдены в составе бактерий, вирусов, митохондрий. Например, у E. coli в клетке найдены белки, аминокислотный состав которых аналогичен гистонам.
Негистоновые белки хроматина выполняют важные функции в живых организмах. До выявления нуклеосом использовали две гипотезы, касающиеся функционального значения, регуляторной, структурной роли таких белков.
Удалось обнаружить, что при добавлении к выделенному хроматину РНК-полимеразы получается матрица для процесса транскрипции. Но активность его оценивается только в 10 процентов от аналогичного показателя для чистой ДНК. Она возрастает при удалении групп гистонов, а при их отсутствии составляет максимальную величину.
Это свидетельствует о том, что суммарное содержание гистонов позволяет контролировать процесс транскрипции. Качественное и количественно изменение гистонов оказывает влияние на активность хроматина, степень его компактности.
Не до конца изучен вопрос, касающийся специфичности регуляторных характеристик гистонов во время синтеза специфичных и-РНК в разных клетках.
При постепенном добавлении фракции гистонов к растворам, содержащим чистую ДНК, наблюдается выпадение осадка в виде комплекса ДНП. При выведении из раствора хроматина гистонов происходит полный переход в растворимое основание.
Функции негистоновых белков не ограничиваются построением молекул, они намного сложнее и многограннее.
Структурное значение нуклеосом
В первых электромикроскопических и биохимических работах было доказано, что в препаратах ДПН есть нитчатые структуры, диаметр которых находится в интервале 5-50 нм. По мере совершенствования представлений о строении белковых молекул удалось выяснить, что существует прямая зависимость между диаметром фибрилла хроматина и способом выделения препарата.
На тонких срезах митотических хромосом и интерфазных ядер после выявления глутаровым альдегидом были обнаружены хроматированные фибриллы, толщина которых составляет 30 нм.
Аналогичными размерами обладают фибриллы хроматина в случае физической фиксации их ядер: при замораживании, скалывании, взятии реплик с подобных препаратов.
Негистоновые белки хроматина были открыты двумя различными способами нуклеосом-частиц хроматина.
Исследования
При осаждении препаратов хроматина на подложку для электронной микроскопии в щелочных условиях при несущественной ионной силе получаются нити хроматина, похожие на бусы. Их размер не превышает 10 нм, а глобулы связаны между собой отрезками ДНК, длина которых не превышает 20 нм. В ходе наблюдений удалось установить связь между структурой ДНК и продуктами распада.
Интересные сведения
Негистоновые белки составляют порядка двадцати процентов белков хроматина. Они являются белками (кроме тех, что выделяются хромосомами). Негистоновые белки - это комбинированная группа белков, которые между собой отличаются не только по свойствам, но и по функциональной важности.
Большая часть их относится к белкам ядерного матрикса, которые обнаруживаются и в составе интерфазных ядер, и в митотических хромосомах.
Негистоновые белки могут включать порядка 450 индивидуальных полимеров, имеющих различную молекулярную массу. Некоторые из них растворимы в воде, есть и такие, которые растворимы в кислых растворах. Из-за непрочности связи с хроматином протекающей диссоциации при наличии денатурирующих агентов возникают существенные проблемы с классификацией и описанием данных белковых молекул.
Негистоновые белки - это регуляторные полимеры, стимулирующие транскрипцию. Есть и ингибиторы данного процесса, которые связываются в специфической последовательности на ДНК.
К негистоновым белкам могут относиться и ферменты, принимающие участие в метаболизме нуклеиновых кислот: метилазы РНК и ДНК, ДНКазы, полимеразы, белки хроматина.
Среда множества подобных полимерных соединений максимально изученными считают негистоновые белки, обладающие высокой подвижностью. Для них свойственна неплохая электрофоретическая подвижность, экстрагирование в растворе поваренной соли.
HMG-белки представлены в четырех видах:
- HMG-2 (м.в. = 26 000),
- HMG-1 (м.в. = 25 500),
- HMG-17 (м.в. = 9247),
- HMG-14 (м.в. = 100 000).
В живой клетке таких структур содержится не больше 5 % от суммарного количества гистонов. Они особенно распространены в активном хроматине.
Белки HMG-2 и HMG-1 не включены в состав нуклеосом, они связываются только с линкерными фрагментами ДНК.
Белки HMG-14 и HMG-17 способны связываться с сердцеподобными полимерами нуклеосом, в результате чего происходит изменение уровня сборки фибрилл ДНП, они будут более доступны для реакции с РНК-полимеразой. В подобной ситуации HMG-белки выполняют роль регуляторов транскрипционной активности. Удалось выявить, что фракция хроматина, которая обладает повышенной чувствительностью к ДНКазе I, насыщена HMG-белками.
Заключение
Третьим уровнем структурной организации хроматина являются петлевые домены ДНК. В ходе исследований было установлено: только при расшифровке принципа хромосомных элементарных компонентов сложно получить полное представление о хромосомах в митозе, в интерфазе.
Уплотнение ДНК в 40 раз получают благодаря максимальной спирализации. Этого недостаточно для того, чтобы получить реальное представление о размерах и характеристиках хромосом. Можно сделать закономерный вывод о том, что должны быть еще более высокие уровни сборки ДНК, с помощью которых можно было бы однозначно дать общую характеристику хромосомам.
Ученым удалось обнаружить подобные уровни организации хроматина в результате его искусственной деконденсации. В подобной ситуации специфические белки будут связываться с некоторыми участками ДНК, имеющими в местах объединения домены.
Принцип петлевой упаковки ДНК был обнаружен и у эукариотических клеток.
Например, если провести обработку выделенных ядер раствором поваренной соли, будет сохранена целостность ядра. Подобная структура стала называться нуклеотидом. Его периферия включает в себя значительное количество замкнутых петель ДНК, средний размер которых составляет 60 т.п.н.
При препаративном выделении хромомеров, последующем экстрагировании гистонов из них под электронным микроскопом будут видны петлистые розеткообразные структуры. Число петель в одной розетке составляет от 15 до 80, суммарная длина ДНК доходит дл 50 мкм.
Представления о строении и основных функциональных характеристиках белковых молекул, полученные в ходе экспериментальной деятельности, позволяют ученым вести разработку лекарственных препаратов, создавать инновационные методики эффективной борьбы с генетическими заболеваниями.
Вторичная структура — полипептидная цепь в виде спирали. Между пептидными связями соседних витков и другими атомами возникают многочисленные водородные связи, обеспечивающие прочную структуру; Четвертичная структура возникает при соединении нескольких макромолекул, образующих агрегаты. Так, гемоглобин крови человека представляет агрегат из четырех макромолекул. Нарушение природной структуры белка… Читать ещё >
Белки, их химический состав, уровни структурной организации. Биологическая роль белков. Понятие о гистоновых и негистоновых белках. Прионовые белки и их медицинское значение ( реферат , курсовая , диплом , контрольная )
Белки — непериодические полимеры, мономерами которых являются аминокислоты. Все белки представляют собой полимеры, состоящие из длинных цепей субъединиц, соединенных вместе в линейную структуру. Субъединицы — это 20 разных аминокислот. Общим признаком для всех аминокислот является наличие в их составе карбоксильной и аминогрупп, соединенных атомом углерода. Кроме этих общих атомов, каждая аминокислота содержит свои особые боковые цепи, присоединенные к центральному атому углерода. Таким образом, хотя все аминокислоты принадлежат к одному классу соединений и имеют некоторые общие химические свойства, отдельные аминокислоты резко отличаются друг от друга.

Уровни структурной организации.
В строении молекул белков различают 4 уровня организации:
- · Первичная структура — полипептидная цепь из аминокислот, связанных в определенной последовательности ковалентными пептидными связями;
- · Вторичная структура — полипептидная цепь в виде спирали. Между пептидными связями соседних витков и другими атомами возникают многочисленные водородные связи, обеспечивающие прочную структуру;
- · Третичная структура — специфическая для каждого белка конфигурация — глобула. Удерживается малопрочными гидрофобными связями или силами сцепления между неполярными радикалами, которые встречаются у многих аминокислот.
- · Четвертичная структура возникает при соединении нескольких макромолекул, образующих агрегаты. Так, гемоглобин крови человека представляет агрегат из четырех макромолекул.
Нарушение природной структуры белка называют денатурацией. Она возникает под воздействием высокой температуры, химических веществ, лучистой энергии и др. факторов.
Биологическая роль белков.
- · Строительная (структурная) функция: белки — строительный материал организма (оболочки, мембраны, органоиды, ткани, органы);
- · Каталитическая функция — ферменты, ускоряющие реакции в сотни миллионов раз;
- · Опорно-двигательная функция — белки, входящие в состав костей скелета, сухожилий; движение жгутиковых, инфузорий, сокращение мышц;
- · Транспортная функция — гемоглобин крови;
- · Защитная — антитела крови обезвреживают чужеродные вещества;
- · Энергетическая функция — при расщеплении белков 1 г освобождает 17,6 кДж энергии;
- · Регуляторная и гормональная — белки входят в состав многих гормонов и принимают участие в регуляции жизненных процессов организма;
- · Рецепторная — белки осуществляют процесс избирательного узнавания отдельных веществ и их присоединение к молекулам.
Понятие о гистоновых и негистоновых белках.
Гистоны — обширный класс ядерных белков, выполняющих две основные функции: они участвуют в упаковке нитей ДНК в ядре и во вторичной регуляции таких ядерных процессов, как транскрипция, репликация и репарация, проявляют сильно оснувные свойства [14, "https://referat.bookap.info"].
Негистоновые белки — это все белки хроматина, кроме гистонов, выделяющиеся с хроматином или хромосомами. Это сборная группа белков, отличающихся друг от друга как по общим свойствам, так и по функциональной значимости. Около 80% из негистоновых белков относится к белкам ядерного матрикса, обнаруживаемых как в составе интерфазных ядер, так и митотических хромосом. Гистоновые и негистоновые белки принимают участие в экспрессии генов, участвуют в создании структуры молекулы ДНК. Гистоновые белки — факторы репрессии (блокирования) генов, негистоновые — наоборот способствуют считыванию информации. Взаимодействие гистоновых и негистоновых белков — механизм блокирования и разблокирования молекулы ДНК.
Прионовые белки и их медицинское значение.
Хромосомная ДНК упакована в компактную структуру с помощью специализированных белков. Все ДНК-связывающие белки эукариот подразделяются на два класса: на гистоны (histones, структурные белки эукариотических хромосом) и на негистоновые хромосомные белки . Комплекс обоих классов белков с ядерной ДНК эукариотических клеток называется хроматином . Гистоны являются уникальной характеристикой эукариот и присутствуют в огромных количествах на клетку (около 60 миллионов молекул каждого типа на клетку).Гистоны - относительно небольшие белки с очень большой долей положительно заряженных аминокислот (лизина и аргинина); положительный заряд помогает гистонам крепко связываться с ДНК (которая заряжена сильно отрицательно) независимо от ее нуклеотидной последовательности. Возможно, гистоны только изредка диссоциируют от ДНК и таким образом, вероятно, оказывают влияние на любой процесс, происходящий на хромосомах.Типы гистонов распадаются на две главных группы - нуклеосомные гистоны и Н1 гистоны, образуя семействовысококонсервативных основных белков, состоящее из пяти больших классов - H1 и H2A ,H2B , H3 и H4 . Гистоны H1 более крупные (около 220 аминокислот) и оказались менее консервативными в ходе эволюции. Размер полипептидных цепей гистонов лежит в пределах от 220 (H1) до 102 (H4) аминокислотных остатков. Гистон H1 сильно обогащен остатками Lys, для гистонов H2A и H2B характерно умеренное содержание Lys, полипептидные цепи гистонов H3 и H4 богаты Arg. Внутри каждого класса гистонов (за исключением H4) на основании аминокислотных последовательностей различают несколько субтипов этих белков. Такая множественность особенно характерна для гистонов класса H1 млекопитающих. В этом случае различают семь субтипов, названных H1.1-H1.5 , H1o и H1t.Гистоны H3 и Н4 принадлежат к наиболее консервативным белкам. Такая эволюционная консервативность предполагает, что для функции данных гистонов важны почти что все их аминокислоты. N- концевая часть данных гистонов может быть обратимо одифицирована в клетке за счет ацетилирования отдельных остатков лизина, что убирает положительный заряд лизинов.Гистоны подвергаются многообразным посттрансляционным модификациям , которые вовлечены в разнообразные биологические процессы, например, регуляцию активности генов , репарацию ДНК ,конденсацию хроматина.
30. Виды РНК, их функции и образование в связи с активностью хроматина. Центральная догма клеточной биологии: ДНК-РНК-белок. Роль компонентов в ее реализации.
Центральная догма молекулярной биологии — обобщающее наблюдаемое в природе правило реализации генетической информации: информация передаётся от нуклеиновых кислот к белку, но не в обратном направлении. Правило было сформулировано Френсисом Криком в 1958 году и приведено в соответствие с накопившимися к тому времени данными в 1970 году. Переход генетической информации от ДНК к РНК и от РНК к белку является универсальным для всех без исключения клеточных организмов, лежит в основе биосинтеза макромолекул. Репликации генома соответствует информационный переход ДНК → ДНК. В природе встречаются также переходы РНК → РНК и РНК → ДНК (например у некоторых вирусов), а также изменение конформации белков, передаваемое от молекулы к молекуле. Транскрипция и трансляция. Условно весь процесс транскрипции и трансляции можно отобразить в cхеме: Транскрипция представляет собой процесс воспроизведения информации, хранящейся в ДНК, в виде одноцепочной молекуле и РНК (информационной РНК, которая переносит информацию о строении белка из ядра клетки в цитоплазму клетки к рибосомам). Этот процесс проявляется в синтезе молекулы и РНК по матрице ДНК. Молекула и РНК состоит и нуклеотидов, каждый из которых включает в себя остаток фосфорной кислоты сахар рибозу и одно из четырёх азотистых оснований (А, Г, Ц и У-урацил вместо Т-тюлина). В основе синтеза и РНК лежит принцип комплиментарности, т.е. против А в одной цепочке ДНК располагается У в и РНК, а против Г в ДНК - Ц в и РНК (см. рис. Транскрипция- на предыдущей странице), таким образом, и РНК является комплиментарной копией ДНК или её определённого участка, и содержит информацию, кодирующую аминокислоту или белок. Каждая аминокислота в ДНК и РНК шифруется последовательностью из 3-х нуклеотидов, т.е. - триплетом, который получил название кодонЕсли в транскрипции узнавание двух молекул друг другом проявляется только в принципе комплиментарности, то в трансляции помимо комплиментарности (временное объединение кодона и РНК и антикодона РНК (транспортной РНК, которая подносит аминокислоты нужные для синтеза белка, к месту синтеза - рибосома - см. рис. Транскрипция) молекулярное узнавание проявляется в процессе присоединения аминокислоты к тРНК с помощью фермента кодазы. Дело в том, что молекула тРНК состоит из головки, включающей в себя антиэАОК-триплет, состоящий из последовательности трёх нуклеотидов, и хвостика имеющего определённую форму. Сколько существует видов антикозонов тРНК, столько и существует форм хвостиков, и каждому антикозону соответствует своя форма хвостика в тРНК. Сколько существует форм хвостиков, столько существует видов форм фермента кодазы, который присоединяет аминокислоты к хвостику, а форма каждой кодазы подходит только к форме определённой аминокислоты. Т.о., тРНК носит с собой информацию не только в п последовательности нуклеотидов в антикозоне но и в форме хвостика молекулы. А основная передача информации здесь заключается в воспроизведении последовательности аминокислот в белке, которую подсказывает ферменту, кодирующему белок и РНК.
31. Уровни упаковки ДНК в составе хроматина.
32. Митотические хромосомы. Морфологическая организация и функции. Кариотип ( на примере человека).
Митотические хромосомы образуются в клетке во время митоза. Это неработающие хромосомы, и молекулы ДНК в них уложены чрезвычайно плотно. Достаточно сказать, что общая длина метафазных хромосом примерно в 104 раз меньше, чем длина всей ДНК, содержащейся в ядре. Благодаря такой компактности митотических хромосом обеспечивается равномерное распределение генетического материала между дочерними клетками при митозе.
Кариоти́п — совокупность признаков (число, размеры, форма и т.д.) полного набора хромосом, присущий клеткам данного биологического вида (видовой кариотип), данного организма (индивидуальный кариотип) или линии (клона) клеток. Кариотипом иногда также называют и визуальное представление полного хромосомного набора (кариограммы).
Внешний вид хромосом существенно меняется в течение клеточного цикла: в течение интерфазы хромосомы локализованы в ядре, как правило, деспирализованы и труднодоступны для наблюдения, поэтому для определения кариотипа используются клетки в одной из стадий их деления — метафазе митоза.
Процедура определения кариотипа
Полученные клетки в стадии метафазы фиксируются, окрашиваются и фотографируются под микроскопом; из набора получившихся фотографий формируются т. н.систематизированный кариотип — нумерованный набор пар гомологичных хромосом (аутосом), изображения хромосом при этом ориентируются вертикально короткими плечами вверх, их нумерация производится в порядке убывания размеров, пара половых хромосом помещается в конец набора (см. Рис. 1).
Исторически первые недетализованные кариотипы, позволявшие проводить классификацию по морфологии хромосом получались окраской по Романовскому — Гимзе, однако дальнейшая детализация структуры хромосом в кариотипах стала возможой с появлением методик дифференциального окрашивания хромосом.
Классический и спектральный кариотипы.

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Читайте также:

