Ассимиляция пищевого жира липопротеины плазмы крови реферат
Обновлено: 01.07.2024
Какова связь маркеров системного воспаления и ИБС? Какие выделяют фракции липопротеинов? Диагностика, лечение и профилактика атеросклероза остаются важнейшей задачей современной медицины, от решения которой во многом зависит успех борьбы с такими забо
Какова связь маркеров системного воспаления и ИБС?
Какие выделяют фракции липопротеинов?
Диагностика, лечение и профилактика атеросклероза остаются важнейшей задачей современной медицины, от решения которой во многом зависит успех борьбы с такими заболеваниями, как инфаркт, инсульт и другие сердечно-сосудистые осложнения. Доказанная в ходе Фрамингамского исследования, проведенного в начале 60-х годов, взаимосвязь между нарушениями липидного обмена и развитием атеросклероза, в частности коронарной (ишемической) болезни сердца, была подтверждена во многих последующих работах.
В настоящее время выявлен целый ряд факторов риска развития атеросклероза и ишемической болезни сердца (ИБС), к которым относятся:
- нарушения липидного обмена;
- артериальная гипертензия;
- курение;
- избыточная масса тела;
- наследственность;
- нарушение толерантности к углеводам;
- мужской пол;
- повышение уровня маркеров, указывающих на наличие воспалительных изменений.
У одного пациента чаще всего выявляются два или более фактора риска. При этом, даже если каждый в отдельности показатель увеличен незначительно, но налицо два-три или более факторов риска, то вероятность развития сердечно-сосудистых заболеваний возрастает в геометрической прогрессии [1].
В практике для оценки этого суммарного риска используются рекомендованные Европейским обществом кардиологов таблицы, в которых учитываются такие факторы, как пол пациента, курение, возраст, уровень АД, уровень холестерина. Эти показатели выражаются в процентах и указывают на вероятность развития осложнений ИБС или летального исхода за десять лет. Оценка этого суммарного риска является решающей для определения тактики профилактических и лечебных мероприятий. В качестве величины, указывающей на необходимость активных профилактических и лечебных мероприятий, принят риск в 20% за десять лет. Особенно важное значение эти факторы риска приобретают у пациентов, уже страдающих ИБС.
К сожалению, в таблицах не могут быть учтены все факторы риска. При наличии этих факторов у больных с сахарным диабетом еще более возрастает опасность развития осложнений. До сих пор нет полной определенности относительно значения таких факторов, как гиподинамия, возраст больных. В ходе исследования LA-VA Study (Los-Angeles Veteran Administration Dietary Study) проводилось лечение энтеросорбентом холестирамином в сочетании с ниацином (лекарственной формой никотиновой кислоты с медленным высвобождением) на фоне строгой гипохолестериновой диеты. На протяжении восьми лет было выявлено снижение смертности у лиц моложе 65 лет, тогда как у лиц старше 70 лет эффект отсутствовал. Многие исследователи по-разному оценивают значимость дислипидемии как одного из важнейших факторов риска сердечно-сосудистых заболеваний у пациентов старше 80 лет. Исследования эффективности гипохолестеринемической терапии в этой возрастной группе проводятся в настоящее время.
В последнее время большое значение придается наличию маркеров, указывающих на воспалительные изменения. Классические патофизиологические исследования продемонстрировали присутствие воспалительных клеток, таких как моноциты, макрофаги и Т-лимфоциты, на всех стадиях развития атеросклероза. Эти морфологические изменения предшествовали дисфункции эндотелиальных клеток, вызывая адгезию молекул при взаимодействии с воспалительными клетками.
В последние годы доказано, что появление маркеров системного воспаления, таких как СРБ (С-реактивный белок), фибриноген и др., предшествует развитию сердечно-сосудистых осложнений [6, 7]. Эти изменения могут выявляться и у больных с нестабильной стенокардией еще до развития очаговых изменений миокарда. Их наличие у больных с высоким уровнем общего холестерина (ОХС) и холестерина липопротеинов низкой плотности (ХС-ЛПНП) резко повышает риск возникновения осложнений. Исследование ЕСАТ (European Concerted Action on Thrombosis and Disabilities Angina Pectoris Study) продемонстрировало увеличение риска развития сердечно-сосудистых осложнений у больных со стабильной стенокардией и высоким уровнем СРБ по сравнению с аналогичными больными и низким уровнем СРБ [5]. По данным Berk, у 90% больных с нестабильным течением стенокардии был выявлен повышенный уровень СРБ, а при стабильной стенокардии этот показатель оказался повышен только у 13% больных [4]. Liuzzo показал, что у больных с нестабильной стенокардией и повышенным уровнем СРБ чаще наблюдались ишемические атаки, такие пациенты нуждались в хирургическом лечении и у них в большем проценте случаев развился острый инфаркт миокарда (ОИМ), чем у аналогичной группы больных с нестабильной стенокардией и пониженным уровнем СРБ [8]. В ходе проведенного в 1998 году исследования SHHS (Scottish Heart Health Study) на примере почти 10 тыс. пациентов была доказана тесная взаимосвязь повышенного уровня фибриногена плазмы крови с развитием ИБС и смертностью от сердечно-сосудистых заболеваний [10]. Возможно, именно эти изменения помогут объяснить случаи развития атеросклероза у больных с нормальными показателями ОХС и ХС-ЛПНП.
Для более адекватного анализа нарушений липидного обмена важно оценивать не только уровень ОХС в крови, но и уровень ХС-ЛПНП, холестерина липопротеинов высокой плотности (ХС-ЛПВП), их соотношение, индекс атерогенности, уровень триглицеридов (ТГ), а также уровень Апо-белков А и В, от которых зависит транспортная функция липопротеинов. По своим физическим свойствам липопротеины плазмы крови подразделяются на следующие фракции: хиломикроны, липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), ЛПНП, ЛПВП.
Индекс атерогенности определяется как отношение разности ОХС и ХС-ЛПВП к ХС-ЛПВП. Еще более важным является определение уровня не липопротеинов, а Апо-белков, входящих в их состав. Однако в настоящее время эти методы только начинают внедряться в клиническую практику. Нормальные показатели уровня основных липидов представлены в табл. 1.
Для удобства запоминания нормальных показателей можно использовать правило один-два-три-четыре-пять, в котором:
- менее 5 — уровень общего холестерина;
- менее 4 — индекс атерогенности;
- менее 3 — уровень ХС-ЛПНП;
- менее 2 — уровень ТГ;
- более 1 — уровень ХС-ЛПВП.
Данные нормативы, кроме индекса атерогенности, представлены в ммоль/л. В литературе также встречаются измерения показателей холестерина и триглицеридов в мг/дл. Для перевода мг/дл в ммоль/л необходимо величину, измеряемую в мг/дл, разделить на 38,7 (для холестерина) и на 88,5 (для триглицеридов).
Однако в практической медицине у большинства больных с ИБС или с многочисленными факторами риска развернутое исследование липидного профиля не проводится или проводится не в полном объеме. Так, количество больных с ИБС, у которых исследовался липидный профиль, в США в 1999 году составило всего 44% (из 48 586 больных); целевой уровень ХС-ЛПНП менее 100 ммоль/л (100 мг/дл), рекомендованный Американской ассоциацией кардиологов, был достигнут лишь у 25% этих больных [9]. Достижение данного уровня всего у одной четверти больных демонстрирует отсутствие настороженности и недооценку важности значения своевременной коррекции этих показателей. Мы не располагаем аналогичными данными по России, но трудно себе представить, чтобы результат оказался более обнадеживающим.
Крайне важным, на наш взгляд, является отношение к нормативным показателям. Описываемой во многих руководствах и учебниках тактики, предусматривающей назначение пациентам с гиперхолестеринемией немедикаментозного лечения в течение двух месяцев с последующим повторным исследованием липидограммы, следует придерживаться лишь в случаях, когда речь идет о первичной профилактике ИБС или больных ИБС со стабильным течением стенокардии. В случаях выраженной дислипидемии, сочетающейся с клинической картиной прогрессирующего течения стенокардии и/или изменениями при функциональных пробах, необходимо проводить быстрое и достаточно агрессивное лечение. Соглашаясь с важностью проведения немедикаментозного лечения у данного контингента больных в полном объеме, мы вынуждены акцентировать внимание на необходимости одновременного начала лекарственной терапии. При выраженной гиперхолестеринемии у таких больных возлагать надежды на эффективность немедикаментозного лечения означает упустить время и подвергнуть больного дополнительному риску. То же можно сказать о медикаментозном лечении гипохолестеринемическими средствами у больных с острым коронарным синдромом (нестабильной стенокардией и Q-необразующим ИМ) при нормальных или незначительно повышенных уровнях ОХ и ХС-ЛПНП. Это объясняется тем, что статины обладают не только гипохолестеринемическим действием. Так, у пациентов с нестабильной стенокардией понижение уровня ОХ при терапии статинами сопровождалось улучшением эндотелиальной функции сосудов, отмечавшимся через шесть недель (Dupurs J. et al, 1999) [11].
В зависимости от повышения той или иной фракции холестерина и/или триглицеридов выделяют пять типов дислипидемий (по Фридриксону) [2]. Классификация ВОЗ с предположительной степенью риска развития атеросклероза, основанная на классификации Фридриксона, представлена в табл. 2.
Наиболее атерогенны, опасны в плане развития сердечно-сосудистых заболеваний и широко распространены дислипидемии IIА, IIБ и IV типа. Если невозможно провести развернутый анализ липидограммы, эти типы дислипидемий можно выявить и путем определения только ХС и ТГ.
Данные, позволяющие выявить тип дислипидемий по уровню этих показателей, представлены в табл. 3.
Эта классификация, достаточно простая и понятная для клиницистов, все же имеет ряд недостатков. Так, в нее не вошел ХС-ЛПВП, значение которого для решения вопроса о тактике лечения и прогнозе является крайне важным.
Не менее значимым представляется и определение причин возникновения дислипидемии, которые подразделяются на первичные и вторичные [3].
Вторичные дислипидемии встречаются значительно чаще. Они либо обусловлены нарушением питания, когда имеет место избыточное потребление пищи, богатой холестерином, либо возникают в результате таких заболеваний, как гипотиреоз, нефротический синдром, подагра, сахарный диабет, ожирение и др. Нарушения липидного обмена могут возникнуть или усугубиться на фоне лечения других заболеваний такими препаратами, как тиазидовые диуретики, иммуносупрессоры. Роль b-блокаторов ограничивается повышением уровня ТГ и некоторым снижением уровня ХС-ЛПВП. Отрицательное проатерогенное действие при этом значительно уступает положительному эффекту b-блокаторов как антиишемических, антиаритмических и гипотензивных средств [3].
Дислипидемии являются одной из наиболее важных причин развития атеросклероза, поэтому их своевременная диагностика и правильное лечение могут замедлить процесс развития атеросклероза и уменьшить риск сердечно-сосудистых осложнений.
Литература
Липиды плазмы крови представлены в основном холестерином (ХС) и триглицеридами (ТГ). ХС имеет сложное гетероциклическое стероидное ядро (рис. 1) и выполняет следующие физиологические функции. Во-первых, он является пластическим материалом, так как представляет собой обязательный структурный компонент любых клеточных мембран, обеспечивающий их стабильность. Во-вторых, из ХС в печени синтезируются желчные кислоты, которые необходимы для эмульгации и абсорбции жиров в тонком кишечнике. В-третьих, ХС является предшественником стероидных гормонов коры надпочечников (гидрокортизона и альдостерона), а также половых гормонов (эстрогенов и андрогенов). Источником экзогенного (поступающего в организм с пищей) ХС служат продукты животного происхождения. При обычной европейской диете потребляется от 300 до 500 мг ХС в день. Однако экзогенный ХС не имеет жизненно важного значения, поскольку даже при исключительно вегетарианской диете ХС синтезируется в количествах, вполне достаточных для обеспечения потребности в нем организма.
| Триглицериды - |
| Холестерин - |
Рис. 1. Структура триглицеридов и холестерина
Главным источником эндогенного ХС является печень. Основные этапы синтеза ХС представлены на схеме 1. На первом этапе этого процесса из трех молекул ацетата и коэнзима А синтезируется 3-гидрокси-3-метилглютарил коэнзим А (ГМГ-КоА). Далее в результате воздействия фермента ГМГ-КоА-редуктазы образуется мевалоновая кислота, которая примерно через 20 последующих этапов превращается в ХС. Несмотря на всю сложность и многоэтапность этих процессов, ключевым ферментом, определяющим скорость синтеза ХС, является именно ГМГ-КоА-редуктаза. Выбор этого фермента в качестве мишени для воздействия статинов позволяет решающим образом вмешиваться в синтез ХС и контролировать тем самым его уровень в плазме крови.
Схема 1. Основные этапы синтеза холестерина
| Ацетат -> ГМГ-КоА + ГМГ-КоА-редуктаза -> Мевалоновая кислота -> -> ~ 20 этапов -> -> Холестерин |
Синтезируемый в печени ХС обеспечивает потребность в нем ряда органов и тканей и прежде всего - самой печени, которая является не только его основным "производителем", но и "потребителем". Известно, что средний период полужизни гепатоцита составляет не более 100 дней, в связи с чем печени требуется много ХС для построения собственных клеточных мембран. Относительно небольшое количество синтезируемого ХС поступает в кровь, а основная его часть трансформируется в желчные кислоты и попадает с желчью в просвет тонкого кишечника. Из нижних отделов кишечника около 97% желчных кислот абсорбируется и возвращается в печень. Этот процесс называется энтерогепатической циркуляцией. Абсорбция желчных кислот в просвете кишечника является основным механизмом действия секвестрантов желчных кислот (анионообменных смол) - холестирамина и колестипола. Небольшие количества ХС и желчных кислот могут также связываться богатыми растительной клетчаткой пищевыми продуктами.
Потребность печени в ХС удовлетворяется не только за счет его синтеза гепатоцитами, но и за счет поступления из крови. В условиях "холестеринового голода", в частности, вызванного приемом статинов, гепатоциты стимулируют специфические рецепторы, расположенные на их клеточной мембране, которые осуществляют распознавание и захват липопротеидов низкой плотности, являющихся основным холестеринсодержащим классом липопротеидов. Это рецепторы к апопротеидам В и Е (В/Е рецепторы). Активация этих рецепторов является основным условием понижения уровня ХС плазмы крови.
ТГ представляют собой эфиры трехатомного спирта глицерина и высших жирных кислот. В зависимости от количества двойных связей жирные кислоты могут быть насыщенными (нет двойных связей), мононенасыщенными (одна связь) и полиненасыщенными (две и более связи). ТГ являются важнейшим источником энергии как для скелетной муслулатуры, так и для миокарда. По своей энергетической ценности жирные кислоты вдвое превосходят глюкозу и другие моносахариды. Функция ТГ (и жирных кислот) как пластического материала заключается в их способности аккумулироваться в жировых депо. Насыщенные жирные кислоты являются атерогенными и содержатся в животных жирах, а также в кокосовом масле. Неатерогенные мононенасыщенные жирные кислоты содержатся в оливковом масле, а полиненасыщенные - в масле подсолнечника и некоторых других растительных маслах.
ХС и ТГ являются гидрофобными соединениями, нерастворимыми в воде и плазме крови. Они могут переноситься с током крови только в составе белково-липидных комплексов - липопротеидов (ЛП), которые представляют собой сферические частицы, имеющие электрический заряд. Наружный слой ЛП образуют белки - апопротеиды, или просто "апо", а ядро ЛП составляют липиды - ХС и ТГ. Выделяют четыре основных класса ЛП, отличающихся по размеру, удельному весу (плотности), подвижности при электрофорезе, содержанию ХС и ТГ и составу апопротеидов: хиломикроны (ХМ), ЛП очень низкой плотности (ЛПОНП), ЛП низкой плотности (ЛПНП) и ЛП высокой плотности (ЛПВП) (рис. 2).
Рис. 2. Классы липопротеидов
Идентификация ЛП возможна с помощью двух основных методов - ультрацентрифугирования, при котором используются их различия по плотности, и электрофореза в агаровом геле, при котором разделение ЛП основывается на различии их подвижности в электрическом поле. Эти методы, являющиеся достаточно сложными и дорогостоящими, применяются преимущественно в научно-исследовательских целях, а также в сложных диагностических случаях. На практике типирование гиперлипопротеидемий (ГЛП) осуществляют с помощью более приблизительной оценки по уровню общего ХС, ТГ и ХС ЛПВП (см. ниже).
При расположении классов ЛП в той последовательности, в которой они представлены на рис. 2 (от ХМ до ЛПВП), легко прослеживаются следующие закономерности: постепенное увеличение их плотности (наиболее "легкими" являются частицы ХМ, а наиболее "тяжелыми" - ЛПВП), усиление подвижности при электрофорезе (ХМ остаются на старте, а ЛПВП составляют наиболее мобильный класс ЛП), уменьшение размера частиц (диаметр ХМ равен примерно 800-5000 А, а ЛПВП - всего лишь 50-80 А), а также увеличение содержания ХС и уменьшение содержания ТГ.
ХМ образуются в стенке тонкого кишечника из экзогенных (поступающих с пищей) жиров. Они представлены крупными частицами, богатыми ТГ и бедными ХС, и содержат 10 различных апопротеидов. Основное назначение ХМ состоит в обеспечении скелетных мышц и миокарда энергией, заключенной в ТГ (вернее, во входящих в их состав жирных кислотах). ХМ переносятся с током крови в мышцы, где фиксируются на соответствующих клеточных рецепторах и подвергаются воздействию фермента липопротеинлипазы, которая расщепляет ТГ, в результате чего жирные кислоты поступают в клетки. После этой операции из ХМ образуется так называемая ремнантная (остаточная) частица. Хиломикроновые ремнанты поступают в печень (принося с собой ХС, потребляемый с пищей), где происходит их полное разрушение. Атерогенность ХМ не доказана, однако хиломикроновые ремнанты являются атерогенными.
ЛПОНП, как и ХМ, представлены крупными частицами, богатыми ТГ и бедными ХС, и содержат 5 апопротеидов. Они выполняют ту же функцию обеспечения мышц энергией, что и ХМ, однако синтезируются в печени не из экзогенных, а из эндогенных источников. Далее они поступают в кровь и доставляются к мышцам. После извлечения миоцитами из ЛПОНП большей части ТГ они, как и ХМ, трансформируются в ремнантные частицы (их также называют липопротеидами промежуточной плотности - ЛППП), которые затем попадают в печень. Концентрация ЛППП в плазме крови примерно в 10 раз ниже, чем концентрация ЛПОНП. В отличие от хиломикроновых ремнантных частиц ЛППП не катаболизируются, а трансформируются в ЛПНП, являясь, таким образом, их предшественниками. Повышение уровня ЛПОНП связано с определенным риском развития атеросклероза. Ускорение катаболизма и/или уменьшение синтеза ЛПОНП лежит в основе холестеринпонижающего эффекта двух групп гиполипидемических препаратов - никотиновой кислоты и фибратов (табл. 1).
Таблица 1. Основные характеристики липопротеидов плазмы крови
| Класс ЛП | Липиды | Аполипопротеиды | Плотность, г/мл | Диаметр, А | ||||
| ХМ | ТГ>>ХС | A-I, A-II, A-IV, B-48 С-I, С-II, С-III, Е | >ХС | В-100, С-I, С-II, С-III, E | ТГ | В-100 | 1,019-1,063 | 180-280 |
| ЛПВП | ХС>>ТГ | А-I, А-II, С-I, С-II, С-III, e | 1,125-1,210 | 50-90 |
ЛПНП синтезируются в печени и являются основным холестеринсодержащим классом ЛП, на долю которого приходится около 70% общего ХС плазмы крови. Физиологическая роль ЛПНП заключается в транспорте ХС к его "потребителям", в основном к надпочечникам, другим эндокринным органам и к самой печени . Окисленные формы ЛПНП, образующиеся в процессе их так называемой модификации эндотелием, проникают в интиму артерий и инициируют формирование атеросклеротической бляшки. В состав ЛПНП входит единственный апопротеид - апо-В100. Распознавание ЛПНП и их фиксация на поверхности клеток осуществляются с помощью В/Е рецепторов, вступающих во взаимодействие с этим апопротеидом. В настоящее время ЛПНП рассматриваются в качестве основного атерогенного класса ЛП, на чем основывается вся стратегия гиполипидемической терапии. Выделяют несколько фракций ЛПНП, характеризующихся различной атерогенностью.
ЛПВП представлены самыми маленькими частицами, весьма богатыми фосфолипидами и белком. Они синтезируются преимущественно в печени. Основная роль ЛПВП заключается в эвакуации избытка ХС из сосудистой стенки и других тканей. При этом относительно бедная ХС фракция ЛПВП3 трансформируется в богатые ХС ЛПВП2, которые возвращаются в печень и затем выводятся с желчью. Предполагается, что ЛПВП обладают протекторным эффектом за счет благоприятного влияния на функции эндотелия и предупреждения образования окисленных форм ЛПНП. В настоящее время ЛПВП считаются единственным антиатерогенным классом ЛП. Снижение уровня ХС ЛПВП менее 35 мг/дл (0,9 ммоль/л) является самостоятельным фактором риска ИБС, а повышение более 80 мг/дл (2,1 ммоль/л) - так называемым отрицательным фактором риска (можно сказать, фактором антириска).
Помимо описанных 5 классов ЛП выделяют ЛП (а). В структурном отношении они идентичны ЛПНП, но содержат дополнительный апо-протеид - апо (а), связанный дисульфидным мостиком с апо В-100. Показано, что ЛП (а) является независимым фактором риска ИБС. Атерогенные окисленные формы ЛП (а) образуются значительно легче, чем окисленные формы ЛПНП. В связи со структурным сходством с плазминогеном ЛП (а) рассматриваются как конкурентные антагонисты плазминогена, ассоциирующиеся с повышенным риском возникновения тромбоза коронарных артерий.
Таким образом, атерогенность ЛП зависит не только от количества содержащегося в них ХС, но и от некоторых качественных параметров. Известно, что существует несколько фракций ЛПНП, обладающих различной атерогенностью. В частности, выделяют "мелкие плотные" ЛПНП, являющиеся весьма атерогенными, и "крупные флотирующие" ЛПНП, наличие которых ассоциируется со значительно меньшим риском возникновения ИБС. Примерно у 20% взрослого населения США и Европы имеет место атерогенный вариант дислипопротеидемии, характеризующийся наличием избыточного количества "мелких плотных" ЛПНП, повышенным уровнем ТГ и пониженным - ХС ЛПВП на фоне нормального содержания общего ХС.
В связи с тем, что определение уровня ЛП (а), а также "мелких плотных" ЛПНП далеко не относится к числу рутинных биохимических методов, оценка так называемого коронарного риска на практике неизбежно оказывается приблизительной. Принятая в настоящее время ориентация на уровень ХС ЛПНП является тем разумным компромиссом, который позволяет оценивать риск возникновения ИБС и ее осложнений с проведением доступных и относительно недорогих лабораторных тестов.
Липопротеины — сложные белково-липидные комплексы, входящие в состав всех живых организмов и являющиеся необходимой составной частью клеточных структур. Липопротеины выполняют транспортную функцию. Их содержание в крови – важный диагностический тест, сигнализирующий о степени развития заболеваний систем организма.
Это класс сложных молекул, в состав которых могут одновременно входить свободные триглицериды, жирные кислоты, нейтральные жиры, фосфолипиды и холестерин в различных количественных соотношениях.
Липопротеины доставляют липиды в различные ткани и органы. Они состоят из неполярных жиров, расположенных в центральной части молекулы — ядре, которое окружено оболочкой, образованной из полярных липидов и апобелков. Подобным строением липопротеинов объясняются их амфифильные свойства: одновременная гидрофильность и гидрофобность вещества.
Функции и значение
Липиды играют важную роль в организме человека. Они содержатся во всех клетках и тканях и участвуют во многих обменных процессах.

- Липопротеины – основная транспортная форма липидов в организме. Поскольку липиды являются нерастворимыми соединениями, они не могут самостоятельно выполнять свое предназначение. Липиды связываются в крови с белками – апопротеинами, становятся растворимыми и образуют новое вещество, получившее название липопротеид или липопротеин. Эти два названия являются равноценными, сокращенно — ЛП.
Липопротеины занимают ключевое положение в транспорте и метаболизме липидов. Хиломикроны транспортируют жиры, поступающие в организм вместе с пищей, ЛПОНП доставляют к месту утилизации эндогенные триглицериды, с помощью ЛПНП в клетки поступает холестерин, ЛПВП обладают антиатерогенными свойствами.
- Липопротеины повышают проницаемость клеточных мембран.
- ЛП, белковая часть которых представлена глобулинами, стимулируют иммунитет, активизируют свертывающую систему крови и доставляют железо к тканям.
Классификация
ЛП плазмы крови классифицируют по плотности (с помощью метода ультрацентрифугирования). Чем больше в молекуле ЛП содержится липидов, тем ниже их плотность. Выделяют ЛПОНП, ЛПНП, ЛПВП, хиломикроны. Это самая точная из всех существующих классификаций ЛП, которая была разработана и доказана с помощью точного и довольно кропотливого метода — ультрацентрифугирования.

По размерам ЛП также неоднородны. Самыми крупными являются молекулы хиломикронов, а затем по уменьшению размера – ЛПОНП, ЛПСП, ЛПНП, ЛПВП.
Электрофоретическая классификация ЛП пользуется большой популярностью у клиницистов. С помощью электрофореза были выделены следующие классы ЛП: хиломикроны, пре-бета-липопротеины, бета-липопротеины, альфа-липопротеины. Данный метод основан на введении в жидкую среду активного вещества с помощью гальванического тока.
Фракционирование ЛП проводят с целью определения их концентрации в плазме крови. ЛПОНП и ЛПНП осаждают гепарином, а ЛПВП остаются в надосадочной жидкости.
В настоящее время выделяют следующие виды липопротеинов:
ЛПВП (липопротеины высокой плотности)

ЛПВП обеспечивают транспорт холестерина от тканей организма к печени.
ЛПВП содержат фосфолипиды, которые поддерживают холестерин во взвешенном состоянии и предупреждают его выход из кровяного русла. ЛПВП синтезируются в печени и обеспечивают обратный транспорт холестерина из окружающих тканей к печени на утилизацию.
- Увеличение ЛПВП в крови отмечают при ожирении, жировом гепатозе и билиарном циррозе печени, алкогольной интоксикации.
- Снижение ЛПВП происходит при наследственной болезни Танжера, обусловленной скоплением холестерина в тканях. В большинстве прочих случаев снижение концентрации ЛПВП в крови — признак атеросклеротического повреждения сосудов.
Норма ЛПВП отличается у мужчин и женщин. У лиц мужского пола значение ЛП данного класса колеблется в пределах от 0,78 до 1,81 ммоль/л, норма у женщин ЛПВП — от 0,78 до 2,20, в зависимости от возраста.
ЛПНП (липопротеины низкой плотности)
ЛПНП являются переносчиками эндогенного холестерина, триглицеридов и фосфолипидов от печени к тканям.
Данный класс ЛП содержит до 45% холестерина и является его транспортной формой в крови. ЛПНП образуются в крови в результате действия на ЛПОНП фермента липопротеинлипазы. При его избытке на стенках сосудов появляются атеросклеротические бляшки.
В норме количество ЛПНП составляет 1,3-3,5 ммоль/л.
- Уровень ЛПНП в крови повышается при гиперлипидемии, гипофункции щитовидной железы, нефротическом синдроме.
- Пониженный уровень ЛПНП наблюдается при воспалении поджелудочной железы, печеночно-почечной патологии, острых инфекционных процессах, беременности.
инфографика (увеличение по клику) – холестерин и ЛП, роль в организме и нормы
ЛПОНП (липопротеины очень низкой плотности)
ЛПОНП образуются в печени. Они переносят эндогенные липиды, синтезируемый в печени из углеводов, в ткани.
Это самые крупные ЛП, уступающие по размерам лишь хиломикронам. Они более, чем на половину состоят из триглицеридов и содержат небольшое количество холестерина. При избытке ЛПОНП кровь становится мутной и приобретает молочный оттенок.
Хиломикроны
Хиломикроны отсутствуют в крови у здорового человека и появляются только при нарушении обмена липидов. Хиломикроны синтезируются в эпителиальных клетках слизистой оболочки тонкого кишечника. Они доставляют экзогенный жир из кишечника в периферические ткани и печень. Большую часть транспортируемых жиров составляют триглицериды, а также фосфолипиды и холестерин. В печени под воздействием ферментов триглицериды распадаются, и образуются жирные кислоты, часть которых транспортируется в мышцы и жировую ткань, а другая часть связывается с альбуминами крови.

как выглядят основные липопротеины
ЛПНП и ЛПОНП являются высокоатерогенными – содержащими много холестерина. Они проникают в стенку артерий и накапливаются в ней. При нарушении метаболизма уровень ЛПНП и холестерина резко повышается.
Наиболее безопасными в отношении атеросклероза являются ЛПВП. Липопротеины этого класса выводят холестерин из клеток и способствуют его поступлению в печень. Оттуда он вместе с желчью попадает в кишечник и покидает организм.
Представители всех остальных классов ЛП доставляют холестерин в клетки. Холестерин – это липопротеид, входящий в состав клеточной стенки. Он участвует в образовании половых гормонов, процессе желчеобразования, синтезе витамина Д, необходимого для усвоения кальция. Эндогенный холестерин синтезируется в печеночной ткани, клетках надпочечников, стенках кишечника и даже в коже. Экзогенный холестерин поступает в организм вместе с продуктами животного происхождения.
Дислипопротеинемия – диагноз при нарушении обмена липопротеинов
Дислипопротеинемия развивается при нарушении в организме человека двух процессов: образования ЛП и скорости их выведения из крови. Нарушение соотношения ЛП в крови – не патология, а фактор развития хронического заболевания, при котором уплотняются артериальные стенки, суживается их просвет и нарушается кровоснабжение внутренних органов.
При повышении уровня холестерина в крови и снижении уровня ЛПВП развивается атеросклероз, приводящий к развитию смертельно опасных заболеваний.
Этиология
Первичная дислипопротеинемия является генетически детерминированной.

Причинами вторичной дислипопротеинемии являются:
- Гиподинамия,
- Сахарный диабет,
- Алкоголизм,
- Дисфункция почек,
- Гипотиреоз,
- Печеночно-почечная недостаточность,
- Длительный прием некоторых лекарств.
Понятие дислипопротеинемия включает 3 процесса — гиперлипопротеинемию, гиполипопротеинемию, алипопротеинемию. Дислипопротеинемия встречается довольно часто: у каждого второго жителя планеты отмечаются подобные изменения в крови.
Гиперлипопротеинемия — повышенное содержание ЛП в крови, обусловленное экзогенными и эндогенными причинами. Вторичная форма гиперлипопротеинемии развивается на фоне основной патологии. При аутоиммунных заболеваниях ЛП воспринимаются организмом как антигены, к которым вырабатываются антитела. В результате образуются комплексы антиген — антитело, обладающие большей атерогенностью, чем сами ЛП.
-
Гиперлипопротеинемия 1 типа характеризуется образованием ксантом – плотных узелков, содержащих холестерин и расположенных над поверхностью сухожилий, развитием гепатоспленомегалии, панкреатита. Больные жалуются на ухудшение общего состояния, подъем температуры, потерю аппетита, приступообразную боль в животе, усиливающуюся после приема жирной пищи.

Ксантомы (слева) и ксантелазмы (в центре и справа) – внешние проявления дислипопротеинемии
Алипопротеинемия — генетически обусловленное заболевание с аутосомно-доминантным типом наследования. Заболевание проявляется увеличением миндалин с оранжевым налетом, гепатоспленомегалией, лимфаденитом, мышечной слабостью, снижением рефлексов, гипочувствительностью.
Гиполипопротеинемия – низкое содержание в крови ЛП, часто протекающее бессимптомно. Причинами заболевания являются:
- Наследственность,
- Неправильное питание,
- Сидячий образ жизни,
- Алкоголизм,
- Патология пищеварительной системы,
- Эндокринопатия.
Дислипопротеинемии бывают: органными или регуляторными, токсигенными, базальными — исследование уровня ЛП натощак, индуцированными — исследование уровня ЛП после приема пищи, препаратов или физической нагрузки.
Диагностика
Известно, что для организма человека избыток холестерина очень вреден. Но и недостаток этого вещества может привести к дисфункции органов и систем. Проблема кроется в наследственной предрасположенности, а также в образе жизни и особенностях питания.

Диагностика дислипопротеинемии основывается на данных анамнеза болезни, жалобах больных, клинических признаках — наличии ксантом, ксантелазм, липоидной дуги роговицы.
Основным диагностическим методом дислипопротеинемии является анализ крови на липиды. Определяют коэффициент атерогенности и основные показатели липидограммы — триглицериды,общий холестерин, ЛПВП, ЛПНП.
Липидограмма – метод лабораторной диагностики, который выявляет нарушения липидного обмена, приводящие к развитию заболеваний сердца и сосудов. Липидограмма позволяет врачу оценить состояние пациента, определить риск развития атеросклероза коронарных, мозговых, почечных и печеночных сосудов, а также заболеваний внутренних органов. Кровь сдают в лаборатории строго натощак, спустя минимум 12 часов после последнего приема пищи. За сутки до анализа исключают прием алкоголя, а за час до исследования — курение. Накануне анализа желательно избегать стресса и эмоционального перенапряжения.
Ферментативный метод исследования венозной крови является основным для определения липидов. Прибор фиксирует предварительно окрашенные специальными реагентами пробы. Данный диагностический метод позволяет провести массовые обследования и получить точные результаты.
Сдавать анализы на определение липидного спектра с профилактической целью, начиная с юности необходимо 1 раз в 5 лет. Лицам, достигшим 40 лет, делать это следует ежегодно. Проводят исследование крови практически в каждой районной поликлинике. Больным, страдающим гипертонией, ожирением, заболеваниями сердца, печени и почек, назначают биохимический анализ крови и липидограмму. Отягощенная наследственность, имеющиеся факторы риска, контроль эффективности лечения — показания для назначения липидограммы.
Результаты исследования могут быть недостоверны после употребления накануне пищи, курения, перенесенного стресса, острой инфекции, при беременности, приеме некоторых лекарственных препаратов.
Диагностикой и лечение патологии занимается эндокринолог, кардиолог, терапевт, врач общей практики, семейный врач.
Лечение
Диетотерапия играет огромную роль в лечении дислипопротеинемии. Больным рекомендуют ограничить потребление животных жиров или заменить их синтетическими, принимать пищу до 5 раз в сутки небольшими порциями. Рацион необходимо обогащать витаминами и пищевыми волокнами. Следует отказаться от жирной и жареной пищи, мясо заменить морской рыбой, есть много овощей и фруктов. Общеукрепляющая терапия и достаточная физическая нагрузка улучшают общее состояние больных.

рисунок: полезная и вредная “диеты” с точки зрения баланса ЛП
Гиполипидемическая терапия и антигиперлипопротеинемические препараты предназначены для коррекции дислипопротеинемии. Они направлены на снижение уровня холестерина и ЛПНП в крови, а также на повышение уровня ЛПВП.
Из препаратов для лечения гиперлипопротеинемии больным назначают:
Лечение вторичной формы дислипопротеинемии заключается в устранении основного заболевания. Больным сахарным диабетом рекомендуют изменить образ жизни, регулярно принимать сахаропонижающие препараты, а также статины и фибраты. В тяжелых случаях требуется проведение инсулинотерапии. При гипотиреозе необходимо нормализовать функцию щитовидной железы. Для этого больным проводят гормональную заместительную терапию.
Больным, страдающим дислипопротеинемией, рекомендуют после проведения основного лечения:
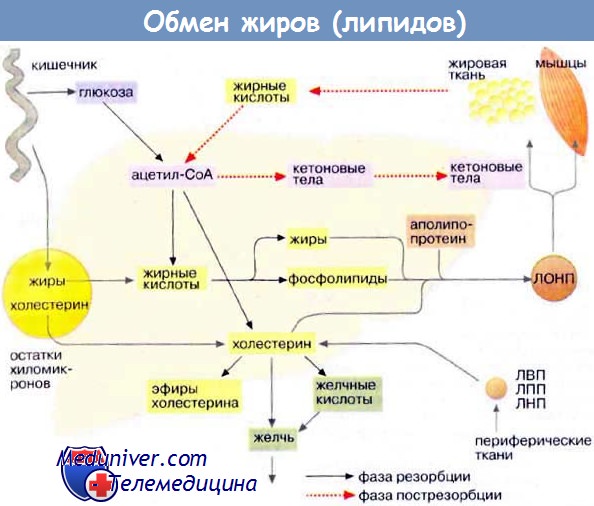
После всасывания в эпителий кишки свободные жирные кислоты и 2-моноглицериды вновь образуют триглицериды и вместе с фосфолипидами и холестеролом включаются в хиломикроны. Хиломикроны транспортируются с током лимфы через грудной проток в верхнюю полую вену, попадая таким образом в общий кровоток.
Внутри хиломикрона триглицериды гидролизуются липопротеинлипазой, что приводит к высвобождению жирных кислот на поверхности кровеносных капилляров в тканях. Это обусловливает транспорт жирных кислот в ткани и последующее образование остатков хиломикронов, обедненных триглицеридами. Эти остатки затем забирают эфиры холестерола из липопротеинов высокой плотности, и частицы быстро захватываются печенью. Данную систему транспорта жирных кислот пищевого происхождения называют экзогенной транспортной системой.
Также существует эндогенная транспортная система, предназначенная для внутриорганного транспорта жирных кислот, образованных в самом организме. Липиды транспортируются из печени в периферические ткани и обратно, а также переносятся из жировых депо к различным органам. Транспорт липидов от печени к периферическим тканям включает согласованные действия ЛПОНП, липопротеинов промежуточной плотности (ЛППП), липопротеинов низкой плотности (ЛПНП) и липопротеинов высокой плотности (ЛПВП). Частицы ЛПОНП подобно хиломикронам состоят из большого гидрофобного ядра, образованного триглицеридами и эфирами холестерола, и поверхностного липидного слоя, состоящего в основном из фосфолипидов и холестерола.
ЛПОНП синтезируются в печени, и отложение жира в периферических тканях является их основной функцией. После попадания в кровоток ЛПОНП подвергаются воздействию липопротеинлипазы, которая гидролизует триглицериды до свободных жирных кислот. Свободные жирные кислоты, происходящие из хиломикронов или ЛПОНП, могут быть использованы в качестве источников энергии, структурных компонентов фосфолипидных мембран или превращаться обратно в триглицериды и в таком виде сохраняться. Триглицериды хиломикронов и ЛПОНП также подвергаются гидролизу липазы печени.
Частицы ЛПОНП посредством гидролиза триглицеридов превращаются в более плотные, меньшие по размеру холестерол- и триглицерид-обогащенные остатки (ЛППП), которые удаляются из плазмы с помощью рецепторов печеночных липопротеинов или могут быть превращены в ЛПНП. ЛПНП являются основными липопротеинами-переносчиками холестерола.
Возврат липидов из периферических тканей в печень часто называют обратным транспортом холестерола. Частицы ЛПВП участвуют в этом процессе, забирая холестерол из тканей и других липопротеинов и перенося его в печень для последующей экскреции. Еще один вид транспортировки, существующей между органами, — перенос жирных кислот из жировых депо к органам для окисления.
Жирные кислоты, получаемые в основном в результате гидролиза триглицеридов жировой ткани, секретируются в плазму, где соединяются с альбумином. Связанные с альбумином жирные кислоты переносятся по градиенту концентрации в ткани с активным метаболизмом, где и используются преимущественно в качестве источников энергии.
В течение последних 20 лет только несколько исследований были посвящены вопросу транспорта липидов в перинатальном периоде (результаты этих исследований в данном издании не представлены). Очевидна необходимость более детального изучения этой проблемы.
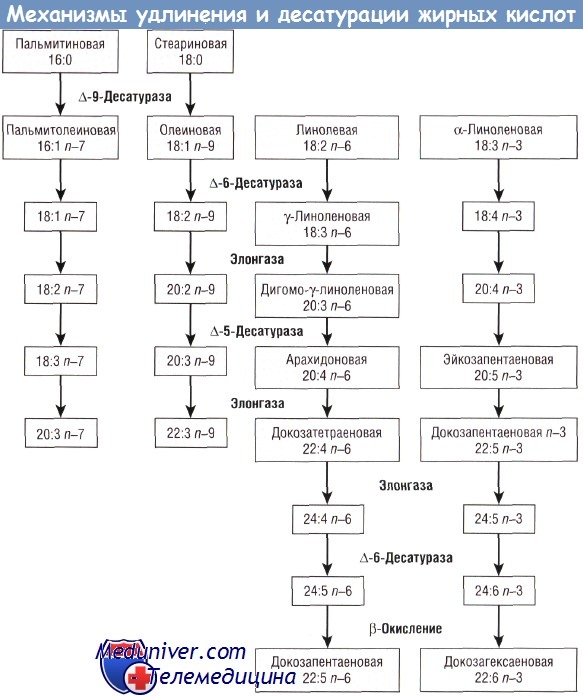
Вопрос о роли ДЦПНЖК ARA и DHA в процессе роста и развития ребенка является одним из важнейших вопросов в исследованиях, проводимых в области детской нутрициологии в течение последних двух десятилетий.
Липиды являются одними из основных компонентов клеточных мембран. Значительное количество исследований в области физиологии липидов посвящено двум жирным кислотам — ARA и DHA. ARA обнаружена в составе клеточных мембран всех структур организма человека; она является предшественником эйкозаноидов 2-й серии, лейкотриенов 3-й серии и других метаболитов, которые включены в сигнальные системы клеток и процесс генной регуляции. Исследования, посвященные DHA, часто указывают на ее структурную и функциональную роль в составе клеточных мембран.
Эта жирная кислота обнаружена в высокой концентрации в сером веществе головного мозга, а также в палочках и колбочках сетчатки. Исследования постепенного исключения из диеты животных омега-3 жирных кислот показали, что содержащие 22 атома углерода омега-6 ДЦПНЖК (например, 22:5 п—6) способны структурно, но не функционально заменить 22:6 n-3. При неадекватном уровне 22:6 n-3 в тканях выявляются нарушения зрения и познавательных способностей. Было показано, что изменение содержания 22:6 n-3 в тканях влияет на нейротрансмиттерную функцию, активность ионных каналов, сигнальные пути и экспрессию генов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Разработчик сайтов, журналист, редактор, дизайнер, программист, копирайтер. Стаж работы — 25 лет. Область интересов: новейшие технологии в медицине, медицинский web-контент, профессиональное фото, видео, web-дизайн. Цели: максимально амбициозные.
- Запись опубликована: 19.08.2020
- Время чтения: 1 mins read
Жиры содержат три типа жирных кислот: насыщенные, мононенасыщенные и полиненасыщенные. Именно их соотношение определяет диетическую ценность.
Что такое липиды
Липиды — это различные классы соединений, таких как стероиды, жиры, сфинголипиды и т.п. Липиды включены в биологические мембраны и, следовательно, от них зависит проводимость мембраны, передача нервных импульсов и образование межклеточных связей.
Они образуют основные запасы энергии клеток. Также липиды — источник эндогенной воды. Они делятся на гидролизуемые и негидролизуемые. К последним относятся терпены и стероиды.
Классификация гидролизуемых липидов намного сложнее. Они делятся на:
- обычные , включающие триглицериды (сложные эфиры глицерина и жирных кислот);
- воски — сложные эфиры длинноцепочечных жирных кислот и длинноцепочечных одноатомных спиртов.
К сложным липидам относятся соединения, которые помимо жирных кислот и спирта содержат молекулы других веществ.
Функции жира в организме
Липиды являются концентрированными источниками энергии. В сутки при нормальном питании потребляется около 100 г липидов. Основные пищевые липиды — триглицериды. С пищей организму необходимо получать липиды животного и растительного происхождения — полиненасыщенные жирные кислоты.
- источник энергии – 1 грамм жира выделяет 9 ккал;
- источник незаменимых жирных кислот;
- переносчик жирорастворимых витаминов A, D, E и K;
- улучшитель вкуса и внешнего вида пищи.
Некоторые типы жиров важны для производства стероидных гормонов, интерлейкинов, тромбоксанов и простагландинов.
Холестерин необходим для производства желчных кислот, которые переваривают жиры.
Триглицериды
Триглецириды — это нейтральные жиры — сложные эфиры глицерина и жирных кислот. Это резервные жиры, которые являются основным источником эндогенной энергии. В жировой ткани триглицериды составляют 60-85% ее массы.
Триглицерид — это сложный эфир, состоящий из глицерина, связанного с тремя жирными кислотами, которые могут быть насыщенными или ненасыщенными. В организме человека преобладают насыщенные пальмитиновая и олеиновая (омега-9) кислоты.

Триглицериды
Триглицериды попадают с пищей или синтезируются в самом организме (печень, жировая ткань, слизистая тонкого кишечника, мышцы). Триглицериды, поступающие с пищей, гидролизуются в желудочно-кишечном тракте ферментом липазой. Скорость синтеза зависит от количества жирных кислот, полученных с пищей.
Триглицериды попадают в кровь в виде хиломикронов (липопротеин, несущий триглицериды). Произведенные жирные кислоты потребляются в тканях или повторно синтезируются из них, а триглицериды сохраняются.
Фосфолипиды
Состоят из двух групп соединений. Это глицерофосфолипиды (спирт-глицерин) и сфингомиелины (спиртовой сфингозин). Фосфолипиды имеют повышенную гидрофильную часть по сравнению с триглицеридами, состоящую из фосфатной группы и определенного аминоспирта, такого как холин. Из-за этой повышенной гидрофильной части фосфолипиды характеризуются полярностью и поэтому также называются полярными липидами.
Фосфолипиды являются основными липидами мембран. Их очень много в нервных клетках. Фосфолипиды образуют миелиновую оболочку нервных волокон и активно участвуют в энергетическом обмене.

Фосфолипиды
Жирные кислоты
- Насыщенные жирные кислоты . Они имеют высокую температуру плавления и поэтому сохраняют твердую консистенцию при комнатной температуре. Насыщенные жирные кислоты получают из животных источников. В растительных маслах (жирах) преобладают ненасыщенные жирные кислоты, за исключением кокосового и пальмового масел. Некоторые промышленные маргарины и спреды содержат много насыщенных жирных кислот.
- Мононенасыщенные жирные кислоты . Эти жирные кислоты находятся в жидкой форме при комнатной температуре. Оливковое и рапсовое масла — лучший источник мононенасыщенных жирных кислот.
- Полиненасыщенные жирные кислоты (PNRR) . PNRR находятся в жидкой форме при комнатной температуре. Они легко окисляются в пище и в организме. PNRR участвуют в процессе метаболизма холестерина и входят в состав фосфолипидов клеточных мембран. Кроме того, они являются предшественниками таких активных биологических веществ, как простагландины, интерлейкины, тромбоксаны, играющих решающую роль в формировании иммунного ответа, регулировании свертывания крови и уменьшении воспаления.
Полиненасыщенные RR делятся на:
- Омега-3 (альфа-линоленовые) – содержатся в льняном, тыквенном, грецком, рапсовом и соевом маслах и зеленых листовых овощах;
- Эйкозапантан, докозагексаен — содержатся в масле морских рыб, масле морских водорослей.
Линоленовые жиры, арахидон — их производные. Они присутствуют в молочном жире, особенно летом, потому что в организме животных они состоят из линолевой кислоты, полученной с кормом.
Более длинные цепи RR: арахидон (AA), докозагексаеновая кислота (DHR), эйкозапентаеновая кислота (EPR) не считаются незаменимыми, но при отсутствии RR омега-3 и омега-6 в пище их выработка в организме может достигать критических уровней. Прямое поступление АК, ЭПК и ДГК с пищей позволяет избежать метаболизма линолевой и альфа линоленовой кислоты.
DHR и EPR очень важны для неврологического развития плода и ребенка. Дефицит DHR связан с болезнью Альцгеймера, синдромом дефицита внимания, фенилкетонурией, муковисцидозом и другими заболеваниями. Растительный α-линоленовый RR омега-3 может быть преобразован ферментами в физиологически важные EPR и DHR или соединения класса гормоноподобных эйкозаноидов.
Жирные кислоты омега-3 активно участвуют в клеточном метаболизме, в регуляции холестерина в организме человека: они снижают количество холестерина липопротеидов низкой плотности (так называемый плохой холестерин) в организме, а также вероятность сердечных заболеваний. Они также очень важны для функционирования клеток мозга, нейронных синапсов, сетчатки глаза, а также для выработки половых гормонов.

Метаболизм жирных кислот
Оптимальное соотношение жирных кислот омега-6 к омега-3 составляет 5:1. В современном рационе это соотношение превышает 15 раз и более. Неправильное соотношение Омега-3 и Омега-6 опасно для здоровья.
Трансизомерные кислоты
Трансизомерные кислоты в небольших количествах содержатся в натуральных жирах, в желудках коров и овец, баранине, говядине, молоке и сыре. Важнейшим источником транс-изомерных кислот являются гидрогенизированные спреды PNRR, маргарины.

Маргарин – источник транс-изомерных кислот
В процессе нагревания растительного масла ненасыщенные кислоты становятся насыщенными, а жидкие жиры становятся твердыми. Гидратированные диетические жиры имеют ряд преимуществ. Они дешевле, портятся медленнее, чем животные жиры, более устойчивы к окислению и высоким температурам.
Транс-изомерные кислоты, образующиеся во время гидрогенизации, связаны с увеличением холестерина ЛПНП и снижением холестерина ЛПВП, что увеличивает риск сердечно-сосудистых заболеваний, ожирения, диабета, а высокие уровни которых могут быть канцерогенными.
Стерины
Производные стероидов — это стероидные спирты, состоящие из четырех конденсированных колец атомов углерода, которые отличаются друг от друга функциональными группами (например, тестостерон, холестерин). Содержится в растениях, мясе и вырабатывается в организме.
В организме человека могут содержаться свободные стерины или сложные эфиры (стериды), образованные с жирными кислотами. Существует множество стеринов и стероидов, включая желчные кислоты, половые гормоны и гормоны коры надпочечников, витамины группы D, сердечные гликозиды, растительные фитостерины и некоторые алкалоиды.
В растениях есть стерины (эргостерин, стигмастерин и т. д.), но эти стерины не очень хорошо усваиваются организмом и, как считается, блокируют всасывание холестерина.
Самый распространенный стерол — это воскоподобный холестерин, который содержится только в продуктах животного происхождения. Фитостерины содержатся в растительной пище.
Холестерин является предшественником желчных кислот, стероидных гормонов и витамина D и представляет собой пергидрофенантреновое производное циклопентана. Это циклический ненасыщенный одноатомный спирт, имеющий полярную гидроксигруппу. Из холестерина в организме синтезируются другие стероиды: гормоны надпочечников, кортикостероиды, половые гормоны, желчные кислоты. Он синтезируется во многих клетках организма, но наиболее интенсивно в эндоплазматическом ретикулуме и цитоплазме эпителиальных клеток печени и кишечника. Холестерин синтезируется из ацетил-КоА. Выводится из организма с желчью или в виде солей желчных кислот.
Пищевой холестерин слабо влияет на уровень холестерина в плазме крови, поскольку большая его часть имеет эндогенное происхождение. Однако уменьшение количества насыщенных жиров в пище также резко снижает уровень холестерина в крови.
Животные и растительные жиры в диете
Животные жиры содержат много насыщенных жирных кислот. Они повышают уровень холестерина в крови и, следовательно, способствуют развитию атеросклероза, сердечно-сосудистых заболеваний и рака. Чрезмерное потребление насыщенных жирных кислот может привести к раку легких, кишечника, прямой кишки, груди и простаты.
Единственное исключение составляет один вид животного жира — жир морской рыбы , такой как скумбрия, сельдь, лосось, треска. Рекомендуется есть их как можно чаще из-за наличия полиненасыщенных жирных кислот омега-3.

Жиры в морской рыбе
Пищевая ценность масла определяется соотношением содержащихся в нем жирных кислот и количества жирорастворимых витаминов. В растительных маслах ненасыщенные жирные кислоты, то есть олеиновая, линолевая и α-линоленовая кислоты, составляют значительную часть всех жирных кислот. Особенно важны группы PNRR омега-6 и омега-3.
- Считается, что дефицит производных омега-6 RR может быть одним из факторов риска, связанных с развитием рака.
- Омега-3 PNRR снижает агрегацию тромбоцитов, а также риск образования тромбов, влияет на электрическую активность сердечной мышцы, тормозит возникновение аритмий. Они снижают уровень триглицеридов в крови, а также частоту ишемической болезни сердца.
Соотношение RR омега-6 и омега-3 в пищевых продуктах, рекомендованных Всемирной организацией здравоохранения (ВОЗ), должно составлять от 1:1 до 5:1. В последние десятилетия стала очевидной искаженная тенденция в этой рекомендации: растет потребление масел с высоким содержанием омега-6 и слишком низким содержанием омега-3 RR. Например, подсолнечное масло.
Соотношение этих кислот в различных продуктах питания колеблется от 10:1 до 20:1. Превышение омега-6 снижает уровень холестерина ЛПВП и увеличивает холестерин ЛПНП. Арахидон, производимый из кислот омега-6 и его метаболиты вызывают сужение сосудов и агрегацию тромбоцитов.
Более насыщенных транс-изомерных кислот, образующихся при гидрогенизации растительных масел, то есть при их затвердевании, увеличивают риск дислипидемии, CD типа II, а также попадания канцерогенов в клетки.
Качество растительного масла определяется его химическим составом, способом экстракции, технологией рафинирования и сохраняемыми при нем естественными физиологически активными веществами. Рекомендуется употреблять не менее 2-3 столовых ложек ненагретого масла в день с различными блюдами или салатами.
Читайте также:

