Анилин реферат по химии
Обновлено: 02.07.2024
Николай Зинин родился 13 (25) августа 1812, г. Шуша Елизаветпольской губернии, ныне в Нагорном Карабахе. Скончался 6 (18) февраля 1880, в Петербурге.
Одним из важнейших направлений исследований Зинина было изучение реакций окисления и восстановления органических веществ. Восстанавливая нитробензол сероводородом, ему удалось синтезировать анилин (1842), который до этого был получен Ю.Ф. Фрицше из красителя индиго. Теперь анилин можно было получать в промышленном масштабе. В 1844, пользуясь восстановительным действием гидросульфида аммония на динитросоединения, Зинин получил нафтилендиамин и фенилендиамин. Таким образом был открыт общий метод получения аминопроизводных из органических нитросоединений. Эти работы заложили научную основу для развития анилинокрасочной промышленности, открыли новую эру в промышленном производстве синтетических красителей, новых фармацевтических препаратов, душистых веществ и др.
Н. Зинин успешно сочетал преподавание в академии и работу в лаборатории. Совместное творчество Зинина с молодым инженером-артиллеристом В.Ф. Петрушевским привело к решению проблемы получения и использования сильнейшего взрывчатого вещества – нитроглицерина. Зинин разработал самый прогрессивный метод синтеза нитроглицерина из глицерина с использованием концентрированной азотной кислоты, низкой температуры и т.д. Когда в 1853 объединенная англо-французско-турецкая армия высадилась в Крыму и война приняла затяжной характер, Николай Зинин сделал все, чтобы русская армия имела на вооружении самые сильные взрывчатые вещества. Он предложил начинять нитроглицерином гранаты (1854), разработал способ получения больших количеств нитроглицерина и способ его взрывания. Однако его предложения не были реализованы артиллерийским ведомством. Только в 1863–67 нитроглицерин начали успешно применять для подземных и подводных взрывов. В 1854–55 Зинин описал открытые им уреиды, синтезировал, независимо от Бертло и де Люка, искусственное горчичное масло и исследовал его взаимодействие с аминами с образованием замещенных тиомочевин.
Еще о Николае Зинине
24 ноября 1830 года – первый учебный день в университете, который положил начало новой жизни – жизни, всецело отданной науке. Профессор математики Лобачевский и профессор астрономии Иван Михайлович Симонов в первые же дни занятий обратили внимание на способного юношу. В университете, как правило, учились дети обеспеченных родителей. Они стремились получить диплом, а наука их особенно не интересовала. Главным для них было сдать экзамен.
На фоне общей студенческой массы фигура Зинина резко выделялась. Такие работоспособные и стремящиеся к знаниям студенты встречались Редко. Профессора всячески содействовали им; они старались оставлять таких студентов ассистентами в университете, поручив им разрабатывая какую-нибудь тему.
– У вас большие возможности, – убеждал его Лобачевский. – Если вы блестяще справляетесь с математикой, преуспеете и в химии. У нас большая потребность в химиках.
Железная логика Лобачевского поколебала сомнения Зинина. Николай Николаевич восхищался великим математиком. Зинин согласился и поехал учиться за границу.
Когда весной 1837 года Николай Зинин приехал в Берлин, он уже свободно владел тремя европейскими языками. Здесь он слушал специальный курс физиологической химии, читаемый профессором Мюллером, посещал лекции по математике и лекции по медицине.
Затем Николай перебрался в Гессен к известному немецкому химику Юстусу Либиху. В лаборатории Либиха царила атмосфера творчества и неустанного поиска. Все работали самоотверженно и увлеченно. Новое открытие радовало всех. Каждое утро Либих выслушивал отчеты сотрудников о работе за прошедший день, давал оценку результатам, но путь решения проблем стажеры должны были искать самостоятельно. Работа с бензойной кислотой увлекла Зинина. Хотя научные исследования занимали его целиком, Зинин выкраивал время на посещение лекций Либиха по экспериментальной химии, а также занятий по аналитической химии. Через несколько месяцев Н. Зинин познал радость первого успеха.
В сентябре 1840 года Зинин вернулся в Россию, а 30 января 1841 года в Петербурге Зинин защитил докторскую диссертацию и получил степень доктора естественных наук.
После защиты молодой ученый вернулся в Казань. В работе, в общении с друзьями текли дни, но, оставаясь наедине с собой, он остро ощущал одиночество. Квартирная хозяйка окружала его заботами, и часто по вечерам Зинин заходил в ее комнату выпить чаю и поговорить. Постепенно привязанность росла, и мысль о женитьбе стала сама собой разумеющейся. С женитьбой жизнь Зинина упорядочилась, и заботы о быте уже не отвлекали его. Теперь все свое время и силы ученый отдавал науке.
В то время Николая Зинина занимала одна проблема: какое вещество получается при обработке нитробензола сероводородом. Идея этих исследований родилась еще в Гессене. Масло горького миндаля, нитробензол и ряд других производных бензола, как и сам бензол, – сильно реакционноспособные вещества. Зинин задался целью изучить возможности их взаимодействия с другими веществами. Подвергая их обработке сероводородом или раствором сульфида натрия, Зинин предполагал получить продукт, содержащий серу. Однако, к его удивлению, бесцветная жидкость, образовавшаяся после взаимодействия нитробензола с сероводородом, не содержала даже следов серы.
Зинин подошел к шкафу, открыл склянку с желтой маслянистой жидкостью и осторожно понюхал. Странно… Запах напоминал ему жидкость, которую он уже видел в лаборатории Фрицше. Неужели это анилин? Но анилин, полученный Фрицше, был окрашен в темно-коричневый цвет…
Николай Зинин продолжал изучать возможности открытой им реакции, применив ее к моно- и динитропроизводным бензола, к нитрокислотам. Во всех случаях исходное нитросоединение превращалось в аминопроизводное. Позже Зинин пытался распространить реакцию и на некоторые нитрированные ациклические углеводороды. В 1845 году Зинин синтезировал азоксибензол, затем гидразобензол, который в кислой среде превращается в бензидин.
Печальные прогнозы оправдались: во время одного из таких приступов сердце не выдержало и Николай Зинин скончался 6 февраля 1880 года.
История открытия, физические характеристики вещества. Структурная формула и краткая характеристика класса органических соединений, к которому относится анилин. Воздействие на организм и окружающую среду. Симптомы отравления анилином, первая помощь.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 13.08.2014 |
| Размер файла | 71,7 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
по органической химии на тему:
Впервые анилин получен при перегонке индиго с известью в 1826 году Отто Ундгердорбеном.
В 1834 году Ф. Рунге обнаружил анилин в каменноугольной смоле.
В 1841 году Фришце получил анилин нагреванием индиго с едким кали (КОН).
В 1842 году анилин получил Н.Н. Зинин восстановлением нитробензола сульфидом аммония
Название вещества по номенклатуре ИЮПАК
ИЮПАК (IUPAC) - Международный союз теоретической и прикладной химии. Анилин имеет химическую формулу C6H5NH2. Это первичный ароматический амин - производное аммиака, в молекуле которого один атом водорода замещен фенил радикалом: С6Н5-. ИЮПАК: Фениламин. Синонимы: бензоламин, аминобензол.
Физические характеристики вещества
Анилин - бесцветная маслянистая жидкость немного тяжелее воды, плохо растворима, хорошо растворяется в органических растворителях.
На воздухе окисляется приобретая красно-бурую окраску. Ядовит.
Молекулярная масса (в а.е.м.): 93,13
Относительная плотность: 1,02220; 0,98860
Температура плавления (в °C): -5,89
Температура кипения (в °C): 184,4
Температура вспышки (в °C): 79
Температурные константы смесей: 181 °C (температура кипения азеотропа, давление 1 атм) анилин 76% этиленгликоль 24%
Растворимость (в г/100 г или характеристика):
ацетон: смешивается бензол: смешивается вода: растворим 3,4 (20°C)вода: растворим 6,4 (90°C)диэтиловый эфир: смешивается лигроин: растворим тетрахлорметан: смешивается этанол: смешивается.
Структурная формула вещества
анилин органический формула отравление
Краткая характеристика класса органических соединений, к которому относится данное вещество
Для анилина характерны реакции как по аминогруппе, так и по ароматическому кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов. С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению с алифатическими аминами и даже с аммиаком. С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол. Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок).
Реакции получения анилина
В промышленности анилин получают в две стадии. На первой стадии бензол нитруется смесью концентрированной азотной и серной кислот при температуре 50 - 60°C в результате образуется нитробензол. На втором этапе нитробензол гидрируют при температуре 200-300°C в присутствии катализаторов
Впервые восстановление нитробензола было произведено с помощью железа:
Другим способом получение анилина является восстановление нитросоединений - Реакция Зинина:
Рис. Схема установки для получения анилина восстановлением нитробензола:1 -- редуктор; 2 -- трубчатый холодильник; 3 -- змеевиковый холодильник; 4 -- холодильник для легких углеводородов;5 -- штуцер для загрузки реагентов; 6 -- труба для загрузки чугунных стружек; 7 -- краны
Характерные для анилина химические реакции
Анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок). Эта реакция может использоваться для качественного и количественного определения анилина:
С сильными неорганическими кислотами (соляная, серная, фосфорная) анилин образует соли.
Наибольшее практическое значение имеет гидрохлорид анилина (С6Н5NH2 * HCl), так называемая анилиновая соль, которая используется в промышленности органических красителей и в текстильной промышленности. Соли анилина и фосфорной кислоты применяются для очистки анилина в лабораторных условиях. Их получают кристаллизацией из воды или из органических растворителей.
Вещество разлагается при разогреве до температуры выше 190°C, или при
сжигании с образованием токсичных или едких паров (аммиак и оксиды азота) и горючих паров. Вещество является слабым основанием. Реагирует бурно с сильными окислителями, кислотами, уксусным ангидридом, мономерами хлормеламина, бета-пропиолактоном и эпихлоргидрином, приводя к опасности возникновения пожара и взрыва. Реагирует с металлами, такими как натрий, калий, кальций, с образованием горючего газа - водорода. Агрессивно в отношении меди и ее сплавов.
Анилин применяют для производства красителей, лекарств, полимеров, взрывчатых веществ, ускорителей вулканизации каучуков. Мировое производство анилина более 1млн.тонн в год.
Из других областей применения анилина следует упомянуть фармацевтическую промышленность, где анилин применяется для получения сульфамидных препаратов и синтетических заменителей сахара.
В химии фотоматериалов анилин используется для получения гидрохинона, хотя в настоящее время разработан новый способ его получения - окислением n-диизопропилбензола и фенола.
Анилин имеет некоторое значение как ингибитор коррозии. Особенно хорошо он зарекомендовал себя для защиты металлов в среде влажного четыреххлористого углерода. Фосфаты анилина при добавлении к растворам сильных электролитов замедляют коррозию углеродистых сталей.
Аддукты анилина с трифторидом бора, а также продукты конденсации анилина с альдегидами могут быть использованы в качестве катализаторов и отвердителей эпоксидных полимеров.
Различные соли и реактивы на основе анилина используются в качестве добавок к топливам и смазочным маслам в процессах очистки топлива. Ряд продуктов и смесей на основе анилина используется в качестве ракетного топлива.
Небольшие количества анилина применяются в текстильной, бумажной и металлургической промышленности, при получении поверхностно-активных веществ, в качестве катализаторов, стабилизаторов, ингибиторов полимеризации, репеллентов. В перечисленных отраслях потребление анилина невелико, но в некоторых случаях наблюдается его динамичный рост; например, в производстве гербицидов и полиамидных волокон в США он достигает 20 % в год.
Анилин находит некоторое применение в лабораторной практике как растворитель и реагент.
В 1979 г. американская фирма Gulf Research a. Development предложила в качестве антидетонационной добавки к моторным топливам использовать производное анилина -- о-азидо-анилин. Интерес к этому соединению достаточно велик в связи с жесткими ограничениями на применение свинцовых и марганцевых антидетонаторов.
Большинство фирм, выпускающих анилин, сами используют его на своих заводах, а экспортируют уже конечные продукты его переработки -- изоцианаты, химикаты для резины, красители и т. д.
Начиная с 60-х годов прошлого столетия, производство анилина стало стремительно возрастать в связи с созданием в химической промышленности полиуретанов. Полиуретанами называют вид полимеров, который производят из полупродуктов на основе анилина.
Широкое применение они нашли при изготовлении конструкционных материалов. За последующие пятнадцать лет производство анилина стремительно росло и увеличилось в пять раз. С тех пор, руководствуясь мировым спросом на производство полиуретанов, продолжает возрастать и производство анилина, как одного из самых востребованных полупродуктов органических соединений.
На мировом рынке анилина самыми крупными производителями являются Китай, Соединенные Штаты, Германия, Великобритания, Франция, Япония, Швейцария и Португалия. Лидером мирового производства химических продуктов остается Китай, именно поэтому на его территории были созданы филиалы многих западных фирм по производству анилина.
Конъюнктура рынка анилина в России всегда зависела от рынка сырья, однако в настоящее время эта проблема утратила свою актуальность. Сейчас объемы производства продукта зависят только от количества спроса. Одним из наиважнейших факторов стабильности российского рынка по производству анилина является сохранение уже имеющихся потребителей и привлечение новых. Подобное расширение рынка анилина позволит существенно снизить цены на поставку, за счет снижения расходов на содержание маркетинговых служб. К середине 2012 года рынок планирует увеличить объемы отгрузки анилина практически в 2 раза.
Воздействие на человеческий организм и окружающую среду
Анилин оказывает негативное действие на центральную нервную систему.
Вызывает кислородное голодание организма за счет образования метагемоглобина, гемолиза и дегенеративных изменений эритроцитов.
При отравлении наблюдается слабость, головная боль, тошнота, посинение губ, ногтей, ушных раковин, учащение пульса.
в воздухе 3мг на кубометр, в воде 0,1 мг на литр.
Это вещество может быть опасным для окружающей среды; особое внимание должно быть уделено рыбам и ракообразным. Опасное загрязнение воздуха будет достигаться довольно медленно при испарении этого вещества при 20°C; при распылении, однако, гораздо быстрее.
Симптомы отравления анилином
Посинение губ или ногтей.
Посинение кожи. Головная боль.
дыхание. Потливость Судороги.
Сердцебиение. Рвота. Слабость.
Первая помощь при отравлении анилином
Вывести пострадавшего из очага отравления.
Давать вдыхать кислород. Обливать теплой водой.
Ввести антидот ( метиленовая синь).
Дать сердечно-сосудистые средства, обеспечить покой.
Анилин классифицирован как опасный груз класса 6, подкласса 6.1 по ГОСТ 19433-88. Специальные инструкции по обращению с продуктом приведены в паспорте безопасности на анилин и международной карте безопасности ICSC: 0011.
Список использованных первоисточников
Подобные документы
Ацетилен: история открытия, физические характеристики, структурная формула. Характеристика класса органических соединений. Характерные химические реакции и области применения вещества. Воздействие ацетилена на человеческий организм и окружающую среду.
контрольная работа [251,6 K], добавлен 15.07.2014
История открытия йода. Потребность организма в этом элементе. Симптомы его нехватки: повышенная раздражительность, чувство разбитости по утрам. Продукты богатые его содержанием. Симптомы отравления препаратами йода. Схема круговорота вещества в природе.
презентация [899,9 K], добавлен 10.03.2011
Методы получения ароматических аминов: первичные, вторичные, третичные. Физические и химические свойства ароматических аминов. Галогенирование анилина свободными галогенами. Гидрирование анилина в присутствии никеля. Отдельные представители аминов.
реферат [278,6 K], добавлен 05.10.2011
Определение альдегидов (органических соединений). Их строение, структурная формула, номенклатура, изомерия, физические и химические свойства. Качественные реакции (окисление) и формулы получения альдегидов. Применение метаналя, этаналя, ацетона.
презентация [361,6 K], добавлен 17.05.2011
Характеристика алкалоидов как класса органических соединений, история открытия их отдельных представителей. Механизм образования алкалоидов, биосинтез некоторых гетероциклических оснований. Пути выделения алкалоидов в растениях и установление структуры.
Анилин — это органическое соединение, содержащее ароматическое ядро и аминогруппу, соединенную с ним. Его также иногда называют фениламином или аминобензолом. Представляет собой маслянистую жидкость, не имеющую цвета, но с характерным запахом. Сильно ядовит.
Получение
Анилин — очень полезное промежуточное вещество, поэтому производится он в относительно больших масштабах. Промышленный синтез начинается с бензола. Его нитруют при температуре 60 °C смесью концентрированных серной и азотной кислот. Далее полученный нитробензол восстанавливают водородом при температуре около 250 °C, используя катализаторы. Также может применяться повышенное давление.

В лаборатории восстановление может производится водородом в момент его выделения. Для этого в реакционной смеси проводят взаимодействие металлического цинка или железа с кислотой. Полученный атомарный водород вступает во взаимодействие с нитробензолом.
Получать анилин можно в одну стадию, если проводить взаимодействие бензола со смесью азида натрия и хлорида алюминия. Реакция длится 12 часов. Выход такой реакции составляет 63 %.
Физические свойства
Как уже было отмечено выше, анилин — это бесцветная маслянистая жидкость. При температуре -5,9 °C он замерзает. Кипит при 184,4 °C. Плотность почти как у воды (1,02 г/см3). Анилин растворим в воде, хотя довольно слабо. Зато он смешивается в любых соотношениях с различными органическими растворителями: бензолом, толуолом, ацетоном, диэтиловым эфиром, этанолом и многими другими.
Химические свойства
Химические свойства анилина довольно разнообразны. Например, он проявляет как кислотные, так и основные свойства. Последние обусловлены тем, что аминогруппа может присоединять к себе ион водорода (протон). Отсюда и название этого процесса — протонирование. Благодаря этому анилин может взаимодействовать с кислотами, образуя соли:
Кислотные свойства объясняются тем, что атомы водорода в аминогруппе легко отщепляются и замещаются другими атомами. Так, анилин может взаимодействовать со щелочными металлами. Реакция с калием идет без катализаторов, с натрием необходимо присутствие катализаторов: меди, никеля, кобальта или солей этих металлов. Идти эта реакция может и с кальцием, но в этом случае необходимо нагревание до 200 °C.

Замещается водород и радикалами. Это происходит при взаимодействии анилина со спиртами. Реакция проводится в кислой среде, так как необходимо протонирование аминогруппы. Температура реакционной смеси должна поддерживаться около 220 °C. Иногда применяется повышенное давление. Конечный продукт содержит моно-, ди- и тризамещенные производные анилина. Поэтому для получения чистого вещества необходимо использовать очистку, например перегонку.

Алкилирование можно также проводить, используя алкилгалогениды. Здесь также может быть получены несколько продуктов.

Анилин может вступать в реакции и по ароматическому ядру. Обычно это реакции электрофильного замещения (нитрование, сульфирование, алкилирование, ацилирование). Аминогруппа активирует бензольное ядро, поэтому новые группы встают в пара-положение. Галогенирование происходит очень легко. В данном случае замещаются все атомы водорода в ядре.
Как видно из уравнений реакций, химические свойства анилина довольно разнообразные. Здесь указаны далеко не все.
Применение
Из-за своих физических и химических свойств, анилин в чистом виде применяется только в лабораториях, как реагент или органический растворитель. В промышленности весь анилин уходит на синтез более сложных и полезных соединений. Например, фосфат анилина применяется как ингибитор (замедлитель) коррозии углеродистых сталей.
Большая доля анилина идет на производство полиизоцианатов, из которых, в свою очередь, получают полиуретаны. Это органический полимер, который используют во многих отраслях промышленности для изготовления эластичных форм, защитных покрытий, лаков, герметиков.
7 % анилина применяется в качестве добавки для полимеров. Это может быть как чистый анилин, так и соединения, полученные из него. Они оказывают роль инициаторов, стабилизаторов, пластификаторов, порообразователей, вулканизаторов или ускорителей полимеризации. Такое разнообразие достигается благодаря специфичным химическим свойствам анилина.
Азотсодержащие органические вещества часто применяют в производстве красителей. Анилин не стал исключением. Из него напрямую синтезируют более 150 различных красителей, еще больше — из его производных. Самые важные из них — это анилиновый черный, пигмент глубоко-черный, нигрозины, индулины и азокрасители.
Токсичность
Анилин — токсичное вещество. Попадая в кровь, он образует соединения, которые вызывают кислородное голодание. Проникать в организм он может также и в виде паров, через кожу или слизистые оболочки. Признаками отравления анилином служат слабость, головокружение, головная боль. При более сильном отравлении возникает тошнота, рвота, а также учащение пульса.
Это вещество оказывает губительное воздействие на нервную систему. При хроническом отравлении может возникать снижение памяти, расстройства сна, а также психические нарушения.
Первая помощь при интоксикациии состоит в том, чтобы убрать источник отравления и омыть пострадавшего теплой водой. Это поможет растворить анилин, который осел на коже пострадавшего. Существуют и специальные антидоты. Их вводят в организм при тяжелых случаях.
Анилин – это соединение, которое относят к органическим веществам. Принадлежит к классу аминов. Чтобы понять, что такое амины, можно представить формулу аммиака, затем один атом водорода или все заменить углеводородным радикалом.
Анилин (фениламин) — понятие, строение, физические свойства
Если в формуле аммиака только один водородный атом заменить фенил радикалом, получится анилин (фениламин). Поэтому его можно считать производным аммиака. Вещество называют также аминобензол.

Можно иначе представить это соединение. Если в формуле бензола вместо одного водорода поставить аминогруппу, получается анилин. Значит это производная бензола, где атом водорода замещается на аминогруппу.
Эмпирическая (молекулярная) формула фениламина C6H5 NH2. Его записывают с помощью структурной формулы:
Аминобензол содержит две группы атомов: аминогруппу и фенил радикал. Они оказывают влияние на свойства вещества.
Аминогруппа NH2– состоит из атома азота и двух атомов водорода. У азота на внешнем энергетическом уровне содержится 5 электронов. Два электрона образуют химическую связь с атомами углерода, один электрон образует связь с углеродом фенил радикала. У него еще остаётся два электрона. Они образуют свободную пару электронов.
Аминогруппа в составе анилина может присоединять протон водорода. Поэтому соединение проявляет свойства оснований. Так как по определению, вещества, присоединяющие протон водорода, принято считать основаниями.
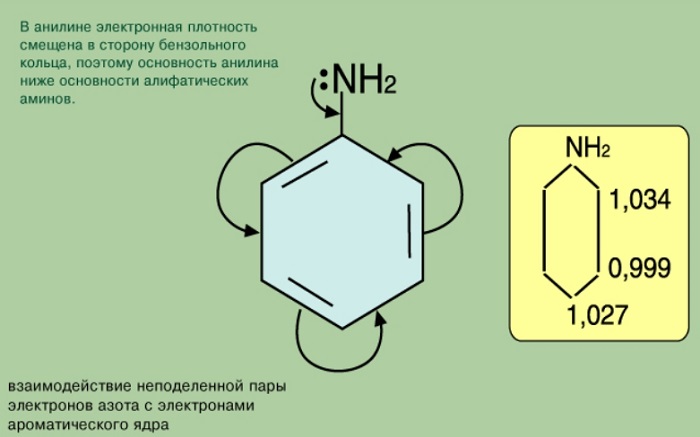
Фенил радикал C6H5 – имеет в своём составе бензольное кольцо. Благодаря этому фениламин должен вступать в реакции, характерные для бензола.
Так как 2 группы атомов находятся в одном соединении, они оказывают влияние друг на друга.
Фенил радикал, влияя на функциональную группу, вовлекает свободную пару электронов в π - электронную систему. Такое смещение плотности влияет на проявление свойств соединения как основания. В результате фениламин не вступает во взаимодействие с водой. Аммиак, таким образом, более сильное основание.
Функциональная группа влияет на π - систему. Нарушается равномерное распределение электронной плотности. Она повышается у атомов 2,4,6 (в орто - и пара - положениях). Именно здесь будет идти замена водорода на другие атомы в химических реакциях.
Фениламин - это жидкость, маслянистая и ограниченно растворяющаяся в воде. Растворяется в органических соединениях.

Кипит при температуре 184 0 С, замерзает при температуре –6 0 С. При окислении окрашивается в красно-бурый цвет. Молярная масса 93 г/моль. Плотность вещества при 20 0 С составляет 1,02173 г/см 3 .
Вещество ядовито. Его относят ко второму классу опасности. При контакте с кожей может вызвать аллергию. При попадании в организм вызывает отравление. Есть информация о том, что оно может вызвать генетические мутации, возникает риск возникновения раковых заболеваний. Его называют ядом крови, так как вызывает кислородное голодание.
Получение анилина

Проводят взаимодействие железа с нитробензолом в присутствии соляной кислоты.
Идёт восстановление нитробензола до анилина. Синтез можно представить уравнениями реакций:
Fe + 2HCl = FeCl2 + 2H

При взаимодействии анилина с галогеналканами и спиртами получают смесь вторичных, а также третичных аминов. Такое превращение носит название алкилирование.

Химические свойства анилина
Для вещества характерны две группы свойств.

Реакции, идущие за счет функциональной группы.
Фениламин взаимодействует с кислотами. В результате образуются соли. При взаимодействии анилина с хлороводородной кислотой получается хлорид фениламмония, или анилин солянокислый:

Свойства, идущие за счёт фенил радикала.
Для фениламина характерна реакция замещения, например бромирование. В результате получают 2,4,6 триброманилин. Образуется осадок белого цвета, поэтому реакцию считают качественной на обнаружение данного вещества.
Уравнение реакции с бромом выглядит следующим образом:

Нитрование, при котором происходит замещение в кольце ароматических аминов:
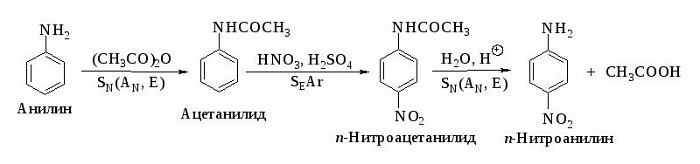
Вступает во взаимодействие с азотной кислотой, образуя тринитроанилин.

Применение анилина
Большая часть фениламина идёт для синтеза красителей. Его используют в получении типографской краски и синтетических красителей для текстильной промышленности.
Так в кислой среде анилин окисляется дихроматом калия, в результате получается чёрный краситель. Эта реакция также рассматривается как качественная на фениламин:

Вещество является исходным для получения лекарственных препаратов. Сульфаниламидные соединения, получаемые на основе анилина, используют в медицине в качестве лекарств. Это производные анилина. К ним относятся: парацетамол, фенацетин и другие.
Также на основе соединения производят химические средства защиты растений, различные смолы, крем для обуви, взрывчатые вещества.

Вещество относится к простейшим ароматическим аминам. Его формула C6H5NH2.
Физические свойства анилина
Ядовитое вещество, пары которого токсичны. Представляет собой маслянистую жидкость, не имеющую цвета. Запах слабый, характерный именно для этого вещества. При его возгорании пламя яркое, коптящее.
Частично растворим в воде (при температуре кипения растворимость 6,4 %). Минерализованная вода понижает его растворимость, за исключением содержания бромидов лития и цезия, а также йодида цезия. Последний, наоборот, повышает растворимость анилина.
Ниже приведены характеристики анилина при нормальном атмосферном давлении:
- температура кипения - 184,4 °С;
- температура плавления/замерзания – минус 5,89 °С;
- плотность при температуре 20 °С - 1,02 г/см куб.;
- температура самовоспламенения на воздухе - 562 °C;
- температура вспышки на воздухе – 79 °C.
Основные области применения анилина
В России вещество в основном применяют для синтеза красителей и лекарственных средств, в текстильной и фармацевтической промышленности. С помощью анилина получают препараты группы сульфамидов, обладающие антибактериальным действием, а также синтезируют заменители сахара.
Существуют и другие области применения аниолина. В химии его используют для получения гидрохинона – вещества, использующегося в косметике, в основном в составе отбеливающих кожу средств. Также вещество применяется в создании взрывчатых веществ, клеев, герметиков.
При помощи анилина замедляется коррозия металлов: его фосфаты добавляют к растворам сильных электролитов, в результате чего ингибируется коррозия углеродистой стали.
Применяют анилин и для повышения антидетонационности топлива (автомобильного, ракетного, авиационного). Октановое число бензина при однопроцентном содержании анилина повышается на 3 единицы и более. Но в чистом виде вещество стараются не использовать, так как при длительном хранении понижается качество бензина с анилином, а также токсичность его газов. Чаще используются производные вещества. В ряде западных государств существуют ограничения на применение анилина в составе топлива.
В мире большая часть получаемого анилина используется в производстве полиуретанов, а также синтетических каучуков, красок, средств от сорняков.
Анилиновые красители
Самой главной сферой применения анилина было и остается производство красителей. Они изготовляются при помощи окисления анилина и его солей.

Первоначально анилиновые краски выпускались только в форме порошка. В СССР им находили применение в быту, реставрируя и переделывая вещи посредством их окраски. Но покрашенные вещи быстро блёкли при попадании солнечного света, краска вымывалась в процессе стирки. В настоящее время анилиновые красители производятся и в форме растворов, причем некоторые производители выпускают концентрированные растворы, которые в отличие от порошков не требуют особой подготовки ткани. Но, несмотря на ощутимый прогресс и улучшение красителей, ткани, покрашенные ими, по-прежнему быстро выгорают на солнце.
Токсичность анилина
Анилин - токсичное вещество. Может угнетать нервную систему, при попадании в кровь вызывает кислородное голодание тканей. Попасть в организм может в виде паров, а также проникнуть через кожу и слизистые оболочки.

Сейчас отравления анилином бывают редко. Опасность это вещество представляет в основном для тех, кто работает с ним. Во избежание попадания токсина в организм нужно соблюдать установленные меры безопасности. При окрашивании дома вещей анилиновыми красителями, в особенности порошковыми, нужно беречь их от детей, проветривать помещение, в котором производится окраска, не глотать вещество, при попадании на части тела немедленно смывать его водой и производить окрашивание в перчатках. Если анилин был случайно проглочен, нужно незамедлительно обращаться к врачу.
Читайте также:

