Анализ качественных признаков реферат
Обновлено: 30.06.2024
Качественный анализ имеет своей целью обнаружение определенных веществ или их компонентов в анализируемом объекте. Обнаружение проводится путем идентификации веществ, то есть установления тождественности (одинаковости) АС анализируемого объекта и известных АС определяемых веществ в условиях применяемого метода анализа. Для этого данным методом предварительно исследуют эталонные вещества (гл. 2.1), в которых наличие определяемых веществ заведомо известно. Например, установлено, что присутствие спектральной линии с длиной волны 350,11 нм в эмиссионном спектре сплава, при возбуждении спектра электрической дугой, свидетельствует о наличии в сплаве бария; посинение водного раствора при добавлении к нему крахмала является АС на присутствие в нем I2 и наоборот.
Качественный анализ всегда предшествует количественному.
В настоящее время качественный анализ выполняют инструментальными методами: спектральными, хроматографическими, электрохимическими и др. Химические методы используют на отдельных стадиях инструментальных (вскрытие пробы, разделение и концентрирование и др.), но иногда с помощью химического анализа можно получить результаты более просто и быстро, например, установить наличие двойных и тройных связей в непредельных углеводородах при пропускании их через бромную воду или водный раствор KMnO4 . При этом растворы теряют окраску.
Детально разработанный качественный химический анализ позволяет определять элементный (атомный), ионный, молекулярный (вещественный), функциональный, структурный и фазовый составы неорганических и органических веществ.
При анализе неорганических веществ основное значение имеют элементный и ионный анализы, так как знание элементного и ионного состава достаточно для установления вещественного состава неорганических веществ. Свойства органических веществ определяются их элементным составом, но также и структурой, наличием разнообразных функциональных групп. Поэтому анализ органических веществ имеет свою специфику.
Качественный химический анализ базируется на системе химических реакций, характерных для данного вещества - разделения, отделения и обнаружения.
К химическим реакциям в качественном анализе предъявляют следующие требования.
1. Реакция должна протекать практически мгновенно.
2. Реакция должна быть необратимой.
3. Реакция должна сопровождаться внешним эффектом (АС):
а) изменением окраски раствора;
б) образованием или растворением осадка;
в) выделением газообразных веществ;
г) окрашиванием пламени и др.
4. Реакция должна быть чувствительной и по возможности специфичной.
Для качественного химического анализа используют все известные типы реакций: кислотно-основные, окислительно-восстановительные, осаждения, комплексообразования и другие.
Качественный анализ растворов неорганических веществ сводится к обнаружению катионов и анионов. Для этого используют общие и частные реакции. Общие реакции дают сходный внешний эффект (АС) со многими ионами (например, образование катионами осадков сульфатов, карбонатов, фосфатов и т.д.), а частные - с 2-5 ионами. Чем меньше число ионов дают сходный АС, тем селективнее (избирательнее) считается реакция. Реакция называется специфической , когда позволяет обнаружить один ион в присутствии всех остальных. Специфической, например, на ион аммония является реакция:
Аммиак обнаруживают по запаху или по посинению красной лакмусовой бумажки, смоченной в воде и помещенной над пробиркой.
Селективность реакций можно повысить, изменяя их условия (рН) или применяя маскирование. Маскирование заключается в уменьшении концентрации мешающих ионов в растворе меньше предела их обнаружения, например путем их связывания в бесцветные комплексы.
Если состав анализируемого раствора несложен, то его после маскировки анализируют дробным способом. Он заключается в обнаружении в любой последовательности одного иона в присутствии всех остальных с помощью специфических реакций, которые проводят в отдельных порциях анализируемого раствора. Поскольку специфических реакций немного, то при анализе сложной ионной смеси используют систематический способ. Этот способ основан на разделении смеси на группы ионов со сходными химическими свойствами путем перевода их в осадки с помощью групповых реактивов, причем групповыми реактивами воздействуют на одну и ту же порцию анализируемого раствора по определенной системе, в строго определенной последовательности. Осадки отделяют друг от друга (например, центрифугированием), затем растворяют определенным образом и получают серию растворов, позволяющих в каждом обнаружить отдельный ион специфической реакцией на него.
Существует несколько систематических способов анализа, называемых по применяемым групповым реактивам: сероводородный, кислотно-основный, аммиачно-фосфатный и другие. Классический сероводородный способ основан на разделении катионов на 5 групп путем получения их сульфидов или сернистых соединений при воздействии H2 S, (NH4 )2 S, NaS в различных условиях.
Более широко применяемым, доступным и безопасным является кислотно-основный метод, при котором катионы разделяют на 6 групп (табл. 1.3.1.). Номер группы указывает на последовательность воздействия реактивом.
Таблица 1.3.1
Классификация катионов по кислотно-основному способу
| Номер группы | Катионы | Групповой реактив | Растворимость соединений |
| I | Ag + , Pb 2+ , Hg2 2+ | 2MHCl | Хлориды нерастворимы в воде |
| II | Ca 2+ , Sr 2+ , Ba 2+ | 1MH2 SO4 | Сульфаты нерастворимы в воде |
| III | Zn 2+ , Al 3+ , Cr 3+ , Sn 2+ , Si 4+ , As | 4MNaOH | Гидроксиды амфотерны, растворимы в избытке щелочи |
| IV | Mg 2+ , Mn 2+ , Fe 2+ , Fe 3+ , Bi 3+ , Sb 3+ , Sb 5+ | 25 %-й NH3 | Гидроксиды нерастворимы в избытке NaOH или NH3 |
| Номер группы | Катионы | Групповой реактив | Растворимость соединений |
| V | Co 2+ , Ni 2+ , Cu 2+ , Cd 2+ , Hg 2+ | 25 %-й NH3 | Гидроксиды растворяются в избытке NH3 с образованием комплексных соединений |
| VI | Na + , K + , NH4 + | Нет | Хлориды, сульфаты, гидроксиды растворимы в воде |
Анионы при анализе в основном не мешают друг другу, поэтому групповые реактивы применяют не для разделения, а для проверки наличия или отсутствия той или иной группы анионов. Стройной классификации анионов на группы не существует.
Наиболее простым образом их можно разделить на две группы по отношению к иону Ba 2+ :
а) дающие хорошо растворимые соединения в воде: Cl - , Br - , I - , CN - , SCN - , S 2- , NO2 2- , NO3 3- , MnO 4- , CH3 COO - , ClO4 - , ClO3 - , ClO - ;
Качественный химический анализ органических веществ подразделяют на элементный , функциональный , структурный и молекулярный .
Анализ начинают с предварительных испытаний органического вещества. Для твердых измеряют tплав. , для жидких - tкип или , показатель преломления. Молярную массу определяют по понижению tзамерз или повышению tкип , то есть криоскопическим или эбулиоскопическим методами. Важной характеристикой является растворимость, на основе которой существуют классификационные схемы органических веществ. Например, если вещество не растворяется в Н2 О, но растворяется в 5%-ном растворе NaOH или NaHCO3 , то оно относится к группе веществ, в которую входят сильные органические кислоты, карбоновые кислоты с более чем шестью атомами углерода, фенолы с заместителями в орто- и параположениях, -дикетоны.
Таблица 1.3.2
Реакции для идентификации органических соединений
| Тип соединения | Функциональная груп-па, участвующая в реакции | Реагент |
| Альдегид | С = О | а) 2,4 - динитрофенилгидрозид б) гидрохлорид гидроксиламина в) гидросульфат натрия |
| Амин | - NH2 | а) азотистая кислота б) бензолесульфохлорид |
| Ароматический углеводород | Азоксибензол и хлорид алюминия | |
| Кетон | С = О | См. альдегид |
| Ненасыщенный углеводород | - С = С - - С ≡ С - | а) раствор KMnO4 б) раствор Вr2 в СCL4 |
| Нитросоединение | - NO2 | а) Fe(OH)2 (соль Мора + КОН) б) цинковая пыль + NH4 Clв) 20% раствор NaOH |
| Спирт | (R) - OH | а) (NH4 )2 [Ce(NO3 )6 ] б) раствор ZnCl2 в HCl в) йодная кислота |
| Фенол | (Ar) - OH | a) FeCl3 в пиридине б) бромная вода |
| Эфир простой | (R΄)- OR | а) йодоводородная кислота б) бромная вода |
| Эфир сложный | (R΄) - COOR | а) раствор NaOH (или КОН) б) гдрохлорид гидроксиламина |
Элементным анализом обнаруживают элементы, входящие в молекулы органических веществ (C, H, O, N, S, P, Cl, и др.). В большинстве случаев органическое вещество разлагают, продукты разложения растворяют и в полученном растворе определяют элементы как в неорганических веществах. Например, при обнаружении азота пробу сплавляют с металлическим калием, получая KCN, который обрабатывают FeSO4 , переводят в K4 [Fe(CN)6 ]. Добавляя к последнему раствор ионов Fe 3+ , получают берлинскую лазурь Fe4 [Fe(CN)6 ]3 - (AC на присутствие N).
Функциональным анализом определяют тип функциональной группы. Например, реакцией с (NH4 )2 [Ce(NO3 )6 ] можно обнаружить спирт, а с помощью раствора KMnO4 отличить первичные, вторичные и третичные спирты. Первичные KMnO4 окисляет до альдегидов обесцвечиваясь, вторичные окисляет до кетонов, образуя MnO2 , а с третичными не реагирует (табл. 1.3.2).
Структурным анализом устанавливают структурную формулу органического вещества или ее отдельные структурные элементы (двойные и тройные связи, циклы и так далее).
Молекулярным анализом устанавливают целиком вещество. Например, фенол можно обнаружить реакцией с FeCl3 в пиридине. Чаще молекулярный анализ сводится к установлению полного состава соединения на основании данных об элементном, функциональном и структурном составе вещества. В настоящее время молекулярный анализ проводят в основном инструментальными методами.
При проведении расчета результатов анализа необходимо очень внимательно выполнять вычисления. Математическая погрешность, допущенная в числовых значениях, равносильна ошибке в анализе.
Числовые значения подразделяют на точные и приближенные. К точным, например, можно отнести число выполненных анализов, порядковый номер элемента в таблице Менделеева, к приближенным - измеренные значения массы или объема.
Значащими цифрами приближенного числа называют все его цифры, кроме нулей, стоящих слева от запятой, и нулей, стоящих справа после запятой. Нули, стоящие в середине числа, являются значащими. Например, в числе 427,205 - 6 значащих цифр; 0,00365 - 3 значащие цифры; 244,00 - 3 значащие цифры.
Точность вычислений определяется ГОСТ, ОСТ или ТУ на анализ. Если погрешность вычислений не оговорена заранее, то следует иметь в виду, что концентрация вычисляется до 4-ой значащей цифры после запятой, масса - до 4-го десятичного знака после запятой, массовая доля (процентное содержание) - до сотых долей.
Каждый результат анализа не может быть точнее, чем это позволяют измерительные приборы (поэтому в массе, выраженной в граммах, не может быть больше 4-5 знаков после запятой, т.е. больше точности аналитических весов 10 -4 -10 -5 г).
Лишние цифры округляют по следующим правилам.
1. Последнюю цифру, если она 4, отбрасывают, если 5, добавляют единицу к предыдущей, если равна 5, а перед ней четная цифра, то добавляют единицу к предыдущей, а если нечетная, то отнимают (например, 12,465 12,46; 12,475 12,48).
2. В суммах и разностях приближенных чисел сохраняют столько десятичных знаков, сколько их было в числе с наименьшим их числом, а при делении и умножении - столько, сколько требуется для данной измеряемой величины (например при вычислении массы по формуле

, несмотря на то, что V измеряют до сотых, результат должен быть вычислен до 10 -4 -10 -5 г).
3. При возведении в степень в результате брать столько значащих цифр, сколько их было у возводимого в степень числа.
4. В промежуточных результатах брать на одну десятичную цифру больше, чем по правилам округления, а для оценки порядка вычислений округлять все числа до первой значащей.
Математическая обработка результатов анализа
На любом из перечисленных этапов количественного анализа могут быть допущены и, как правило, допускаются погрешности, поэтому, чем меньшее число этапов имеет анализ, тем точнее его результаты.
Погрешностью измерения называют отклонение результата измерений x i от истинного значения измеряемой величины .
Разность хi - =∆хi называется абсолютной погрешностью , а отношение (∆хi /)100% называется относительной погрешностью .
Погрешности результатов количественного анализа подразделяют на грубые (промахи), систематические и случайные . На их основе проводят оценку качества полученных результатов анализа. Параметрами качества являются их правильность, точность, воспроизводимость и надежность.
Результат анализа считается правильным , если у него нет грубой и систематической погрешности, а если, кроме того, случайная погрешность сведена к минимуму, то точным, соответствующим истинному. Для получения точных результатов измерения количественные определения повторяют несколько раз (обычно нечетное).
Грубыми погрешностями ( промахами) называются те, которые приводят к резкому отличию результата повторного измерения от остальных. Причинами промахов являются грубые оперативные ошибки аналитика (например потеря части осадка при его фильтровании или взвешивании, неправильное вычисление или запись результата). Промахи выявляют среди серии результатов повторных измерений, как правило, с помощью Q-критерия. Для его расчета результаты выстраивают в ряд по возрастанию: х1 , х2 , х3 ,…хn-1 , хn . Сомнительным обычно является первый или последний результат в этом ряду.
Q-критерий вычисляют как отношение взятой по абсолютной величине разности сомнительного результата и ближайшего к нему в ряду к разности последнего и первого в ряду. Разность хn - х1 называют размахом варьирования.

Например, если сомнителен последний результат в ряду, то
Для выявления промаха рассчитанное для него Q сравнивают с табличным критическим значением Qтабл , приведенным в аналитических справочниках. Если Q Qтабл , то сомнительный результат исключают из рассмотрения, считая промахом. Промахи должны быть выявлены и устранены.
Систематическими погрешностями считают те, которые приводят к отклонению результатов повторных измерений на одну и ту же только положительную или отрицательную величину от истинного значения. Их причиной может быть неправильная калибровка измерительных приборов и инструментов, примеси в применяемых реактивах, неправильные действия (например, выбор индикатора) или индивидуальные особенности аналитика (например, зрение). Систематические погрешности могут и должны быть устранены. Для этого используют:
1) получение результатов количественного анализа несколькими различными по природе методами;
2) отработку методики анализа на стандартных образцах, т.е. материалах, содержание определяемых веществ, в которых известно с высокой точностью;
Случайные погрешности - это те, которые ведут к незначительным отклонениям результатов повторных измерений от истинного значения по причинам, возникновение которых выяснить и учесть невозможно (например колебания напряжения в электросети, настроение аналитика и т.п.). Случайные погрешности вызывают разброс результатов повторных определений, проведенных в идентичных условиях. Разброс определяет воспроизводимость результатов, т.е. получение одинаковых или близких результатов при повторных определениях. Количественной характеристикой воспроизводимости является стандартное отклонение S, которое находят методами математической статистики. Для небольшого числа измерений (малой выборки) при n =1-10

.
Выборной называют совокупность результатов повторных измерений. Сами результаты называют вариантами выборки . Совокупность результатов бесконечно большого числа измерений (в титровании n30) называют генеральной выборкой , а вычисленное по ней стандартное отклонение обозначают . Стандартное отклонение S() показывает, на какую в среднем величину отклоняются результаты n измерений от среднего результата xили истинного.
Типы качественных признаков
l Качественные признаки делятся на два типа: ранговые и номинальные.
l Ранговые признаки представлены категориями, для которых можно указать порядок, т.е. они сравнимы по принципу "больше-меньше" или "лучше-хуже".
l Номинальные признаки представлены категориями, для которых не определен никакой другой способ сравнения, кроме как буквальное совпадение или несовпадение.
Прикрепленные файлы: 1 файл
биостат.doc
АНАЛИЗ ВЗАИМОСВЯЗЕЙ КАЧЕСТВЕНН ЫХ ПРИЗНАКОВ
Типы качественных признаков
l Качественные признаки делятся на два типа: ранговые и номинальные.
l Ранговые признаки представлены категориями, для которых можно указать порядок, т.е. они сравнимы по принципу "больше-меньше" или "лучше-хуже".
l Номинальные признаки представлены категориями, для которых не определен никакой другой способ сравнения, кроме как буквальное совпадение или несовпадение.
Взаимосвязь ранговых признаков
l Меры взаимосвязи между парой ранговых признаков, каждый из которых ранжирует изучаемую совокупность объектов, называются в статистике коэффициентами ранговой корреляции.
l Эти коэффициенты строятся так, чтобы выполнялись следующие свойства:
- Если ранжированные ряды по обоим признакам полностью совпадают, то коэффициент ранговой корреляции равен +1, что означает полную положительную корреляцию.
- Если объекты в обоих рядах расположены в противоположном порядке, коэффициент равен –1, что означает полную отрицательную корреляцию.
- Нулевое значение коэффициента означает отсутствие соответствия между ранжированными рядами.
- В остальных ситуациях значения коэффициента заключены в интервале [–1, +1]; при этом возрастание абсолютного значения коэффициента корреляции от 0 до 1 характеризует увеличение соответствия между двумя ранжированными рядами.
- Коэффициенты ранговой корреляции
- Указанными свойствами обладают наиболее известные коэффициенты ранговой корреляции: Спирмена r и Кендалла t.
- Формулы для этих коэффициентов различаются, но дают достаточно близкие значения, хотя коэффициент Кендалла дает более осторожную оценку корреляции, чем коэффициент Спирмена (числовое значение t всегда меньше, чем значение r).
- Ранжирование объектов
l При ранжировании иногда возникает ситуация, когда два (или больше) объектов получают одинаковые ранги (такие объекты называют связанными). В этом случае ранг связанных объектов берется равным среднему значению тех рангов, которые имели бы эти объекты, если бы они были различны.
l Например, если связанными оказались 3-й,
4-й и 5-й объекты в ранжированном ряду, то каждому из них приписывается ранг 4.
Коэффициены Спирмена и Кендалла. Значимость
l Проверка значимости коэффициентов ранговой корреляции проходит по той же схеме, что и проверка значимости коэффициентов регрессии.
l Вычисляется величина t- статистики (для коэффициента Кендалла она обозначена z) и соответствующий ей уровень значимости p (вероятность ошибки, т.е. получения в выборке таких коэффициентов при отсутствии корреляции в генеральной совокупности).
l Если значение t (или z) достаточно велико, а вероятность p, соответственно, достаточно мала, коэффициент ранговой корреляции можно считать статистически значимым, т.е. гипотеза об отсутствии корреляции (т.е. о независимости признаков) должна быть отклонена.
l На практике чаще всего применяется уровень значимости 0,05 (или 5%). Этому уровню соответствуют значения t, которые по модулю больше 2.
Применение ранговой корреляции
l Коэффициенты ранговой корреляции могут использоваться не только для анализа взаимосвязи двух ранговых признаков, но и при определении силы связи между ранговым и количественным признаками.
l В этом случае значения количественного признака упорядочиваются и им приписываются соответствующие ранги.
Взаимосвязь номинальных признаков
l В статистическом анализе существуют различные методы, позволяющие изучать взаимосвязи номинальных признаков.
l Наиболее популярным из них является метод построения таблиц сопряженности (кросс- табуляция).
l Таблицей сопряженности называется прямоугольная таблица, по строкам которой указываются категории одного признака, а по столбцам – категории другого.
l Каждый объект совокупности попадает в какую-либо из клеток этой таблицы в соответствии с тем, к какой категории он относится по каждому из двух признаков.
l Таким образом, в клетках таблицы стоят числа, представляющие собой частоты совместной встречаемости категорий двух признаков (например, число людей, принадлежащих конкретной социальной группе и при этом входящих в определенную партию).
l В зависимости от характера распределения этих частот внутри таблицы можно судить о том, существует ли связь между признаками.
l Что означает связь между признаками?
l В данном примере: что означает связь между социальным статусом и партийной принадлежностью?
l Видимо, в этом случае о существовании связи свидетельствовало бы наличие определенных политических пристрастий у членов разных социальных групп.
l Формально говоря, связь номинальных признаков понимается как более частая (или наоборот, более редкая) совместная встречаемость отдельных комбинаций категорий по сравнению с ожидаемой встречаемостью – ситуацией чисто случайного распределения объектов по категориям двух признаков.
l Например, о связи между социальным статусом и партийной принадлежностью может свидетельствовать более высокая доля крестьян в партии трудовиков по сравнению с долей крестьян среди всех депутатов Думы (или же более высокая доля трудовиков среди крестьян по сравнению с долей трудовиков во всей Думе).
l Аналогично: о связи между социальным статусом и партийной принадлежностью может свидетельствовать более высокая доля дворян в партии кадетов по сравнению с долей дворян среди всех депутатов Думы (или же более высокая доля кадетов среди дворян по сравнению с долей кадетов во всей Думе).
l В приведенной таблице представлены данные для 378 депутатов; среди них 80 человек (т.е. 21% – см. последнюю строку таблицы) принадлежат фракции трудовиков.
l Если бы распределение по фракциям не зависело от социального происхождения, то доля фракции трудовиков среди крестьян, дворян и т.д. составляла бы 21% численности каждой из этих групп.
Например, из общего числа крестьян в Думе (187 человек ) 21% или 40 человек "должны были бы" принадлежать фракции трудовиков.
Если же взглянуть на реальное число трудовиков-крестьян в Думе, то окажется, что их 65 человек, то есть больше, чем ожидалось.
Если подсчитать, сколько дворян принадлежало бы партии трудовиков, то окажется, что это 28 человек (21% от общего числа дворян, которых в Думе было 133).
Однако в действительности оказалось, что дворян–членов фракции трудовиков было всего трое, то есть значительно меньше, чем ожидалось бы.
Проверка гипотезы о независимости признаков
l Итак, мы собираемся проверить гипотезу о независимости фракционной принадлежности депутатов от их социального происхождения.
l Для этого надо сравнить в целом таблицу реальных частот с таблицей ожидаемых частот (т.е. частот, соответствующих гипотезе, что два изучаемых признака независимы).
l Для подсчета суммарного расхождения между таблицами по всем клеткам таблиц суммируют разности (точнее – квадраты разностей) между реальными и ожидаемыми частотами.
l Если суммарное расхождение равно нулю (таблицы совпадают), нет оснований отвергнуть гипотезу о независимости признаков.
l Наоборот – чем больше суммарное расхождение между таблицами, тем меньше вероятность принятия нулевой гипотезы о независимости признаков.
l Иначе говоря, чем больше суммарное расхождение между реальными и ожидаемыми частотами по всем клеткам таблицы сопряженности, тем менее вероятной является эта гипотеза.
l Сумма квадратов разностей реальных и ожидаемых частот по всем клеткам таблицы обозначается Хи-квадрат (X2). Распределение этой величины (как и известной нам t-статистики) хорошо изучено.
l То есть, для всех значений Хи-квадрат известна вероятность p того, что такие значения могут быть получены в выборке из генеральной совокупности, в которой величина Хи-квадрат равна нулю, т.е. признаки независимы.
l Значит, если вероятность p, соответствующая величине Хи-квадрат, достаточн о мала, это свидетельствует о том, что гипотеза о независимости признаков должна быть отклонена, т.е. связь между ними является статистически значимой.
l Как известно, в пакете Statistica по умолчанию достаточно малыми считаются значения вероятности p, меньшие 0,05 или 5%.
l В заголовке таблицы ожидаемых частот приводятся значение X2, которое равно 193,71, и соответствующее ему значение вероятности (p = 0,0000), которое практически равно нулю (и, очевидно, меньше чем 0,05).
l Это свидетельствует о том, что гипотеза о независимости признаков должна быть отклонена, т.е. связь между признаками является статистически значимой.
l В этом же заголовке приводится величина
df = 63. Это так называемое число степеней свободы (degree of freedom), от которого зависит вероятность p.
l Число степеней свободы для таблицы сопряженности равно произведению
(n – 1) (m – 1), где n и m – число строк и число столбцов этой таблицы.
Коэффициенты взаимосвязи номинальных признаков
l Итак, значимая величина Хи-квадрат является свидетельством связи между двумя признаками. Как же измерить силу этой связи?
l Ясно, что при отсутствии связи величина Хи-квадрат равна нулю, и это значение является минимальным.
l Существует ли максимальное значение для Хи-квадрат?
l К сожалению, даже тогда, когда связь между признаками является максимально сильной, т.е. когда каждому значению (категории) одного признака в точности соответствует определенная категория другого признака, нельзя заранее сказать, каким будет значение X2, т.к. эта величина не имеет общего для всех таблиц сопряженности максимального значения.
l Более того, так как Хи-квадрат зависит от числа степеней свободы, то невозможно сравнивать между собой значения этой величины для таблиц с разным числом строк и столбцов.
l Значит необходим коэффициент, который, подобно коэффициенту корреляции, имел бы фиксированный максимум в случае максимальной связи и позволял бы сравнивать между собой разные таблицы
l Одним из коэффициентов, удовлетворяющих этим требованиям, является коэффициент Крамера V.
l Базируясь на значении Хи-квадрат, коэффициент Крамера позволяет измерять силу связи между двумя номинальными признаками.
l Коэффициент Крамера принимает значения от 0 до 1, т.е. от полного отсутствия связи до максимально сильной связи.
l В нашем примере коэффициент Крамера равен 0,27, что говорит о наличии довольно слабой связи между признаками "сословное происхождение" и "партия".
Изучение основных методов качественного анализа. Специфичность и чувствительность реакций качественного анализа. Рассмотрение типов реакций, применяемых в качественном анализе. Маскирование ионов в качественном анализе. Дробные реакции обнаружения ионов.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 02.04.2017 |
| Размер файла | 30,8 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
ИНСТИТУТ ВЕТЕРИНАРНОЙ МЕДИЦИНЫ
Кафедра общей химии и экологического мониторинга
Выполнил: студент 1а группы Корепанова А.А
Проверила: Гизатуллина Юлия Абдуловна
качественный анализ реакция ион
1. Методы качественного анализа
2. Специфичность и чувствительность реакций
3. Типы реакций, используемые в качественном анализе
4. Маскирование ионов в качественном анализе
5. Дробные реакции обнаружения ионов
6. Аналитическая классификация ионов
Список использованной литературы
Аналитическая химия - установление качественного и количественного состава вещества или смеси веществ. В соответствии с этим аналитическая химия делится на качественный и количественный анализ.
Задачей качественного анализа является выяснение качественного состава вещества, т. е. из каких элементов или ионов состоит данное вещество.
При изучении состава неорганических веществ в большинстве случаев приходится иметь дело с водными растворами кислот, солей и оснований. Эти вещества являются электролитами и в растворах диссоциированы на ионы. Поэтому анализ сводится к определению отдельных ионов -- катионов и анионов.
При проведении качественного анализа можно работать с различными количествами исследуемого вещества. Имеются так называемые грамм-метод, при котором масса исследуемого вещества берется более 0,5 г (более 10 мл раствора), сантиграмм-метод (масса исследуемого вещества от 0,05 до 0,5 г, или 1--10 мл раствора), миллиграмм-метод (масса исследуемого вещества от 10 -6 г до 10 -3 г, или от 0,001 до 0,1 мл раствора) и др. Наиболее распространенным является сантиграмм-метод, или полумикрометод.
1. Методы качественного анализа
Качественный анализ имеет своей целью обнаружение определенных веществ или их компонентов в анализируемом объекте. Обнаружение проводится путем идентификации веществ, то есть установления тождественности (одинаковости) АС анализируемого объекта и известных АС определяемых веществ в условиях применяемого метода анализа. Для этого данным методом предварительно исследуют эталонные вещества, в которых наличие определяемых веществ заведомо известно. Например, установлено, что присутствие спектральной линии с длиной волны 350,11 нм в эмиссионном спектре сплава, при возбуждении спектра электрической дугой, свидетельствует о наличии в сплаве бария; посинение водного раствора при добавлении к нему крахмала является АС на присутствие в нем I2 и наоборот.
Качественный анализ всегда предшествует количественному.
В настоящее время качественный анализ выполняют инструментальными методами: спектральными, хроматографическими, электрохимическими и др. Химические методы используют на отдельных стадиях инструментальных (вскрытие пробы, разделение и концентрирование и др.), но иногда с помощью химического анализа можно получить результаты более просто и быстро, например, установить наличие двойных и тройных связей в непредельных углеводородах при пропускании их через бромную воду или водный раствор KMnO4. При этом растворы теряют окраску.
Детально разработанный качественный химический анализ позволяет определять элементный (атомный), ионный, молекулярный (вещественный), функциональный, структурный и фазовый составы неорганических и органических веществ.
При анализе неорганических веществ основное значение имеют элементный и ионный анализы, так как знание элементного и ионного состава достаточно для установления вещественного состава неорганических веществ. Свойства органических веществ определяются их элементным составом, но также и структурой, наличием разнообразных функциональных групп. Поэтому анализ органических веществ имеет свою специфику.
Качественный химический анализ базируется на системе химических реакций, характерных для данного вещества - разделения, отделения и обнаружения.
К химическим реакциям в качественном анализе предъявляют следующие требования.
1. Реакция должна протекать практически мгновенно.
2. Реакция должна быть необратимой.
3. Реакция должна сопровождаться внешним эффектом (АС):
а) изменением окраски раствора;
б) образованием или растворением осадка;
в) выделением газообразных веществ;
г) окрашиванием пламени и др.
4. Реакция должна быть чувствительной и по возможности специфичной.
2. Специфичность и чувствительность реакций
Чувствительность реакции характеризуется минимальным количеством определяемого компонента или минимальной его концентрацией в растворе, при которых с помощью данного реагента этот компонент может быть обнаружен.
Предельная концентрация Cmin -- это минимальная концентрация вещества в растворе, при которой данная реакция еще дает положительный результат. Предельное разбавление G -- величина, обратная предельной концентрации. Предельную концентрацию выражают отношением 1: G, которое показывает, в какой массе растворителя должна содержаться одна массовая часть вещества, чтобы внешний эффект был еще заметен. Например, для реакции Сu 2+ с аммиаком предельное разбавление равно 250 000 и предельная концентрация 1:250 000, что означает возможность открыть ионы меди в растворе, содержащем 1 г Сu 2+ в 250 000 г воды. Реакция считается тем чувствительнее, чем больше предельное разбавление.
Чувствительность реакции зависит от многих условий: кислотности среды, температуры, ионной силы раствора и других, поэтому каждую аналитическую реакцию следует проводить в строго определенных условиях. Если не соблюдать требуемых условий, то реакция может или совсем не пойти, или пойти в нежелательном направлении.
Аналитическая реакция, свойственная только данному иону, называется специфической реакцией. Это, например, реакция обнаружения иона NH + 4 действием щелочи в газовой камере, синее окрашивание крахмала при действии йода и некоторые другие реакции. При наличии специфических реакций можно было бы открыть любой ион непосредственно в пробе исследуемой смеси, независимо от присутствия в ней других ионов. Открытие ионов специфическими реакциями в отдельных пробах всего исследуемого раствора в произвольно выбранной последовательности называется дробным анализом.
Отсутствие специфических реакций для большинства ионов делает невозможным проведение качественного анализа сложных смесей дробным методом. Для таких случаев разработан систематический анализ. Он состоит в том, что смесь ионов с помощью особых групповых реагентов предварительно разделяют на отдельные группы.
Из этих групп каждый ион выделяют в строго определенной последовательности, а потом уже открывают характерной для него аналитической реакцией.
Реактивы, позволяющие в определенных условиях разделять ионы на аналитические группы, называются групповыми реагентами (реактивами). В основе использования групповых реагентов лежит избирательность их действия. В отличие от специфических избирательные (или селективные) реакции проходят с несколькими ионами или веществами. Например, С1---ионы образуют осадки с катионами Ag + , Hg2 2+ и Pb 2+ , следовательно, эта реакция является селективной для указанных ионов, а соляная кислота НСl может использоваться в качестве группового реагента аналитической группы, включающей эти катионы.
3. Типы реакций, используемые в качественном анализе
Пирохимические реакции. Ряд методов качественного анализа основан на проведении химических реакций, проводимых сплавлением, нагреванием на древесном угле, в пламени газовой горелки или паяльной лампы. При этом вещества окисляются кислородом воздуха, восстанавливаются оксидом углерода, атомарным углеродом пламени или древесного угля. Окисление или восстановление может привести к образованию окрашенных продуктов. Одной из наиболее употребительных пирохимических реакций является проба окрашивания пламени. Пламя окрашивается в характерный для катиона цвет. Окрашивание пламени соединениями некоторых элементов представлено в таблице.
Микрокристаллоскопические реакции - это реакции при проведении которых образуются осадки, состоящие из кристаллов характерной формы и цвета. Определяют внешнюю форму кристаллов, которые обладают определенной симметрией. Газовыделительные реакции - реакции в которых выделяются газообразные соединения. Для обнаружения отдельных газов применяют специфичные реактивы (сероводород обнаруживают ацетатом свинца - почернение, аммиак-фенолфталеином - покраснение в щелочной среде). Цветные реакции - основной тип реакций обнаружения веществ. Цвет сохраняется у всех соединений цветных катионов и анионов (манганаты, хроматы, дихроматы). Цвет может появиться и измениться в зависимости от условий под действием иона противоположного знака- например б/ц ионы йода и серебра образуют иодид серебра желто-коричневого цвета.
Открытие ионов, специфическим реакциями в отдельной пробе всего исследуемого раствора в любой последовательности называется дробным анализом. Систематический ход анализа в отличие от дробного анализа заключается в том, что смесь ионов с помощью особых реактивов предварительно разделяют на отдельные группы. Из этих групп каждый ион выделяют в определенной последовательности, а потом уже открывают характерной реакцией. Реактивы, позволяющие в определенной последовательности разделять ионы на аналитические группы, называются групповыми.
4. Маскирование ионов в качественном анализе
Многие качественные реакции являются общими для нескольких ионов, что не позволяет обнаружить их в присутствии друг друга. В этом случае применяют маскирование или удаление мешающих ионов одним из следующих способов:
Связывание мешающих ионов в комплексное соединение. Чаще всего для этой цели используют получение фторидных (Al3+, Fe3+), хлоридных (Ag+, Fe3+, Mn2+), тиоцианатных (Сu2+, Zn2+, Cd2+, Co2+, Ni2+), тиосульфатных (Pb2+, Bi3+, Cr3+, Cu2+, Ag+), аммиачных (Zn2+, Cd2+, Co2+, Ni2+), ЭДТА -- (большинство катионов) и других комплексов. Получаемый комплекс должен обладать необходимой устойчивостью, чтобы осуществить достаточно полное связывание мешающего иона. Возможность применения того или иного маскирующего реагента определяют по общей константе химической реакции с совмещенными равновесиями. При этом руководствуются прежде всего отсутствием взаимодействия определяемого иона с маскирующим реагентом и степенью маскирования мешающих ионов, исходя из которой и определяют требуемую величину константы равновесия. Большое значение константы равновесия свидетельствует о полноте связывания маскируемого нона (или о степени маскирования).
Удаление мешающих ионов в осадок. При этом руководствуются произведениями растворимости получающихся осадков и значением общей константы реакции с совмещенными равновесиями.
Часто для избирательного осаждения мешающих ионов используют малорастворимые реактивы, ПР которых меньше ПР осадка обнаруживаемых ионов и больше ПР осадков мешающих ионов. При этом обнаруживаемые ионы в силу равновесного состояния не связываются, мешающие -- выпадают в виде осадка. Подобным образом решают довольно сложные задачи избирательного удаления многих мешающих ионов. Чаще всего используют осаждение гидроксидов, карбонатов, сульфидов, сульфатов, фосфатов.
Экстракция органическими растворителями. Относится к числу широко применяемых методов удаления мешающих ионов. Экстракционному отделению подвергают соединения ионов, легко растворимые в органических растворителях. Чаще всего экстракцией удаляют ионы в виде хлоридных (Со2+, Sn2+), дитизонатных (Со2+, Ni2+, Сu2+, Zn2+, Cd2+, Hg2+), оксихинолятных (Mg2+, Са2+, Sr2+, Fe2+), диэтилдитиокарбаминатных (Mn2+, Co2+, Fe2+, Ni2+, Cu2+), купферонатных (Ва2+, Cr3+, Fe3+, Sn2+, Bi3+, Sb3+) и других комплексов. При этом используют органические растворители, не смешивающиеся с водой, -- бензол, гексан, хлороформ, высшие спирты. Экстракционное отделение осуществляют при определенном оптимальном значении рН, способствующем полной экстракции мешающих ионов.
Окисление мешающих ионов до высших степеней окисления.При этом получают ионы, не вступающие в реакцию с реагентом. Применяют для маскирования ионов Сг3+ (окисление до СгO42-), Sn2+ (окисление до Sn4+), Mn2+(окисление до МnO4- или MnO2), Fe2+ (перевод в Fe3+) и др. Окисление обычно проводят пероксидом водорода при нагревании.
Часто также используют восстановление катионов до элементного состояния или низших степеней окисления. При выборе восстановителя руководствуются значениями редокс-потенциалов Е°. Чаще всего применяют цинк, восстанавливающий в аммиачной среде катионы d-элементов (кроме Cr3+, Fe2+, Fe3+) и некоторых p-элементов (Pb2+, Sb3+, Bi3+). Иногда используют восстановители, действующие селективно. Например, элементное железо восстанавливает до металла Sb3+, Cu2+, Bi3+, переводит Sn4+ в Sn2+, хлорид олова (II) восстанавливает Fe3+ до Fе2+.
5. Дробные реакции обнаружения ионов
Дробные реакции предназначены для обнаружения ионов либо в присутствии всех остальных, либо после предварительного удаления (1 -- 2 операции), либо после маскировки мешающих ионов. Специфичных реакций, позволяющих обнаружить данный ион в присутствии всех остальных, известно немного. Поэтому многие реакции приходится проводить после предварительной обработки анализируемой пробы и маскировки или удаления катионов и веществ, мешающих определению При выборе и проведении дробных реакций обычно необходимо: подобрать наиболее специфичную реакцию обнаружения анализируемого иона; выяснить по литературным данным или экспериментально, какие катионы, анионы или другие соединения мешают обнаружению; установить специфичными реакциями присутствие мешающих ионов в анализируемой пробе; подобрать, руководствуясь табличными данными, маскирующий реагент, не вступающий в реакцию с анализируемым веществом; рассчитать полноту удаления мешающих ионов (по общей константе реакции); определить методику выполнения дробной реакции.
6. Аналитическая классификация ионов
В качественном анализе выделяют две методики проведения анализа вещества: дробный анализ и систематический анализ.
Дробный анализ основан на открытии ионов специфическими реакциями, проводимыми в отдельных порциях исследуемого раствора. Так например, ион Fe2+ можно открыть при помощи реактива К3[Fе(СN)6] в присутствии любых ионов. Так как специфических реакций немного, то в ряде случаев мешающее влияние посторонних ионов устраняют маскирующими средствами. Например, ион Zn2+ можно открыть в присутствии Fe2+ при помощи реактива (NH4)2[Hg(SCN4], связывая мешающие ионы Fe2+ гидротартратом натрия в бесцветный комплекс.
Дробный анализ имеет ряд преимуществ перед систематическим: возможность обнаруживать ионы в отдельных порциях в любой последовательности, а также экономия времени и реактивов. Однако, большинство аналитических реакций недостаточно специфично и дает сходный эффект с несколькими ионами. Специфических реакций немного и мешающее влияние многих ионов нельзя устранить маскирующими средствами. Поэтому для проведения полного анализа и получения более надежных результатов в процессе анализа приходится прибегать к разделению ионов на группы, а затем открывать их в определенной последовательности. Последовательное разделение ионов, а затем их последующее открытие и является систематическим методом анализа. Лишь некоторые ионы открывают дробным методом. Систематическим анализом называют полный анализ исследуемого объекта, осуществляемый путем разделения исходной аналитической системы на несколько подсистем (групп) в определенной последовательности на основе сходства и различий аналитических свойств компонентов системы. Систематический ход анализа основан на том, что сначала с помощью групповых реактивов смесь ионов разделяют на группы и подгруппы, а затем уже в пределах этих подгрупп обнаруживают каждый ион характерными реакциями. Групповыми реагентами действуют на смесь ионов последовательно и в строго определенном порядке. Для удобства определения в аналитической химии предложено объединять ионы в аналитические группы, дающие одинаковые или сходные эффекты (осадки) с определенными реактивами, и созданы аналитические классификации ионов (отдельно для катионов и анионов). Установление присутствия тех или иных катионов в исследуемом растворе значительно облегчает обнаружение анионов. Пользуясь таблицей растворимости, можно заранее предсказать наличие в исследуемом растворе отдельных анионов. Например, если соль хорошо растворяется в воде и в нейтральном водном растворе обнаружен катион Ва2+, то этот раствор не может содержать анионы SO42-, CO32-, SO32-. Поэтому вначале открывают катионы, присутствующие в исследуемом растворе, а затем анионы.
Для катионов практическое значение имеют две классификации: сероводородная и кислотно-основная. В основе сероводородной классификации и сульфидного (или сероводородного) метода систематического анализа лежит взаимодействие катионов с сульфидом (или полисульфидом) аммония или сероводородом. Серьёзный недостаток данного метода - использование ядовитого сероводорода, следовательно, необходимость использования специального оборудования.
Поэтому в учебных лабораториях предпочтительнее использование кислотно-основного метода систематического анализа. В основе этого метода лежит взаимодействие катионов с серной и соляной кислотой, гидроксидами натрия и аммония.
По кислотно-основной классификации катионы делят на шесть аналитических групп.
Значение аналитической химии определяется необходимостью общества в аналитических результатах, в установлении качественного и количественного состава веществ, уровнем развития общества, общественной потребностью в результатах анализа, так же и уровнем развития самой аналитической химии.
Список использованной литературы

Критерий χ 2 – это непараметрический критерий, является аналогом дисперсионного анализа для качественных признаков.
По имеющимся данным исследования строят таблицу сопряженности. Строки таблицы представляют собой сравниваемые факторы, а столбцы - возможные исходы эксперимента. Подсчитывают число объектов в каждой строке и каждом столбце. Наблюдаемые значения обозначают буквой О (observed). Таблица сопряженности выглядит следующим образом (Ri – суммы в строках таблицы, Cj – суммы в столбцах таблицы, N – общий объем исследования, r-число строк, c-число столбцов):
Далее подсчитывают с точностью до двух знаков после запятой ожидаемые числа – количество объектов, которое попало бы в каждую клетку, если бы изучаемые факторы не влияли бы на исход. Ожидаемые значения обозначают буквой E (expected). Таблица ожидаемых чисел рассчитывается следующим образом (обратите внимание, что суммы по строкам и столбцам должны сохраниться):
По полученным таблицам рассчитывается значение критерия:
где Оij – наблюдаемые значения в клетках таблицы, Еij – ожидаемые значения. Суммирование производится по всем клеткам таблицы.
Применение критерия χ 2 правомерно, если ожидаемые числа в любой из клеток больше либо равны 5.
Число степеней свободы ν=(r-1)(c-1).
В случае таблицы 2×2 в формулу вводят поправку Йейтса:
Пример. Изучение влияния дополнительного приема эстрогена на риск развития болезни Альцгеймера. В исследовании принимала участие группа из 1124 пожилых женщин, 156 из которых длительное время получали эстроген. Группа наблюдалась в течение пяти лет, регистрировались случаи болезни Альцгеймера. Результаты расчетов:
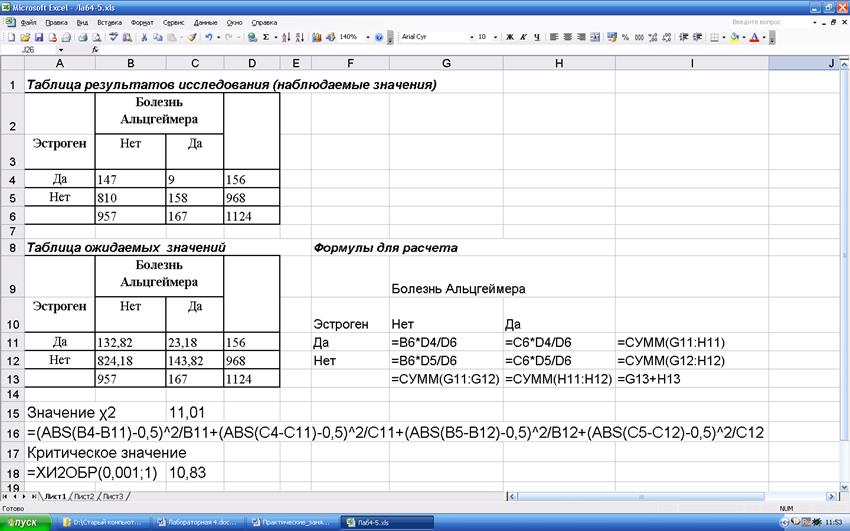
Рассчитанное значение больше критического, поэтому можем утверждать, что дополнительный прием эстрогена снижает риск развития болезни Альцгеймера (вероятность ошибки менее 0,1%).
1. Синдром внезапной детской смерти — основная причина смерти детей в возрасте от 1 недели до 1 года. Обычно смерть наступает на фоне полного здоровья незаметно, во сне, поэтому определение факторов риска имеет первостепенное значение. Исследователи собрали сведения о 18 955 детях, родившихся в одном из роддомов Окленда, штат Калифорния, с 1960 по 1967 г. Судьбу детей проследили до 1 года. От синдрома внезапной детской смерти умерли 44 ребенка. Данные о предполагаемых факторах риска представлены в таблице. Найдите признаки, связанные с риском синдрома внезапной детской смерти (два по выбору). По некоторым признакам данные отсутствуют, поэтому сумма в третьем столбце может оказаться меньше 44, а в четвертом — меньше 18955.
Читайте также:

