Зачем раствор фильтровался при кристаллизации кратко
Обновлено: 02.07.2024
При охлаждении горячего насыщенного раствора из него выделяется растворенное вещество, и чем ниже температура, до которой охлаждают раствор, тем большее количество кристаллов выпадает в осадок.
Жидкость, которую после этого можно отделить от осадка фильтрованием (так называемый маточный раствор), будет все же насыщенным при данной температуре раствором, из которого можно дополнительно выделить некоторое количество растворенного вещества или при более сильном охлаждении, или путем упаривания, т. е. удаляя некоторую часть растворителя.
Если в растворе находится не одно, а несколько различных веществ, то они могут быть разделены так называемой дробной кристаллизацией. Возможность такого разделения объясняется неодинаковой растворимостью веществ при различных температурах. При некоторой определенной температуре раствор будет насыщенным в отношении одного и ненасыщенным в отношении другого вещества. Естественно, что в то время как первое вещество станет при охлаждении выпадать в осадок, второе еще будет полностью находиться в растворе.
Указанные соображения положены в основу метода очистки кристаллических веществ путем кристаллизации.
ПРОВЕДЕНИЕ КРИСТАЛЛИЗАЦИИ
Чтобы перекристаллизовать какое-либо вещество, его растворяют в подходящем растворителе, нагретом до кипения, стараясь получить концентрированный или даже насыщенный при данной температуре раствор. Если рас* твор содержит какие-либо механические примеси или муть, его отфильтровывают через воронку для горячего фильтрования (см. выше), причем приемником может служить кристаллизатор, фарфоровая чашка, коническая колба или стакан. Если же полученный раствор совершенно прозрачен и не содержит механических примесей, фильтрование излишне н даже вредно, так как оно неизбежно связано с потерей некоторого количества кристаллизуемого вещества.
При перекристаллизации стараются получить вещество в кристаллах некоторого среднего размера (не очень крупных и не очень мелких). Крупные кристаллы обычно «одержат включения маточного раствора с находящимися в нем примесями, в результате чего перекристаллизованное вещество оказывается загрязненным. Наоборот, очень мелкие кристаллы, будучи свободными от этих включений, образуют густую кашицу; между отдельными кристаллами последней очень прочно удерживается маточный раствор, отмыть который полностью без большой потери вещества не удается. Кроме того, установить кристаллическую структуру очень мелких кристаллов затруднительно (даже под микроскопом), а это лишает исследователя возможности использовать один из важных критериев чистоты вещества — его кристаллическую етруктуру и однородность образованных кристаллов. &• общем можно рекомендовать получать кристаллы таких размеров, чтобы структура их была ясно видна при увеличении в 50—100 раз. Величина отдельных кристаллов, выделяющихся при перекристаллизации, зависит от скорости охлаждения раствора. Если раствор охлаждается медленно, то образующиеся кристаллы постепенно, растут и могут достигнуть иногда очень больших размеров и, наоборот, при быстром охлаждении образуются мелкие кристаллы.
Для быстрого охлаждения раствора при кристаллизации кристаллизатор («ли другой приемник) помещают в холодную воду, снег или лед. Если при быстром охлаждении кристаллы все же не выделяются, образование их можно вызвать, потерев стеклянной палочкой изнутри о стенку сосуда или же внеся самое незначительное количество вещества в охлажденный раствор. В последнем елучае бывает достаточно кристаллика величиной с пылинку.
Если при кристаллизации образовались очень мелкие кристаллы, их снова растворяют при нагревании и сосуд,' в котором проводилось растворение, сразу же обертывают полотенцем, накрывают часовым стеклом (выпуклой стороной наружу) и оставляют стоять в полном покое.
Выпавшее при кристаллизации вещество отделяют от маточного раствора путем фильтрования под вакуумом; тщательно отжимают на воронке плоской стороной стеклянной пробки и промывают небольшим количеством чистого холодного растворителя. Маточный раствор упаривают до половины и снова выделяют новую порцию вещества, как это было описано выше.
Отфильтрованные кристаллы высыпают на фильтровальную бумагу, равномерно распределяют по ней, сверху закрывают другим листом фильтровальной бумаги и сушат па воздухе. Если вещество не теряет кристаллизационной воды (перекристаллизация из воды), то его можно сушить в эксикаторе. Вещества, расплывающиеся на воздухе, быстро отжимают на пористой глиняной тарелке « перекладывают в банку с притертой пробкой.
Когда перекристаллизацию ведут не из воды, а из какого-нибудь органического растворителя, например спирта или бензола, необходимо принимать меры, чтобы при нагревании и фильтровании раствора не возник пожар.
Трудной задачей при кристаллизации является определение нужного объема растворителя. Как уже указывалось, желательно получить наиболее концентрированный горячий раствор. Если растворимость кристаллизуемого вещества при различных температурах известна, задача упрощается, так как потребное количество растворителя можно подсчитать. Если же, что является более частым случаем, растворимость вещества неизвестна, поступают следующим образом.
К колбе соответствующего размера подбирают пробку, в которую вставляют стеклянную трубку длиной не менее 75 см. Эта трубка служит холодильником.
Взвесив кристаллизуемое вещество, высыпают примерно половину его в колбу с холодильной трубкой. Определенное количеств© *(по объему) растворителя приливают небольшими порциями в колбу и после прибавления каждой порции содержимое колбы нагревают дэ кипения "(как описано ниже). Так поступают до тех пор, пока все находящееся в колбе веществе не яерейдет яри нагревании в раствор. При этом не нужно забывать, что кристаллизуемое вещество может содержать примеси, не растворимые в данном растворителе. Поэтому, когда основная масса вещества растворится, оценивают на глаз, какая часть его осталась нерастворенной. Зная объем взятого растворителя, добавляют в колбу количество его, пропорциональное остающемуся нерастворенному осадку. Если последний при этом не перейдет в раствор, можно считать его посторонней примесью, которая должна быть отделена при последующем фильтровании. Если же при прибавлении растворителя весь осадок перейдет в раствор, небольшими порциями добавляют в колбу оставшееся вещество до тех пор, пока при нагревании не будет оставаться небольшой нерастворяющийся остаток. Этот остаток растворяют при нагревании, добавляя снова соответствующее количество растворителя. Можно считать, что приготовленный таким путем горячий раствор насыщенный. Тогда взвешивают оставшееся вещество, измеряют объем оставшегося растворителя и по разности масс и 'объемов находят количество растворителя, требующееся для растворения всего взятого вещества. Всыпают оставшееся количество последнего в колбу, прибавляют соответствующее количество растворителя и растворяют при кипячении.
Нужно обратить внимание на способ нагревания колбы при растворении. Закрыв колбу пробкой с холодильной трубкой, нагревают колбу на водяной или другой бане (в зависимости от температуры кипения растворителя), горелку гасят до начала кипения растворителя. Нагревание продолжают еще в течение нескольких минут, после чего смотрят (как указано выше), достаточно ли взято растворителя. Так поступают при каждом новом нагревании. Когда в колбу введено все количество вещества и взят нужный объем растворителя, горячий раствор в случае необходимости быстро фильтруют через воронку для горячего фильтрования (горелка погашена) в кристаллизатор или стакан.
При охлаждении раствора и выпадении кристаллов их отфильтровывают, отжимают или сушат.
Для более тщательной очистки перекристаллизацию приходится проводить несколько раз. Следует заметить, что с каждой новой перекристаллизацией количество вещества будет уменьшаться, так как потери при кристаллизации неизбежны, как бы тщательно она ни велась.
Когда перекристаллизацию ведут из какого-либо органического растворителя, то проводят упаривание раствора .
После фильтрования горячего раствора фильтр следует промыть небольшим количеством чистого нагретого растворителя. Таким образом удается уменьшить потери кристаллизуемого вещества.
Вопрос по физике:
Зачем фильтровать раствор при кристаллизации? физика 10 класс
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок - бесплатно!
- 22.06.2015 09:35
- Физика
- remove_red_eye 5023
- thumb_up 39
Ответы и объяснения 1
Для более тщательной очистки перекристаллизацию приходится проводить несколько раз. Следует заметить, что с каждой новой перекристаллизацией количество вещества будет уменьшаться, так как потери при кристаллизации неизбежны, как бы тщательно она ни велась.
Когда перекристаллизацию ведут из какого-либо органического растворителя, то проводят упаривание раствора .
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Физика.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи - смело задавайте вопросы!
Физика — область естествознания: естественная наука о простейших и вместе с тем наиболее общих законах природы, о материи, её структуре и движении.

Для более тщательной очистки перекристаллизацию приходится проводить несколько раз.
Следует заметить, что с каждой новой перекристаллизацией количество вещества будет уменьшаться, так как потери при кристаллизации неизбежны, как бы тщательно она ни велась.
Когда перекристаллизацию ведут из какого - либо органического растворителя, то проводят упаривание раствора .

Как замерзают растворыЕсли охладить раствор какой - либо соли в воде, то обнаружится, что температура кристаллизации понизилась?
Как замерзают растворы
Если охладить раствор какой - либо соли в воде, то обнаружится, что температура кристаллизации понизилась.
Кристаллики появятся в жидкости лишь при температуре на несколько градусов ниже нуля градусов.
Температура кристаллизации зависит от концентрации раствора.
Она тем ниже, чем выше концентрация раствора.
Например, при растворении 45 кг поваренной соли в 1 м3 воды температура кристаллизации уменьшается до –3 °С.
Самую низкую температуру имеет насыщенный раствор, т.
Е. раствор, содержащий максимально возможное количество растворённой соли.
При этом уменьшение температуры достаточно существенное.
Так, насыщенный раствор поваренной соли в воде кристаллизуется при температуре –21 °С, а насыщенный раствор хлористого кальция – при температуре –55 °С.
Рассмотрим, как идёт процесс кристаллизации.
в растворе появятся первые кристаллики льда, концентрация раствора повысится.
Возрастёт относительное число молекул соли, увеличатся помехи процессу кристаллизации воды, и температура кристаллизации понизится.
Если дальше не понижать температуру, то кристаллизация остановится.
При дальнейшем понижении температуры кристаллики воды продолжат образовываться, и раствор станет насыщенным.
Дальнейшее обогащение раствора растворённым веществом (солью) становится невозможным, и раствор застывает сразу.
Если рассмотреть замёрзшую смесь в микроскоп, то можно увидеть, что она состоит из кристалликов льда и кристалликов соли.
Таким образом, раствор замерзает не так, как простая жидкость.
Процесс замерзания растягивается на большой температурный интервал.
Если посыпать лёд солью, то лёд начнёт таять.
Конечно, это будет иметь место, если температура замерзания насыщенного раствора соли ниже температуры воздуха.
При этом лёд будет плавиться, а соль – растворяться
в образовавшейся воде.
Процесс плавления требует энергии, которую лёд потребляет из окружающего воздуха.
В результате температура воздуха понижается.
Задание Что произойдет с процессом кристаллизации воды в растворе, если не понижать температуру раствора?

Какое количество теплоты выделится при кристаллизации 4 кг свинца и последующем его охлаждении до температуры 27 градусов цельсия?
Какое количество теплоты выделится при кристаллизации 4 кг свинца и последующем его охлаждении до температуры 27 градусов цельсия!
Пожалуйста помогите с физикой!

Какое количество теплоты выделится при кристаллизации 100 гр воды при 0 градусов?
Какое количество теплоты выделится при кристаллизации 100 гр воды при 0 градусов.
Задачи по физике 8 - 9 класс.

Приведите примеры кристаллизации?
Приведите примеры кристаллизации.

Формула для расчёта кристаллизации?
Формула для расчёта кристаллизации.

Что произойдет с процессом кристаллизации воды в растворе, если не понижать температуру раствора?
Что произойдет с процессом кристаллизации воды в растворе, если не понижать температуру раствора?

Ребят помогите пожалуйста?
Ребят помогите пожалуйста!
В физике полный 0
какое количество теплоты выделиться при кристаллизации 200 г нафталина и его охлаждении от температуры кристаллизации до температуры 30 гр С.
Начертите график зависимости температуры нафталина от времени.
Обещаю поставить лучший!
График, если получиться.
Должно получиться 42 к Дж
я в долгу не останусь).

Сколько энергии выделяется при кристаллизации льда массой 5кг?
Сколько энергии выделяется при кристаллизации льда массой 5кг.
, если лед находится при температуре кристаллизации?

Температура кристаллизации спирта?
Температура кристаллизации спирта.

Все формулы по физике 7 класс?
Все формулы по физике 7 класс.

4с - частота колебаний.

Находим массу керосина : m = ρ * V = 820 * 5 * 10⁻³ = 4, 250 кг Выделится : Q = q * m = 46, 2 * 10⁶ * 4, 250≈ 196 МДж.

Эйнштейн — автор более 300 научных работ по физике, а также около 150 книг и статей в области истории и философии науки, публицистики и др. Он разработал несколько значительных физических теорий : Специальная теория относительности (1905). В её рам..

Исаак Ньютон(1642 - 1727) — английский математик, механик, астроном ифизик, создатель классической механики, член (1672) и президент (с 1703) Лондонского королевского общества. Знак зодиака —Козерог. Один из основоположников современной физики, сфо..

59 - 31 = 28 дм3 в первом сосуд с жидкостью, во втором с телом.

Дано V = 1, 8 м \ с t = 5ч S - ? S = V * t = 1. 8 * 5 * 3600 = 32400 м.

T = 2π√(l / g). Выразим отсюда l l = (T / 2π)² * g l = (0. 5 / π)² * 9. 8 ≈0. 24 м.

Вот так вот : 1)в 2)в 3)а 4)б 5)б 6)а.

Физическое тело 1)Карандаш 2)Стол Вещество 1)Вода 2)Железо 3)Керосин Явление 1)Эхо 2)Рассвет 7)Кипение.

Согласно F = G * m1 * m2 / R ^ 2 = 6, 67 * 10 ^ - 11 * 1 * 1 / 1 ^ 2 = 6, 67 * 10 ^ - 11 H.
© 2000-2022. При полном или частичном использовании материалов ссылка обязательна. 16+
Сайт защищён технологией reCAPTCHA, к которой применяются Политика конфиденциальности и Условия использования от Google.
Информация в чистом виде ‒ это не знание. Настоящий источник знания ‒ это опыт.
Альберт Эйнштейн
Вопросы к экзамену
Для всех групп технического профиля
Учу детей тому, как надо учиться
Часто сталкиваюсь с тем, что дети не верят в то, что могут учиться и научиться, считают, что учиться очень трудно.
Урок 23 (дополнительный материал) Лабораторная работа Наблюдение роста кристаллов из раствора
Лабораторная работа
Тема: "Наблюдение роста кристаллов из раствора"
Цель: научиться создавать кристаллы, пронаблюдать за ростом кристалла
Теоретические сведения
Существуют два простых способа выращивания кристаллов из раствора: охлаждение насыщенного раствора соли и его выпаривание. Первым этапом при любом из двух способов является приготовление насыщенного раствора. В условиях школьного физического кабинета проще всего выращивать кристаллы алюмокалиевых квасцов. В домашних условиях можно выращивать кристалл медного купороса или обычной поваренной соли.
Растворимость любых веществ зависит от температуры. Обычно с повышением температуры растворимость увеличивается, а с понижением температуры уменьшается.
При охлаждении горячего (примерно 40°С) насыщенного раствора до 20°С в нем окажется избыточное количества соли на 100 г воды. При отсутствии центров кристаллизации это вещество может оставаться в растворе, т.е. раствор будет пересыщенным.
С появлением центров кристаллизации избыток вещества выделяется из раствора, при каждой данной температуре в растворе остается то количество вещества, которое соответствует коэффициенту растворимости при этой температуре. Избыток вещества из раствора выпадает в виде кристаллов; количество кристаллов тем больше, чем больше центров кристаллизации в растворе. Центрами кристаллизации могут служить загрязнения на стенках посуды с раствором, пылинки, мелкие кристаллики соли. Если предоставить выпавшим кристалликами возможность подрасти в течение суток, то среди них найдутся чистые и совершенные по форме экземпляры. Они могут служить затравками для выращивания крупных кристаллов.
Чтобы вырастить крупный кристалл, в тщательно отфильтрованный насыщенный раствор нужно внести кристаллик - затравку, заранее прикрепленный на волосе или тонкой леске, предварительно обработанной спиртом.
Можно вырастить кристалл без затравки. Для этого волос или леску обрабатывают спиртом и опускают в раствор так, чтобы конец висел свободно. На конце волоса или лески может начаться рост кристалла.
Если для выращивания приготовлен крупный затравочный кристалл, то его лучше вносить в слегка подогретый раствор. Раствор, который был насыщенным при комнатной температуре, при температуре на 3-5°С выше комнатной будет ненасыщенным. Кристалл-затравка начнет растворяться в нем и потеряет при этом верхние, поврежденные и загрязненные слои. Это приведет к увеличению прозрачности будущего кристалла. Когда температура понизится до комнатной, раствор вновь станет насыщенным, и растворение кристалла прекратится. Если стакан с раствором прикрыть так, чтобы вода из раствора могла испаряться, то вскоре раствор станет пересыщенным и начнется рост кристалла. Во время роста кристалла стакан с раствором лучше всего держать в теплом сухом месте, где температура в течение суток остается постоянной. На выращивание крупного кристалла в зависимости от условий эксперимента может потребоваться от нескольких дней до нескольких недель.
Ход работы
1. Тщательно вымойте стакан и воронку, подержите их над паром.
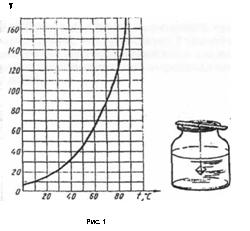
2. Налейте 100, г дистиллированной (или дважды прокипяченной) воды в стакан и нагрейте её до 30°С-40°С. Используя кривую растворимости, приведенную на рисунке 1, определите марсу соли, необходимую для приготовления насыщенного раствора при 30°С.
Приготовьте насыщенный раствор и слейте его через ватный фильтр в чистый стакан. Закройте стакан крышкой или листком бумаги. Подождите, пока раствор остынет до комнатной температуры. Откройте стакан. Через некоторое время начнут выпадать первые кристаллы.
3. Через сутки слейте раствор через ватный фильтр в чистый, вновь вымытый и попаренный стакан. Среди множества кристаллов, оставшихся на дне первого стакана, выберите самый чистый кристалл правильной формы. Прикрепите кристалл-затравку к волосу или леске и опустите его в раствор. Волос или леску предварительно протрите ватой, смоченной спиртом. Можно также положить кристалл-затравку на дно стакана перед запивкой в него раствора. Поставьте стакан в теплое чистое место. В течение нескольких суток или недель не трогайте кристалл и не переставляйте стакан. В конце срока выращивания выньте кристалл из раствора, тщательно осушите бумажной салфеткой и уложите в специальную коробку. Руками кристалл не трогайте, иначе он потеряет прозрачность.
Видеоопыт.
Опыт 1. Выращивание кристалла из медного купороса.
Опыт 2. Выращивание кристалла из поваренной соли.
Контрольные вопросы
1. Что может служить центром кристаллизации?
2. Чем объясняется неодинаковая скорость роста различных граней одного и того
же кристалла?
3. Каким способом можно насыщенный раствор сделать пересыщенным без
добавления растворенного вещества?
Читайте также: