Взаимодействие между молекулами вещества кратко
Обновлено: 30.06.2024
Межмолекулярное взаимодействие в химии, суть процесса
Различные атомы и группы атомов, входящие в состав молекулы вещества могут осуществлять внутримолекулярное и межмолекулярное взаимодействие, приводящее к образованию нового типа связей — межмолекулярных связей.
Межмолекулярным называют взаимодействие частиц (атомов, молекул или ионов), проявляющееся на расстояниях, значительно превышающих размеры этих частиц.
Данное явление объясняет отличие идеальных газов от реальных, нахождение одних и тех же веществ в разных агрегатных состояниях и влияет на такие физические свойства, как плотность, электро- и теплопроводность, температура кипения и плавления, твердость и другие.
Первым понятие межмолекулярного взаимодействия ввел голландский ученый Йоханнес Дидерик ван-дер-Ваальс в 1873 году, когда изучал свойства реальных газов и жидкостей. Поэтому силы, обеспечивающие межмолекулярное взаимодействие, также называют ван-дер-ваальсовыми силами.
Отличия межмолекулярного взаимодействия от химической связи:
- Сравнительно слабое. Энергия связи составляет от 4 до 20 кДж/моль, что в 20 раз меньше энергии химических связей.
- Действует на бóльших расстояниях, во всех направлениях вокруг данной частицы (не имеет направленности).
- Ненасыщаемое: молекула может взаимодействовать с любым количеством находящихся рядом молекул.
Основные виды межмолекулярного взаимодействия
Ван-дер-ваальсовы взаимодействия (силы) имеют электростатический характер и образуются за счет диполей (молекул, содержащих два одинаковых по величине, но разных по знаку заряда, находящимися на расстоянии друг от друга). В зависимости от вещества механизм образования диполей различен, поэтому выделяют три составляющие ван-дер-ваальсовых сил:
- ориентационное взаимодействие (эффект Кеезома) — характерно для веществ, образованных полярными молекулами: вода H 2 O , аммиак N H 3 , сероводород H 2 S и т.д. В конденсированном состоянии молекулы располагаются так, чтобы концы с разными зарядами находились рядом, обеспечивая взаимное притяжение. При нагревании ориентационный эффект становится слабее из-за беспорядочного движения молекул, препятствующего правильной ориентации. Ориентационное взаимодействие позволяет полярным молекулам образовывать жидкости, кипящие при температуре выше комнатной;
- индукционное взаимодействие (эффект Дебая) — возникает между полярным и неполярным веществами за счет наведенных (или индуцированных) диполей. Дипольные моменты, постоянно имеющиеся у полярного вещества, продуцируют образование диполей в неполярном соединении. Эти силы действуют и на два полярных вещества, но они слабее, чем при ориентационном взаимодействии. Не зависит от температуры и имеет важное значение при образовании растворов;
- дисперсионное взаимодействие (эффект Лондона) — проявляется у мгновенных диполей неполярных молекул. Мгновенные диполи образуются, когда значение дипольного момента какого-либо атома становится не равным нулю. Мгновенный диполь создает электрическое поле, поляризуя соседние молекулы, которые притягиваются друг к другу. Это слабый вид межмолекулярного взаимодействия. Он универсальный и присущ всем частицам, включая атомы инертных газов, но проявляется только при отсутствии ориентационного и индукционного взаимодействия (см.таблицу 2). Все неполярные газообразные вещества (водород, метан, азот, кислород и др.) при охлаждении до низких температур переходят в жидкое состояние, а при дальнейшем понижении температуры кристаллизуются.
Влияние агрегатного состояния вещества на ван-дер-ваальсовы взаимодействия
Атомы или молекулы газообразных веществ постоянно двигаются в разных направлениях, поэтому большую часть времени находятся на значительных (по сравнению с собственными размерами) расстояниях друг от друга. Силы межмолекулярного взаимодействия между ними настолько малы, что его даже не учитывают, кроме тех случаев, когда газ находится под высоким давлением.
Частицы веществ в конденсированном состоянии (жидком или твердом) находятся ближе друг к другу, а силы взаимодействия достаточно велики для того, чтобы удержать их в таком положении. Поэтому жидкие и твердые вещества имеют, в отличие от газов, постоянный при данной температуре объем.
Для твердых тел (кристаллов) силы межмолекулярного взаимодействия обеспечивают сохранение не только объема, но и формы. Правильная геометрическая форма (кристаллическая решетка), в узлах которой находятся электрически нейтральные частицы, называется молекулярным кристаллом.
Примерами могут быть такие органические соединения, как парафин, спирт, резина; инертные газы, а также C O 2 , O 2 и N 2 в твердом состоянии; лед, кристаллы брома, йода и др. Силы взаимодействия в таких кристаллах формируются за счет небольшого смещения электронов в оболочках атомов. Они невелики, поэтому молекулярные кристаллы подвержены деформации.
Для некоторых твердых тел свойственно наличие сразу нескольких видов связи. Примером такого вещества является графит с гексагональной решеткой:
- ван-дер-ваальсовы силы действуют между слоями параллельных плоскостей, образующих кристаллическую решетку;
- ковалентная связь в пределах одного слоя формируется тремя валентными электронами каждого атома углерода с соседними атомами.
Мягкость графита и скольжение его слоев друг относительно друга обусловлена этими факторами.
Водородная связь — частный случай ориентационных межмолекулярных сил, образующихся между положительно поляризованным атомом водорода одной группы или молекулы и отрицательно поляризованным атомом другой. Функцию отрицательного полюса выполняет атом с высокой отрицательностью (кислород, фтор, азот и др.).
Если представить соединение с формулой X-H, то водородная связь будет выглядеть так: X-H⋅⋅⋅Y (или H⋅⋅⋅Y), где Y — атом с высокой отрицательностью, входящий в состав какого либо вещества, образующего с X-H водородные связи.
В силу высокой прочности (сравнительно с другими вариантами межмолекулярного взаимодействия), широкой распространенности и важности в объяснении свойств различных соединений водородная связь рассматривается как отдельный тип межмолекулярных связей.
Значение водородной связи:
- Является промежуточным звеном между валентным и межмолекулярным взаимодействием.
- За счет водородных связей образуются кристаллогидраты, ассоциации молекул.
- Образование и расщепление водородных связей — основа таких процессов, как электролитическая диссоциация, растворение и кристаллизация.
- Непрочные, легко образуются и легко рвутся при комнатной температуре.
- Повышают такие физические характеристики, как вязкость, растворимость, температура кипения и плавления, диэлектрическая постоянная и другие у воды и многих органических жидкостей: карбоновых кислот и их амидов, спиртов, сложных эфиров. Например, у воды H 2 O , аммиака N H 3 и фтороводорода H F аномально высокие температуры плавления и кипения.
Водородные связи могут быть как внутримолекулярными (образуются между фрагментами одной молекулы), так и межмолекулярными (возникают между частями разных молекул).
Энергия межмолекулярного взаимодействия молекул
Энергия ориентационного взаимодействия Еориент растет при увеличении дипольных моментов частиц, уменьшается при повышении температуры.
Энергия индукционного взаимодействия Еинд увеличивается с ростом дипольного момента полярной молекулы и с увеличением поляризуемости неполярной. Не зависит от температуры.
Энергия дисперсионного взаимодействия Едисп пропорциональна квадрату поляризуемости частиц. Низкая поляризуемость характерна для многих соединений фтора, следовательно, они проявляют слабое дисперсионное взаимодействие. Доказательством этого является сравнительная таблица 1 температур кипения соединений фтора и хлора, похожих по строению:
| C F 4 | C C l 4 | O F 2 | O C l 2 | |
| tкип, °C | -128 | 76 | -144 | 3,8 |
Электрический момент диполя,
- С увеличением размера молекул в рядах Ar—Xe и HCl-HJ увеличивается их поляризуемость и Едисп.
- Еориент вносит существенный вклад в Еобщ только при высоком значении электрического момента диполя, μ.
- При увеличении Еобщ растет температура кипения жидкостей, а также теплота их испарения.
Общая энергия межмолекулярного взаимодействия выражается суммой энергий трех видов взаимодействия:
Еобщ = Еориент + Еинд +Едисп.
Вклад каждого из слагаемых определяется полярностью и поляризуемостью частиц. Во взаимодействие сильно полярных и легко поляризующихся молекул наибольший вклад вносят Еориент + Еинд, хотя значение Еинд обычно сравнительно невелико. У малополярных молекул дисперсионное взаимодействие выходит на первое место, а у неполярных оно является единственной составляющей.

Существование различных агрегатных состояний вещества объясняется тем, что между молекулами существуют силы притяжения и отталкивания. При изменении температуры баланс этих сил и энергии теплового движения изменяется, что и приводит к изменению состояния вещества. Кратко рассмотрим силы взаимодействия между молекулами.
Природа сил взаимодействия молекул
В 10 классе известно, что атомы всех элементов состоят из положительно заряженного ядра и отрицательно заряженных электронных оболочек вокруг. Взаимодействие электронных оболочек приводит к образованию молекул, состоящих из некоторого числа атомов.
Получается, что в любой молекуле существуют области, имеющие как положительный, так и отрицательный заряд. Распределение этих областей и создает силы, действующие на молекулы в данный момент времени, а с учетом изменения температуры оно определяет строение газообразных, жидких и твердых тел.
При этом природа этих сил всегда электростатическая. Впервые они были описаны в середине XIX в. Я. Ван-дер-Ваальсом. Поэтому нередко их называют ван-дер-ваальсовыми.
Виды межмолекулярных сил
Из-за того, что силы притяжения между молекулами изменяют пространственную ориентацию и форму самих молекул, они гораздо сильнее изменяются с изменением расстояния, как правило, пропорционально седьмой степени.
Это убывание гораздо быстрее, чем обычное кулоновское, пропорциональное квадрату расстоянию. Поэтому межмолекулярные силы играют значительную роль лишь на малых расстояниях.
По механизму их возникновения можно выделить следующие.
Ориентационные силы
Ориентационные силы еще называют дипольными. Они возникают в результате того, что многие молекулы представляют собой электрические диполи. Разноименные полюса диполей притягиваются, а одноименные — отталкиваются. В результате дипольные молекулы стремятся занять определенное пространственное положение друг относительно друга, что также влияет на величину сил.
В результате ориентационные силы прямо пропорциональны дипольным моментам молекул:

Рис. 1. Ориентационные силы.
Поляризационные (индукционные) силы
Сила взаимодействия будет пропорциональна дипольному моменту полярной молекулы и способности к поляризации под внешним воздействием неполярной молекулы (поляризуемости $\alpha$):

Рис. 2. Поляризационные силы.
Дисперсионные силы
Поляризуемость неполярных молекул приводит к тому, что даже между ними возникают силы притяжения.
Хотя в среднем у неполярной молекулы дипольный момент отсутствует, в каждый конкретный момент времени электроны в электронном облаке могут иметь несимметричное положение. В результате мгновенный дипольный момент будет отличен от нуля. То же самое происходит и с соседними молекулами. Суммарное взаимодействие этих мгновенных дипольных моментов приводит к существованию сил притяжения, называемых дисперсионными.
Дисперсионные силы пропорциональны поляризуемостям взаимодействующих молекул:

Рис. 3. Дисперсионные силы.
Что мы узнали?
Силы взаимодействия молекул имеют электростатическую природу. Механизм их возникновения определяется существованием дипольных моментов у молекул. По виду эти силы делятся на ориентационные, поляризационные и дисперсионные. Их величина пропорциональная седьмой степени расстояния, поэтому они проявляются лишь на относительно небольших дистанциях.
Мы уже знаем, что молекула и атомы — наименьшие частицы, составляющие то или иного вещества. Однако, иметь знания о составляющих вещество молекулах недостаточно, чтобы описать его свойства. Например, пар и лед состоят из одинаковых молекул воды, но свойства у них отличаются.
Аналогично обстоит дело и с веществом. Чтобы его описать, необходимо не только знать атомный и молекулярный состав, но и способы соединения частиц, а также их взаимодействия.
Свойство разных простых веществ состоять из одинаковых частиц называется аллотропией, а сами вещества — аллотропными модификациями.
Самым большим количеством аллотропных модификаций обладает углерод (рисунок 14). Его атом получил свое название от вещества, состоящего из атомов угля.
Из таких же самых атомов состоят сажа, графит и алмаз. Просто атомы в них по-другому расположены и по-другому взаимодействуют. Поэтому, их свойства сильно отличаются: из твердого алмаза делают режущие инструменты, а из мягкого графита — стержни для карандашей.
Рисунок 15. Аллотропные модификации углерода.
Взаимное притяжение молекул
Если же все молекулы находятся в беспрерывном движении, почему твердые и жидкие тела не распадаются? Значит, молекулы как-то взаимодействуют между собой, взаимно притягиваются друг к другу.
Но, если вы сломаете карандаш, он же не склеится обратно? Из этого можно сделать просто вывод, что притяжение между молекулами действует только на очень коротком расстоянии. Притяжение между молекулами разных тел неодинаково, что объясняется различной прочностью.
Рассмотрим следующий опыт: если у двух цилиндров идеально ровно срезать поверхности и прижать их друг к другу, вам удастся разорвать их только при большой нагрузке (рисунок 16).
Рисунок 16 Сцепление двух свинцовых цилиндров.
Заметим, что притяжение между молекулами становится заметным, когда расстояние между ними не превышает размеров самих молекул.
Если мы попытаемся таким же образом соединить осколки стекла, то из-за неровностей у нас ничего не выйдет – расстояние между молекулами окажется слишком велико.
Но если нагреть куски стекла, то стекло станет возможно починить. На том же принципе происходит соединение кусков металла при сварке или пайке.
Но почему тогда между молекулами существуют промежутки? По логике вещей, они должны намертво слипнуться. Но этого не происходит, поскольку между молекулами (атомами) в то же время существуют силы отталкивания.
На расстояниях, сравнимых с размерами самих молекул (атомов), заметнее проявляется притяжение, а при дальнейшем сближении – отталкивание (рисунок 17).
Рассмотрим примеры, подтверждающие существование отталкивания между молекулами. Если вы несильно скомкаете лист бумаги, постепенно он начнет расправляться, так как при сжатии молекулы оказались настолько близко друг к другу, что начало проявляться отталкивание. Другие явление связаны со смачиванием твердого тела жидкостью. Взгляните на рисунок 18.
Рисунок 18. Иллюстрация опыта, доказывающего притяжения между молекулами вещества и демонстрирующего эффект смачивания.
На пружине с помощью нитей закреплена стеклянная пластина, ее подносят к емкости с водой так, чтобы она легла на поверхность жидкости.
Когда мы пытаемся оторвать платину от поверхности воды, пружина заметно растягивается. Это доказывает существование притяжения между молекулами.
К тому же, мы можем заметить, что стеклянная пластина теперь покрыта тонким слоем воды – это значит, что разрыв произошел там, где молекулы воды соприкасаются друг с другом, а не с поверхностью стекла.
Благодаря эффекту смачивания мы можем вытирать мокрые предметы, но с другой стороны, вода может и не смачивать тела (парафин/воск/жир) – это означает, что молекулы жидкости притягиваются друг к другу с большей силой, чем к молекулам твердого тела.

Межмолекулярное взаимодействие
Силы Ван-дер-Ваальса
Силы взаимодействия молекул, вызываемые мгновенными флюктуациями распределения электронов в атомах, называются силами Ван-дер-Ваальса. Заумно прозвучало? Далее все встанет на свои места. Силы Ван-дер-Ваальса являются одним из видов межмолекулярного взаимодействия, но можно считать эти силы взаимодействия молекул основными. Просто запомните, что именно благодаря силам Ван-дер-Ваальса в природе существуют три агрегатных состояния вещества.

Температура плавления и кипения

В таблице, которая расположена ниже, сопоставлены температуры плавления и кипения некоторых веществ, состоящих из простых молекул. Как правило, большим по размеру молекулам соответствуют более высокие температуры плавления и кипения, потому что такие молекулы обладают бОльшей поверхностью, что приводит к большим силам Ван-дер-Ваальса. Вот почему при одном и том же давлении H2 кипит при -252°С, а CH4 при -164°C, а C8H18 следует нагреть до +125,7°C, чтобы его молекулы отделились одна от другой и перешли в газовую фазу.

Ковалентная полярная химическая связь
Приведем примеры молекул, образованных ковалентной полярной связью: CO, H2O, HCl. Из примеров видно что, ковалентная полярная химическая связь, как и неполярная, возникает только между атомами неметаллов и разница в электроотрицательности между ними должна быть более 0.4, но менее 2.0 . Если разница в электроотрицательности атомов менее 0.4 , то связь между ними считается ковалентной неполярной. Думаю, что теперь у вас сложилось некоторое представление о различиях ковалентной полярной и ковалентной неполярной химической связи.
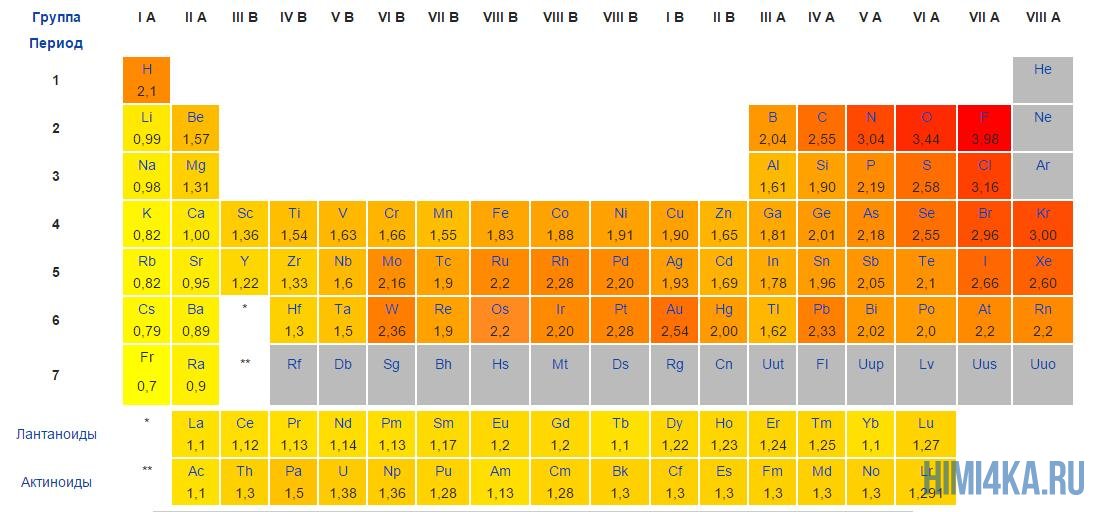
Постарайтесь запомнить самые электроотрицательные химические элементы в порядке возрастания их электроотрицательности: I, Br, N, Cl, O, F. За помощью вы всегда можете обратиться к таблице электроотрицательности, которая расположена ниже.
Образование водородной связи
Очевидно, что молекулы воды образованы ковалентной полярной химической связью, поскольку электроотрицательность кислорода больше, чем у водорода. Поэтому атом кислорода в молекуле воды несет в себе небольшой отрицательный заряд, а атомы водорода — небольшие положительные заряды.
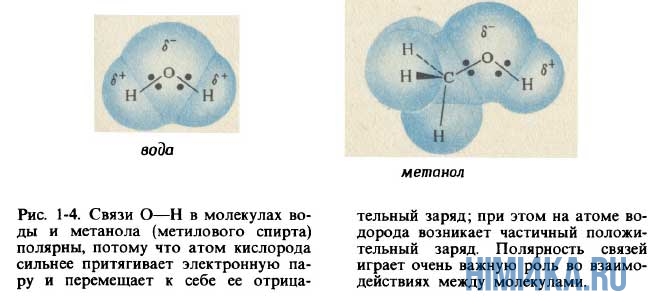
Подобные молекулы называются полярными, поскольку они ведут себя как крошечные электрические диполи; другими словами, отрицательный заряд на атоме кислорода притягивает расположенные поблизости положительные заряды, а положительно заряженные атомы водорода притягивают другие отрицательные заряды. Так возникает еще один тип сил притяжения между молекулами, помимо вандерваальсовых сил притяжения. Вследствие наличия дополнительных сил взаимодействия между полярными молекулами метанола CH3OH (метилового спирта) он плавится и кипит при гораздо более высоких температурах, чем метан CH4, который имеет сходные с метанолом размеры молекул. При комнатной температуре метанол представляет собой жидкость, а метан — газ. В воде силы притяжения между атомами водорода и кислорода, принадлежащими различным молекулам, столь велики, что получили название водородных связей. Водородные связи играют чрезвычайно важную роль в белках и других гигантских молекулах, из которых построены живые организмы. Если бы не полярность молекул воды и наличие между ними водородных связей, вода плавилась бы и кипела при более низких температурах, чем даже сероводород (см. табл. в начале урока). При комнатной температуре она находилась бы в газообразном состоянии, а не в виде наиболее распространенной на Земле жидкости.
Читайте также:

