Взаимное влияние атомов в молекулах органических соединений кратко
Обновлено: 04.07.2024
Органическая химия – это раздел химии, который изучает структуру, свойства и методы получения (синтеза) углеводородов и их производных. Сейчас число известных органических соединений составляет почти 30 млн, однако оно продолжает расти (в мае 1999 года было известно около 12 млн органических веществ). Этот рост обусловлен необычными свойствами углерода. Например, данный элемент может образовать цепи любой длины, способные замыкаться и образовывать циклы, а также атом углерода способен создавать одинарные, двойные или тройные связи. Валентность углерода всегда равна 4-м, поэтому он всегда будет создавать вокруг себя 4 связи. Это могут быть четыре одинарных, две двойных, одна тройная и одна одинарная и др. В любом случае, способов образовывать связи много, однако чаще всего углерод связывается с водородом, кислородом, фосфором, азотом и некоторыми другими атомами этих элементов.
Теория строения органических соединений
Ещё в глубокой древности люди могли получать органические вещества, но теория их строения была сформулирована только в 1860-х годах русским химиком Александром Михайловичем Бутлеровым. Теория получила название в честь своего автора и стала фундаментом органической химии. До возникновения этой теории существовала такая точка зрения, что органические вещества нельзя получить из неорганических, то есть для их синтеза необходима некая сила, существующая только у живых организмов. Естественно, что появление теории, противоречащей всем знаниям в области органики, вызвало непонимание у химиков того времени. Научившись самостоятельно синтезировать органические вещества, ученые столкнулись с соединениями с одинаковой молекулярной формулой и молярной массой, но абсолютно другими свойствами. Например, диметиловый эфир при нормальных условиях представляет собой газ, а этиловый спирт, имеющий такой же состав, – жидкость. Подобные соединения стали называть изомерами, а явление – изомерией.
Основные положения теории Бутлерова
- Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностью.
- Химическое строение можно устанавливать химическими методами.
- Свойства любого органического вещества зависят от последовательности соединения атомов в молекуле.
- По свойствам вещества можно определить строение его молекулы, а по строению молекулы – предугадать свойства.
- Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга.
Данная теория оказала сильное влияние на скорость развития органической химии. С ее помощью А.М. Бутлеров объяснил явление изомерии, а также самостоятельно получил некоторые изомеры, в очередной раз доказав верность своих мыслей.
Гомология и изомерия.
В органических соединениях атомы и группы атомов, взаимодействуя, взаимно влияют друг на друга. Атомы и атомные группы в молекулах органических соединений могут быть объединены общим названием заместители.
Электронные эффекты – это смещение электронной плотности в молекуле, ионе или радикале под влиянием заместителей.
Заместителем считается любой атом (кроме водорода) или группа атомов, связанные с атомом углерода.
Существует два важнейших эффекта влияния заместителей на распределение электронной плотности в молекуле — индуктивный (I) и мезомерный (M) эффекты заместителей.
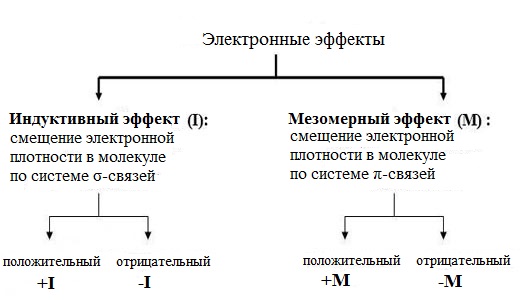
Мезомерный и индукционный эффекты в сопряженных системах действуют независимо друг от друга и могут совпадать по знаку либо иметь противоположные знаки.
Продолжаем разбирать основы органической химии. В теории Бутлерова сказано, что одна из особенностей строения веществ — взаимное влияние атомов друг на друга. Химические связи определяют свойства соединений. Например, в зависимости от радикалов и полярности связей в бензольном кольце новые атомы замещаются в разных положениях. Теория взаимного влияния атомов в молекуле — достаточно сложная тема. В статье мы разберем ее основы. Если вы хотите понимать химию лучше, запишитесь на курсы подготовки к ЕГЭ, где каждый раздел изучается подробно.
Химические связи в органических веществах
Прежде чем изучать влияние атомов друг на друга, нужно разобраться в природе связей в молекулах органических соединений. Вещества в органике образованы неметаллами — углеродом, кислородом, водородом, азотом, серой. Элементы связаны между собой ковалентными полярными связями. Они образуются в результате появления общих электронных пар. Рассмотрим на примере неорганического вещества — HCl. Водород имеет всего один электрон. Он и участвует в образовании соединений. У хлора на внешнем уровне 7 валентных электронов. Происходит объединение, при котором образуется общая плотность с 8 электронами. Хлор — более электроотрицательный элемент, поэтому он оттягивает на себя электронную плотность.
Это влияет на свойства органических соединений. Когда молекула HCl распадается (например, в водных растворах), хлор забирает себе электроны и становится анионом с зарядом —. Он будет взаимодействовать с электроположительными областями, то есть является нуклеофилом. Водород лишается электрона, поэтому становится катионом с зарядом +. В реакциях он выступает в роли электрофила, взаимодействуя с электроотрицательными участками. Напомним, что при распаде молекул с неполярной связью образуются радикалы — нейтральные частицы.
Смещение электронной плотности
Разберем влияние атомов в молекуле на примере хлорметана CH 3 Cl. В нем присутствуют три типа связей: С-С, С-Н и С-Cl. Связь С-С неполярна, поэтому ее мы рассматривать не будем. В группе CH 3 - углерод является более электроотрицательным элементом. Электронные плотности всех трех атомов водорода стянуты к нему. Они приобретают частично положительный заряд, а углерод — частично отрицательный. В связи C-Cl более электроотрицательным является хлор. Он забирает на себя электронную плотность со всей группы -CH 3 . В химии это обозначают стрелками: CH 3 →Cl. Метильный радикал передает электроны хлору, то есть является донором. Хлор, в свою очередь, выступает в роли акцептора. Если мы рассмотрим этан CH 3 -CH 3 , то не увидим такого явного донорно-акцепторного взаимодействия. Небольшое смещение наблюдается только по направлению от Н к С. В органических молекулах донорами являются все углеводородные радикалы. Акцепторами — группы, содержащие кислород, азот, галогены.
Индуктивный эффект
Первый вариант взаимного влияния атомов в молекулах органических веществ — индуктивный эффект. Он характеризует смещение плотности по сигма-связям. Эффект возникает в полярных молекулах, распространяется в одном направлении и быстро затухает. Пример индуктивного влияния — рассмотренный нами хлорметан CH 3 →Cl. Метильная группа — это электрофильный (донорный) участок, обладающий положительным индуктивным эффектом +I. Галоген выступает в роли нуклеофильного участка с отрицательным эффектом -I. Важный момент: в акцепторной области всегда есть элемент с высокой электроотрицательностью (O, N, Hal).
Мезомерный эффект
Перед изучением мезомерного влияния атомов в молекулах органических веществ разберемся в таком понятии, как π-система. Как вам наверное известно, π-связь — часть кратной. Если в молекуле есть одна двойная или тройная связь, то она локализована, так как взаимодействует только с ядрами соседних атомов. Если же таких связей несколько и они разделены одним простым (сигма) переходом, то они делокализуются. Электронная плотность распределяется между всеми атомами, благодаря чему образуется сопряженная система. Простейшей π-системой является бутадиен-1,3. Кроме того, она реализуется в бензольном кольце. Сопряженные связи являются чем-то средним между одинарными и двойными. Они меняют свойства органических веществ.
Мезомерный эффект — это взаимное влияние атомов в молекуле с π-связями. В случае отрицательного эффекта электронная плотность притягивается атомом, в случае положительного — отталкивается.
Определение свойств веществ
Разберем примеры взаимного влияния атомов в молекулах. Сравним кислотные свойства фенола, этанола и азотной кислоты. Все три соединения можно описать общей формулой Х-О-Н. При этом электронная плотность смещается к более отрицательному кислороду, что обеспечивает отщепление водорода и, соответственно, кислотные свойства: Х-О←Н. Осталось определить, насколько сильно это взаимодействие:
В азотной кислоте есть нитрогруппа -NO 2 , обладающая отрицательными мезомерным и индуктивным эффектами. Азот — электроотрицательный элемент, он стягивает на себя электронную плотность, поэтому водород становится еще более активным. Вещество является сильной кислотой.
У этанола вместо Х стоит углеводородный радикал. Он обладает положительным индуктивным эффектом, из-за чего полярность связи О-Н снижается. У вещества очень слабые кислотные свойства.
Особенность фенола — наличие бензольного кольца. У кислорода есть неподеленная электронная пара, которая вступает в сопряжение с π-системой. Благодаря этому электронная плотность стягивается в кольцо, водород становится более подвижным. Кислотные свойства фенола сильнее, чем у этанола, но слабее азотной кислоты.
Итак, мы разобрались с взаимным влиянием атомов в молекуле, узнали о мезомерном и индуктивном эффектах. Эти термины не встречаются в ЕГЭ по химии, но они позволяют лучше понимать природу соединений и предсказывать их химические свойства. Разберитесь с теорией из статьи, а также уделите время практике, определяя эффекты у разных веществ. Это можно делать самостоятельно, а можно записаться на курсы и решать задачи под руководством преподавателя. В любом случае мы уверены — при должной подготовке вы сможете набрать высокие баллы на ЕГЭ.
Атомы и атомные группы в молекулах органических соединений влияют друг на друга, причём не только атомы, непосредственно связанные друг с другом. Это влияние каким-то образом передаётся по молекуле. Передача влияния атомов в молекулах за счёт поляризации связей называется электронными эффектами. Существует два вида электронных эффектов: индуктивный и мезомерный эффект.
Индуктивный эффект - это передача влияния заместителей по цепи σ-связей за счёт их поляризации. Индуктивный эффект обозначается символом I. Рассмотрим его на примере 1-хлорбутана:
Большинство заместителей проявляют отрицательный индутивный эффект, т.к. в их структуре есть атомы, более электроотрицательные, чем водород (индуктивный эффект водорода принят равным нулю). Например: -F, -Cl, -Br, -I, -OH, -NH2, -NO2, -COOH, >C=O .


Если заместитель смещает электронную плотность по цепи σ-связей от себя, он проявляет положительный индуктивный эффект (+I). Например:

Кислород с полным отрицательным зарядом проявляет положительный индуктивный эффект.

В молекуле пропена углерод метильной группы sp 3 -гибридизован, а атомы углерода при двойной связи sp 2 -гибридизованы, т.е. более электроотрицательны. Поэтому метильная группа смещает электронную плотность от себя, проявляя положительный индуктивный эффект (+ICH3) .
Итак, индуктивный эффект может проявляться в любой молекуле, в которой есть разные по электроотрицательности атомы.
Мезомерный эффект – это передача электронного влияния заместителей в сопряжённых системах, посредством поляризации π-связей. Мезомерный эффект передаётся без затухания, т.к. π-связи поляризуются легко. Обратите внимание: мезомерным эффектом обладают только те заместители, которые сами являются частью сопряжённой системы. Например:


Амино-группа является частью p,π-сопряжённой системы.


Амино-группа не является частью сопряжённой системы. Мезомерный эффект отсутствует.

Мезомерный эффект может быть как положительный (+М), так и отрицательный (-М).
В молекуле хлорвинила неподелённая электронная пара хлора участвует в p,π-сопряжении, т.е. вклад хлора в сопряжённую систему больше, чем у каждого из атомов углерода. Поэтому хлор проявляет положительный мезомерный эффект.

Молекула акрилового альдегида – это π.π-сопряжённая система. Атом кислорода отдаёт в сопряжение один электрон – столько же, как и каждый атом углерода, но при этом электроотрицательность кислорода выше, чем у углерода, поэтому кислород смещает электронную плотность сопряжённой системы на себя, альдегидная группа в целом проявляет отрицательный мезомерный эффект.
Итак, заместители, отдающие в сопряжение два электрона, обладают положительным мезомерным эффектом. К ним относятся:
а) заместители с полным отрицательным зарядом, например, –O - ;
б) заместители, в структуре которых есть атомы с неподелёнными электронными парами на pz-орбитали, например: -NH2, -OH, -F, -Cl, -Br-, -I, -OR (-OCH3, -OC2H5).
Заместители, смещающие электронную плотность по сопряжённой системе на себя, проявляют отрицательный мезомерный эффект. К ним относятся заместители, в структуре которых есть двойные связи, например:

Заместитель может проявлять и индуктивный, и мезомерный эффекты одновременно. В некоторых случаях направление этих эффектов совпадает (например, -I и –M), в других – они действуют в противоположных направлениях (например, -I и +M). Как в этих случаях определить общее влияние заместителя на остальную часть молекулы (другими словами, как определить, является данный заместитель электронодонорным или электроноакцепторным)? Заместители, повышающие электронную плотность в остальной части молекулы, называют электронодонорными, а заместители, понижающие электронную плотность в остальной части молекулы, – электроноакцепторными.
Чтобы определить общее влияние заместителя, необходимо сравнить его электронные эффекты по величине. Если преобладает положительный по знаку эффект, заместитель является электронодонорным. Если преобладает отрицательный по знаку эффект, заместитель является электроноакцепторным. Нужно отметить, что, как правило, мезомерный эффект проявляется сильнее, чем индуктивный (из-за большей способности π-связей к поляризации). Однако есть и исключения из этого правила: индуктивный эффект галогенов проявляется сильнее, чем мезомерный.
Рассмотрим конкретные примеры:

В этом соединении аминогруппа является электронодонорным заместителем, т.к. её положительный мезомерный эффект проявляется сильнее, чем отрицательный индуктивный.
В этом соединении аминогруппа является электроноакцепторным заметителем, т.к. проявляет только отрицательный индуктивный эффект.
В молекуле фенола гидроксильная группа является электронодонорным заместителем из-за преобладания положительного мезомерного эффекта над отрицательным индуктивным.

В молекуле бензилового спирта гидроксильная группа не участвует в сопряжении и проявляет только отрицательный индуктивный эффект. Поэтому она является электроноакцепторным заместителем.
Эти примеры показывают, что нельзя рассматривать влияние какого-либо заместителя вообще, а нужно рассматривать его влияние в конкретной молекуле.

Только галогены всегда являются электроноакцепторными заместителями, т.к. их отрицательный индуктивный эффект проявляется сильнее, чем положительный мезомерный. Например:

А теперь вернёмся к реакциям электрофильного замещения в производных бензола. Итак, мы выяснили, что заместитель, уже имеющийся в кольце, влияет на ход реакций электрофильного замещения. В чём же выражается это влияние?
Заместитель влияет на скорость реакций SE и на положение второго заместителя, вводимого в кольцо. Рассмотрим оба этих аспекта влияния.
Влияние на скорость реакции. Чем выше электронная плотность в кольце, тем легче протекают реакции электрофильного замещения. Понятно, что электронодонорные заместители облегчают реакции SE (являются активаторами цикла), а электроноакцепторные заместители – затрудняют их (дезактивируют цикл). Поэтому реакции электрофильного замещения в производных бензола, содержащих электроноакцепторные заместители, проводят в более жёстких условиях.

Сравним активность фенола, толуола, бензола, хлорбензола и нитробензола в реакции нитрования.
Так как фенол и толуол содержат электронодонорные заместители, они более активны в реакциях SE, чем бензол. Наоборот, хлорбензол и нитробензол менее активны в этих реакциях, чем бензол, т.к. содержат электроноакцепторные заместители. Фенол активнее толуола из-за положительного мезомерного эффекта OH-группы. Хлор не такой сильный электроноакцепторный заместитель, как нитрогруппа, т.к. нитрогруппа проявляет и отрицательный индуктивный, и отрицательный мезомерный эффекты. Итак, в данном ряду активность в реакциях электрофильного замещения убывает от фенола к нитробензолу. Экспериментально установлено, что если скорость реакции нитрования бензола принять за 1, то этот ряд будет выглядеть так:
Читайте также:

