Влияние температуры на растворимость кратко
Обновлено: 04.07.2024
Растворимость большинства твердых и жидких веществ при повышении температуры в той или иной степени увеличивается. Для некоторых твердых веществ (особенно если при их растворении теплота выделяется) растворимость, наоборот, может понижаться с повышением температуры.
Зависимость растворимости веществ от температуры часто наглядно показывают при помощи графиков, которые называют кривыми растворимости (рис. 20).
Растворимость газов уменьшается с повышением температуры. Длительным кипячением можно почти полностью удалить растворенные газы из жидкости. Насыщение же жидкости газом, наоборот, целесообразнее проводить при низких температурах.
Изменением растворимости с температурой часто пользуются для очистки веществ путем перекристаллизации. При остывании горячего насыщенного раствора какой-либо соли, загрязненной посторонними примесями, значительная ее часть (соли) выделится в виде осадка, а загрязняющие примеси останутся в растворе, так как последний даже на холоде по отношению к ним не будет насыщенным.
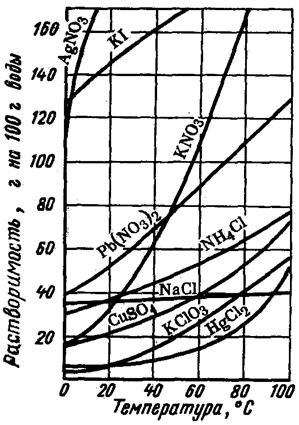
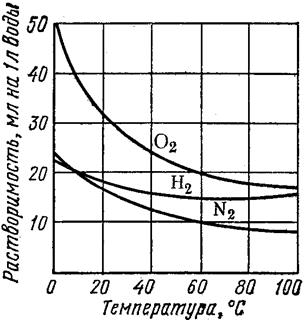
Рис. 20. Кривые растворимости твердых веществ (1) и газов (2) в зависимости от температуры
Подобным образом можно очищать лишь те твердые вещества, растворимость которых сильно зависит от температуры.
Способностью вещества переходить в раствор (растворяться) является его растворимость (концентрация насыщенного раствора).
Способностью вещества переходить в раствор (растворяться) является его растворимость (концентрация насыщенного раствора). На растворимость влияют множественные факторы: природа вещества, характер растворителя, внешние условия (температура, давление). Разделяют:
- малорастворимые вещества (растворимость менее 1 г на 100 г воды). Относят гипс, гашеную известь.
- нерастворимые вещества (менее 0,1 г на 100 г воды). Относят: сульфат бария, бромид серебра, карбонат кальция;
- легкорастворимыевещества (более 10 г на 100 г воды). К таким относят: поваренную соль, медный купорос, аммиак).
Необходимо помнить, что абсолютно нерастворимых веществ не бывает.
Влияние природы на растворимость веществ.
Издавна существовало правило: подобное растворяется в подобном. Т.е. спирты в спиртах, водные растворы – в воде, полярные соединения (альдегиды и т.д.) – в полярных растворах.
Растворимость газовых смесей в жидкостях варьируется в широких диапазонах. Например, в 100 объемах воды может раствориться 2 объема H2, 3 объема O2 и 700 объемов NH3.
Растворимость жидкостей в жидкостях зависит всецело от природы веществ. Модно выделить 3 класса жидкостей:
1. Жидкости, которые неограниченно растворяются друг в друге (воды – спирт, вода – уксусная кислота);
2. Жидкости, которые почти не растворяются друг в друге (вода – ртуть, бензол);
3. Жидкости, которые ограниченно растворяются друг в друге (вода – эфир, амин и т.д.).
Растворимость твердых веществ в жидких средах зависит от характера химической связи в кристаллической решетке. Молекулярные структуры имеют малую растворимость в воде, ковалентные неполярные соединения – не растворимы, а ковалентные полярные – растворяются.
Неорганические соли имеют различную растворимость в воде. Например, соли азотной и азотистой кислот, подавляющее большинство фторидов, бромидов и иодидов также хорошо растворимы, а вот соли угольной кислоты (кроме солей щелочных металлов и NH4 + ) – имеют малую растворимость.
Влияние температуры на растворимость веществ.
Существует основное правило: с повышением температуры растворимость всех твердых веществ повышается.

Приведенная зависимость показывает, что с повышением температуры растворимость данных содей увеличивается. Растворимость NaCl изменяется мало, о чем свидетельствует график.
Взаимная растворимость твердых веществ и жидкостей повышается с увеличением температуры. Ограниченная растворимость может перейти в неограниченную и наоборот.
Критическая температура растворения – такая температура, выше или ниже которой жидкости смешиваются между собой в неограниченных количествах.
Растворимость газов в жидкостях с повышением температуры уменьшается, а с понижением увеличивается..
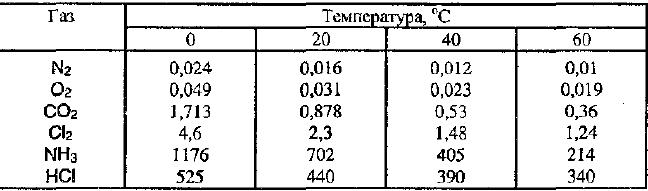
Примеры растворимости газов при различных температурах.
Влияние давления на растворимость веществ.
На растворимость газов больше влияние оказывает давление. При конкретных температуре и давлении газ растворяется до тех пор, пока скорость отрыва молекул газа от поверхности не станет равной скорости, с которой молекулы газа проникают в жидкость. В этот момент устанавливается равновесие, и жидкость становится насыщенным газом.
Зависимость растворимости газов описывается законом Генри:
При постоянной температуре растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью:
где С(Х) – концентрация газа в насыщенном растворе, моль/л;
Kr – постоянная Генри моль·л -1 ·Па -1 ;
Р(Х) – давление газа над раствором, Па.
Также вещества могут взаимно влиять друг на друга. Если раствор содержит электролиты, то вещества растворяются намного хуже, чем в простой воде.
Уменьшение растворимости газов в присутствие электролитов объясняется гидратацией ионов, вследствие чего понижается концентрация свободных молекул воды.
Растворимость — это свойство вещества образовывать с различными растворителями гомогенные смеси. Количество растворяемого вещества, необходимое для получения насыщенного раствора и определяет растворимость этого вещества.
В связи с этим растворимость имеет ту же меру, что и состав, например, массовая доля растворенного вещества в его насыщенном растворе или количество растворенного вещества в его насыщенном растворе.
Все вещества с точки зрения его растворимости можно классифицировать на:
- Хорошо растворимые – в 100 г воды способно раствориться более 10 г. вещества.
- Малорастворимые — в 100 г воды способно раствориться менее 1 г. вещества.
- Нерастворимые — в 100 г воды способно раствориться менее 0,01 г. вещества.
Известно, что если полярность растворяемого вещества схожа с полярностью растворителя, то оно скорее всего растворится. Если же полярности разные, то с большой долей вероятности раствора не получится. Почему же так происходит?
Процесс растворения
Полярный растворитель – полярное растворяемое вещество.
Для примера опишем раствор поваренной соли в воде. Как мы уже знаем, молекулы воды имеют полярную природу с частичным положительным зарядом на каждом атоме водорода и частичным отрицательным – на атоме кислорода. А твердые ионные вещества, вроде хлорида натрия, содержат катионы и анионы. Поэтому, когда поваренную соль помещают в воду, частичный положительный заряд на атомах водорода молекул воды притягивается отрицательно заряженным ионом хлора в NaCl. Аналогично, частичный отрицательный заряд на атомах кислорода молекул воды притягивается положительно заряженным ионом натрия в NaCl. И, поскольку притяжение молекул воды для ионов натрия и хлора сильнее взаимодействия, удерживающего их вместе, соль растворяется.

растворение хлорида натрия
Неполярный растворитель – неполярное растворяемое вещество.
Попробуем растворить кусочек тетрабромида углерода в тетрахлориде углерода. В твердом состоянии молекулы тетрабромида углерода удерживаются вместе благодаря очень слабому дисперсионному взаимодействию. При помещению его в тетрахлорид углерода его молекулы будут располагаться более хаотично, т.е. увеличивается энтропия системы и соединение растворится.
Равновесия при растворении. Произведение растворимости
Рассмотрим раствор малорастворимого соединения. Для того, чтобы между твердым веществом и его раствором установилось равновесие, раствор должен быть насыщенным и соприкасаться с нерастворившейся частью твердого вещества.
Например, предположим, что равновесие установилось в насыщенном растворе хлорида серебра:
AgCl(тв)=Ag + (водн.) + Cl — (водн.)
Рассматриваемое соединение является ионным и в растворенном виде присутствует в виде ионов. Нам уже известно, что в гетерогенных реакциях концентрация твердого вещества остается постоянной, что позволяет включить ее в константу равновесия. Поэтому выражение для константы равновесия будет выглядеть следующим образом:
K = [Ag + ][ Cl — ]
Такая константа называется произведением растворимости ПР, при условии, что концентрации выражаются в моль/л.
ПР = [Ag + ][ Cl — ]
Произведение растворимости равно произведению молярных концентраций ионов, участвующих в равновесии, в степенях, равных соответствующим стехиометрическим коэффициентам в уравнении равновесия.
Следует отличать понятие растворимости и произведения растворимости.
Растворимость вещества может меняться при добавлении в раствор еще какого-либо вещества, а произведение растворимости не зависит от присутствия в растворе дополнительных веществ. Хотя эти две величины взаимосвязаны, что позволяет зная одну величину, вычислить другую.
Зависимость растворимости от температуры и давления
Вода играет важную роль в нашей жизни, она способна растворять большое количество веществ, что имеет большое значение для нас. Поэтому основное внимание уделим именно водным растворам.
Влияние давления на растворимость
Растворимость газов повышается при росте давления газа над растворителем, а растворимость твердых и жидких веществ зависит от давления несущественно.
Уильям Генри впервые пришел к выводу, что
количество газа, которое растворяется при постоянной температуре в заданном объеме жидкости, прямо пропорциональна его давлению.
Данное утверждение известно как закон Генри и выражается оно следующим соотношением:
С = k·P,
где С – растворимость газа в жидкой фазе
Р – давление газа над раствором
k – постоянная Генри
Влияние температуры на растворимость
На следующем рисунке приведены кривые зависимости растворимости некоторых газов в воде от температуры при постоянном давлении газа над раствором (1 атм)
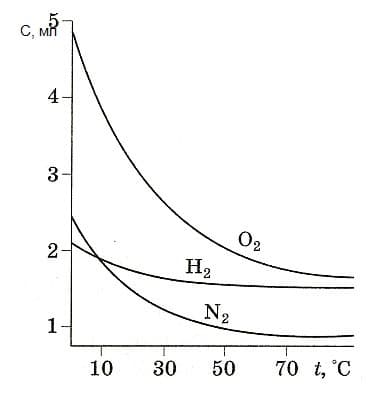
растворимость газов в воде
Как видно, растворимость газов уменьшается с ростом температуры, в отличие от большинства ионных соединений, растворимость которых растет с увеличением температуры.
Влияние температуры на растворимость зависит от изменения энтальпии, которое происходит при процессе растворения. При протекании эндотермического процесса происходит увеличение растворимости с ростом температуры.
Это следует из уже известного нам принципа Ле – Шателье: если изменить одно из условий, при котором система находится в состоянии равновесия – концентрацию, давление или температуру, — то равновесие сместится в направлении той реакции, которая противодействует этому изменению.
Представим, что мы имеем дело с раствором, находящимся в равновесии с частично растворившимся веществом. И этот процесс является эндотермическим, т.е. идет с поглощением теплоты из вне, тогда:
Вещество + растворитель + теплота = раствор
Согласно принципу Ле – Шателье, при эндотермическом процессе, равновесие смещается в направлении, способствующее уменьшению поступления теплоты, т.е. вправо. Таким образом, растворимость увеличивается.
Если же процесс экзотермический, то повышение температуры приводит к уменьшению растворимости.
Далее на рисунке показаны зависимости растворимости некоторых ионных соединений от температуры.

зависимость растворимости ионных соединеий от Температуры
Известно, что существуют растворы жидкостей в жидкостях. Некоторые из них могут растворяться друг в друге в неограниченных количествах, как вода и этиловый спирт, а другие — растворяются лишь частично.
Так, если попробовать растворить четыреххлористый углерод в воде, то при этом образуются два слоя: верхний — насыщенный раствор воды в четыреххлористом углероде и нижний — насыщенный раствор четыреххлористого углерода в воде.
При повышении температуры, в основном, взаимная растворимость таких жидкостей увеличивается. Это происходит до тех пор, пока не будет достигнута критическая температура, при которой обе жидкости смешиваются в любых пропорциях. От давления растворимость жидкостей практически не зависит.
При вводе в смесь, состоящую из двух несмешивающихся между собой жидкостей, вещества, которое может растворяться в любой из этих двух жидкостей, его распределение между этими жидкостями будет пропорционально растворимости в каждой из них.
Согласно закону распределения вещество, способное растворяться в двух несмешивающихся растворителях, распределяется между ними так, что отношение его концентраций в этих растворителях при постоянной температуре остается постоянным, независимо от общего количества растворенного вещества:
где С1 и С2 – концентрации вещества в двух жидкостях
Прежде чем перейти непосредственно к обсуждению мицеллообразования, необходимо хотя бы кратко рассмотреть влияние температуры на растворимость различных ПАВ.
Современные тенденции использования тканей из смесей волокон и необходимость создания энергосберегающей технологии облагораживания тканей и стирки изделий заставляют разрабатывать такие композиции моющих средств, которые были бы эффективными при низких температурах моющей ванны. Это приводит к тому, что в качестве активных компонентов ТВВ и СМС могут быть использованы лишь те ПАВ, которые хорошо растворяются при сравнительно низких температурах.
Многие ПАВ, как ионные, так и неионогеиные, имеют кривые растворимости с верхней критической температурой смешения. Растворимость неионогенных ПАВ, кроме того, ограничена также кривой с нижней критической температурой смешения. Область температур, в которой ПАВ растворяются в концентрациях, достаточных для использования их в составе моющих композиций, зависит от длины углеводородного радикала, природы полярных групп анионактивных веществ и степени оксиэтилирования неионогенных. Растворимость ионогенных веществ обычно характеризуют точкой Крафта (Ткрит), т.е. такой температурой, выше которой ПАВ начинает растворяться практически неограниченно. Такая же характеристика может быть использована и для неионогенных ПАВ с невысокой степенью оксиэтиэтилирования. Повышение температуры растворов, приводящее к дегидратации молекул неионогенных ПАВ, вызывает выделение растворенных молекул в виде отдельной макрофазы. Температуру, выше которой неионогенные ПАВ выделяются из растворов, можно характеризовать точкой (температурой) помутнения Тп. Обычно температуру помутнения с достаточной точностью можно определить визуально по резкому возрастанию мутности растворов при постепенном нагревании. Следует помнить, что процесс разделения фаз в растворах ПАВ носит релаксационный характер и экспериментальные значения Тп зависят от скорости нагревания.
Еще в конце прошлого столетия (1896 г.) Крафт при изучении растворения мыл в воде установил необычную температурную зависимость их растворимости.
Последующие многочисленные исследования показали, что такая зависимость характерна для многих коллоидных поверхностно-активных веществ. В частности, Мэррей и Гартли показали, что растворимость длинноцепочечных коллоидных анионактивных ПАВ, например цетилсульфоната натрия, также изменяется с повышением температуры необычным образом. Незначительная при низких температурах растворимость их с повышением температуры увеличивается незначительно и монотонно, а затем в довольно узком критическом интервале температур возрастает очень резко, скачкообразно. Аналогичные исследования были проведены на ряде других катион- и анионактивных коллоидных ПАВ.
Растворимость типичных ионогенных ПАВ, состоящих из углеводородного радикала и гидрофильной ионной группы, зависит от числа углеродных атомов в гидрофобной части молекулы. Некоторое влияние оказывает природа ионной группы, а также сопутствующий катион - противоион. Обычно эти вещества плохо растворимы в холодной воде и выделяются из раствора при охлаждении до определенной температуры.
Рис. 2.54. Диаграмма состояния ионогенного ПАВ (на примере цетилпиридиний бромида)
Для многих ионных ПАВ, имеющих практическое значение, такая температура находится в пределах 30-50°С. Снизить ее можно либо смешивая анионактивные вещества с неионогенными, либо вводя оксиэтиленовые группы в молекулы анионактивных веществ.
Сульфатирование ПАВ позволяет получить перспективный класс веществ. Введение оксиэтиленовых групп приводит к улучшению растворимости при низких температурах, снижению точки Крафта, а наличие ионной гидрофильной группы придает этому классу ПАВ хорошую растворимость при повышенных температурах.
Неионогенные ПАВ растворяются в воде в результате гидратации эфирных атомов кислорода оксиэтиленовых групп. Их растворимость определяется балансом энергий взаимодействия:
где Е11– энергия взаимодействиямолекулводы;Е12- энергия взаимодействиямолекулводыс эфирными атомами кислорода оксиэтиленовой цепочки ПАВ; Е22- энергия взаимодействиямолекулПАВ в кристаллах.
При повышении температуры все три вида энергии уменьшаются, но интенсивность их изменения такова, что при низких температурах будет преобладать энергия взаимодействия Е22, в результате чего неионогенное ПАВ будет растворяться ограниченно и в равновесии с кристаллами ПАВ будет разбавленный молекулярный раствор. Присутствие полиэтиленгликолей, образующихся как примесь при синтезе неионогенных веществ методом оксиэтилирования, в образцах ПАВ исключает образование кристаллов.
Таким образом, снижение растворимости неионогенных ПАВ при понижении температуры раствора ниже некоторой критической приводит к выделению растворенного вещества. При этом система разделяется на две несмешивающиеся фазы, одна из которых представляет водный раствор неионогенного ПАВ, а другая - кристаллогидрат этого вещества. Установлено, что кристаллы неионогенных ПАВ имеют типичную для кристаллов мыл игольчатую форму.
Если повышать температуру раствора, то кристаллогидраты начинают растворяться, и система из гетерогенной переходит в гомогенную. Эта температура, подобно температурной границе точки Крафта будет характеризовать фазовое превращение - растворение кристаллов ПАВ.
Дальнейшее нагревание раствора приводит к тому, что система вновь разделяется на две несмешивающиеся фазы - раствор неионогенного ПАВ и выделившееся дегидрагированное вещество. Начало этого фазового разделения характеризуется резким возрастанием мутности раствора. При последующем увеличении температуры мутность увеличивается и после достижения некоторого максимального значения происходит уменьшение мутности вследствие выделения капелек неионогенного ПАВ и образования макрофазы. Температура этого фазового разделения может определяться визуально.
Таким образом, растворимость неионогенных веществ в воде имеет две ярко выраженные температурные границы: нижнюю границу растворения, связанную с недостаточной кинетической энергией молекул ПАВ, и верхнюю границу растворения, связанную с уменьшением гидратации эфирного кислорода оксиэтиленовых групп.
Рис. 2.55. Фазовая диаграмма водного раствора неионогенного ПАВ (на примере ДС-7)
Увеличение концентрации растворенного вещества смещает нижнюю температурную границу растворения в сторону более высоких значений температуры. При этом фазовый переход проявляется более четко в растворах с высокой концентрацией.
Температура помутнения имеет экстремальную зависимость от концентрации растворенного вещества. Такое влияние концентрации растворенного неионогенного ПАВ должно быть связано с изменением в мицеллярной структуре раствора при изменении концентрации.
На рис. 2.55. показана типичная диаграмма состояния раствора неионогенного ПАВ (на примере ДС-7). На этом рисунке: 1-зависимость температуры помутнения растворов от концентрации, 2- зависимость температуры растворения от концентрации, 3- зависимость ККМ от температуры; I- кристаллы« молекулы, II- мицеллы« молекулы, III- эмульсия ПАВ« молекулы, IV- молекулярный раствор.
Очень часто в технологической практике и в быту используются технические неионогенные ПАВ, в образцах которых присутствуют примеси полиэтиленгликолей, препятствующие образованию кристаллов. Они растворяются при низких температурах, но выделяются при нагревании. Поэтому на диаграммах состояния у них присутствует только кривая равновесия с нижней критической температурой смешения.
Растворимость (Р, χ или ks) – это характеристика насыщенного раствора, которая показывает, какая масса растворенного вещества может максимально раствориться в 100 г растворителя. Размерность растворимости — г/ 100 г воды. Поскольку мы определяем массу соли, которая приходится на 100 г воды, в формулу растворимости добавляем множитель 100:

здесь mр.в. – масса растворенного вещества, г
mр-ля – масса растворителя, г
Иногда используют обозначение коэффициент растворимости kS.
Задачи на растворимость, как правило, вызывают сложности, так как эта физическая величина для школьников не очень привычна.
Растворимость веществ в различных растворителях меняется в широких пределах.
В таблице приведена растворимость некоторых веществ в воде при 20 o С:
Растворимость, г на 100 г H2O
Растворимость, г на 100 г H2O
От чего же зависит растворимость веществ? От ряда факторов: от природы растворенного вещества и растворителя, от температуры и давления. В справочных таблицах предлагается вещества делят на хорошо растворимые, малорастворимые и нерастворимые. Такое деление очень условное, поскольку абсолютно нерастворимых веществ нет. Даже серебро и золото растворимы в воде, однако их растворимость настолько мала, что можно пренебречь ей.
Зависимость растворимости от природы растворенного вещества и растворителя*
Растворимость твердых веществ в жидкостях зависит от структуры твердого вещества (от типа кристаллической решетки твердого вещества). Например , вещества с металлическими кристаллическими решетками (железо, медь и др.) очень мало растворимы в воде. Вещества с ионной кристаллической решеткой, как правило, хорошо растворимы в воде.
Есть замечательное правило: “подобное хорошо растворяется в подобном”. Вещества с ионным или полярным типом связи хорошо растворяются в полярных растворителях. Например , соли хорошо растворимы в воде. В то же время неполярные вещества, как правило, хорошо растворяются в неполярных растворителях.
Большинство солей щелочных металлов и аммония хорошо растворимы в воде. Хорошо растворимы почти все нитраты, нитриты и многие галогениды (кроме галогенидов серебра, ртути, свинца и таллия) и сульфаты (кроме сульфатов щелочноземельных металлов, серебра и свинца). Для переходных металлов характерна небольшая растворимость их сульфидов, фосфатов, карбонатов и некоторых других солей.
Растворимость газов в жидкостях также зависит от их природы. Например, в 100 объемах воды при 20 o С растворяется 2 объема водорода, 3 объема кислорода. В тех же условиях в 1 объеме Н2О растворяется 700 объемов аммиака.
Влияние температуры на растворимость газов, твердых веществ и жидкостей*
Растворение газов в воде вследствие гидратации молекул растворяемого газа сопровождается выделением теплоты. Поэтому при повышении температуры растворимость газов понижается.
Температура различным образом влияет на растворимость твердых веществ в воде. В большинстве случаев растворимость твердых веществ возрастает с повышением температуры. Например , растворимость нитрата натрия NaNO3 и нитрата калия КNO3 при нагревании увеличивается (процесс растворения протекает с поглощением теплоты). Растворимость NaCl при увеличении температуры возрастает незначительно, что связано с почти нулевым тепловым эффектом растворения поваренной соли.
Влияние давления на растворимость газов, твердых веществ и жидкостей*
На растворимость твердых и жидких веществ в жидкостях давление практически не оказывает влияния, так как изменение объема при растворении невелико. При растворении газообразных веществ в жидкости происходит уменьшение объема системы, поэтому повышение давления приводит к увеличению растворимости газов. В общем виде зависимость растворимости газов от давления подчиняется закону У. Генри (Англия, 1803 г.): растворимость газа при постоянной температуре прямо пропорциональна его давлению над жидкостью.
Закон Генри справедлив лишь при небольших давлениях для газов, растворимость которых сравнительно невелика и при условии отсутствия химического взаимодействия между молекулами растворяемого газа и растворителем.
Влияние посторонних веществ на растворимость*
В присутствии в воде других веществ (солей, кислот и щелочей) растворимость газов уменьшается. Растворимость газообразного хлора в насыщенном водном растворе поваренной соли в 10 раз меньше. Чем в чистой воде.
Эффект понижения растворимости в присутствии солей называется высаливанием. Понижение растворимости обусловлено гидратацией солей, что вызывает уменьшение числа свободных молекул воды. Молекулы воды, связанные с ионами электролита, уже не являются растворителем для других веществ.
Примеры задач на растворимость
Задача 1. Массовая доля вещества в насыщенном растворе равна 24% при некоторой температуре. Определите коэффициент растворимости этого вещества при данной температуре.
Решение:
Для определения растворимости вещества примем массу раствора равной 100 г. Тогда масса соли равна:
Масса воды равна:
mводы = mр-ра – mр.в. = 100 — 24 = 76 г
χ = mр.в./mр-ля⋅100 = 24/76⋅100 = 31,6 г вещества на 100 г воды.
Еще несколько аналогичных задач:
2. Массовая доля соли в насыщенном растворе при некоторой температуре равна 28,5%. Определите коэффициент растворимости вещества при этой температуре.
3. Определите коэффициент растворимости нитрата калия при некоторой температуре, если массовая доля соли при этой температуре равна 0,48.
4. Какая масса воды и соли потребуется для приготовления 500г насыщенного при некоторой температуре раствора нитрата калия, если его коэффициент растворимости при этой температуре равен 63,9г соли в 100г воды?
Ответ: 194,95 г
5. Коэффициент растворимости хлорида натрия при некоторой температуре составляет 36г соли в 100г воды. Определите молярную концентрацию насыщенного раствора этой соли, если плотность раствора 1,2 г/мл.
6. Какая масса соли и 5% раствора её потребуется для приготовления 450г насыщенного при некоторой температуре раствора сульфата калия, если его коэффициент растворимости при этой температуре равен 439г/1000г воды?
7. Какая масса нитрата бария выделится из раствора, насыщенного при 100ºС и охлаждённого до 0ºС, если во взятом растворе было 150мл воды? Коэффициент растворимости нитрата бария при температурах 0ºС и 100ºС равен соответственно 50г и 342г в 100г воды.
8. Коэффициент растворимости хлорида калия при 90ºС равен 500г/л воды. Сколько граммов этого вещества можно растворить в 500г воды при 90ºС и какова его массовая доля в насыщенном растворе при этой температуре?
9. В 500г воды растворено при нагревании 300г хлорида аммония. Какая масса хлорида аммония выделится из раствора при его охлаждении до 50ºС, если коэффициент растворимости соли при этой температуре равен 50г/л воды?
Читайте также:

