Вероятность протекания химических реакций кратко
Обновлено: 02.07.2024
Вероятность протекания реакции по верхней части схемы исключается, так как алкилкарбаминоилхлориды устойчивы при температуре до - 100 С, в то время как реакция почти количественно протекает при температурах ниже нуля. Возможность же легкого дегидрохлорирования алкилкарбаминоилхлоридов в условиях реакции ( под действием аминосиланов или выделяющихся хлорсиланов) маловероятна, так как метилкарбаминоилхлорид не изменяется даже при длительном кипячении его с хлорсиланами. [2]
Вероятность протекания реакции по этой схеме ( А или Б) отчасти подтверждается констатированной на многочисленных примерах склонностью сульфогруппы уступать место ннтрогруппе, особенно при наличии реактивирующей ядро группы ОН. [3]
Вероятность протекания реакций раскисления в сварочной ванне определяется сродством различных элементов к кислороду и их количеством в сварочной ванне. [4]
Он характеризует вероятность протекания реакции при падении одной ядерной частицы на тонкую мишень площадью 1 см2); К - константа распада радиоактивного изотопа. [5]
Данные о вероятности протекания реакций в процессе обжига могут быть получены при сравнении значений изменения изобарного потенциала этих реакций. [6]
При повышении температуры вероятность протекания реакции ( 3) и, соответственно этому, концентрация углекислоты в продуктах реакции падают. В табл. 35 приводятся равновесные концентрации компонентов при нескольких значениях температуры. Эти данные свидетельствуют о том, что выше 900 С реакция ( 1) протекает до конца, и вторичное превращение ( 3) не имеет места. [7]
Верхние температурные пределы вероятности протекания реакции полимеризации бутиленов и алкилирования изобутана бутиленами практически совпадают. [9]
Такой громадный перепаде смысле вероятности протекания реакций требует объяснения; самое изучение эфемерности молекул, связанное с особой криохимической техникой низкотемпературного замораживания их реакционной способности, в матрицах из инертных газов оказывается довольно сложным. Эфемерные молекулы, служа промежуточными образованиями в сложных звеньях элементарных актов, очень существенны как для понимания процессов химической технологии, так и в биохимии. [10]
Учитывать концентрацию ионов при предсказании вероятности протекания реакции следует только в тех случаях, когда потенциалы двух сравниваемых реакций окисления-восстановления очень близки; практически же при разнице больше чем в 0 3 В о возможности протекания окислительно-восстановительной реакции можно судить по стандартным потенциалам. [11]
Сечением ядра ( а) называется вероятность протекания реакции . [13]
Применение законов химической термодинамики дает возможность определить вероятность протекания реакции , максимальную степень превращения и равновесную концентрацию продуктов. [14]
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.

Описание презентации по отдельным слайдам:

Вероятность протекания химических реакций. Скорость химических реакций. Казань 2017г.

Скорость химических реакций Химическая кинетика изучает скорость и механизмы химических реакций

Гомогенные и гетерогенные системы Гетерогенные системы Фаза – совокупность всех гомогенных частей системы, одинаковых по составу и по всем физическим и химическим свойствам и отграниченных от других частей системы поверхностью раздела. Гомогенные системы состоят из одной фазы.

Сущность химических реакций сводится к разрыву связей в исходных веществах и возникновению новых связей в продуктах реакции. При этом общее число атомов каждого элемента до и после реакции остается постоянным. Поскольку образование связей происходит с выделением, а разрыв связей — с поглощением энергии, то химические реакции сопровождаются энергетическими эффектами. Очевидно, если разрушаемые связи в исходных веществах менее прочны, чем образующиеся в продуктах реакции, то энергия выделяется, и наоборот. Обычно энергия выделяется и поглощается в форме теплоты. Со скоростью химических реакций связаны представления о превращении веществ, а также экономическая эффективность их получения в промышленных масштабах. Учение о скоростях и механизмах химических реакций называется химической кинетикой. Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ в единицу времени при неизменном объеме системы.

По мере расходования вещества А скорость реакции уменьшается (как это показано на рис. 4.1). Отсюда следует, что скорость реакции может быть определена лишь для некоторого промежутка времени. Так как концентрация вещества А в момент времени Т1 измеряется величиной c1, а в момент Т2 — величиной С2, то за промежуток времени изменение концентрации вещества составит ∆С = с2 — с1, откуда определится средняя скорость реакции (и): Рассмотрим в общем виде скорость реакции, протекающей по уравнению:

Скорость химических реакций (для гомогенных систем) A + B = D + G C0 = 0,5 моль/л C1 = 5 моль/л t = 10 c

Скорость химических реакций (для гомогенных систем) A + B = D + G C0 = 2 моль/л C1 = 0,5 моль/л t = 10 c (для гетерогенных систем)

Факторы, от которых зависит скорость реакции Природа реагирующих веществ Концентрация веществ в системе Площадь поверхности (для гетерогенных систем) Температура Наличие катализаторов

1. Влияние концентраций реагирующих веществ. Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число же столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. Для реакции (I) этот закон выразится уравнением v = ксА- св, где СА и Св — концентрации веществ А и В, моль/л; к — коэффициент пропорциональности, называемый константой скорости реакции. Основной закон химической кинетики часто называют законом действующих масс.

2.Влияние температуры Правило Вант-Гоффа При нагревании системы на 10 ˚С скорость реакции возрастает в 2-4 раза - температурный коэффициент Вант-Гоффа. Якоб Вант-Гофф (1852-1911)

Энергия, которую надо сообщить молекулам (частицам) реагирующих веществ, чтобы превратить их в активные, называется энергией активации Еа – кдж /моль

На примере реакции в общем виде: А2+ В2 = 2АВ. Ось ординат характеризует потенциальную энергию системы, ось абсцисс — ход реакции: исходное состояние —* переходное состояние —* конечное состояние. Чтобы реагирующие вещества А2 и В2 образовали продукт реакции АВ, они должны преодолеть энергетический барьер С (рис. 4.2). На это затрачивается энергия активации Ed, на значение которой возрастает энергия системы. При этом в ходе реакции из частиц реагирующих веществ образуется промежуточная неустойчивая группировка, называемая переходным состоянием или активированным комплексом (в точке С), последующий распад которого приводит к образованию конечного продукта АВ.

Механизм реакции можно изобразить схемой Если при распаде активированного комплекса выделяется больше энергии, чем это необходимо для активации частиц, то реакция экзотермическая.

Как видно из рис. 4.2, разность энергий конечного состояния системы и начального равна тепловому эффекту реакции. Скорость реакции непосредственно зависит от значения энергии активации: если оно мало, то за определенное время протекания реакции энергетический барьер преодолеет большое число частиц и скорость реакции будет высокой, но если энергия активации велика, то реакция идет медленно. При взаимодействии ионов энергия активации очень мала и ионные реакции протекают с очень большой скоростью (практически мгновенно).

Механизм разложения пероксида водорода 2H2O2 = 2H2O + O2 (1)H2O2 = H+ + HO2- (2)HO2- + H2O2 = H2O + O2 + OH- (3)OH- + H+ = H2O

Разложение H2O2 в присутствии Fe3+ H2O2 = H+ + HO2- HO2- + Fe3+ = Fe2+ + HO2 HO2 + Fe3+ = Fe2+ + O2 + H+ Fe2+ + H2O2 = Fe3+ + OH + OH- OH + H2O2 = H2O + HO2 Fe2+ + HO2 = Fe3+ + HO2- OH- + H+ = H2O . . . . . . Сравните с механизмом без участия катализатора

Сущность химических реакций сводится к разрыву связей в исходных веществах и возникновению новых связей в продуктах реакции. При этом общее число атомов каждого элемента до и после реакции остается постоянным. Поскольку образование связей происходит с выделением, а разрыв связей — с поглощением энергии, то химические реакции сопровождаются энергетическими эффектами. Очевидно, если разрушаемые связи в исходных веществах менее прочны, чем образующиеся в продуктах реакции, то энергия выделяется, и наоборот. Обычно энергия выделяется и поглощается в форме теплоты. Со скоростью химических реакций связаны представления о превращении веществ, а также экономическая эффективность их получения в промышленных масштабах. Учение о скоростях и механизмах химических реакций называется химической кинетикой. Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ в единицу времени при неизменном объеме системы.
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

Вероятность Вероятность протекания протекания химических реакций. химических реакций. Скорость химических Скорость химических реакций. реакций. Подготовила: Подготовила: преподаватель химии преподаватель химии 1 квалификационной 1 квалификационной категории категории Сагдиева М.С. Сагдиева М.С. Казань 2017г. Казань 2017г.
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

Скорость химических Скорость химических реакций реакций Химическая кинетика изучает скорость и изучает скорость и Химическая кинетика механизмы химических реакций механизмы химических реакций
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

Гомогенные и Гомогенные и гетерогенные системы гетерогенные системы Фаза – совокупность всех гомогенных частей системы, одинаковых по составу и по всем химическим физическим свойствам и отграниченных от других поверхностью раздела. системы и частей Гомогенные системы состоят из одной фазы. Гетерогенные системы Гетерогенные системы
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

Сущность химических реакций сводится к разрыву связей в исходных веществах и возникновению новых связей в продуктах реакции. При этом общее число атомов каждого элемента до и после реакции остается постоянным. энергии, поглощением Поскольку образование связей происходит с выделением, а разрыв связей — с сопровождаются энергетическими эффектами. Очевидно, если разрушаемые связи в исходных веществах менее прочны, чем образующиеся в продуктах реакции, то энергия выделяется, и наоборот. Обычно энергия выделяется и поглощается в форме теплоты. химические то реакции Со скоростью химических реакций связаны представления о превращении веществ, в промышленных масштабах. Учение о скоростях и механизмах химических реакций называется химической кинетикой. эффективность их получения экономическая также а Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ в единицу времени при неизменном объеме системы.
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

Рассмотрим в общем виде скорость реакции, протекающей по уравнению: По мере расходования вещества А скорость реакции уменьшается (как это показано на рис. 4.1). Отсюда следует, что скорость реакции может быть определена лишь для некоторого промежутка времени. Так как концентрация вещества А в момент времени Т1 измеряется величиной c1, а в момент Т2 — величиной С2, то за промежуток времени изменение концентрации вещества составит ∆С = с2 — с1, откуда определится средняя скорость реакции (и):
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)
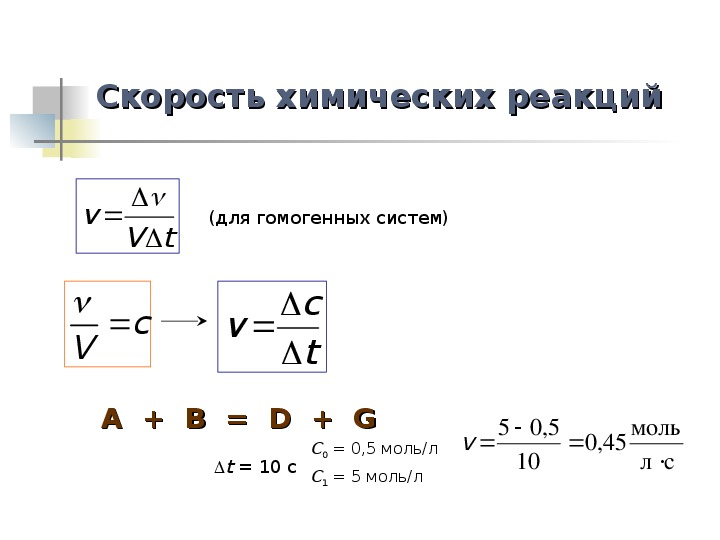
Скорость химических реакций Скорость химических реакций (для гомогенных систем) tVv cV A + B = D + G A + B = D + G cv t t = 10 c C0 = 0,5 моль/л C1 = 5 моль/л v 5,05 10 45,0 моль сл
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

Скорость химических реакций A + B = D + G A + B = D + G C0 = 2 моль/л C1 = 0,5 моль/л t = 10 c v 25,0 10 15,0 моль сл cv t tSv (для гомогенных систем) v 25,0 10 15,0 моль сл (для гетерогенных систем)
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

Факторы, от которых зависит скорость реакции Природа реагирующих веществ Природа реагирующих веществ Концентрация веществ в Концентрация веществ в системе системе Площадь поверхности (для Площадь поверхности (для гетерогенных систем) гетерогенных систем) Температура Температура Наличие катализаторов Наличие катализаторов
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

1. Влияние концентраций реагирующих веществ. Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число же столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. Для реакции (I) этот закон выразится уравнением v = ксА св, где СА и Св — концентрации веществ А и В, моль/л; к — коэффициент пропорциональности, называемый константой скорости реакции. Основной закон химической кинетики часто называют законом действующих масс.
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

2.Влияние температуры Якоб ВантГофф Якоб ВантГофф (18521911) (18521911) Правило Вант-Гоффа При нагревании системы на 10 ˚С скорость реакции возрастает в 2-4 раза - температурный коэффициент Вант-Гоффа. t vv 10 0 100tvv
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

сообщить молекулам сообщить молекулам Энергия, которую надо которую надо (частицам) реагирующих (частицам) реагирующих веществ, чтобы превратить веществ, чтобы превратить их в активные, , называется называется их в активные энергией активации энергией активации ЕЕа – кдж /моль а – кдж /моль
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

На примере реакции в общем виде: А2+ В2 = 2АВ. Ось ординат характеризует потенциальную энергию системы, ось абсцисс — ход реакции: исходное состояние —* переходное состояние —* конечное состояние. Чтобы реагирующие вещества А2 и В2 образовали продукт реакции АВ, они должны преодолеть энергетический барьер С (рис. 4.2). На это затрачивается энергия активации Ed, на значение которой возрастает энергия системы. При в ходе реакции из частиц реагирующих образуется промежуточная неустойчивая группировка, называемая переходным состоянием или активированным комплексом (в точке С), последующий распад которого приводит к образованию конечного продукта АВ. веществ этом
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)
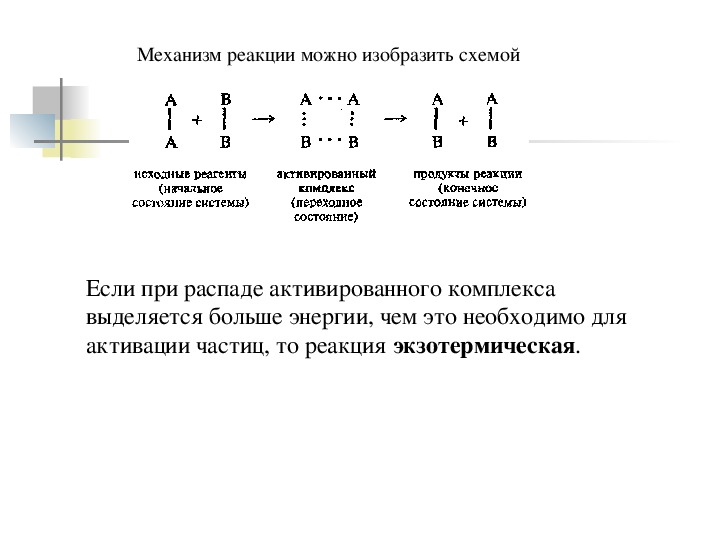
Механизм реакции можно изобразить схемой Если при распаде активированного комплекса выделяется больше энергии, чем это необходимо для активации частиц, то реакция экзотермическая.
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

Как видно из рис. 4.2, разность энергий конечного и начального равна тепловому эффекту реакции. состояния системы Скорость реакции непосредственно зависит от значения энергии активации: если оно мало, то за определенное время протекания энергетический барьер преодолеет большое число частиц и скорость реакции будет высокой, но если энергия активации велика, то реакция идет медленно. реакции При взаимодействии ионов энергия активации очень мала и ионные реакции протекают с очень большой скоростью (практически мгновенно).
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

Механизм разложения Механизм разложения пероксида водорода пероксида водорода 2H2O2 = 2H2O + O2 (1) H2O2 = H+ + HO2 (2) HO2 + H2O2 = H2O + O2 + OH (3) OH + H+ = H2O
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

Разложение H2O2 в присутствии Fe3+ . H2O2 = H+ + HO2- HO2- + Fe3+ = Fe2+ + HO2 HO2 + Fe3+ = Fe2+ + O2 + H+ Fe2+ + H2O2 = Fe3+ + OH + OH- OH + H2O2 = H2O + HO2 Fe2+ + HO2 = Fe3+ + HO2- OH- + H+ = H2O . . . . . Сравните с механизмом без участия катализатора
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
1. Температура
Самый простой способ изменить скорость реакции – изменить температуру . Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается .
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10 о С.
Правило Вант-Гоффа звучит так: повышение температуры на 10 о С приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ . Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например , для реакции образования аммиака:
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление
Концентрация газов напрямую зависит от давления . При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается .
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор

Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.

Пример гетерогенного катализа – синтез аммиака:
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например , для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности . Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например , хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например , оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
Читайте также:

