Углерод и его свойства материаловедение кратко
Обновлено: 06.07.2024
УГЛЕРОД, С (carboneum), неметаллический химический элемент IVA группы (C, Si, Ge, Sn, Pb) периодической системы элементов. Встречается в природе в виде кристаллов алмаза (рис. 1), графита или фуллерена и других форм и входит в состав органических (уголь, нефть, организмы животных и растений и др.) и неорганических веществ (известняк, пищевая сода и др.).
Углерод широко распространен, но содержание его в земной коре всего 0,19%.
Рис. 1. СТРУКТУРА алмаза (а) и графита (б).
Углерод широко используется в виде простых веществ. Кроме драгоценных алмазов, являющихся предметом ювелирных украшений, большое значение имеют промышленные алмазы – для изготовления шлифовального и режущего инструмента.
Древесный уголь и другие аморфные формы углерода применяются для обесцвечивания, очистки, адсорбции газов, в областях техники, где требуются адсорбенты с развитой поверхностью. Карбиды, соединения углерода с металлами, а также с бором и кремнием (например, Al4C3, SiC, B4C) отличаются высокой твердостью и используются для изготовления абразивного и режущего инструмента. Углерод входит в состав сталей и сплавов в элементном состоянии и в виде карбидов. Насыщение поверхности стальных отливок углеродом при высокой температуре (цементация) значительно увеличивает поверхностную твердость и износостойкость. См. также СПЛАВЫ.
В природе существует множество различных форм графита; некоторые получены искусственно; имеются аморфные формы (например, кокс и древесный уголь). Сажа, костяной уголь, ламповая сажа, ацетиленовая сажа образуются при сжигании углеводородов при недостатке кислорода. Так называемый белый углерод получается сублимацией пиролитического графита при пониженном давлении – это мельчайшие прозрачные кристаллики графитовых листочков с заостренными кромками.
Историческая справка.
Впервые алмазы нашли применение в Индии, а в Бразилии драгоценные камни приобрели коммерческое значение в 1725; месторождения в Южной Африке были открыты в 1867. В 20 в. основными производителями алмазов являются ЮАР, Заир, Ботсвана, Намибия, Ангола, Сьерра-Леоне, Танзания и Россия. Искусственные алмазы, технология которых была создана в 1970, производятся для промышленных целей.
Аллотропия.
Если структурные единицы вещества (атомы для одноатомных элементов или молекулы для полиатомных элементов и соединений) способны соединяться друг с другом в более чем одной кристаллической форме, это явление называется аллотропией. У углерода три аллотропические модификации – алмаз, графит и фуллерен. В алмазе каждый атом углерода имеет 4 тетраэдрически расположенных соседа, образуя кубическую структуру (рис. 1,а). Такая структура отвечает максимальной ковалентности связи, и все 4 электрона каждого атома углерода образуют высокопрочные связи С–С, т.е. в структуре отсутствуют электроны проводимости. Поэтому алмаз отличается отсутствием проводимости, низкой теплопроводностью, высокой твердостью; он самый твердый из известных веществ (рис. 2). На разрыв связи С–С (длина связи 1,54 Å, отсюда ковалентный радиус 1,54/2 = 0,77 Å) в тетраэдрической структуре требуются большие затраты энергии, поэтому алмаз, наряду с исключительной твердостью, характеризуется высокой температурой плавления (3550° C).
Другой аллотропической формой углерода является графит, сильно отличающийся от алмаза по свойствам. Графит – мягкое черное вещество из легко слоящихся кристалликов, отличающееся хорошей электропроводностью (электрическое сопротивление 0,0014 Ом·см). Поэтому графит применяется в дуговых лампах и печах (рис. 3), в которых необходимо создавать высокие температуры. Графит высокой чистоты применяют в ядерных реакторах в качестве замедлителя нейтронов. Температура плавления его при повышенном давлении равна 3527° C. При обычном давлении графит сублимируется (переходит из твердого состояния в газ) при 3780° C.
Структура графита (рис. 1,б) представляет собой систему конденсированных гексагональных колец с длиной связи 1,42 Å (значительно короче, чем в алмазе), но при этом каждый атом углерода имеет три (а не четыре, как в алмазе) ковалентные связи с тремя соседями, а четвертая связь (3,4 Å) слишком длинна для ковалентной связи и слабо связывает параллельно уложенные слои графита между собой. Именно четвертый электрон углерода определяет тепло- и электропроводность графита – эта более длинная и менее прочная связь формирует меньшую компактность графита, что отражается в меньшей твердости его в сравнении с алмазом (плотность графита 2,26 г/см 3 , алмаза – 3,51 г/см 3 ). По той же причине графит скользкий на ощупь и легко отделяет чешуйки вещества, что и используется для изготовления смазки и грифелей карандашей. Свинцовый блеск грифеля объясняется в основном наличием графита.
Волокна углерода имеют высокую прочность и могут использоваться для изготовления искусственного шелка или другой пряжи с высоким содержанием углерода.
При высоких давлении и температуре в присутствии катализатора, например железа, графит может превращаться в алмаз. Этот процесс реализован для промышленного получения искусственных алмазов. Кристаллы алмаза растут на поверхности катализатора. Равновесие графит алмаз существует при 15 000 атм и 300 K или при 4000 атм и 1500 K. Искусственные алмазы можно получать и из углеводородов.
К аморфным формам углерода, не образующим кристаллов, относят древесный уголь, получаемый нагревом дерева без доступа воздуха, ламповую и газовую сажу, образующуюся при низкотемпературном сжигании углеводородов при недостатке воздуха и конденсируемую на холодной поверхности, костяной уголь – примесь к фосфату кальция в процессе деструкции костной ткани, а также каменный уголь (природное вещество с примесями) и кокс, сухой остаток, получаемый при коксовании топлив методом сухой перегонки каменного угля или нефтяных остатков (битуминозных углей), т.е. нагреванием без доступа воздуха. Кокс применяется для выплавки чугуна, в черной и цветной металлургии. При коксовании образуются также газообразные продукты – коксовый газ (H2, CH4, CO и др.) и химические продукты, являющиеся сырьем для получения бензина, красок, удобрений, лекарственных препаратов, пластмасс и т.д. Схема основного аппарата для производства кокса – коксовой печи – приведена на рис. 3.
Различные виды угля и сажи отличаются развитой поверхностью и поэтому используются как адсорбенты для очистки газа, жидкостей, а также как катализаторы. Для получения различных форм углерода применяют специальные методы химической технологии. Искусственный графит получают прокаливанием антрацита или нефтяного кокса между углеродными электродами при 2260° С (процесс Ачесона) и используют в производстве смазочных материалов и электродов, в частности для электролитического получения металлов.
Строение атома углерода.
Ядро наиболее стабильного изотопа углерода массой 12 (распространенность 98,9%) имеет 6 протонов и 6 нейтронов (12 нуклонов), расположенных тремя квартетами, каждый содержит 2 протона и два нейтрона аналогично ядру гелия. Другой стабильный изотоп углерода – 13 C (ок. 1,1%), а в следовых количествах существует в природе нестабильный изотоп 14 C с периодом полураспада 5730 лет, обладающий b-излучением. В нормальном углеродном цикле живой материи участвуют все три изотопа в виде СO2. После смерти живого организма расход углерода прекращается и можно датировать С-содержащие объекты, измеряя уровень радиоактивности 14 С. Снижение b-излучения 14 CO2 пропорционально времени, прошедшему с момента смерти. В 1960 У.Либби за исследования с радиоактивным углеродом был удостоен Нобелевской премии. См. также ДАТИРОВКА ПО РАДИОАКТИВНОСТИ.
В основном состоянии 6 электронов углерода образуют электронную конфигурацию 1s 2 2s 2 2px 1 2py 1 2pz 0 . Четыре электрона второго уровня являются валентными, что соответствует положению углерода в IVA группе периодической системы (см. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ). Поскольку для отрыва электрона от атома в газовой фазе требуется большая энергия (ок. 1070 кДж/моль), углерод не образует ионные связи с другими элементами, так как для этого необходим был бы отрыв электрона с образованием положительного иона. Имея электроотрицательность, равную 2,5, углерод не проявляет и сильного сродства к электрону, соответственно не являясь активным акцептором электронов. Поэтому он не склонен к образованию частицы с отрицательным зарядом. Но с частично ионным характером связи некоторые соединения углерода существуют, например, карбиды. В соединениях углерод проявляет степень окисления 4. Чтобы четыре электрона смогли участвовать в образовании связей, необходимо распаривание 2s-электронов и перескок одного из этих электронов на 2pz-орбиталь; при этом образуются 4 тетраэдрические связи с углом между ними 109°. В соединениях валентные электроны углерода лишь частично оттянуты от него, поэтому углерод образует прочные ковалентные связи между соседними атомами типа С–С с помощью общей электронной пары. Энергия разрыва такой связи равна 335 кДж/моль, тогда как для связи Si–Si она составляет всего 210 кДж/моль, поэтому длинные цепочки –Si–Si– неустойчивы. Ковалентный характер связи сохраняется даже в соединениях высокореакционноспособных галогенов с углеродом, CF4 и CCl4. Углеродные атомы способны предоставлять на образование связи более одного электрона от каждого атома углерода; так образуются двойная С=С и тройная СєС связи. Другие элементы также образуют связи между своими атомами, но только углерод способен образовывать длинные цепи. Поэтому для углерода известны тысячи соединений, называемых углеводородами, в которых углерод связан с водородом и другими углеродными атомами, образуя длинные цепи или кольцевые структуры. См. ХИМИЯ ОРГАНИЧЕСКАЯ.
В этих соединениях возможно замещение водорода на другие атомы, наиболее часто на кислород, азот и галогены с образованием множества органических соединений. Важное значение среди них занимают фторуглеводороды – углеводороды, в которых водород замещен на фтор. Такие соединения чрезвычайно инертны, и их используют как пластичные и смазочные материалы (фторуглероды, т.е. углеводороды, в которых все атомы водорода замещены на атомы фтора) и как низкотемпературные хладагенты (хладоны, или фреоны, – фторхлоруглеводороды).
Стандартная атомная масса.
В 1961 Международные союзы теоретической и прикладной химии (ИЮПАК) и по физике приняли за единицу атомной массы массу изотопа углерода 12 C, упразднив существовавшую до того кислородную шкалу атомных масс. Атомная масса углерода в этой системе равна 12,011, так как она является средней для трех природных изотопов углерода с учетом их распространенности в природе. См. АТОМНАЯ МАССА.
Химические свойства углерода и некоторых его соединений.
Некоторые физические и химические свойства углерода приведены в статье ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ. Реакционная способность углерода зависит от его модификации, температуры и дисперсности. При низких температурах все формы углерода достаточно инертны, но при нагревании окисляются кислородом воздуха, образуя оксиды:
Мелкодисперсный углерод в избытке кислорода способен взрываться при нагревании или от искры. Кроме прямого окисления существуют более современные методы получения оксидов.
Субоксид углерода
C3O2 образуется при дегидратации малоновой кислоты над P4O10:
C3O2 имеет неприятный запах, легко гидролизуется, вновь образуя малоновую кислоту.

В этой статье мы дадим характеристику углерода с точки зрения химии: узнаем, металл это или неметалл, какими свойствами он обладает, с какими веществами реагирует и где находят применение различные модификации углерода.
О чем эта статья:
Углерод — это химический элемент, неметалл, расположенный в таблице Д. И. Менделеева в главной подгруппе IV группы, во 2-м периоде, имеет порядковый номер 6.
Агрегатное состояние углерода при нормальных условиях — твердое вещество с атомной кристаллической решеткой. Молекула углерода одноатомна. Химическая формула углерода — С.
Строение углерода
В нейтральном атоме углерода находится шесть электронов. Два из них расположены вблизи ядра и образуют первый слой (1s-состояние). Следующие четыре электрона образуют второй электронный слой. Два из четырех электронов находятся в 2s-состоянии, а два других — в 2р-состоянии. Нейтральный атом углерода в основном состоянии двухвалентен и имеет электронно-графическую конфигурацию 1s 2 2s 2 2р 2 .

Возможные валентности: II, IV.
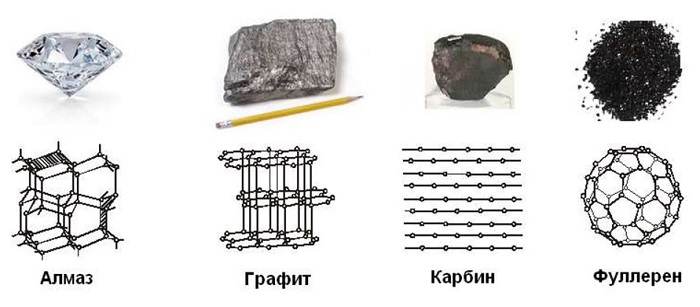
Аллотропия углерода
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Выделяют два вида углерода в зависимости от образования модификаций:
Кристаллический углерод входит в состав твердых веществ (алмаз, графит, графен, фуллерен, карбин).
Аморфный углерод образует мягкие вещества (уголь, кокс, сажа).
Рассмотрим подробнее основные аллотропные модификации углерода, их физические свойства и применение.
Алмаз
Алмаз — трехмерный полимер, бесцветное кристаллическое вещество, самый твердый природный минерал, имеет высокую теплопроводность. Его используют в промышленности для обработки различных твердых материалов, для бурения горных пород. Несмотря на то что алмаз твердый, в то же время он хрупкий. Получающийся при измельчении алмаза порошок применяют для шлифовки драгоценных камней. Хорошо отшлифованные прозрачные алмазы называют бриллиантами.
В кристаллической решетке атомы углерода связаны ковалентной связью. Расстояние между всеми атомами одинаковое, поэтому связи прочные по всем направлениям.
Одно из уникальных свойств алмазов — способность преломлять свет (люминесценция). При действии излучения алмазы начинают светиться разными цветами. Такая игра света, хороший показатель преломления и прозрачность делают этот драгоценный камень одним из самых дорогих. При этом необработанный алмаз не обладает такими качествами.
В промышленных масштабах алмазы получают при высоком давлении (тысячи МПа) и высоких температурах (1 500–3 000 °С). Процесс протекает в присутствии катализатора (например, Ni).
При нагревании алмаза до 1 000 °С и высоком давлении без доступа воздуха получают графит. При температуре 1 750 °С переход из алмаза в графит протекает существенно быстрее. При прокаливании в кислороде алмаз сгорает, образуя диоксид углерода.
Графит
Графит — темно-серое мягкое кристаллическое вещество со слабым металлическим блеском. Хорошо электро- и теплопроводен, стоек при нагревании в вакууме. Имеет слоистую структуру. На поверхности оставляет черные черты. На ощупь графит жирный и скользкий.
Графит термодинамически устойчив, поэтому в расчетах термодинамических величин он принимается в качестве стандартного состояния углерода.
На воздухе графит не загорается даже при сильном накаливании, но легко сгорает в чистом кислороде с образованием диоксида углерода.
При температуре 3 000 °С в электрических печах получают искусственный графит из лучших сортов каменного угля.
Графен
Графен представляет собой монослой графита. Впервые графен был получен ручным механическим отщеплением в лабораторных условиях, что не предполагает широкого производства.
В более крупных масштабах графен получают при помощи нагревания кремниевых пластин, верхний слой которых состоит из карбида кремния. Под действием высоких температур происходит отщепление атомов углерода, которые остаются на пластинке в виде графена, а кремний испаряется. Графен представляет собой тонкое и прочное вещество с высокой электропроводностью. В настоящее время он широко используется в микроэлектронике и автомобилестроении.
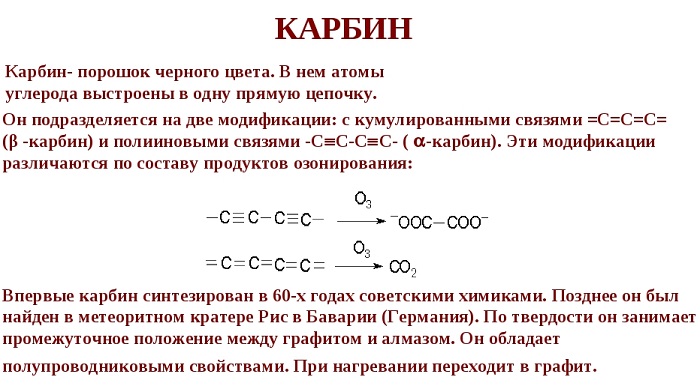
Карбин
Карбин — твердое черное вещество. Состоит из линейных полимерных цепей, которые соединены чередующимися одинарными и тройными связями в линейные цепочки: −С≡С−С≡С−С≡С−.
Впервые карбин был открыт в 60-х годах, но его существование не признавали до тех пор, пока его не обнаружили в природе — в метеоритном веществе.
Карбин — полупроводник, под действием света его проводимость сильно увеличивается. Переход в графит возможен при нагревании до 2 300 °С.
Карбин применяют в медицине для изготовления искусственных кровеносных сосудов.
Уголь
Уголь — мельчайшие кристаллики графита, полученные путем термического разложения углеродсодержащих соединений без доступа воздуха.
Угли имеют разные свойства в зависимости от веществ, из которых получены. Наиболее важные сорта угля — кокс, древесный уголь, сажа.
Кокс получается при нагревании каменного угля без доступа воздуха. Применяется в металлургии при выплавке металлов из руд.
Древесный уголь образуется при нагревании дерева без доступа воздуха. Благодаря пористому строению он обладает высокой адсорбционной способностью.
Сажа — очень мелкий графитовый кристаллический порошок. Образуется при сжигании углеводородов (природного газа, ацетилена, скипидара и др.) с ограниченным доступом воздуха.
Активные угли — пористые промышленные адсорбенты, получаемые из твердого топлива, дерева и продуктов его переработки. Применяются для поглощения паров летучих жидкостей из воздуха.
Сравнение основных аллотропных модификаций углерода

Нахождение углерода в природе
Основная масса углерода существует в виде природных карбонатов кальция CaCO3 (мела, мрамора, известняка) и магния MgCO3, а также горючих ископаемых.
Углерод – это один из самых важных химических элементов, без которого невозможна жизнь всех живых организмов. Он является основным компонентом всех органических соединений, которые поддерживают жизнь на Земле.
Положение углерода в периодической системе химических элементов
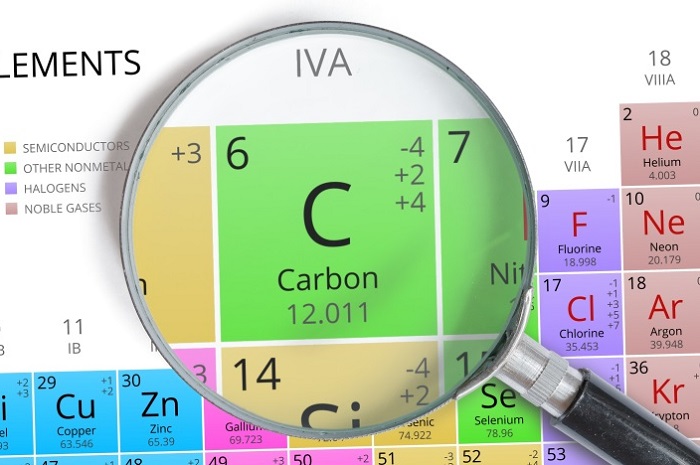
Кратко об углероде (С):
порядковый номер атома углерода – 6;
он расположен во втором периоде;
углерод занимает 4 группу, главную подгруппу (а).
Электронное строение углерода

У атома углерода всего два электронных уровня. На первом расположено 2 электрона, на втором – 4. Всего электронов 6, а значит, заряд ядра будет равен +6.
Атомная масса атома – 12.011.
Степень окисления углерода (-4; -2; 0; +2; +4) зависит от вещества, в котором он состоит.
Аллотропные модификации и физические свойства
Рассмотрим 4 основные аллотропные модификации углерода, их формулы и физические свойства.
Алмаз (С)

Благодаря своей уникальной кристаллической решётке, алмаз считается самым твёрдым камнем на планете после корунда.
Из твёрдости алмаза следует ещё одно его важное физическое свойство – высокая плотность.
Алмаз отличается своей уникальной теплопроводностью, которая лидирует среди всех твёрдых тел. Кроме того, такая порода не проводит электричество.
Графит (С)

тёмный, ближе к чёрному цвет;
имеет сильно выраженный металлический блеск;
прозрачность проявляется в наименьшей степени;
имеет огромную температуру сгорания (38500 градусов по Цельсию);
температура плавления больше 3800 градусов по Цельсию:
теплопроводность 100 - 354 Вт.
Фуллерен (С60)

плотность 1,68 г/см 3 ;
температура плавления 1180 градусов по Цельсию;
не растворяется в воде (но растворим в бензоле);
плотность 1,69 г/см 3 ;
Карбин (CH3OH)
электропроводен (зависит от действия света: чем он больше, тем выше электропроводность);
плотность 1,9 -3,30 г/см 3 ;
высокая твёрдость и теплопроводность.
Качественные реакции
Цель проведения качественных реакций – выявление наличия нужного атома, вещества или иона.
Рассмотрим их подробнее:
Ca(OH)2 + CO2 = Ca(CO3) (осадок) + H2O – образование вещества, нерастворимого в воде, что свидетельствует о том, что в реакции присутствует углекислый газ.
CaCO3 + 2HCl = CaCl2 + H2O + CO2 – образование углекислого газа, что говорит о присутствии в реакции иона CO3 2- .
Соединения углерода

Углерод образует два оксида:
1. Оксид углерода (II) – CO. Другое название – угарный газ.
Характеристика: не имеет запаха и цвета. Опасен для жизни живых организмов. Молярная масса – 28,01 г/моль. Получают за счёт окисления углерода кислородом:
C + O2 = 2CO + Q (теплота).
Это кислотный оксид, которому соответствует угольная кислота. Молярная масса – 44,01 г/моль.
Карбиды – бесцветные вещества, имеющие форму кристаллов и содержащие в своём составе углерод. Примеры: SiC, Al3C4, CaC2, Cr3C2.
Органические соединения углерода:
углеводороды (алкины, алкены, алканы);
кислородосодержащие соединения (спирты, кислоты и альдегиды, кетоны);
азотосодержащие соединения (нитросоединения, амины, аминокислоты).
Химические свойства углерода
Углерод является и окислителем и восстановителем.

Восстановитель:
C 0 + 2CuO = 2Cu + C +4 O2
Углерод – это неметалл, т. е. принимает на внешний уровень недостающие атомы.
Таким образом, значение углерода в жизни всего живого очень велико. Его многочисленные уникальные свойства, различные модификации позволяют использовать углерод во множестве сфер промышленности.
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Цели урока:
Обучающая: сформулировать новые понятия о видах железоуглеродистых сплавов, их составляющих
Развивающая: формировать умение выделять главное и работать с учебной литературой
Воспитывающая: воспитывать работоспособность
Тип урока: у рок формирования новых знаний.
Средства обучения:
Дидактический материал (опорные конспекты, слайды).
Технические средства: мультимедийный комплекс
1. Организационно – мотивационный этап – 8 мин.
1.1. Мотивация (важность темы при изучении дисциплины- устно)
1.1.Предварительное определение уровня знаний обучающихся (актуализация по предыдущим темам - устно)
2. Организация самостоятельной деятельности обучающихся по основным вопросам темы- 72мин.
( Учебный материал № 1 , лист с заданием 1.1, «Закрепляющий материал-задание 1.2).
3. Подведение итогов учебной деятельности – 10 мин.
3.1.Проверка степени усвоения изученной информации (лист с заданием 1.3.)
3.2.Оценка учебного занятия
Учебный материал 1
Сплавы железа с углеродом являются основными компонентами так называемых чёрных сплавов- сталей и чугунов, которые служат важнейшими конструкционными материалами в технике. Изучением железоуглеродистых сплавов занимались такие учёные: Ледебур, Аустен, Осмонд, Ле-Шателье, Гудцов, Байков. Учёный Дмитрий Чернов впервые указал на существование критических точек в сплавах и дал первое представление о диаграмме состояния сплавов железа с углеродом.
Сталь- сплав железа с углеродом, где углерода до 2,14%.
Чугун- сплав железа с углеродом, где углерода от 2,14% до 6,67%.
Сталь и чугун также содержат небольшое количество примесей: полезных - кремний и марганец, вредных - сера и фосфор. Структура и свойства любого сплава зависят, прежде всего, от свойств базового компонента и элементов- добавок, а также от характера их взаимодействия. Рассмотрим свойства основных компонентов железоуглеродистых сплавов
Железо и его свойства — пластичный металл серебристо-белого цвета. При комнатной температуре чистое железо - мягкий пластичный металл с невысокой твердостью (НВ 80). Относительное удлинение 45-55%.Железо имеет две полиморфные модификации: альфа-железо и гамма-железо (Рис. 1).

Рис.1 Кривая охлаждения железа
Альфа-железо магнитно до температуры 768° С (точка Кюри), решётка КОЦ.. При нагреве выше 911°С происходит перекристаллизация: образуется гамма-железо, имеющее решётку КГЦ. В результате дальнейшего нагревания (при температуре выше 1441°С) железо снова меняет свою решётку на КОЦ . Температура 1539°С является температурой плавления чистого железа. При охлаждении все эти процессы протекают в обратном порядке. В результате полиморфных превращений происходит вторичная кристаллизация, являющаяся основной предпосылкой проведения термической обработки. С углеродом железо образует химическое соединение и твёрдые растворы.
Углерод и его свойства - неметаллический элемент. Температура плавления — 3500°С.В природе может существовать в двух полиморфных модификациях: алмаз и графит. В железоуглеродистых сплавах в свободном виде углерод находится в форме графита. Кристаллическая структура графита слоистая. Прочность и пластичность его очень низкие. Углерод растворим в железе, в жидком и твёрдом состояниях может образовывать химическое соединение- цементит, может находиться в свободном виде - в форме графита.
Структурные составляющие сплавов железа с углеродом
В сплавах могут образовываться следующие фазы: жидкие растворы, химические соединения, а также твёрдые растворы. В сплавах железа с углеродом могут образовываться следующие структурные составляющие:
Цементит (Ц) — химическое соединение железа с углеродом (карбид железа) Fe 3 C . Характеризуется очень высокой твердостью (НВ 800), крайне низкой пластичностью и высокой хрупкостью. Цементит неустойчив и в определённых условиях распадается с образованием свободного графита.
Феррит (Ф)- твердый раствор углерода в а- железе. Благодаря малому содержанию углерода свойства феррита близки к свойствам чистого железа - низкая твердость (НВ 80-100) и высокая пластичность(50%).
Аустенит (А) — твердый раствор углерода в у- железе. Имеет твердость НВ 220, непрочный, средняя пластичность(40%).
Перлит (П) — это механическая смесь феррита с цементитом, содержит 0,8% углерода, образуется из аустенита при температуре 727°С . Имеет пластинчатое строение, т.е. его зерна состоят из чередующихся пластинок феррита и цементита. Цементит придаёт перлиту высокую прочность(800МПа), низкую пластичность(15%).Твёрдость перлита невысокая (НВ160). Перлит является эвтектоидом. Эвтектоид — это механическая смесь двух фаз, образующаяся из твердого раствора (а не из жидкого сплава, как эвтектика).
Ледебурит (Л) представляет собой эвтектику - механическую смесь аустенита с цементитом. Содержит 4,3% углерода, образуется из жидкого сплава при температуре 1147°С. При температуре 727°С аустенит, входящий в состав ледебурита превращается в перлит и ниже этой температуры ледебурит представляет собой механическую смесь перлита с цементитом.
Графит - аллотропическая модификация углерода. Графит мягок, прочность его очень низкая. В чугунах содержится в виде включений различной формы: пластинки, хлопья и шары.
Читайте также:

