Тканевая совместимость это кратко
Обновлено: 05.07.2024
XX век и начало XXI столетия ознаменованы большими успехами в области отечественной трансплантологии. XX век связан с первыми удачными пересадками органов, в XXI веке российская трансплантология вышла на новый количественный уровень. Стало увеличиваться не только число трансплантаций, но и качество хирургических вмешательств. До настоящего времени трансплантация органов остается единственным способом лечения пациентов с терминальными поражениями солидных органов, таких как сердце, легкие, печень, почки, поджелудочная железа и кишечник. Трансплантация органов проводится в тех случаях, когда другие способы лечения применить невозможно.
HLA гены располагаются в шестой хромосоме человека. Они подразделяются на области A, В, С, D и обозначаются как:
Среди областей генов HLA выделяют три класса. К первому классу относятся гены HLA–А, HLA–В и HLA–С. Эти гены контролируют образование так называемых трансплантационных антигенов (антигенов пациента), которые распознают донорские клетки, введенные пациенту в трансплантат. Ко второму классу относятся гены HLA-D регулирующие силу иммунного ответа. Гены третьего класса контролируют синтез молекул системы комплемента - неспецифического фактора иммунной защиты организма.
Система HLA индивидуальна. Полное соответствие по всем антигенам донора и реципиента наблюдается только у однояйцевых близнецов. Во всех других случаях развивается иммунологический конфликт и происходит реакция отторжения трансплантанта.
Гены HLA передаются потомству двумя блоками - по одному от каждого родителя. Такой блок носит название - гаплотип HLA.
Ребенок наследует по два аллеля каждого гена HLA: один из материнского гаплотипа, другой - из отцовского. Если удается определить лишь одну аллельную форму какого-либо антигена HLA, то это значит, что либо 2-ая аллель аналогична первой, либо в типирующем наборе нет сыворотки для определения другой аллельной формы антигена [1].
Соответствие HLA при трансплантации органов, таких как почка и печень, дает множество преимуществ, а несовпадения связаны с худшими результатами [2]. Однако в стремлении найти подходящего донора есть компромиссы, такие как длительное время ожидания и прогрессирование заболевания, приводящее к летальному исходу. Постоянное совершенствование иммуносупрессивных тактик лечения способствует большей толерантности к некоторым несоответствиям. Подход к HLA-сопоставлению для трансплантации органов за последние годы претерпел несколько этапов эволюции.
Сопоставление HLA при трансплантации органов традиционно сосредоточено на локусах HLA-A, и -B, причем совпадения в этих локусах связаны с общей выживаемостью донора. Эти преимущества оказались более заметными у высокочувствительных пациентов [3]. Достижения в области иммуносупрессии привели к снижению акцента к сопоставлению HLA при трансплантации почек [4]. Тем не менее, соответствие HLA по-прежнему имеет свои преимущества. Было показано, что HLA-DR имеет наибольший вклад в исходе операции при трансплантации [5].
В течение многих лет золотым стандартом HLA-типирования было серологическое типирование, при котором использовались сыворотки, взятые у добровольцев с известными HLA-антителами, комплементом и витальным красителем [6]. Если клетки, помещенные в лунки, содержат антигены, соответствующие антителам в лунках, комплемент активируется, клетки погибают, и краситель поглощается. Серологическое типирование может быть выполнено быстро и поэтому полезно в таких неотложных ситуациях, как типирование умершего донора. Однако различия антигенов, которые могут иметь существенное влияние in vivo, не всегда выявляются при серологической оценке [7]. Другая проблема, связанная с серологическим типированием, - идентификация источников специфических антител, проблема, которая возрастает по мере того, как идентифицируются более клинически значимые антигены HLA. В результате для трансплантации органов приемлемо только HLA-типирование молекулярными методами. Большинство лабораторий используют либо ПЦР в реальном времени, либо последовательность-специфический олигонуклеотид (SSO) для достижения HLA-типирования с низким разрешением при трансплантации органов. Скорость, точность и удобство технологий делают их отличным выбором для HLA-типирования умерших доноров.
Появление HLA-типирования с высоким разрешением (на уровне аллелей) ввело новый уровень специфичности в этот процесс. В дополнение к прямому секвенированию ДНК, другие варианты молекулярного типирования включают полимеразную цепную реакцию, специфичную для последовательности (SSP-PCR), и специфичные для последовательности олигонуклеотидные зонды (SSOP).
Хотя идентично подобранный родственный донор идеально подходит для трансплантации, такое соответствие обнаруживается у 15–30% реципиентов [8]. Когда подходящий донор из члена семьи недоступен, трансплантация с использованием неродственного донора-добровольца может быть жизнеспособным вариантом при выявлении HLA-подходящего донора. Как установлено в исследовании 2007 года, в котором сравнивались характеристики более чем 3800 пар пациент-донор, совпадение аллелей HLA-A, -B, -C и -DRB1 с высоким разрешением (на уровне аллелей) коррелирует с общей выживаемостью. [9].
Есть несколько важных вопросов, которые необходимо решить, чтобы лучше понять генотипы HLA и их функции при трансплантации:
1 - лабораториям не хватает возможности фазировать полные гаплотипы HLA 1 или 2 класса.
2 - экспрессия HLA клинически плохо используется и недооценена.
3 - лаборатории неспособны генерировать генотипы HLA с высоким разрешением для распределения донорских органов. Решение этих проблем может значительно улучшить не только наше понимание того, как локусы HLA взаимодействуют друг с другом, но также улучшить результаты для реципиентов за счет более эффективного сопоставления HLA.
Одним из способов решения первой проблемы является секвенирование одной молекулы. Типирование позволяет использовать один метод секвенирования для определения дополнительных биомаркеров по мере развития наших знаний. Следующим важным сдвигом в HLA-типировании с помощью NGS может стать переход к HLA-типированию с высоким разрешением для доноров заболеваний. Традиционно эта популяция типизировалась по HLA с низким разрешением из-за времени, необходимого для достижения HLA-типирования с высоким разрешением. Будущее HLA-типирования с помощью NGS - это то, что включает расширение иммуногенетики за пределы традиционной области HLA на другие регионы, включает возможность фазировать полные гаплотипы HLA и использует анализ, который является удобным и мобильным. Как всегда, лаборатории столкнутся с множеством проблем при разработке этих процессов и всегда ставят во главу угла высокое качество ухода за пациентами.
2 - Cecka JM, Reed EF, Zachary AA (2015) HLA high-resolution typing for sensitized patients: a solution in search of a problem? Am J Transplant 15 (4): 855–856.
3 - Zachary AA, Leffell MS (2016) HLA mismatch- ing strategies for solid organ transplantation - a balancing act. Front Immunol 7: 575.
4 - Grgic I, Chandraker A (2017) Significance of biologics in renal transplantation: past, pres- ent, and future. Curr Opin Organ Transplant 23 (1): 51–62.
5 - Williams RC, Opelz G, McGarvey CJ, Weil EJ, Chakkera HA (2016) The risk of trans- plant failure with HLA mismatch in first adult kidney allografts from deceased donors. Transplantation 100 (5): 1094–1102.
6 - Tinckam KJ (2012) Basic histocompatibility testing methods. pp 21–42.
7 - Eng HS, Leffell MS (2011) Histocompatibility testing after fifty years of transplantation. J Immunol Methods 369 (1–2): 1–21.
8 - Gragert L, Eapen M, Williams E, Freeman J, Spellman S, Baitty R, Hartzman R, Rizzo JD, Horowitz M, Confer D, Maiers M (2014) HLA match likelihoods for hematopoietic stem- cell grafts in the U. S. registry. N Engl J Med 371 (4): 339–348.
9 - Tie R, Zhang T, Yang B, Fu H, Han B, Yu J, Tan Y, Huang H (2017) Clinical implica- tions of HLA locus mismatching in unrelated donor hematopoietic cell transplantation: a meta-analysis. Oncotarget 8 (16): 27645– 27660.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Тканевая совместимость и переливание крови"
У каждого человека ткани имеют свои особенности, поэтому пересадка кожи и внутренних органов, например печени или сердца, возможна только тогда, когда ткани людей совместимы. При несовместимости произойдет отторжение пересаженной ткани, так как содержащиеся в ней чужеродные вещества вызовут иммунную реакцию и антитела больного начнут уничтожать эту ткань.
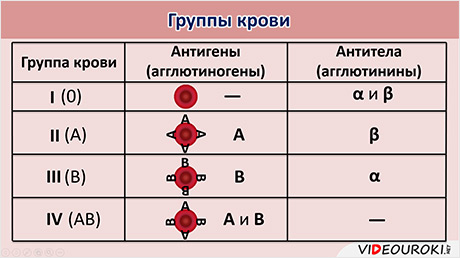
Кровь каждого человека имеет индивидуальные признаки. Они связаны с наличием в ней особых веществ. Основную часть форменных элементов крови составляют красные безъядерные клетки двояковогнутой формы – эритроциты. На мембране эритроцитов располагаются особые вещества – антигены, или агглютиногены, А и Б. В плазме крови растворены антитела, или агглютинины, альфа (α) и бэта (β). Когда происходит взаимодействие антигена А и антитела альфа, несколько эритроцитов сближается и склеивается между собой. Происходит их агглютинация. Аналогичное явление наблюдается и при взаимодействии антигена Б и антитела бэта.

В крови новорождённых детей, как правило, антител нет или они присутствуют в очень малых количествах, если поступили с молоком матери. Антитела образуются в течение первого года жизни к тем антигенам, которых нет в его собственных эритроцитах. Например, если эритроциты имеют антиген А, то будут образовываться антитела бэта.
В зависимости от того, какие антигены и антитела присутствуют в крови человека, выделяют четыре группы крови: первую, вторую, третью и четвёртую. В течение всей жизни человека его группа крови не меняется.
На мембране эритроцитов людей, имеющих 1-ю группу крови, антигенов нет, значит, в плазме крови присутствуют антитела альфа и бэта.
На мембране эритроцитов людей со 2-й группой крови находятся антигены А, значит, в плазме растворены антитела бэта. У людей с 3-й группой крови, соответственно, антигены Б и антитела альфа. У людей с 4-й группой крови на мембране эритроцитов располагаются антигены А и Б, а антитела отсутствуют.
Наличие антигенов или их отсутствие в эритроцитах дало основание называть эту систему групп крови А-Б-ноль. Первая группа крови – нулевая, вторая – А, третья группа – Б и четвёртая – А-Б.

Около 40 % россиян имеют первую группу крови, 39 процентов – вторую, 15 процентов – третью и только 6 процентов людей – четвёртую группу крови.
К индивидуальным признакам крови относится также присутствие в эритроцитах особого белка – резус-фактора.
Кровь, в которой имеется этот антиген, называется резус-положительной, в которой его нет – резус-отрицательной. Большая часть людей на нашей планете (85 %) имеет резус-положительную кровь.

При различных травмах, ранениях, операциях люди могут терять много крови. Потеря большого количества крови опасна для жизни, и единственным способом помочь пострадавшему является переливание крови. Людей, которые дают кровь, называют донорами. А человека, которому вливают кровь, – реципиентом.
Проблема переливания крови возникла очень давно. Еще древние греки пытались спасти истекающих кровью раненых воинов, давая им пить тёплую кровь животных. Но большой пользы это принести не могло.
В 1638 году начали проводиться опыты по переливанию крови животным, а в 1667 году было проведено первое успешное переливание крови животного – ягнёнка – молодому человеку, однако после совершения нескольких переливаний он умер. В связи с этим опыты по переливанию крови прекратились почти на целое столетие. Постепенно учёные пришли к выводу, что человеку можно переливать кровь только человека.
Впервые переливание крови от человека к человеку совершил в 1819 году английский акушер Джеймс Бланделл. В России первое успешное переливание крови произвёл акушер Вольф в 1832 году. Он спас женщину, которая умирала после родов от открывшегося кровотечения. Позднее австрийский учёный Карл Ландштейнер открыл группы крови, за что был удостоен Нобелевской премии.
Кровь донора должна быть совместима с кровью больного. Поэтому каждый человек должен знать свою группу крови и резус-фактор. Если группы крови и резус-фактор подобраны неправильно, то наступает несовместимость – эритроциты склеиваются, закупоривая мелкие сосуды и нарушая кровообращение.
Если эритроциты донора содержат, например, антигены А, а плазма крови реципиента (получающего кровь) – антитела бэта, то переливание пройдёт успешно. Если же эритроциты донора содержат антиген А, а плазма крови реципиента – антитела альфа, то произойдёт агглютинация эритроцитов.

Людям с 1-й группой крови можно переливать кровь только этой же группы. Кровь 1-й группы можно переливать людям всех групп, так как в их эритроцитах нет антигенов и донорские эритроциты в крови реципиента не склеиваются. Поэтому людей с 1-й группой крови называют универсальными донорами.
Люди с 4-й группой крови принимают кровь всех групп, поэтому их называют универсальными реципиентами.
Тем, у кого кровь относится ко 2-й или 3-й группе, можно переливать кровь своей или 1-й группы.

Но в настоящее время в современной медицине реципиентам переливают кровь только их же группы в целях исключения различных осложнений.
Напомним, что осложнения возникают также, если повторно переливать людям с резус-отрицательной кровью резус-положительную кровь. А также в том случае, если женщина с резус-отрицательной кровью вынашивает плод, который унаследовал от отца резус-положительную кровь.
В этом случае фрагменты эритроцитов плода попадают в кровь матери, и в ней начинают вырабатываться антитела. Эти антитела проникают в организм плода и разрушают его эритроциты. Если первая беременность обычно протекает без осложнений, то итогом второй может быть гибель плода.

Иногда осложнения возникают в случае переливания одногруппной крови. Причиной могут быть функционально неполноценные тромбоциты или лейкоциты, антитела и антигены, которые получены реципиентом при переливании.
Итог урока. При пересадке органов необходимо учитывать совместимость тканей. При переливании крови также необходимо учитывать групповую совместимость. По наличию или отсутствию в крови человека определённых антигенов и антител выделяют четыре группы крови.
Тканевая совместимость (histocompatibility) — Сходство тканей донора и реципиента, благодаря которому после пересадки клеток, тканей или органов отсутствует реакция отторжения трансплантата. Тканевая совместимость обусловлена генетически детерминированной адекватностью антигенных свойств клеток донора и реципиента. Система HLA (human leukocyte antigens) — группа тканевых антигенов, являющихся продуктами генов МНС. HLA- антигены найдены на всех ядерных клетках человека в различном количестве. Иммунный ответ на этот антиген является главной причиной реакции трансплантат-хозяин. HLA — антигены контролируются генами главного комплекса гистосовместимости, который располагается в коротком плече 6- ой хромосомы. Гены или локусы системы HLA входят в три региона, каждый из которых имеет характерные генные продукты и функции. Эти регионы носят название классы — класс I, класс II и класс III. Продуктами генов класса I являются гликопротеиновые молекулы, экспрессированные на мембране почти всех ядросодержащих клеток. Регион класса II (D- область) состоит из субрегионов. Гены DP-, DQ- и DR- субрегионов кодируют HLA- молекулы с выраженным антигенным полиморфизмом. Регион класса III содержит гены, которые непосредственно вовлечены в иммунную функцию.
Тканевая несовместимость (histoincompatibility) — Отсутствие сходства между тканями донора и реципиента, приводящее к отторжению (с участием иммунной системы реципиента) клеток, тканей или органов донора после трансплантации. Как и тканевая совместимость, тканевая несовместимость определяется антигенами гистосовместимости клеток двух особей.
Иммуногенетика, комплексная научная дисциплина, сочетающая методы иммунологии, молекулярной биологии и генетики для изучения наследственных факторов иммунитета, внутривидового разнообразия и наследования тканевых антигенов, генетических и популяционных аспектов взаимоотношений макрои микроорганизма и тканевой несовместимости.
Перенесение генетических представлений в область иммунологии позволило советскому учёному В. П. Эфроимсону сформулировать эволюционно-генетическую концепцию иммуногенеза, объясняющую внутривидовое антигенное разнообразие и гетерогенность антител по специфичности. Каждая здоровая зрелая в иммунологическом отношении особь способна к иммунному ответу на тканевые антигены особи с другим генотипом. Таким образом, тканевая несовместимость — универсальная биологическая закономерность. Лишь однояйцевые близнецы и животные одной чистой линии не разделены барьером тканевой несовместимости, выраженность которой зависит от степени несходства генотипов донора и реципиента. Для успешных пересадок органов и тканей, переливаний крови и клеток костного мозга очень важно снизить до минимума величину этого несходства путём подбора совместимого донора. Изучение клеточных антигенов, их наследования и разнообразия, их обнаружение (типирование) — это те разделы Иммуногенетика, которые особенно важны для трансплантологии, трансфузиологии, иммуногематологии и клинической иммунологии.
В пользу генетической природы злокачественности свидетельствовали два факта: 1. Корреляции между существованием наследуемых опухолей и наличием специфических хромосомных транслокаций в клетках опухоли.2. Стабильность качественных свойств в трансформированных клетках и их передача из одного клеточного поколения в другое также свидетельствуют в пользу генетической природы наследственности. Наиболее прямые доказательства генетического контроля образования злокачественных опухолей были получены при изучении температурочувствительных мутаций у вирусов. В начале 1970-х годов были получены температурочувствительные мутанты вируса саркомы, которые трансформировали нормальные клетки в раковые только при определенной температуре. Это значит, что при этой температуре экспрессируется мутация только одного гена, и этого достаточно для того, чтобы вызвать опухолевую трансформацию и поддерживать ее. Инактивация этой мутации при другой температуре возвращала клетку в нормальное состояние. Таким образом в вирусе саркомы содержится один ген, вызывающий и поддерживающий злокачественность. Он был назван онкогеном. В конце 1970-х годов был выделен первый онкоген из вируса саркомы курицы и был назван src. LTR вирусов содержат многие из регуляторных сигналов транскрипции: сайты инициации транскрипции, полиаденилирования Вскоре было показано, что искусственное введение гена src в генетический аппарат клетки трансформирует ее и без вируса.
После этого были открыты и другие вирусные онкогены: туе, ras, abl и многие другие. Стало ясно, что опухолевые вирусы вызывают опухоли не сами по себе, а потому, что вносят онкоген в генетический аппарат клетки и закрепляют его там. Если удалить онкоген из генетического аппарата вируса, то он, не лишаясь способности размножаться и интегрироваться в геном клетки, утратит возможность вызывать формирование злокачественных опухолей.
Геномы нормальных клеток позвоночных содержат последовательности, которые похожи, но не полностью идентичны гену src, входящему в состав вируса саркомы Рауса. Поэтому их называют несколько по разному: v-src вирусный (онкоген), c-src -клеточный (протоонкоген). Эти гены регулируют нормальное поведение клетки — ее ответы на ростовые факторы, на гормоны, нормальный темп и расписание ее делений. Протоонкогены находятся под контролем других генов. Мутации протоонкогенов выводят их из-под воздействия контролирующих генов и в результате чего они становятся автономными . Как правило, опухолеродное действие различных канцерогенных факторов приводит к постоянной активности протоонкогена. Так, хромосомные транслокации могут перенести протоонкоген в новое положение — под контроль постоянно активного промотора.
В результате этого переноса протоонкоген начинает работать непрерывно , не давая клетке выйти из цикла делений (туе), или посылая непрерывные сигналы с мембраны в ядро (ras), или приводя к синтезу ростовых факторов. Некоторые опухолевые вирусы сами по себе не содержат онкогена, но, встраиваясь в хромосому рядом с протоонкогеном, активируют его, вызывая непрерывную активность (вставочный канцерогенез) Канцерогенные вещества и облучение обладают высокой мутагенной активностью, вызывая мутации в различных генах, в том числе и в протоонкогенах. Эти мутации могут вести либо к нарушению регуляции протоонкогена, и тогда он выходит из-под контроля, либо к изменению свойств белка, кодируемого этим онкогеном.
Гистосовместимость, состояние, при к-ром клетки или органы особи (донора) приживаются и функционируют во внутр. Среде др. Особи (реципиента). Соответственно отторжение иммунной системой реципиента донорских клеток, тканей или органов, а также разрушение донорскими иммунокомпетентными клетками тканей реципиента является проявлением тканевой несовместимости. Т. С. Определяется генетически обусловленным сходством антигенного состава клеток донора и реципиента. Благодаря генетич. Идентичности полностью совместимы ткани однояйцевых близнецов и однополых особей, принадлежащих к одной и той же инбредной линии животных. Т. С. Имеет место также у химер, возникших в эмбриональном или раннем постнатальном периоде, либо после радиационного или медикаментозного подавления иммунитета, в результате формирования специфич.
Иммунологич. Толерантности к чужеродным антигенам Т. С. За исключением этих весьма редких состояний, в природе наблюдается универсальная несовместимость тканей, к-рая отражает балансированный полиморфизм по кодоминантным генам гистосовместимости в свободно скрещивающихся популяциях. Эти гены кодируют структуру нек-рых мембранных глико-протеидов (антигенов гистосовместимости), расположенных на поверхности всех ядросодержащих клеток. Наиб, значение имеют гены гл. Комплекса гистосов-местимости. У человека этот комплекс занимает область на 6-й хромосоме и имеет 6 сублокусов (А, В, С, DR, DP и DQ), каждому из к-рых принадлежит до 40 аллельных генов. Каждый аллель кодирует индивидуальный антиген гисто-совместимости.
Наиб, изучены антигены сублокусов А, В, С, относящиеся к I классу и участвующие в трансплантационном иммунитете. Они в большем кол-ве присутствуют на мембранах лимфоцитов, а в меньшем - в мышечной, соединит, и нервной тканях. Антигены сублокусов DR, DP, DQ относятся ко II классу. Они обнаруживаются на мембранах макрофагов, В-лимфоцитов, активированных Т-лимфоцитов, тромбоцитов, сперматозоидов и клеток эпителия. Осн. Их функция - участие в механизмах иммунологич. Распознавания чужеродных структур, в осуществлении и регуляции иммунного ответа. С помощью типирования антигенов гистосовместимости подбирают совместимые ткани для трансплантации, исключают отцовство, диагностируют наследств, дефекты обмена веществ..
(Tardigrada), тип беспозвоночных. В строении сочетают черты кольчатых червей и членистоногих. Ископаемые Т. Известны с мела. Тело короткое (дл. 0,1-1,2 мм), голова не обособлена, 4 пары нечленистых бугорковидных ножек с коготками. Передвигаются медленно. Покровы с кутикулой. Пищеварит. Система начинается ротовой полостью с парой острых стилетов для прокалывания клеточных оболочек водорослей, мхов, мелких животных, к-рыми Т. Питаются. Имеется пара слюнных желёз и в задней части 2 выпячивания, ино..
Интерстициальная жидкость, содержится в межклеточных и околоклеточных пространствах тканей и органов у позвоночных. Наряду с кровью и лимфой составляет внутр. Среду организма. Из Т. Ж. Клетки получают питат. Вещества и отдают в неё продукты обмена. Характеризуясь постоянством состава (он специфичен для отд. Органов), Т. Ж. Предохраняет клетки органов и тканей от воздействий, связанных с изменением состава крови. Объём Т. Ж. У человека составляет в среднем 26,5% массы тела. Оттекая от органов в л..
(лат. Textus, греч. Histds), у животных - система клеток, сходных по происхождению, строению и функциям в организме, а также межклеточных веществ и структур - продуктов их жизнедеятельности. Выделяют 4 типа Т., соответствующие осн. Соматич. Функциям организма. Эпителий, соединительную, мышечную, нервную. Развитие каждого типа Т. (гистогенез) - результат дифференцировки, т. Е. Становления черт специализации у клеток-предшественников, детерминированных в эмбриогенезе для развития определ. Типа Т. ..
(Ploceus), род ткачиковых. Дл. В среднем 15 см. Брачное оперение птиц (самцов) с яркими, чаще жёлтыми пятнами, самки буроватые. 57 видов, распространены преим. В Африке (к Ю. От Сахары), лишь 5 видов в Юж. Азии (от Индостана к В. До Малакки и о. Калимантан). Гнездятся в период дождей. Крытые гнёзда вьют на концах ветвей, на кустах или на верхушках высоких стеблей сахарного тростника и др. Трав. Гнездо строит самец, самка помогает лишь в конце работы. Конструкция гнезда различна, наиб, сложные им..
Читайте также:

