Тепловые явления при растворении кратко
Обновлено: 30.06.2024
Загрузить презентацию (273 кБ)
Тип урока: урок повторения и закрепления материала, изученного на уроке физики + изучение нового материала по химии.
Цели:
- Познакомить учащихся с растворением веществ как физико-химическим процессом и с растворами как физико-химическими системами.
- Формировать единую научную картину мира, раскрывая физико-химическую природу тепловых явлений.
- Развивать у учащихся умение выделять главное, анализировать и сравнивать информацию, аргументировано отвечать на вопросы.
- Продолжить формирование у учащихся навыков безопасной работы в лаборатории, умения наблюдать, описывать наблюдения и делать выводы по результатам эксперимента.
- Воспитание интереса к естественным наукам.
Оборудование: термометр, пробирки, штативы для пробирок, компьютер, проектор, весы рычажные с разновесами, мензурки.
Хим. реактивы: вода, аммиачная селитра, концентрированная серная кислота, медный купорос.
Ход урока
1. Оргмомент (взаимное приветствие учителей и учащихся, организация внимания).
2. Подготовка учащихся к основному этапу занятия.
Учитель физики. На сегодняшнем уроке нам предстоит вспомнить изученные на уроках физики явления, выяснить, растворение – это физический или химический процесс? Мы попытаемся совершить небольшие, но самостоятельные открытия. Работа предстоит большая, но увлекательная и мы надеемся, что вы с ней справитесь. Для этого надо быть настойчивыми и внимательными. Вспомним физические понятия, которые подготовят нас к основному этапу урока.
Приложение 1. Технологическая карта урока.
Презентация к уроку. С процессом растворения мы с вами знакомились в начале этого года. Что же доказывает процесс растворения?
Какую же цель можно поставить для нашего урока?
У вас на столах лежат оценочные листы. Подпишите их. За каждый этап урока вы получите оценку.
Учитель физики. Вспомнили, что процесс растворения доказывает, что вещества состоят из молекул.
Этот процесс был бы невозможен, если бы молекулы покоились. Молекулы постоянно движутся.
Как называется беспорядочное движение молекул? Почему? Какие явления доказывают, что молекулы движутся?
Более подробно сегодня вспомним явление диффузии. Что называется диффузией? Каковы особенности данного явления?
Возвращаемся к растворам. По данной теме мы демонстрировали образование раствора марганцовки и медного купороса.
Объясните данные явления.
Какой же процесс растворения: химический или физический?
Сторонниками физической теории растворов были шведский учёный Аррениус, нидерландский учёный Вант-Гофф и немецкий учёный Оствальд.
Учащиеся (2 чел) выполняют практическую работу по определению плотности серной кислоты и аммиачной селитры.
Определение плотности раствора серной кислоты.
- Определить массу пустого стакана.
- Определить массу стакана с раствором.
- Найти массу раствора.
- Рассчитать плотность раствора, поделив массу раствора на его объём. (V=3 мл)
Определение плотности раствора аммиачной селитры.
- Определить массу пустого стакана.
- Определить массу стакана с раствором.
- Найти массу раствора.
- Рассчитать плотность раствора, поделив массу раствора на его объём. (V= 5 мл)
Расчёт демонстрируется на доске.
3. Изучение нового материала.
Учитель химии. Я соглашусь с вашими доводами, действительно, растворение – это физический процесс, но не только, и вы мне поможете это доказать.
О химическом взаимодействии судят по некоторым признакам. Вспоминаем признаки химических реакций:
- изменение цвета;
- появление запаха;
- образование и растворение осадка;
- выделение газа;
- выделение или поглощение теплоты.
При растворении некоторых веществ выделяется или поглощается большое количество теплоты.
Экзотермический процесс – это процесс, идущий с выделением теплоты. Эндотермический процесс – это процесс, идущий с поглощением теплоты.
Вывод: растворение это физико-химический процесс.
Учитель физики. Для закрепления выполним практические работы.
Закрепление.
Учитель химии – инструктаж по ТБ
- Работать над столом, соблюдая чистоту рабочего места.
- Не ставьте склянки с реактивами на книги и тетради. Берегите их от попадания капель реактивов!
- Выполняем опыты по указанию учителя.
- Не расходуем реактивов больше, чем это необходимо.
- Кислоту льем в воду, а не наоборот.
- Работаем спокойно, без суетливости.
Выполнение практической работы.
- Измерить температуру t1 воды, объёмом 2 мл. Вынуть термометр из воды.
- Добавить аккуратно кислоту, сняв капельку.
- Быстро опустить термометр в раствор, измерить температуру t2.
- Вынуть термометр из раствора, опустить его в стакан с водой.
- Определить массу раствора, зная объём и плотность. m – масса раствора, которая определяется формулой m=ρ×V, где ρ=1100 кг/м 3 , V= 3 мл.
- Определить количество теплоты, расчёт вести по формуле Q=cm(t2 – t1), где с = 3300 Дж/кг °С – удельная теплоёмкость раствора, t1 -начальная температура , t2 - конечная температура раствора, m – масса раствора
- Провести анализ результата.
- Измерить температуру t1 воды, объёмом 5 мл. Вынуть термометр из воды.
- Всыпать аккуратно аммиачную селитру.
- Быстро опустить термометр в раствор, слегка помешать до полного растворения, измерить температуру t2.
- Вынуть термометр из раствора, опустить его в стакан с водой.
- Определить массу раствора, зная объём и плотность. m – масса раствора, которая определяется формулой m=ρ×V, где ρ=1070 кг/м 3 , V= 5 мл.
- Определить количество теплоты, расчёт вести по формуле Q=cm(t2 – t1), где с=2500 Дж/кг °С – удельная теплоёмкость раствора, t1 -начальная температура , t2 - конечная температура раствора, m – масса раствора.
- Провести анализ результата.
Выполнение теста и его взаимопроверка.
- Диффузия – это …
А) взаимное проникновение соприкасающихся веществ друг в друга
Б) взаимное проникновение молекул одного вещества в молекулы другого
В) произвольное перемешивание жидкостей - Беспорядочное движение называется тепловым, потому что
А) тёплые молекулы движутся быстрее
Б) скорость движения молекул зависит от температуры
В) диффузия быстрее происходит при высокой температуре - Растворение веществ – это химический процесс.
А) Да
Б) Нет, это физический процесс
В) Нет, это физико-химический процесс - При образовании раствора соли энергия
А) выделяется
Б) поглощается
В) не выделяется, не поглощается
Итог урока.
Заполняются оценочные листы учащимися. Учителя оценивают работу учащихся.
Вы уже знакомы со смесями веществ — растворами и механическими смесями, их классификацией ( рис. 50 ). Напомним, что механические смеси образуются в результате простого перемешивания веществ без образования ими химической связи или других химических изменений. Каждый компонент такой механической (гетерогенной) смеси сохраняет свой состав и свойства.
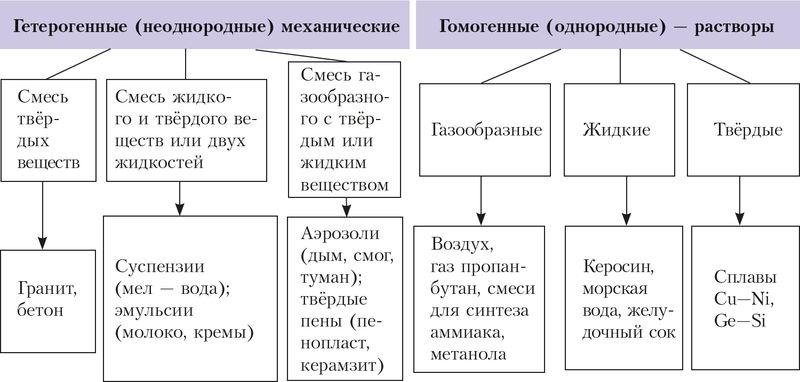
Рис. 50. Классификация смесей
Также вам уже известны растворы — гомогенные устойчивые системы переменного состава, состоящие из нескольких компонентов. Различают жидкие (водные и неводные), газообразные и твёрдые растворы. Некоторые их примеры приведены на рисунке 50. Мы будем рассматривать преимущественно водные растворы.
В отличие от механических смесей растворы однородны, то есть отсутствуют границы раздела фаз. Кроме того, растворы устойчивы, так как при неизменных условиях (концентрация растворённого вещества, температура, давление) они бесконечно долго остаются гомогенными системами.
Физико-химический процесс, при котором происходит взаимодействие частиц растворяемого вещества и растворителя с образованием гомогенной устойчивой системы переменного состава, называют растворением.
Химическая сторона процесса растворения заключается в разрушении связей между частицами растворяемого вещества и их взаимодействии с молекулами растворителя. При растворении протекают физические процессы взаимной диффузии частиц растворяемого вещества и молекул воды.





Особую осторожность следует проявлять при растворении серной кислоты, так как из-за повышенной температуры часть воды может превратиться в пар, а кислота может выделиться из емкости под ее воздействием. pressure. To избегайте этого, влейте серную кислоту в воду тонкой струйкой, постоянно помешивая (и наоборот! это не. Например, если тонкостенный стакан аммиачной селитры, который помещают на влажную тарелку, растворить в воде, то охлаждение будет интенсивным, и стекло может даже замерзнуть(рис.88).
Почему при растворении веществ наблюдается обратное явление? На этот вопрос можно ответить, опираясь на положения атомно-молекулярной теории(I, с. 27). При растворении твердые частицы распределяются между молекулами solvent. In в этом случае необходимая энергия поглощается извне и происходит охлаждение. Исходя из этого, процесс растворения следует отнести к физическим явлениям. Рис.87.
Нагревание во время растворения 88.Охлаждение, когда некоторые вещества растворяются в воде. Некоторые вещества в воде. Почему растворение некоторых веществ вызывает нагревание? Выделение тепла (I, 10) является признаком химической реакции. Поэтому при растворении также осуществляется химическая реакция. Например, молекулы серной кислоты вступают в реакцию с молекулами воды, образуя соединения в составе H2S04•Н20 (моногидрат серной кислоты) и H2S04•2Н20 (дигидрат серной кислоты).
Молекулы серной кислоты связываются с 1 или 2 молекулами воды1. Взаимодействие молекул воды с молекулами серной кислоты относится к реакции гидратации (I, 91), и образующееся вещество называется гидратами. Когда твердое вещество растворяется в воде, происходят как физические, так и химические процессы. Если в результате гидратации выделяется больше энергии, чем тратится на разрушение кристалла вещества, то растворение сопровождается нагревом, а в обратном случае-охлаждением. _
Растворение-это физико-химический процесс, а раствор-это физико-химическая система. Такое объяснение сущности процесса растворения и природы раствора впервые было теоретически продемонстрировано великим русским ученым Д. И. Менделеевым•Он разработал теорию гидратации растворов. Кристаллогидрат. Когда раствор испаряется, вещество часто отделяется в виде кристаллов, содержащих химически связанные water.
- So например, если добавить воду к сульфату меди (II) CuSO4 (белый порошок), то произойдет нагревание, и образуется синий раствор. При выпаривании выделяется голубое кристаллическое вещество-сульфат меди, который имеет состав CuS04•5H20.Медицинское образование 1 точка между уравнениями не является знаком умножения, но указывает на то, что вода химически связана с веществом.
Сульфаты из сульфата меди (II) выражаются следующим уравнением: Cu SO Людмила Фирмаль
Вода, которая является частью кристалла, называется кристаллической водой. Многие вещества образуют кристаллогидраты. Например, FeS04•7H20-кристаллогидрат сульфата железа (II) (сульфат железа), CaS04•2H20-кристаллогидрат сульфата кальция (гипс), Na2CO3•10H20-кристаллогидрат карбоната натрия(кристаллическая сода).
При изучении процесса гидратации у ученых возникает вопрос: какие частицы, молекулы или ионы вступают в реакцию с водой? И. А. Кабульков предположил, что ионы электролита вступают в реакцию с молекулами воды, то есть происходит гидратация ионов. Это было далее полностью подтверждено. Так, например, было обнаружено, что сульфат меди безводный (II) CuSO4 не содержит цветков. Безводные Cu2 +и S04-ионы также бесцветны.
При растворении сульфата меди (II) в воде происходит гидратация ионов. При испарении такого раствора образуются кристаллы, узлы которых имеют синий гидратированный Ион меди Cu (H20) 4+ и бесцветный гидратированный сульфат-ион S04•Н202 -.Это медный купорос CuS04•5H20.
Также за счет диссоциации молекул кислот образуются не свободные ионы водорода, а их гидраты — гидроксониевые ионы: n * + Hr0-H30 + Диссоциацию молекул кислоты можно объяснить образованием дополнительного ковалента bonds. It характеризуется тем, что оба атома не дают общей пары связанных электронов, а только 1 из них.
Атом, дающий общую связную электронную пару, называется донором, а атом, который ее приобретает, — акцептором, и механизм этой реакции-донор-акцептор. Образование ионов гидроксония при диссоциации молекул соляной кислоты схематично показано следующим образом:
Н Н: Б: и Н: ИЦ:+ и: о: и-•••• Или нсl + Н2О — ^ h3o ++ ки ’ Этот рисунок показывает, что атом кислорода обеспечивает общую пару электронов, то есть атом кислорода является донором, а Ион H4-акцептором. отот-это тип ковалентного соединения, обозначенный стрелкой. Н л Н Вопрос 5-8 (стр. 18).Решите задачу I (стр. 19).
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.





















































Образовательный сайт для студентов и школьников
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Подписывайтесь на наши новые рассылки:
Выпуск 24
ХИМИЯ
- Растворы. Электролитическая диссоциация. Процесс растворения. Тепловые явления при растворении (Продолжение. )
БИОЛОГИЯ
- Растения в природе. Растения-паразиты. Насекомоядные растения (. Продолжение)
ФИЗИКА
- Свободное падение тел (. Продолжение)
АСТРОНОМИЯ
- Солнечная система. Нептун. Плутон (. Окончание)
Процесс растворения. Тепловые явления при растворении
Растворение представляет собой сложное физико-химическое явление и в зависимости от природы растворителя и растворенного вещества может преобладать либо физический, либо химический процесс. Обычно физический процесс всегда предшествует химическому. Д. И. Менделеев, обосновывая теорию растворов, впервые выдвинул идею о существовании в них неопределенного состава химических соединений. Эта идея составила основу химической теории растворов.
Обычно растворение одного вещества в другом может протекать по одному или нескольким механизмам. Например, взаимодействие металла с кислотой является химическим растворением, осуществляемым в результате конкретного химического превращения:
Химическое растворение – это такой процесс, в результате которого можно получить соответствующий раствор целевого продукта. Так, можно легко рассчитать, например, массы Р2О5 и Н2О для получения раствора Н3РО4 определенной концентрации:
В результате таких процессов образуются растворы молекулярного или ионного типа. При нехимическом растворении процесс взаимодействия между молекулами растворяемого вещества с молекулами растворителя называют сольватацией, а продукты взаимодействий – сольватами (от лат. solvere – растворять). Если в качестве растворителя используется вода, то процесс называют гидратацией, а продукты взаимодействия – гидратами. Образование сольватов может протекать различными путями в зависимости от природы растворителя и растворяемого вещества. Так, если растворяются вещества с ионной структурой, то молекулы растворителя удерживаются у образовавшегося иона за счет электростатических сил взаимодействия. Например, при растворении некоторых солей двух- и трехзарядных катионов (Cu 2+ , A1 3+ , Ni 3+ и т. д.) образуются сольватированные ионы:
Число молекул воды, координированных с ионом растворенного вещества, зависит от его строения и размеров: чем меньше радиус, тем меньше число молекул воды может быть ассоциировано. Ионы же с большими радиусами (например, Na + , K + , Cs + ) могут в зависимости от концентрации раствора сольватироваться различным числом молекул растворителя.
Часто образующиеся сольваты (гидраты) могут быть настолько прочны, что их можно выделить из раствора в кристаллическом состоянии. Такие кристаллы, содержащие в связанном виде молекулы растворителя, называют кристаллосольватами (если растворитель вода, то кристаллогидратами). Например:
Когда энергия связи между сольватируемыми частицами и молекулами растворителя становится больше, чем энергия связи между частицами в решетке твердого кристалла, то постепенно происходит разрушение всего кристалла.
Следовательно, при растворении веществ происходит разрыв связей между ионами, атомами или молекулами, что связано с затратой энергии. Одновременно происходит взаимодействие частиц растворяемого вещества с растворителем, что сопровождается выделением энергии. Общий же энергетический эффект зависит от соотношения выделяемой или поглощенной энергии. Если энергия, затраченная на разрыв связей в исходном веществе, больше, чем выделившаяся при образовании сольвата, то наблюдается понижение температуры раствора, а если наоборот, – то повышение температуры раствора. Тепловая энергия, выделяемая или поглощаемая при растворении веществ, называется теплотой растворения.
Таким образом, растворение можно рассматривать как два последовательных процесса:
1) разрыв связей в исходном веществе (эндотермический процесс)
2) сольватация (гидратация) частиц А и В с образованием сольватов (гидратов) и выделение тепловой энергии (экзотермический процесс)
Тепловой эффект растворения определяется природой веществ. Например, при смешении концентрированной серной кислоты с водой выделяется столько теплоты, что раствор может закипеть. Наоборот, растворение хлорида кальция или нитрата аммония сопровождается сильным охлаждением.
Следовательно, растворение серной кислоты представляет собой экзотермический процесс и ∆H 0, поскольку при растворении температура понижается.
Продолжение следует.
Э.Т. Оганесян "Руководство по химии", М., "Высшая школа", 1991 г.
В лесах наших широт нередко встречается паразит петров крест. Он развивается так же, как заразиха, и паразитирует па корнях широколиственных деревьев – липы, ясеня, орешника. Но увидеть его можно только ранней весной, когда он на короткий срок показывается из-под земли. В тенистом лесу на поверхность земли выходит невысокий розово-белый стебель с односторонней густой кистью малиново-красных цветков. Этот стебель вскоре отмирает, но растение-паразит продолжает жить под землей в виде многолетнего мясистого чешуйчатого корневища, вес которого достигает 5 кг.
Среди цветковых растений существует большая группа паразитов, у которых есть свои зеленые листья. Их называют полупаразитами. Хлорофилл в их листьях и стеблях делает растения способными к фотосинтезу, а воду и минеральные вещества они добывают паразитически, т. е. отнимая у других растений. Среди таких полупаразитов особенно интересна омела. Особенно часто она поселяется на плодовых деревьях (на груше и яблоне) и на тополях. Омела – сильно ветвящийся многолетний кустарник с кожистыми темно-зелеными листьями. Она достигает иногда сорокалетнего возраста. Кустарник омелы, поселившийся на ветвях дерева, напоминает гнездо крупной птицы. Вместо корней в основании куста развивается система присосков, проникающих в древесину растения-хозяина. Ягоды омелы похожи на ягоды белой смородины. Их охотно поедают птицы, особенно дрозды. Мякоть ягоды слизистая и очень клейкая. Поэтому птице после еды приходится очищать клюв, обтирая его о ветки деревьев. Остатки ягод прилипают к веткам, и там их семена прорастают. Корешок зародыша пробивает кору ветки и дорастает до древесины. После этого начинает расти стебелек с семядолями. Корешок же при дальнейшем развитии видоизменяется в присоски, напоминающие грабли. Хотя омела и не полный паразит, но она может принести растению-хозяину значительный ущерб.
Некоторые полупаразиты могут существовать самостоятельно, у них есть и листья, и корни, но при благоприятных условиях они добывают себе дополнительное питание, отнимая его у своих соседей, т. е. паразитируя. Это всем известные полевые цветы: иван-да-марья, погремок, мытник и ряд других. Если корни такого полупаразита придут в соприкосновение с корнями другого растения, подходящего для того, чтобы стать растением-хозяином, то полупаразит использует этот случай. На корнях образуются присоски, которыми присоединится к растению-хозяину. Это можно обнаружить, осторожно выкопав корневые системы полупаразита и соседних с ним растений.
Вред, приносимый такими паразитами, по-видимому, небольшой. Обычно по внешнему виду растений-хозяев незаметно каких-либо признаков их угнетения.
Понятно, что паразиты могли появиться лишь, когда на Земле были уже другие живые существа. Приспособление к паразитическому образу жизни среди зеленых цветковых растений шло, по-видимому, определенными ступенями.
На первой ступени стоят такие зеленые полупаразиты, как иван-да-марья и погремок, еще мало, чем отличающиеся от обычных зеленых растений. Значительно усилился паразитизм у растений, подобных омеле: у них еще есть зеленые листья и стебли, но уже нет корней, и вместо них образовались присоски. Еще дальше ушли от самостоятельно питающихся растений паразиты типа заразихи и петрова креста: у них уже нет хлорофилла, и пищу они получают целиком от растения-хозяина; но у них остались стебель и листья. Крайний тип паразита среди цветковых растений – раффлезия. Из прежних органов у нее остался лишь цветок, все остальное тело превратилось в клеточные нити, внедрившиеся между клетками растения-хозяина и похожие на мицелий гриба.
Основная масса растений-паразитов встречается среди грибов и бактерий.
НАСЕКОМОЯДНЫЕ РАСТЕНИЯ
Никого не удивляет то, что птицы ловят мошек, клюют червяков, поедают личинок. Растения питаются иначе: они получают пищу из воздуха и почвы. Растения поглощают, усваивают пищу незаметно для глаза – через лист и корень. Однако среди растений есть и такие, которые поедают мелких рачков, мальков рыб, насекомых. Это – насекомоядные растения. Они очень разнообразны: их насчитывают в различных семействах до 500 видов. Насекомоядные растения встречаются во всех частях света.
На торфяном болоте среди клюквы, голубики, багульника, пушицы, белоуса можно довольно часто встретить росянку, а изредка и жирянку – два типично насекомоядных растения. Обычно они растут непосредственно на кочках торфяного мха сфагнума.
Росянка – небольшое растеньице красновато-зеленой окраски. Самое интересное у росянки – ее листья, распластанные по поверхности мохового покрова. По краям и на верхней стороне пластинки листа расположено около 25 ресничек. По краю листа сидят самые длинные реснички, а в центре листовой пластинки – наиболее короткие. Верхний конец каждой реснички утолщен в виде головки. В утолщении находится желёзка, выделяющая блестящую капельку слизи, похожую на каплю росы; отсюда и название растения – "росянка".
Когда на лист сядет какое-нибудь маленькое насекомое – а его привлекает блеск капельки, похожей на росу, – то оно и прилипнет к ресничке. Ресничка вскоре начнет нагибаться к центру пластинки. Минут через 10–20 головка реснички вместе с насекомым достигнет пластинки. Тогда начнут нагибаться сначала соседние реснички, а потом и более отдаленные; раздражение будет передаваться все далее и далее. И часа через 2–3 значительная часть ресничек – а иногда и все они – склонится над пойманной жертвой. Кроме ресничек, обычно приходит в движение и сама пластинка листа. Край ее загибается и прикрывает попавшее в западню насекомое.
Раздражение и последующее движение ресничек может вызвать кусочек мяса или какое-либо другое белковое вещество. Но если положить на лист вещество, не содержащее белка, например кусочек сахара или же просто песчинку, реснички двигаться не будут.
Желёзки ресничек выделяют, кроме слизи, особые вещества – ферменты, расщепляющие белки. У росянки ферменты похожи на желудочный сок животных – пепсин. Кроме того, желёзки у росянки выделяют кислоту, которая помогает растению переварить белки.
Когда организм растения всосет переваренную пищу, реснички распрямляются, выделяют капельки слизи и снова готовы ловить насекомых. Весь процесс переваривания и всасывания длится несколько дней – в зависимости от величины насекомого.
Жирянка встречается, как и росянка, на торфяных болотах, но реже. Листья жирянки также распластаны по поверхности мохового покрова, но они значительно крупнее, чем у росянки, и ярко-зеленого цвета. Поверхность пластинки листа покрыта слизью, отчего листья кажутся жирными, отсюда и название растения.
Под микроскопом можно увидеть на срезе листа, что вся поверхность его пластинки усеяна желёзками двух типов: одни из них головчатые, на ножках, напоминающие шляпочные грибы; другие же без ножки – сидячие. Возможно, что желёзки на ножках выделяют пищеварительные соки, а сидячие – всасывают переваренную пищу.
На один квадратный сантиметр листа жирянки приходится до 25 000 желёзок. Они выделяют слизь. Насекомое, прилипшее к листу, вызывает раздражение в желёзках, и они начинают выделять пищеварительные соки (ферменты и кислоту). Для лучшего переваривания пищи у жирянок выработалось еще одно приспособление: когда насекомое попадает на лист, пластинка листа вблизи от этого места медленно загибает свой край, пока не покроет насекомое сверху. У жирянки переваривание пищи и ее всасывание идет быстрее, чем у росянки. Через сутки края листа обычно уже раскручиваются.
Народ уже давно подметил и использовал свойство росянок и жирянок вырабатывать ферменты, переваривающие белок. В Вологодской области, например, очищают глиняные кувшины от остатков молока, выпаривая их в печке отваром из листьев росянки. Фермент росянки разлагает белок молока даже в порах стенок посуды. На Кольском п-ве листья жирянки кладут в парное молоко и получают своеобразный сыр.
Росянку и жирянку можно культивировать и дома. Для этого нужно перенести их с болота вместе с торфяным мхом, на котором они росли, и поместить в широкую банку, или террариум. Сверху банку нужно прикрыть стеклом для поддержания влажной атмосферы, чтобы мох не высыхал и все время был влажным. Банку нужно держать на свету, но в прохладном месте, предохраняя растения от перегрева солнечными лучами.
Продолжение следует.
"Детская энциклопедия", том 4, М.: 1960 г.
Свободное падение тел
1. Свободным падением называется движение, которое совершало бы тело только под действием силы тяжести без учета сопротивления воздуха. При свободном падении тела с небольшой высоты h от поверхности Земли (h RЗ, где RЗ – радиус Земли) оно движется с постоянным ускорением g, направленным по вертикали вниз.
Ускорение g называется ускорением свободного падения. Оно одно и то же для всех тел и зависит лишь от высоты над уровнем моря и от географической широты.
2. Если в момент начала отсчета времени (t0 = 0) тело имело скорость v0, то по истечении произвольного промежутка времени ∆t = t – t0 скорость тела при свободном падении будет
При начальной скорости падения, равной нулю (v0 = 0), скорость тела в произвольный момент времени t
3. Путь h, пройденный телом в свободном падении, к моменту времени t
Если начальная скорость тела равна нулю (v0 = 0), то
4. Модуль скорости тела после прохождения в свободном падении пути h
Если координатная ось Оу направлена вертикально сверху вниз, то модуль скорости тела в произвольной точке траектории с координатой у
5. Продолжительность ∆t свободного падения без начальной скорости (v0 = 0) с высоты h
Продолжение следует.
Б.М. Яворский "Справочное руководство по физике", М.: "Наука", 1984 г.
Нептун – восьмая по порядку от Солнца большая планета Солнечной системы. Нептун был открыт необычным образом. Было замечено, что Уран движется не совсем так, как ему полагается двигаться под действием притяжения Солнца и известных в то время планет. Тогда заподозрили существование еще одной массивной планеты и попытались предвычислить ее положение на небе. Эту чрезвычайно сложную математическую задачу независимо друг от друга успешно решили английский астроном Дж. Адамс и французский астроном У. Леверье. Получив данные Леверье, ассистент Берлинской обсерватории И. Галле 23 сентября 1846 г. обнаружил планету. Открытие Нептуна имело величайшее значение, прежде всего, потому, что оно послужило блестящим подтверждением правильности закона всемирного тяготения (см. Гравитация), положенного в основу расчетов.
Средняя удаленность Нептуна от Солнца – 30,1 а. е., период обращения по орбите 164 года и 288 дней. Таким образом, с момента открытия Нептун еще даже не совершил полного оборота по своей орбите.
Видимый угловой диаметр Нептуна не превышает 2''. При измерении столь малого диаметра угломерными приспособлениями с поверхности Земли относительная ошибка очень велика. Уточнить диаметр Нептуна удалось 7 апреля 1967 г., когда планета в своем движении на фоне звездного неба заслонила одну из далеких звезд. По результатам наблюдений с нескольких астрономических обсерваторий экваториальный диаметр Нептуна был определен равным 50 200 км. Новые сведения о диаметре позволили уточнить величину средней плотности Нептуна: она оказалась равной 2,30 г/см 3 , т. е. несколько больше, чем у других планет гигантов, состоящих главным образом из водорода и гелия с примесью соединений других химических элементов. В центре Нептуна согласно расчетам, имеется тяжелое ядро из силикатов, металлов и других элементов, входящих в состав планет земной группы.
Изучение характера ослабления блеска звезды при ее затемнении атмосферой Нептуна дало много дополнительной информации. В частности, был найден средний молекулярный вес надоблачных слоев атмосферы Нептуна. Он соответствует молекулярному водороду с небольшой примесью метана.
Детали на поверхности Нептуна различить очень трудно. Поэтому чрезвычайно сложно определить из наземных наблюдений и период его осевого вращения. Направление полярной оси можно найти косвенным методом из длительных наблюдений движения спутников Нептуна и прецессии их орбит.
Плутон был открыт Клайдом Томбо (США) в 1930 г. Из 9 известных больших планет Солнечной системы Плутон наиболее удален от Солнца. Среднее расстояние Плутона от Солнца составляет 39,5 а. е. Плутон выглядит как точечный объект 15 и звездной величины, т. е. примерно в 4 тыс. раз слабее тех звезд, которые находятся на пределе видимости невооруженным глазом. Плутон очень медленно, за 247,7 года, совершает оборот по орбите, которая имеет необычно большой наклон (17|) к плоскости эклиптики и вытянута настолько, что в перигелии Плутон подходит к Солнцу на более короткое расстояние, чем Нептун. Из-за огромной удаленности от Солнца и слабой освещенности изучать Плутон очень сложно.
Измерить диаметр Плутона долго не удавалось. Лишь в 80-е годы, применив новый метод спекл-интерферометрии, астрономы установи ли, что он близок к 3000 км. Поверхность Плутона, нагреваемая Солнцем до –220|С, даже в наименее холодных полуденных участках покрыта, по-видимому, снегом из замерзшего метана. Атмосфера планеты разреженная и состоит из газообразного метана с возможной примесью инертных газов.
Блеск Плутона меняется с периодом вращения 6 сут. 9 ч. В 1978 г. выяснилось, что эта периодичность соответствует также орбитальному движению спутника Плутона, обнаруженного американскими астрономами. Спутник Плутона – Харон относительно яркий, но расположен настолько близко к планете, что его изображение на фотоснимках сливается с изображением Плутона, лишь слегка выступая то с одной, то с другой стороны. Из периода обращения и расстояния между центрами вычислили массу системы "Плутон – спутник". Масса оказалась неожиданно малой: приблизительно 1,7% массы Земли. Почти вся она сосредоточена в Плутоне, так как диаметр спутника, судя по блеску, мал по сравнению с диаметром планеты. В таком случае средняя плотность Плутона составляет приблизительно 0,7 г/см 3 , если принять его диаметр равным 3000 км. Такая малая плотность означает, что Плутон состоит преимущественно из летучих химических элементов и соединений, т. е. имеет примерно такой же состав, как планеты-гиганты и их спутники.


В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Растворение как физико-химический процесс. Растворимость. Типы растворов"
В каждой нашей клеточке напоминание о зарождении жизни. По нашим сосудам: артериям, венам и капиллярам тоже течет раствор, где содержание солей около 0,9%. Плазма крови, желудочный сок тоже являются растворами. Все физико-химические процессы, происходящие в живых организмах, протекают тоже в растворах. Природные водные растворы участвуют в почвообразовании и снабжают растения питательными веществами. Многие технологические процессы также протекают в растворах (получение бумаги, красок, металлов, удобрений, продуктов питания).
Растворы в организме человека
Растворы в промышленности

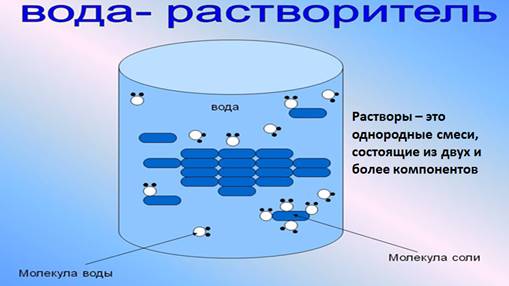
Растворы – это однородные смеси, состоящие из двух и более компонентов.
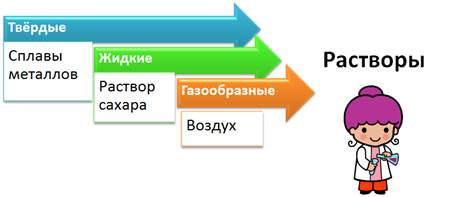
По агрегатному состоянию растворы делят на: твердые (например, сплавы металлов), жидкие (раствор сахара), газообразные (смесь газов – воздух). Наиболее распространены жидкие растворы.
Растворы состоят из растворителя и растворенного вещества (твердого, жидкого или газообразного). Растворителем может быть вода, тогда раствор является водным, а также бензин, эфир, спирт.

Как происходит растворение веществ?
Сторонники физической теории растворов, как Вант-Гофф, Аррениус, Оствальд, считали, что процесс растворения является результатом диффузии, т.е. проникновения молекул растворенного вещества между молекулами воды.
Сторонники химической теории растворов, одним из которых был Д. И. Менделеев, считали, что растворение является химическим взаимодействием растворенного вещества и воды.
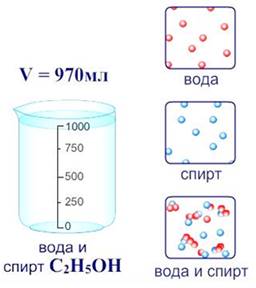
В настоящее время принята физико-химическая теория растворов, которую ещё в 1906 г. предсказывал Д. И. Менделеев. Поэтому растворение является физико-химическим процессом.
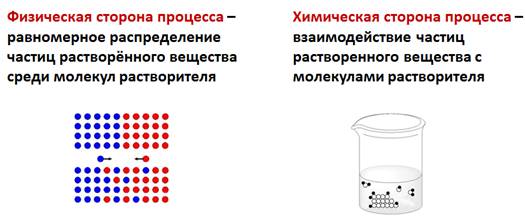
Физическая сторона процесса заключается в разрушении кристаллической решетки вещества и равномерном распределении, по принципу диффузии, частиц растворенного вещества среди молекул растворителя. Химическая сторона процесса проявляется во взаимодействии частиц растворенного вещества с молекулами растворителя.
В результате взаимодействия растворенного вещества и воды образуются гидраты. Растворение сопровождается тепловыми эффектами: при растворении серной кислоты воду добавляют к кислоте, из-за сильного разогревания раствора, т.е. теплота выделяется, а при растворении нитрата аммония, хлорида натрия, теплота, наоборот, поглощается.
Кроме гидратов есть еще кристаллогидраты, т.е. это кристаллические вещества, содержащие молекулы воды. Вода, входящая в их состав – кристаллизационная. Примером кристаллогидратов служит медный купорос – CuSO4 · 5H2O. Медный купорос является веществом голубого цвета, а безводный сульфат меди (II) – белый, при растворении в воде, раствор становится голубого цвета.

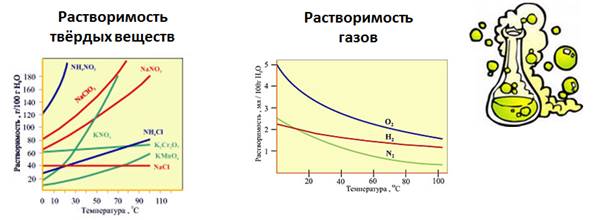
Растворимость веществ в воде зависит от температуры. Растворимость в воде твердых веществ при повышении температуры увеличивается, а газов, наоборот, уменьшается.
Если растворить в воде хлорид калия, то при комнатной температуре может раствориться только 34,4 г в 100 г воды. Если добавить больше соли, то сколько бы мы не перемешивали, соль не раствориться в воде, т.е. этот раствор уже насыщенный. Раствор, в котором при данной температуре вещество больше не растворяется является насыщенным. Если растворить не 34,4 г соли, а меньше, то раствор будет ненасыщенным. Т.е. раствор, в котором при данной температуре вещество ещё может раствориться, называют ненасыщенным.
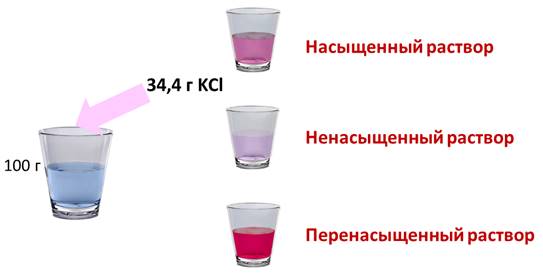
При охлаждении насыщенного раствора возникает избыток растворенного вещества, если оно не выпадает в осадок, то образуется перенасыщенный раствор. Перенасыщенным называют такой раствор, в котором при данной температуре находится в растворенном состоянии больше вещества, чем в его насыщенном растворе при тех же условиях.
Перенасыщенный раствор можно легко приготовить. Для этого нужно приготовить насыщенный раствор соли при высокой температуре, затем избыток соли отфильтровать, накрыть сосуд и охладить при комнатной температуре. Этот раствор может храниться довольно долго, но если в него внести стеклянную палочку, на которой будет несколько крупинок этой соли, то начнется ее кристаллизация из раствора. В мертвом море концентрация соли так велика, что помещенные сюда предметы, начинают покрываться кристаллами.

По растворимости вещества делятся на хорошо растворимые, если при комнатной температуре в 100 г воды растворяется более 1 г вещества, если меньше 1 г вещества, то такие вещества являются малорастворимыми, и если вещества растворяется меньше 0,01 г на 100 г воды, то такие вещества относятся к практически нерастворимым. Совершенно нерастворимых веществ нет. Даже атомы серебра чуть-чуть переходят в раствор из изделий, помещенных в воду.
Читайте также:

