Теория фишера и кошланда биохимия кратко
Обновлено: 05.07.2024
Структура и функции ферментов, а также механизм их действия почти ежегодно подробно обсуждаются на многих международных симпозиумах и конгрессах. Важное место отводится рассмотрению структуры всей молекулы фермента и ее активных центров, молекулярному механизму действия различных типов ферментов, общей теории энзиматического катализа. Тем не менее до сих пор нет полной ясности по двум кардинальным проблемам энзимологии: чем вызваны специфичность действия и высокая каталитическая эффективность ферментов?
Л. Михаэлис не только постулировал образование промежуточного фермент-субстратного ES-комплекса, но и рассчитал влияние концентрации субстрата на скорость реакции. В процессе реакции различают несколько стадий: присоединение молекулы субстрата к ферменту, преобразование первичного промежуточного соединения в один или несколько последовательных (переходных) комплексов и протекающее в одну или несколько стадий отделение конечных продуктов реакции от фермента. Это можно схематически проиллюстрировать следующими примерами:
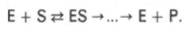
В реакциях анаболизма, например А + В —> АВ, фермент может соединяться как с одним, так и с другим субстратом или обоими субстратами:
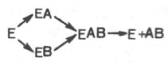
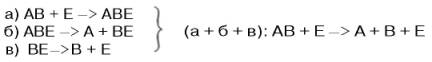
На рис. 4.7 представлена схема образования промежуточного фермент-субстратного комплекса. Если фермент в активном центре содержит кофермент, то предполагается образование тройного комплекса (рис. 4.8).
Фермент вступает во взаимодействие с субстратом на очень короткий период, поэтому долгое время не удавалось показать образование такого комплекса. Прямые доказательства существования фермент-субстратного комплекса были получены в лабораториях Д. Кейлина и Б. Чанса. В настоящее время экспериментальные и математические методы кинетики, термодинамики и статической механики химических реакций позволяют
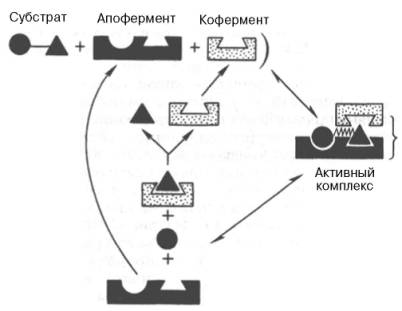
Рис. 4.8. Функция кофер-мента (по А. Кантарову и Б. Шепартцу).
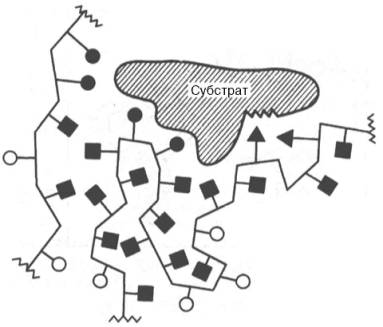
Рис. 4.9. Образование не-ковалентных связей между ферментом и субстратом (схема).
определить для ряда ферментативных реакций кинетические и термодинамические показатели, в частности константы диссоциации промежуточных фермент-субстратных комплексов, константы скорости и равновесия их образования.
В образовании фермент-субстратных комплексов участвуют водородные связи, электростатические и гидрофобные взаимодействия, а в ряде случаев также ковалентные, координационные связи (рис. 4.9). Информация о природе связей между субстратом и связывающим участком активного центра фермента может быть получена методами ЭПР и ЯМР, а также методами УФ- и ИК-спектроскопии.
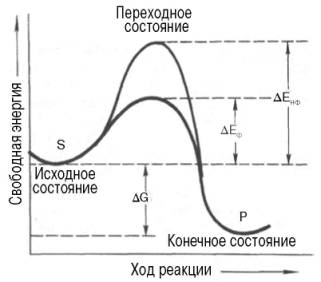
Рис. 4.11. Энергетический механизм ферментативной и неферментативной химических реакций.
S - исходный субстрат; Р - продукт; ΔЕНФ -энергия активации неферментативной реакции; ΔЕФ - энергия активации ферментативной реакции; ΔG - стандартное изменение свободной энергии.
конформации белковой молекулы, но также геометрической и электронно-топографической перестройкой молекулы субстрата.
Подобно другим катализаторам, ферменты, с термодинамической точки зрения, ускоряют химические реакции за счет снижения энергии активации . Энергией активации называется энергия, необходимая для перевода всех молекул моля вещества в активированное состояние при данной температуре. Другими словами, это энергия, необходимая для запуска химической реакции, без которой реакция не начинается несмотря на ее термодинамическую вероятность. Фермент снижает энергию активации путем увеличения числа активированных молекул, которые становятся реакционноспособными на более низком энергетическом уровне (рис. 4.11). На рисунке видно, что ферментативная реакция имеет более низкую энергию активации. Следует отметить, что как катализируемая ферментом, так и не катализируемая им реакция независимо от ее пути имеет одинаковую величину стандартного изменения свободной энергии (ΔG). Действуя на скорость реакции, ферменты не изменяют равновесия между прямой и обратной реакциями, как и не влияют на величину свободной энергии реакции; они лишь ускоряют наступление равновесия химической реакции.
Зависимость между константой равновесия и изменением свободной энергии реагирующих веществ математически принято выражать уравнением ΔG = = –R•T•lnK, где R – газовая постоянная; Т – абсолютная температура в Кельвинах; lnК – натуральный логарифм константы равновесия; ΔG – стандартное изменение свободной энергии, Дж/моль. Из представленного уравнения вытекает, что при высоком значении К величина ΔG оказывается отрицательной. Подобные реакции сопровождаются уменьшением свободной энергии. При низком значении К величина ΔG оказывается положительной. Если константа равновесия равна единице, то изменение свободной энергии будет равно нулю и реакция легкообратима.
Для измерения константы равновесия и величины свободной энергии какой-либо химической реакции, например реакции взаимопревращения глюкозо-1-фосфата в глюкозо-6-фосфат, катализируемой ферментом фосфоглюкомутазой, определяют количество глюкозо-6- и глюкозо-1-фосфата при достижении химического равновесия. В состоянии равновесия содержание глюкозо-6-фосфата оказывается в 19 раз больше количества глюкозо-1-фосфата. Отсюда константа равновесия К равна 19. Подставляя эту цифру в уравнение, получаем ΔG = –7329 Дж/моль. Это означает, что при превращении 1 моля глюкозо-1-фосфата в 1 моль глюкозо-6-фосфата при температуре 25°С происходит уменьшение свободной энергии системы на 7329 Дж.
Таким образом, в механизме ферментативного катализа ведущую роль играют промежуточные фермент-субстратные комплексы, образование которых определяется как тонкой трехмерной структурой активного центра, так и уникальной структурной организацией всей молекулы фермента, обеспечивающими высокую каталитическую активность и специфичность действия биокатализатора.

Светлана, 1-активный центр
фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении
2- происходит гибкость активного центра. Присоединение субстрата к участку
фермента вызывает изменение конфигурации каталитического центра, чтобы
его форма соответствовала форме субстрата.

Здесь показаны 2 теории действия ферментов
слева - теория Фишера( активный центр фермента строго соответствует конфигурации субстрата, и не изменяется при его присоединении)
справа - теория Кошланда ( Присоединение к якорному участку фермента вызывает изменение конфигурации каталитического центра, чтобы его форма соответствовала форме субстрата)



Адиле, Гипотеза Кошланда или же "рука-перчатка" - подразумевает гибкость активного центра. Субстрат присоединяется к якорному участку фермента и вызывает изменение конфигурации каталитического центра так, чтобы его форма соответствовала форме субстрата.
Гипотеза Фишера или же "ключ-замок" заключается в том, что активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении

А)Теория Фишера "ключ-замок" – активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении.Б) Теорию Кошленда " рука-перчатка" - активный центр фермента может изменить конформацию после связывания субстрата

Это теории взаимодействия ферментов (образование фермент - субстратного комплекса):
Первый рисунок - жесткое взаимодействие - фермент устанавливает связь с активным центром как ключ - замок (теория Фишера), второй рисунок - иллюстрирует теорию Кошланда - субстрат изменяет конформацию активного центра фермента, делая ее комплементарной (рука-перчатка).

Адиле, на первом рисунке жесткое взаимодействие , установление связи с активным центром (ключ-замок)
Второй рисунок субстрат меняет конфирмацию активного центра -> комплементарная конформация

А. взаимодействие субстратов с ферментами согласно модели "ключ-замок"( механизм действия ферментов по Фишеру)
Б. взаимодействие субстратов с ферментами согласно модели "рука -перчатка"(по Кошланду)


Анастасия Карпова
А. Теория Фишера - специфичностью действия фермента определяется строгим соответствием геометрической структуры субстрата и активногоо центра фермента
Б. Теория Кошленда - активный центр подстраивается под форму субстрата после связывания с ним

1. Теория Фишера (модель "жесткой матрицы", "ключ-замок") – активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении. Эта модель хорошо объясняет абсолютную специфичность, но не групповую.



Эмиль Салимов
1.Гипотез Фишера - активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении.
Б. Гипотиза Кошланда - присоединение субстрата к якорному участку фермента вызывает изменение конфигурации каталитического центра таким образом, чтобы его форма соответствовала форме субстрата.
1. Зависимость активности фермента от температуры – описывается колоколообразной кривой с максимумом скорости при значениях оптимальной температуры для данного фермента.
Закон о повышении скорости реакции в 2-4 раза при повышении температуры на 10°С справедлив и для ферментативных реакций, но только в пределах до 55-60°С, т.е. в значениях до денатурации белков. Наряду с этим, как исключение, имеются ферменты некоторых микроорганизмов, существующих в воде горячих источников и гейзеров.
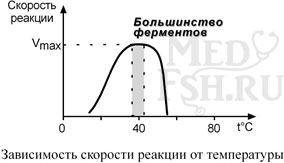
При понижении температуры активность ферментов понижается, но не исчезает совсем. Иллюстрацией может служить зимняя спячка некоторых животных (суслики, ежи), температура тела которых понижается до 3-5°С. Это свойство ферментов также используется в хирургической практике при проведении операций на грудной полости, когда больного подвергают охлаждению до 22°С.
2. Зависимость активности фермента от рН – описывается колоколообразной кривой с максимумом скорости при оптимальном для данного фермента значения рН.
Для каждого фермента существует определенный узкий интервал рН среды, который является оптимальным для проявления его высшей активности. Например, оптимальные значения рН для пепсина 1,5-2,5, трипсина 8,0-8,5, амилазы слюны 7,2, аргиназы 9,7, кислой фосфатазы 4,5-5,0, сукцинатдегидрогеназы 9,0.
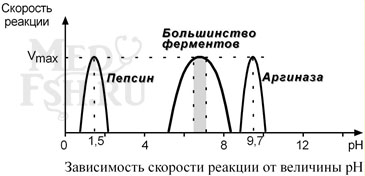
Объясняется это наличием таких аминокислот в структуре фермента, заряд которых изменяется при изменении рН (лизин, аргинин, глутамат, аспартат). Изменение ионизации аминокислот приводит к изменению конформации молекулы и, следовательно, субстрат связывается или не связывается с активным центром.
3. Зависимость от количества фермента
При увеличении количества молекул фермента скорость реакции возрастает непрерывно и прямо пропорционально количеству фермента, т.к. большее количество молекул фермента производит большее число молекул продукта Зависимость активности фермента от субстрата описывает ферментативная кинетика, ее центральным понятием является константа Михаэлиса (Km) (см. ниже).
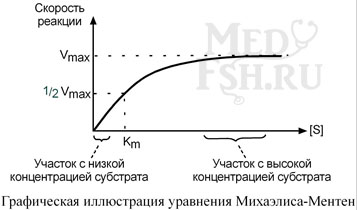
4. Зависимость активности фермента от концентрации субстрата
При увеличении концентрации субстрата скорость реакции сначала возрастает, т.к. к катализу добавляемых молекул субстрата подключаются новые и новые молекулы фермента. Т.е. скорость накопления продукта возрастает, и это означает увеличение активности фермента. Затем наблюдается эффект насыщения (плато на кривой), когда все молекулы фермента заняты молекулами субстрата и непрерывно ведут катализ. Здесь скорость реакции максимальна. В некоторых случаях, при дальнейшем увеличении концентрации субстрата между его молекулами возникает конкуренция за активный центр фермента и активность фермента (скорость реакции) снижается.
Уравнение Михаэлиса-Ментен
Зависимость активности фермента от субстрата описывает уравнение Михаэлиса-Ментен, использующее константу Михаэлиса (Km), биологический смысл которой заключается в характеристике сродства фермента к субстрату, а именно: увеличение величины Кm означает снижение сродства фермента к субстрату.
Уравнение Михаэлиса-Ментен показывает взаимосвязь максимальной и реальной скоростей реакции, константы Михаэлиса и концентрации субстрата.
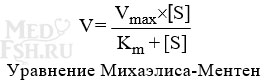
Выделяют три решения уравнения:
2. Теория Кошланда (модель "индуцированного соответствия", "рука-перчатка") – подразумевает гибкость активного центра. Присоединение субстрата к якорному участку фермента вызывает изменение конфигурации каталитического центра таким образом, чтобы его форма соответствовала форме субстрата.

Схематичное представление теории Кошланда
Активность ферментов в клетке непостоянна
Активность ферментов в клетке непостояннаво времени. Ферменты чутко реагируют на ситуацию, в которой оказывается клетка, на факторы, воздействующие на нее как снаружи, так и изнутри. Главная цель такой чувствительности ферментов – отреагировать на изменение окружающей среды, приспособить клетку к новым условиям, дать должный ответ на гормональные и иные стимулы, а в некоторых ситуациях – получить шанс выжить.
Регуляция активности ферментов
В клетке имеется несколько способов регуляции активности ферментов – одни способы подходят для любых ферментов, другие более специфичны.
 Роль оксалоацетата для работы ЦТК |
Доступность субстрата или кофермента
Здесь работает закон действия масс– фундаментальный закон химической кинетики: при постоянной температуре скорость химической реакции пропорциональна произведению концентрации реагирующих веществ. Или упрощенно – скорость, с которой вещества реагируют друг с другом, зависит от их концентрации. Таким образом, изменение количества хотя бы одного из субстратов прекращает или начинает реакцию.
Например, для цикла трикарбоновых кислот (ЦТК) таким субстратом является оксалоацетат(щавелевоуксусная кислота). Наличие оксалоацетата "подталкивает" реакции цикла, что позволяет вовлекать в окисление молекулы ацетил-SКоА.
Именно из-за недостатка оксалоацетата (относительного или абсолютного) развивается кетоацидоз (механизм развития) при голодании и инсулинзависимом сахарном диабете.
Компартментализация
Компартментализация – это сосредоточение ферментов и их субстратов в одном компартменте (одной органелле) – в эндоплазматическом ретикулуме, митохондриях, лизосомах.
Например, ферменты цикла трикарбоновых кислот (ЦТК) и β-окисления жирных кислот расположены в митохондриях, ферменты синтеза белка – в рибосомах.
Изменение количества фермента
Изменение количества фермента может происходить в результате увеличения или снижения его синтеза. Изменение скорости синтеза фермента обычно зависит от количества определенных гормонов или субстратов реакции, например:
· исчезновение пищеварительных ферментов при длительном голодании и их появление в восстановительный период (в результате изменения секреции кишечных гормонов),
· при беременности и после родов в молочной железе активно идет синтез фермента лактозосинтазыпод воздействием лактотропного гормона,
· гормоны глюкокортикоиды стимулируют синтез ферментов глюконеогенеза, что обеспечивает стабильность концентрации глюкозы в крови и устойчивость ЦНС к стрессу,
· токсические субстраты этанол, барбитураты стимулируют в печени синтез "своего" изоферментацитохрома Р450, который окисляет и обезвреживает эти вещества.
Ограниченный (частичный) протеолиз проферментов
Ограниченный (частичный) протеолиз проферментов подразумевает, что синтез некоторых ферментов осуществляется в виде более крупного предшественникаи при поступлении в нужное место этот фермент активируется через отщепление от него одного или нескольких пептидных фрагментов. Подобный механизм защищает внутриклеточные структуры от повреждений.

Схема активации фермента способом
"ограниченного протеолиза"
Примером служит активация протеолитических ферментов желудочно-кишечного тракта (трипсиноген,пепсиноген, прокарбоксипептидазы), факторов свертывания крови, лизосомальных ферментов (катепсины).
Аллостерическая регуляция
Аллостерические ферменты построены из двух и более субъединиц: одни субъединицы содержат каталитический центр, другие имеют аллостерический центр и являются регуляторными. Присоединение эффектора к аллостерической (регуляторной) субъединице изменяет конформацию белка и, соответственно, активность каталитической субъединицы.
Аллостерические ферменты обычно стоят в начале метаболических путей, и от их активности зависит течение многих последующих реакций. Поэтому они часто называются ключевыми ферментами.
Читайте также:

