Свойства и применение изотопов водорода 11 класс кратко
Обновлено: 11.05.2024
Водород образует три изотопа с массовыми числами 1, 2, 3:
Впервые дейтерий был получен в виде тяжелой воды D2O путем электролиза природной воды.
Тяжелая вода D2O – вода, образованная атомами дейтерия. По своим физико-химическим свойствам отличается от Н2О:
| Н2О | D2O |
| °С | 3,83 |
| °С | 101,42 |
| 1 (при 20 ºС) | 1,1053 (при 20 ºС) |
В настоящее время дейтерий получают из природной смеси путем изотопного обмена между водой и сероводородом: . Для получения 1 л тяжелой воды требуется 41 т воды и 135 т сероводорода.
Химические реакции в тяжелой воде протекают медленнее, по сравнению с обычной водой, водородные связи с участием дейтерия несколько сильнее обычных. Тяжёлая вода токсична. Тяжелая вода оказывает губительное действие на животных и человека. Например, замена 1/3 Н2О на D2O приводит к бесплодию, нарушению углеводного баланса и анемии.
Однако некоторые микроорганизмы способны жить в 70%-ной тяжёлой воде (простейшие) и даже в чистой тяжёлой воде (бактерии). Человек может без видимого вреда для здоровья выпить стакан тяжёлой воды, весь дейтерий будет выведен из организма через несколько дней. В этом отношении тяжёлая вода менее токсична, чем, например, поваренная соль.
Тяжелая вода является промышленным продуктом и доступна в больших количествах. Производство тяжёлой воды очень энергоёмко, поэтому её стоимость довольно высока (ориентировочно 200 – 250 долларов за кг).
Ядра дейтерия имеют спин ядра равный 1, с этим связано использование тяжелой воды и других дейтерированных растворителей (дейтерохлороформ CDCl3) в спектроскопии ядерного магнитного резонанса. Тяжелая вода находит применение в ядерной технике в качестве замедлителя быстрых нейтронов, поскольку она быстро понижет энергию нейтронов ядерного деления, а также вследствие того, что дейтерий имеет низкое сечение захвата нейтронов (не поглощает нейтроны), чем водород, и, следовательно, заметно уменьшает нейтронный поток.
Дейтерий широко применяют при изучении механизмов реакции и при кинетических исследованиях.
От других изотопов тритий отличается тем, что он радиоактивен. В природе тритий встречается в очень малых количествах. Естественное содержание трития – 1 атом на 10 18 атомов водорода, это результат ядерных реакций, протекающих вод действием космических лучей в верхних слоях атмосферы:
После испытаний термоядерного оружия (1954 г.) концентрация трития увеличилась в сотни раз, но в настоящее время она упала в результате запрета на испытания ядерного оружия в атмосфере. Низкое содержание трития в земной коре объясняется и его радиоактивностью с периодом полураспада 12,35 года . В последние годы основным источником техногенного трития в окружающей среде стали атомные электростанции, которые ежегодно выделяют несколько десятков килограммов трития.
В настоящее время тритий получают в ядерных реакторах при облучении лития нейтронами: .
Литий используют в виде сплава с магнием или алюминием, который удерживает в себе много трития, который освобождается при растворении облученного сплава в кислоте.
Прим. Наиболее удобный способ хранения трития состоит в превращении его в UT3 по реакции с мелко раздробленным ураном. Из данного соединения тритий легко освобождается при нагревании выше 400 ºС.
Тяжелая вода на основе трития T2O обладает сильной радиоактивностью. Поэтому обычно используют разбавленные растворы, содержащие 1% тритиевой воды. Тритий является чистым β-излучателем без примеси γ-компоненты, поэтому он относительно безопасен, так как β-частицы обладают низкой проникающей способностью, поэтому задерживаются листом бумаги или слоем воздуха в 3 мм. Тритий – один из наименее токсичных радиоизотопов.
Тритий может служить радиоактивной меткой для изучения различных природных процессов. Анализ атмосферного трития дает ценную информацию о космических лучах. А тритий в осадочных породах может свидетельствовать о перемещениях воздуха и влаги на Земле.

Наиболее богатые природные источники трития – дождь и снег, поскольку почти весь тритий, образующийся под действием космических лучей в атмосфере, переходит в воду. Интенсивность космической радиации изменяется с широтой, поэтому осадки, например, в средней полосе России несут в несколько раз больше трития, чем тропические ливни. И совсем мало трития в дождях, которые идут над океаном, поскольку их источник – в основном та же океаническая вода, а ней трития немного.
Понятно, что глубинный лед Гренландии или Антарктиды совсем не содержит трития – он там давно успел полностью распасться. Зная скорость образования трития в атмосфере, можно рассчитать, как долго влага находится в воздухе – с момента ее испарения с поверхности до выпадения в виде дождя или снега. Оказалось, что, например, в воздухе над океаном этот срок составляет в среднем 9 дней.
Чаще всего тритий применяют как метку при изучении механизмов реакций и их кинетики.
Синтезированный тритий сравнительно дешев и находит применение в научных исследованиях и в промышленности. Широкое применение нашли тритиевые светящиеся краски, которые наносят на шкалы приборов. Эти светосоставы с точки зрения радиации менее опасны, чем традиционные радиевые. Такие светосоставы постоянного действия используют для изготовления указателей, шкал приборов и т.п. На их производство ежегодно расходуют сотни граммов трития.
Тритий присутствует и в человеческом организме. Он поступает в него с пищей, с вдыхаемым воздухом и через кожу. Интересно, что газообразный Т2 в 500 раз менее токсичен, чем тритиевая вода Т2О. Это объясняется тем, что молекулярный тритий, попадая с воздухом в легкие, затем быстро (примерно за 3 мин) выделяется из организма, тогда как тритий в составе воды задерживается в нем на 10 суток и успевает за это время передать ему значительную дозу радиации.
Тритий имеет важное значение в реакциях термоядерного синтеза: , протекающих при взрыве водородной бомбы.
Водород образует три изотопа с массовыми числами 1, 2, 3:
Впервые дейтерий был получен в виде тяжелой воды D2O путем электролиза природной воды.
Тяжелая вода D2O – вода, образованная атомами дейтерия. По своим физико-химическим свойствам отличается от Н2О:
| Н2О | D2O |
| °С | 3,83 |
| °С | 101,42 |
| 1 (при 20 ºС) | 1,1053 (при 20 ºС) |
В настоящее время дейтерий получают из природной смеси путем изотопного обмена между водой и сероводородом: . Для получения 1 л тяжелой воды требуется 41 т воды и 135 т сероводорода.
Химические реакции в тяжелой воде протекают медленнее, по сравнению с обычной водой, водородные связи с участием дейтерия несколько сильнее обычных. Тяжёлая вода токсична. Тяжелая вода оказывает губительное действие на животных и человека. Например, замена 1/3 Н2О на D2O приводит к бесплодию, нарушению углеводного баланса и анемии.
Однако некоторые микроорганизмы способны жить в 70%-ной тяжёлой воде (простейшие) и даже в чистой тяжёлой воде (бактерии). Человек может без видимого вреда для здоровья выпить стакан тяжёлой воды, весь дейтерий будет выведен из организма через несколько дней. В этом отношении тяжёлая вода менее токсична, чем, например, поваренная соль.
Тяжелая вода является промышленным продуктом и доступна в больших количествах. Производство тяжёлой воды очень энергоёмко, поэтому её стоимость довольно высока (ориентировочно 200 – 250 долларов за кг).
Ядра дейтерия имеют спин ядра равный 1, с этим связано использование тяжелой воды и других дейтерированных растворителей (дейтерохлороформ CDCl3) в спектроскопии ядерного магнитного резонанса. Тяжелая вода находит применение в ядерной технике в качестве замедлителя быстрых нейтронов, поскольку она быстро понижет энергию нейтронов ядерного деления, а также вследствие того, что дейтерий имеет низкое сечение захвата нейтронов (не поглощает нейтроны), чем водород, и, следовательно, заметно уменьшает нейтронный поток.
Дейтерий широко применяют при изучении механизмов реакции и при кинетических исследованиях.
От других изотопов тритий отличается тем, что он радиоактивен. В природе тритий встречается в очень малых количествах. Естественное содержание трития – 1 атом на 10 18 атомов водорода, это результат ядерных реакций, протекающих вод действием космических лучей в верхних слоях атмосферы:
После испытаний термоядерного оружия (1954 г.) концентрация трития увеличилась в сотни раз, но в настоящее время она упала в результате запрета на испытания ядерного оружия в атмосфере. Низкое содержание трития в земной коре объясняется и его радиоактивностью с периодом полураспада 12,35 года . В последние годы основным источником техногенного трития в окружающей среде стали атомные электростанции, которые ежегодно выделяют несколько десятков килограммов трития.
В настоящее время тритий получают в ядерных реакторах при облучении лития нейтронами: .
Литий используют в виде сплава с магнием или алюминием, который удерживает в себе много трития, который освобождается при растворении облученного сплава в кислоте.
Прим. Наиболее удобный способ хранения трития состоит в превращении его в UT3 по реакции с мелко раздробленным ураном. Из данного соединения тритий легко освобождается при нагревании выше 400 ºС.
Тяжелая вода на основе трития T2O обладает сильной радиоактивностью. Поэтому обычно используют разбавленные растворы, содержащие 1% тритиевой воды. Тритий является чистым β-излучателем без примеси γ-компоненты, поэтому он относительно безопасен, так как β-частицы обладают низкой проникающей способностью, поэтому задерживаются листом бумаги или слоем воздуха в 3 мм. Тритий – один из наименее токсичных радиоизотопов.
Тритий может служить радиоактивной меткой для изучения различных природных процессов. Анализ атмосферного трития дает ценную информацию о космических лучах. А тритий в осадочных породах может свидетельствовать о перемещениях воздуха и влаги на Земле.
Наиболее богатые природные источники трития – дождь и снег, поскольку почти весь тритий, образующийся под действием космических лучей в атмосфере, переходит в воду. Интенсивность космической радиации изменяется с широтой, поэтому осадки, например, в средней полосе России несут в несколько раз больше трития, чем тропические ливни. И совсем мало трития в дождях, которые идут над океаном, поскольку их источник – в основном та же океаническая вода, а ней трития немного.
Понятно, что глубинный лед Гренландии или Антарктиды совсем не содержит трития – он там давно успел полностью распасться. Зная скорость образования трития в атмосфере, можно рассчитать, как долго влага находится в воздухе – с момента ее испарения с поверхности до выпадения в виде дождя или снега. Оказалось, что, например, в воздухе над океаном этот срок составляет в среднем 9 дней.
Чаще всего тритий применяют как метку при изучении механизмов реакций и их кинетики.
Синтезированный тритий сравнительно дешев и находит применение в научных исследованиях и в промышленности. Широкое применение нашли тритиевые светящиеся краски, которые наносят на шкалы приборов. Эти светосоставы с точки зрения радиации менее опасны, чем традиционные радиевые. Такие светосоставы постоянного действия используют для изготовления указателей, шкал приборов и т.п. На их производство ежегодно расходуют сотни граммов трития.
Тритий присутствует и в человеческом организме. Он поступает в него с пищей, с вдыхаемым воздухом и через кожу. Интересно, что газообразный Т2 в 500 раз менее токсичен, чем тритиевая вода Т2О. Это объясняется тем, что молекулярный тритий, попадая с воздухом в легкие, затем быстро (примерно за 3 мин) выделяется из организма, тогда как тритий в составе воды задерживается в нем на 10 суток и успевает за это время передать ему значительную дозу радиации.
Тритий имеет важное значение в реакциях термоядерного синтеза: , протекающих при взрыве водородной бомбы.
Известно несколько изотопов водорода: дейтерий ( 2 H) с одним протоном и одним нейтроном в ядре, тритий ( 3 H) с одним протоном и двумя нейтронами в ядре и очень неустойчивые тяжелые изотопы 4 H, 5 H, 6 H и 7 H. Ядра протия и дейтерия стабильны, а ядра трития подвергаются бета-распаду:
Предполагают, что эта реакция является главным источником изотопа гелия-3 в атмосфере.
Время жизни атомов остальных изотопов составляет ничтожные доли секунды.

Таблица изотопов водорода:
| Символ | Название | Массовая доля в природной смеси в % | Тпл. (°C) | Ткип. (°C) | Период полураспада | Тип и энергия распада |
| 1 H | Протий | 99,9849 | -259,2 | -252,6 | – | – |
| 2 D ( 2 H) | Дейтерий | 0,0139 | -254,5 | -249,5 | – | – |
| 3 T ( 3 H) | Тритий | 0,0012 | -252,2 | -248,1 | 12,33 года | ß – , 18,591 кэВ |
| 4 H | – | – | – | – | 1,39·10 -22 с | -n, 23,48 МэВ |
| 5 H | – | – | – | – | 9,1·10 -22 с | -nn, 21,51 МэВ |
| 6 H | – | – | – | – | 2,90·10 -22 с | -3n, 24,27 МэВ |
| 7 H | – | – | – | – | 2,3·10 -23 с | -nn, 23,03 МэВ |
Содержание изотопов водорода в природе:
Массовая доля (в %) в природной смеси:
1 H – 99,9849 2 H – 0,0139 3 H – 0,0012
Количественные соотношения между изотопами водорода H : D : T могут быть представлены как 1 : 1,46·10 -5 : 4,0·10 -15
Нормальный изотопный состав природных соединений водорода соответствует отношению D : H=1 : 6800
Содержание трития в атмосферном водороде составляет 4·10 -15 % (мольные доли) и в атмосферных осадках ~3·10-18 % (мольные доли). Очевидно, он образуется в результате ядерных реакций, вызванных действием космических лучей.
Получение изотопов водорода
Дейтерий.
Впервые был получен в значительных количествах в виде тяжелой воды D2O путем электролиза природной воды. При электролизе воды разряд H + происходит значительно быстрее, чем D + , поэтому в остатке после разложения электролизом большого количества воды накапливается D2O. Этот использовался большую часть XX века.
В настоящее время дейтерий получают ректификацией жидкого водорода и пот так называемому двухтемпературному сероводородному методу, в основе которого лежит реакция изотопного обмена:
Константа равновесия которой при 30 и 120 °C равна соответственно 2,31 и 1,86.
Тритий синтезируют, действуя на 6 Li3 нейтронами, получаемыми в ядерном реакторе:
Для водорода, как ни для какого другого элемента, относительное различие изотопных масс достигает значительной величины. Поэтому, несмотря на одинаковую электронную структуру, все изотопы заметно различаются не только физическими, но и химическими свойствами. Вследствие резкого преобладания протия влияние тяжелых изотопов сказывается незначительно и может быть зафиксировано лишь в очень точных экспериментах. Поэтому можно считать, что свойства природного водорода соответствуют свойствам чистого протия.
Небольшие различия свойств, называемые изотопным эффектом, обусловлены различием масс изотопных атомов, которое в первую очередь сказывается на частоте колебаний атомов в молекулах и твердых телах. Так, колебательная энергия молекул T2 и D2 меньше, чем H2. А это, в свою очередь, сказывается на термодинамических свойствах: теплоемкости, температуре плавления и кипения, энтальпии плавления и испарения, давлении насыщенного пара и т.д. Так, D2 по сравнению с обычным водородом обладает меньшей теплоемкостью, теплопроводностью и скоростью диффузии. Таким образом, для изотопных соединений характерна термодинамическая неравноценность, а, следовательно, неравноценность активных комплексов при химических реакциях, в результате чего имеет место различие в скоростях протекания реакций, т.е. наблюдается кинетический изотопный эффект. Он выражается отношением констант скоростей химических реакций для различных изотопных соединений. Например, отношение констант скоростей синтеза HBr и DBr равно 5. Такие значительные отличия физических и химических свойств изотопов одного и того же элемента уникальны и не имеют аналогов в периодической системе. Все это в какой-то мере оправдывает применение для каждого изотопа водорода собственного названия (особенно для протия и дейтерия).
| Eдис(H2) = 436 кДж/моль | dH-H = 0,07414 нм |
| Eдис(D2) = 439,56 кДж/моль | dD-D = 0,07417 нм |
| t°пл(D2O) = 3,82 °C | t°кип(D2O) = 101,42 °C | ρ = 1,1050 г/см 3 (20 °C) |
Заметно с H2O различаются также энтальпия растворения солей, константы диссоциации кислот и другие характеристики растворов. Реакции в D2O идут медленнее, поэтому она является биологическим ядом.
В постиндустриальную эпоху развития человечества все больше стало отдавать предпочтение новым технология получения энергии. Изотопы являются субстратом в энергетическом производстве (топливный компонент ядерного реактора). Также данные видоизменные химические атомы используются и других областях человеческой деятельности: медицина, патологическая физиология, отрасль изготовление ядерного оружия.
- Что такое изотоп?
- Обозначения изотопов
- Изотопы водорода
- Изотопы урана
- Нуклиды
- Изотопы галлия
- Превращения изотопов
- Применение радиоактивных изотопов
Что такое изотоп?
Изотопами называют видоизменные элементы периодической таблицы Менделеева, которые имеют один и тот же порядковый номер, но различную атомную массу. Название характеризует нахождение подобных структур в одной клеточке периодической таблицы с нормальными элементами (изо – равное, топ – положение, место – в переводе с английского). Состав изотопов представляет собой совокупность протонов, электронов и нейтронов (количество нейтронов обычно больше, чем в обычных элементах периодической таблицы).
Обозначения изотопов
Видоизмененные элементы периодической таблицы Менделеева обозначаются следующим образом: к символу химического элемента, к которому принадлежит изотоп, подписывается верхний левый индекс с обозначением массового числа. Так, например, изотоп кислорода, обладающий массовым числом равным восемнадцати атомных единиц, будет обозначаться следующим образом: 18 O. Имеется также другое обозначение подобных атомов (например, кислород – 18).
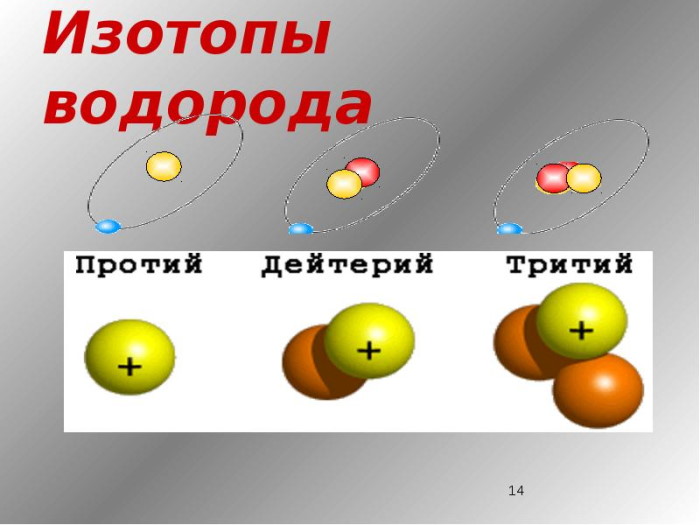
Изотопы водорода
Выделяют три видоизменённых атома водорода, обладающих разными массовыми числами:
протий (Н) – одна атомная единица массы;
дейтерий (D) – две атомные единицы массы;
тритий (Т) – три атомные единицы массы.
В природе чаще всего встречается протий (в 99,98 процентах случаев), именно поэтому среднее массовое число водорода будет равняться приблизительно 1 а.е.м. Стоит, отметить, что бета-распад трития составляет порядка 12 лет, после чего он переходит в форму Гелий - 3.
Отдельно необходимо выделить, видоизменённые атомы водорода, массовое число которого может колебаться в районе 4 – 7 а.е.м.
Изотопы урана
Изотопный ряд урана включает в себя изотопы, имеющие массу от 219 а.е.м. до 243 а.е.м. Элементы, обладающие наибольшей изотопной распространенностью – это уран – 235 и уран – 238.
Изотопные атомные урана с массовыми числами 235 и 238 представляют собой основной компонент для производства плутония – 239 (основного компонента ядерного оружия и ядерного топлива для реакторов нового поколения).
Нуклиды
Нуклиды подразделяются на две больших категории:
Химический элемент периодической таблицы ртуть (гидраргирум) обладает наибольшей изотопной распространенностью стабильных нуклидов. Так, стабильные нуклиды ртути – это вещества изотопного ряда гидраргиума, обладающие атомной массой от 170 а.е.м. до 219 а.е.м.
Термин нуклид (в понятии радионуклид) был предложен в двадцатом веке американцем Трумэном Команом. Радионуклиды отличаются длительным периодом полураспада, который в большинстве случаев имеет значение порядка 5*10 8 лет. Таким образом, радионуклиды населяют Землю с момента ее зарождения как планеты. В зависимости от массового числа нуклиды могут подвергать различным видам превращения, обозначим некоторые из них:
альфа-распад (для большинства радионуклидов подобный вид распада не наблюдается и из-за большого периода полураспада);
нейтронный и двухнейтронный распады.
Изотопы галлия
Изотопный ряд галлия представлен элементами, обладающими промежутком массовых числен от 49 а.е.м. до 71 а.е.м. Наиболее часто в природе встречаются следующие изотопные атомы: галлий – 69, галлий -71. Природный галлий обычно представлен смесью двух данных видоизмененных атомов, имеющих малый период полураспада (порядка 68 минут). Для представителей изотопного ряда галлия характерные следующие виды ядерных превращений:
электронный захват (наблюдается в 13% случаев);
позитронный распад (наблюдается в 87% случаев).
Превращения изотопов
Превращения изотопов могут протекать двумя способами:
при участии технологий, созданных человеком (используется в промышленности);
самопроизвольно (протекает в природе).
Выделяют следующие виды ядерных превращений, связанных со изменением атомной массы химических элементов: распад (альфа, бета, двойной бета, нейтронный, позитронный), электронный захват (происходит присоединение электрона, вследствие чего изменяется заряд и состав нуклида).
Применение радиоактивных изотопов
Изотопы химических элементов представляют собой элементы периодической таблицы Менделеева, обладающие нестабильными ядрами и свойством подвергаться различного ядерному распаду. В научной терминологии подобные атомы называют также радионуклидами. Радиоактивные изотопы применяются в различных сферах человеческой деятельности.
В сельском хозяйстве использования радиоизотопов необходимо для изучения особенностей роста, развития и функционирования корневых систем растений (такой способ изучения получил название – метод меченных атомов).
В авиастроительстве радионуклиды применяют для испытания авиационных конструкций на предмет износостойкости.
В сфере градостроительстве радиоактивные изотопы нашли свое применение как универсальные измерители плотности почвы.
В области коммунального хозяйства видоизмененные химические элементы, обладающие радиоактивной способностью, применяют в целях стерилизации постельного белья.
В текстильной промышленности радионуклиды используются для удаления электрических зарядов с поверхности одежды.
В машиностроительной отрасли радионуклиды используются для определения толщины металлического покрытия.
Особое место в этом списке занимает использование радиоактивных изотопов в химической промышленности и в сфере медицинских услуг. Так, получение различных полимерных соединений, которые составляют основу большинства современных предметов обихода, письменных принадлежностей, резиновых изделий того или иногда вида использования происходит при помощи взаимодействия y-излучения с различными химическими соединениями органической природы. В медицине радиоизотопы применяются в лечебных целях в рамках радиационной терапии (процедура, при которой под воздействием радионуклидов происходит разрушение любого типа живой ткани). Радиотерапия нашла свое применения в области лечения онкологических заболеваний (на данный момент, по эффективности радиотерапия уступает только химиотерапии, но зачастую данные способы лечения составляют две стадии одного процесса).
В заключении, стоит отметить, что научный прогресс в области получения новых видов изотопов тех или иных химических элементов не стоит на месте, поэтому возможно в будущем при помощи грамотного и целесообразного использования видоизмененных атомов можно будет лечить неизлечимые на данный момент заболеваний и строить космические корабли для покорения других планет и галактик.
Протий, наиболее распространенный изотоп водорода, состоящий из протона и электрона. Уникальный случай, это единственный стабильный изотоп без нейтрона.
Водорода с символом Н и массы атомов стандарта 1.00782504 (7) U , имеет три изотопа естественно, обозначается 1 Н, 2 Н и 3 H. Другие (из 4 H 7 H), особенно нестабильным, были синтезированы в лаборатории , но никогда наблюдается в природе.
Резюме
Мюоний
Мюоний Mu состоит из электрона и антимюона . Мюоний имеет химические свойства , которые приближаются к атому водорода и может рассматриваться в качестве самого легкого изотопа водорода, обозначаемого 0,11 H .
Водород 1 (протий)

Водород 2 (дейтерий)

Водород 3 (тритий)

3 H- известный под названием тритий имеет ядро, состоящее из протона и двух нейтронов. Это радиоактивный элементкоторый распадается на гелий 3 путем бета - распада - с периодом полураспада в 12,32 лет. Небольшие количества трития естественным образом присутствуют из-за взаимодействия космических лучей с атмосферными газами. Тритий также был выделен во время испытаний ядерного оружия . Тритий используется в термоядерном оружии , как индикатор в изотопной геологии и в некоторых осветительных устройствах с автономным питанием .
Наиболее распространенный метод производства трития - бомбардировка встречающегося в природе изотопа лития , лития 6 , нейтронами в ядерном реакторе .
Когда-то тритий широко использовался в качестве маркера в химии и биологии (но его использование стало менее распространенным). Ядерного синтеза DT тритий используется в качестве основного реагента с дейтерием , высвобождая энергию за счет потери массы , когда два ядра сливаются до очень высоких температур.
Водород 4 (квадриум)
4 H, иногда называемый квадрием, имеет ядро, состоящее из одного протона и трех нейтронов. Это очень нестабильный изотоп водорода, который был синтезирован в лаборатории путем бомбардировки трития быстрыми ядрами дейтерия . В этом эксперименте ядро трития захватывает нейтрон из быстрого ядра дейтерия. Присутствие водорода 4 было установлено путем регистрации испускания протонов. Его атомная масса 4,02781 ± 0,00011. Он распадается из-за испускания нейтронов с периодом полураспада (1,39 ± 0,10) × 10 -22 секунды.
Водород 4.1 (мюонный гелий)
Мюонный гелий ( 4,1 Н ) было создано путем замены электрона в гелии 4 для мюонов , с мюона на орбите ближе к ядру , чем электрон. Таким образом, мюонный гелий можно рассматривать как изотоп водорода, ядро которого состоит из двух нейтронов, двух протонов и мюона, с одним электроном, вращающимся вокруг ядра. Водород 4.1 может связываться с другими атомами и поэтому действует больше как атом водорода, чем как инертный атом гелия.
Водород 5
5 H - крайне нестабильный изотоп водорода. Его ядро состоит из одного протона и четырех нейтронов. Он был синтезирован в лаборатории путем бомбардировки трития быстрыми ядрами трития. В этом эксперименте ядро трития захватывает два нейтрона от другого ядра и, следовательно, становится ядром с четырьмя нейтронами. Оставшийся протон может быть обнаружен, что доказывает с помощью дедукции существование водорода 5. Он распадается в результате двойного испускания нейтронов, и его период полураспада составляет не менее 9,1 × 10 -22 секунды.
Водород 6
6 H - крайне нестабильный изотоп водорода. Его ядро состоит из одного протона и пяти нейтронов. Он распадается от тройного испускания нейтронов, а его период полураспада составляет 2,90 × 10 −22 секунды.
Водород 7
7 H - известный изотоп с самым высоким соотношением числа нейтронов и протонов ( N / Z = 6). Это также нуклид с наименьшим известным периодом полураспада (2,3 ± 0,6) × 10 -27 с . Он распадается на тритий 3 H и четыре нейтрона.
Впервые он был синтезирован в 2003 году группой российских, японских и французских ученых из RIKEN путем бомбардировки водорода 8 атомами гелия . По этой реакции шесть нейтронов гелия 8 передаются ядру водорода. Это два оставшихся протона, которые были обнаружены телескопом RIKEN, устройством, состоящим из нескольких слоев датчиков, расположенных между целью и радиусом RI циклотрона.
Реальность существования водорода 7, хотя и весьма мимолетного, была подтверждена в 2007 году наблюдением ядерного резонанса. Этот эксперимент был проведен в GANIL , Франция, путем бомбардировки мишени из углерода 12 через углерод 13 , в результате чего был получен пучок атомов гелия 8 , некоторые из которых прореагировали с углеродом 12 окружающего газа ( бутан C 4 H 10 ) по реакции 8
2 Он + 12
6 C → 7
1 H + 13
7 НЕТ.
Читайте также:

