Сурфактант у новорожденных кратко
Обновлено: 02.07.2024
Респираторный дистресс-синдром – это одна из основных причин смертности недоношенных новорожденных. Для лечения респираторного дистресс-синдрома применяют препараты сурфактанта в сочетании с респираторной поддержкой. Нативные препараты сурфактанта получают из ткани легких свиней (порактантальфа) или телят (берактант, сурфактант БЛ) или лаважной жидкости телят (бовактант). По данным мета-анализа рандомизированных контролируемых исследований берактант и бовактант не отличались по эффективности в лечении респираторного дистресс-синдрома у новорожденных, в то время как порактант альфа имел достоверные преимущества перед берактантом. В российском ретроспективном исследования была показана более высокая эффективность порактанта альфа по сравнению с сурфактантом БЛ. Возможность введения порактанта альфа в высокой дозе и в небольшом объеме делает его препаратом выбора при использовании стратегии LISA, когда сурфактант вводится с помощью катетера на фоне СРАР. Стратегии малоинвазивного применения препаратов сурфактантов (INSURE, LISA) позволяют уменьшить нежелательные эффекты механической вентиляции легких на новорожденных.
Детскую смертность (в возрасте до 5 лет) считают одним из ключевых демографических показателей общего состояния здоровья и уровня жизни населения страны или региона, а ее снижение относят к числу приоритетных задач здравоохранения. На долю новорожденных (в первые 28 дней жизни), особенно родившихся недоношенными, приходится 40% всех случаев смерти детей в возрасте до 5 лет. В 2010 г. недоношенными (т.е. до 37 недель гестации) в мире родились около 15 млн детей, из которых умерли более 1 млн [1]. Важную роль в структуре причин смерти недоношенных детей играет респираторный дистресссиндром новорожденных (РДСН). Если во время беременности не проводится профилактика глюкокортикостероидными гормонами, частота РДСН у новорожденных детей, родившихся на сроке гестации
Препараты сурфактанта
Выделяют синтетические и природные (нативные) сурфактанты. Синтетические сурфактанты, в частности колфосерил (Экзосурф), получают из фосфолипидов, которые также могут быть синтетическими или имеют природное происхождение. По эффективности синтетические препараты уступают природным [12], поэтому в настоящее время колфосерил не применяется. Природные препараты сурфактанта получают из лаважной жидкости или ткани легких свиней или телят или амниотической жидкости рожениц. В отличие от синтетических препаратов, они содержат различные фосфолипиды, а также сурфактантные белки, в частности SP-B и SP-C, которые частично опосредуют биофизические свойства сурфактанта. Природные препараты сурфактанта разделяют на модифицированные и немодицированные. Берактант (Сюрванта) выделяют из ткани легкого телят, бовактант (Альвеофакт) – из лаважной жидкости телят, а порактант альфа (Куросурф) – из легкого свиньи. Последний, в отличие от других природных сурфактантов, содержит только фосфолипиды и сурфактантные белки (SP-B и SP-C), так как в процессе модификации нейтральные липиды и холестерин удаляют при хроматографии. Благодаря этому порактант альфа характеризуется самой высокой концентрацией кислых фосфолипидов среди нативных препаратов сурфактанта. Это позволяет вводить порактант альфа в более эффективной высокой дозе (200 мг/кг) и в меньшем объеме, чем другие сурфактанты, что может привести к снижению риска блокады эндотрахеальной трубки и других нежелательных явлений. Кроме того, порактант альфа лучше всего подходит для неинвазивного применения, учитывая возможность введения большой дозы в малом объеме. Препарат оказывает быстрое действие и уменьшает фракцию вдыхаемого кислорода (FiO2) у новорожденных с РДСН в течение 5 минут. При этом он характеризуется более длительным интервалом дозирования по сравнению с берактантом (12 и 6 ч, соответственно), что нередко дает возможность ограничиться однократным введением дозы 200 мг/кг. В рандомизированном многоцентровом исследовании у 293 новорожденных с РДСН введение одной дозы сурфактанта оказалось достаточным, соответственно, у 73% и 50% детей, получавших порактант альфа и берактант (p
Сравнительный анализ эффективности различных препаратов сурфактанта
Сравнение препаратов сурфактанта, выделенных из лаважной жидкости (калфактант или бовактант) или ткани легких (берактант или сурфактант ТА) телят. Эффективность различных препаратов бычьего сурфактанта сравнивали в 9 исследованиях (профилактика – 2, лечение – 7). Достоверной разницы частоты неблагоприятных исходов между группами сравнения выявлено не было, в частности риск смерти или развития хро нического поражения легких не отличался при при менении различных бычьих сурфактантов как с профилактической (относительный риск [ОР] 1,02; 95% доверительный интервал [ДИ] 0,89-1,17; n=1123), так и с лечебной целью (ОР 0,95; 95% ДИ 0,86-1,07; n=2009). Риск отдельных первичных и вторичных конечных точек также был сопоставимым при назначении препаратов сурфактанта, выделенных из лаважной жидкости или ткани легких телят.
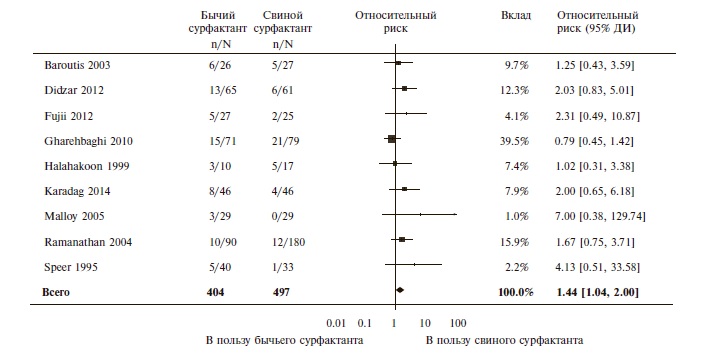
Рис. 1. Относительный риск смерти передвыпиской при применении сурфактантов, полученных из легких телят и свиней
Таким образом, результаты мета-анализа показали, что препараты сурфактанта, выделенные из лаважной жидкости или ткани легких телят, достоверно не отличались по эффективности в лечении или профилактике РДСН у недоношенных новорожденных. В то же время лечебное введение порактанта альфа по сравнению с берактантом привело к достоверному снижению риска ряда неблагоприятных исходов, включая госпитальную смерть, смерть или потребность в кислороде в постменструальном возрасте 36 недель или открытый артериальный проток, потребовавший лечения. При применении порактанта альфа достоверно реже требовалось повторное введение сурфактанта. Преимущества порактанта альфа перед берактантом могли быть следствием различий биофизических или биохимических свойств сурфактантов или введения первого препарата в более высокой дозе. Подтвер ждением второй гипотезы был тот факт, что разница частоты неблагоприятных исходов между группами сравнения была выявлена только у детей, которым порактант альфа вводили в более высокой стартовой дозе (более 100 мг/кг). Кроме того, ранее было установлено, что порактант альфа в дозе 200 мг/кг дает более выраженный эффект, чем в дозе 100 мг/кг. Однако результаты мета-анализа не позволили исключить или подтвердить преимущества более низкой стартовой дозы порактанта альфа, так как выборка таких пациентов была небольшой. Следует отметить, что только порактант альфа может вводиться в дозе 200 мг/кг, в то время как однократные дозы других препаратов сурфактанта не превышают 100 мг/кг. Результаты настоящего систематизированного обзора согласуются с данными других авторов. Например, при мета-анализе 5 исследований, в которых сравнивали препараты сурфактанта разного происхождения у детей с РДСН, также было выявлено достоверное снижение госпитальной летальности при введении порактанта альфа в высокой дозе по сравнению с таковой при применении берактанта [15].
Российский опыт сравнения препаратов сурфактанта
В Российской Федерации среди природных препаратов сурфактанта разрешены для клинического применения порактант альфа (Куросурф; Кьези Фармацевтичи, Италия), бовактант (Альвеофакт; Лиомарк, Германия), берактант (Сюрванта; Эббви, США) и сурфактант БЛ (ООО Биосурф, Россия). Рекомендуемая стартовая доза порактанта альфа составляет 100-200 мг/кг, при этом доза 200 мг/кг по эффективности превосходит дозу 100 мг/кг. При необходимости препарат можно ввести повторно в дозе не менее 100 мг/кг. Рекомендуемая стандартная доза бовактанта – 50 мг/кг. При этом лечебная доза бовактанта 100 мг/кг превосходит по эффективности дозу 50 мг/кг. Рекомендуемая стартовая доза берактанта составляет 100 мг/кг, сурфактанта БЛ – 50-75 мг/кг. В дозе 200 мг/кг бовактант, берактант и сурфактант БЛ не изучались, а использование их в такой дозировке у недоношенных новорожденных проблематично из-за большого объема раствора.
В Российской Федерации рандомизированные контролируемые исследования различных препаратов сурфактанта не проводились. Крупные клинические исследования, посвященные изучению эффективности препарата Сурфактант БЛ, отсутствуют. В связи с этим эффективность препарата при лечении детей с РДСН остается на сегодняшний день малоизученной и сомнительной [2]. Опубликованы результаты ретроспективного анализа опыта применения порактанта альфа и сурфактанта БЛ для лечения РДСН у недоношенных детей [16]. Критериями включения в исследование были тяжелая степень РДСН (механическая вентиляция с фракцией ингаляционного кислорода FiO2≥0,6), масса тела новорожденного от 700 до 2000 г, срок гестации до 32 недель, постнатальный возраст 2-15 ч. Из исследования исключали детей со значительными врожденными аномалиями развития.
В исследование были включены 45 детей, которых распределили на три группы. Дети первой группы (n=18) получали терапию порактантом альфа, который вводили однократно болюсно в дозе около 100 мг/кг, отсоединяя пациента от контура аппарата. Возраст новорожденных на момент введения составлял 9,8±7,1 ч. Вторую группу составили новорожденные (n=13), получавшие отечественный сурфактант БЛ однократно в дозе в среднем 100 мг/кг в возрасте 12,0±6,2 ч. Инстилляция препарата производилась в течение 1,5-3 ч на фоне продолжающейся искусственной вентиляции легких (ИВЛ). Дети контрольной группы (n=14) не получали препараты сурфактанта. По основным клиническим показателям три группы были сопоставимы (табл. 1). Средняя масса тела при рождении во всех группах составляла около 1400 г, длина тела – около 39 см, срок гестации – 29 недель. Доля мальчиков и девочек была примерно одинаковой.
| Параметры | Порактант альфа (n=18) | Сурфактант БЛ (n=13) | Контроль (n=14) |
|---|---|---|---|
| Мужской пол, n (%) | 9 (50,0) | 6 (46,2) | 6 (42,9) |
| Масса тела при рождении, г | 1401,0±282,0 | 1400,3±305,5 | 1368,6±330,6 |
| Длина тела при рождении, см | 39,7±2,7 | 39,8±3,1 | 38,9±4,4 |
| Срок гестации, недели | 29,5±2,0 | 29,5±2,4 | 29,4±2,2 |
| Индекс Апгар, баллы | |||
| 1-я минута | 5,3±1,6 | 5,6±2,0 | 5,2±1,3 |
| 5-я минута | 7,1±0,8 | 7,2±1,3 | 7,1±0,3 |
Исходные параметры ИВЛ в трех группах были практически одинаковыми и носили достаточно “жесткий” характер. Введение порактанта альфа уже через 5 мин привело к значительному снижению основных параметров ИВЛ, в том числе FiO2, давления на вдохе (PIP) и среднего давления в дыхательных путях, в то время как при применении сурфактанта БЛ их динамика была сопоставимой с таковой в контрольной группе (рис. 2). Например, FiO2 через 5 мин уменьшилась с 0,94 до 0,54 в группе порактанта альфа и с 0,92 до 0,87 в группе сурфактанта БЛ. Через 3 и 24 ч после введения порактанта альфа доля детей, у которых FiO2 составляла ≤0,4, увеличилась до 44,4% и 66,7%, соответственно, в то время как в группе сурфактанта БЛ в те же сроки их доля была значительно ниже – около 8% и фактически не отличалась от таковой в контрольной группе (рис. 3). Сходные результаты были получены и при изучении изменений среднего давления в дыхательных путях и инспираторного давления, которые также удавалось достаточно быстро снизить в первые сутки после введения порактанта альфа. Динамика этих параметров ИВЛ у новорожденных, получавших сурфактант БЛ, и детей контрольной группы достоверно не отличалась. При ме нение порактанта альфа привело к сокращению длительности ИВЛ, кислородной зависимости и сроков пребывания в палате интенсивной терапии по сравнению с таковыми в двух других группах (табл. 2).
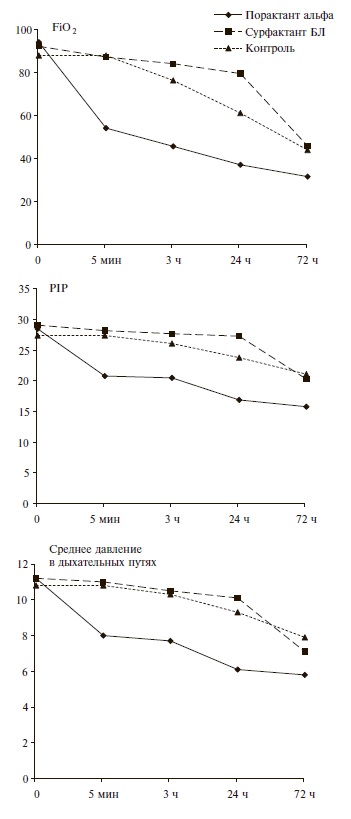
Рис. 2. Динамика показателей искусственной вентиляции легких у новорожденных с РДСН в трех группах
Среди осложнений в настоящем исследовании чаще всего встречались пневмоторакс, пневмония, внутрижелудочковые кровоизлияния. Частота их в группе порактанта альфа была ниже, чем в группах сравнения, хотя разница достигла статистической значимости только для частоты внутрижелудочковых кровоизлияний между группами детей, получавших порактант альфа и не получавших препараты сурфактанта (табл. 2). Отсут ствие достоверной разницы частоты различных исходов между группами, вероятно, отражало небольшое число больных, включенных в исследование. Летальность в группе порактанта также была недостоверно ниже, чем в группе сурфактанта БЛ и контрольной группе.
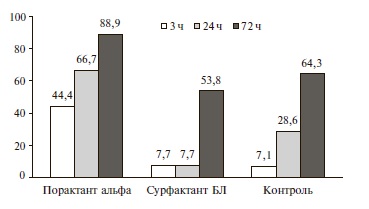
Рис. 3. Доля детей с FiO2≤0,4 в различные сроки после введениясурфактанта
| Параметры | Порактант альфа (n=18) | Сурфактант БЛ (n=13) | Контроль (n=14) |
|---|---|---|---|
| Примечание: ПИТ - палата интенсивной терапии. Достоверные различия были выявлены только при сравнении частоты внутрижелудочковых кровоизлияий между группой порактанта альфа и контрольной группой (р | |||
| ИВЛ, сут | 12,2±9,9 | 17,1±16,8 | 21,1±14,6 |
| Оксигенотерапия, сут | 20,4±15,0 | 27,3±20,6 | 35,4±40,7 |
| Койко-день в ПИТ | 15,8±10,2 | 20,5±19,4 | 23,0±14,5 |
| Осложнения*, n (%) | |||
| Пневмоторакс | 0 | 3 (23,1) | 2 (14,3) |
| Пневмония | 7 (38,9) | 7 (53,8) | 10 (71,4) |
| Внутрижелудочковые кровоизлияния | 2 (11,1) | 5 (38,5) | 10 (71,4) |
| Летальность, n (%) | 2 (11,1) | 5 (38,5) | 3 (21,4) |
Проведенное исследование имеет очевидные ограничения, в том числе ретроспективный дизайн и отсутствие рандомизации. Тем не менее, оно показало преимущество порактанта альфа перед сурфактантом БЛ и контролем по эффективности в лечении тяжелого РДСН у недоношенных детей, находившихся на ИВЛ. Введение порактанта альфа позволяло быстрее и эффективнее восстановить механику легких и сократить длительность ИВЛ и оксигенотерапии. Кроме того, применение порактанта альфа ассоциировалось с тенденцией к снижению частоты осложнений и летальности новорожденных. Для улучшения состояния новорожденных оказалось достаточным однократного введения порактанта альфа.
Заключение
Заместительное введение сурфактанта в сочетании с респираторной поддержкой остается основным методом лечения РДСН у недоношенных детей. Результаты систематизированного обзора и мета-анализа Cochrane свидетельствуют о том, что наибольшей эффективностью в лечении РДСН обладает сурфактант свиного происхождения – порактант альфа (Куросурф), который имел достоверные преимущества перед сурфак тантом бычьего происхождения – берактантом. В российском ретроспективном исследования была показана более высокая эффективность порактанта альфа по сравнению с сурфактантом БЛ. который получают из ткани легких телят. Следует отметить, что эффективность последнего в лечении РДСН сомнительная, так как в адекватных исследованиях этот препарат, в отличие от других сурфактантов, не изучался. Пора ктант альфа характеризуется самой высокой концентрацией кислых фосфолипидов, что позволяет вводить препарат в более эффективной дозе 200 мг/кг и в меньшем объеме, чем другие сурфактанты. Возмож ность введения порактанта альфа в небольшом объеме делает его препаратом выбора при использовании стратегии LISA, когда сурфактант вводится с помощью тонкого катетера на фоне СРАР. Стратегии малоинвазивного применения пре паратов сурфактантов (INSURE, LISA) позволяют уменьшить нежелательные эффекты механической вентиляции легких на новорожденных.
Причины развития РДС у новорожденных
Основные причины развития РДС у новорожденных - это нарушение образования в альвеолах легких специального вещества – сурфактанта, связанное с функциональной и структурной незрелостью легочной ткани. Сурфактант представляет собой природное вещество, состояще из фосфолипидов и четырех видов белка, которое покрывает стенки дыхательных пузырьков – альвеол.
Легкие плода до родов находятся в спавшемся состоянии , легочные пузырьки – альвеолы напоминают сдувшиеся воздушные шарики. После рождения ребенок делает первый вдох, легкие расправляются и из сдувшихся шарики должны превратиться в надутые. Однако все структуры легких у малышей с массой тела менее 1500 г при рождении незрелые. Они менее воздушные и более полнокровные, а самое главное, в них отмечается недостаток сурфактанта.
Профилактика и лечение РДС у недоношенных детей
При угрозе преждевременных родов на 32 неделе гестации и менее беременная женщина должна быть госпитализирована в акушерский стационар III уровня (в перинатальный центр), где имеется отделение реанимации новорожденных. Риск развития РДС тем выше, чем более недоношенным рождается ребенок. Но этот риск можно снизить. Для этого всем беременным женщинам на сроке гестации 23-34 недели при угрозе преждевременных родов проводят курс гормональной терапии кортикостероидами для профилактики РДС недоношенных и снижения риска возможных неблагоприятных осложнений у ребенка таких, как ВЖК и НЭК. Возможны две альтернативные схемы пренатальной профилактики РДС: Бетаметазон – 12 мг внутримышечно через 24 часа, всего 2 дозы на курс; или Дексаметазон – 6 мг внутримышечно через 12 часов, всего 4 дозы на курс. Стероидные гормоны ускоряют созревание легких у плода. Максимальный эффект терапии развивается спустя 24 часа после начала терапии и продолжается неделю. К концу второй недели эффект от терапии стероидами значительно снижается. Повторный курс профилактики РДС рекомендован только спустя 2-3 недели после первого в случае повторного возникновения угрозы преждевременных родов на сроке беременности менее 33 недель.
Профилактически уже в первые 20 минут жизни всем детям, родившимся на сроке гестации 26 недель и менее при отсутствии проведения их матерям полного курса антенатальной профилактики стероидами проводится введение сурфактанта в легкие. Также сурфактант в родильном зале вводится всем новорожденным гестационного возраста ≤ 30 недель, потребовавшим интубации трахеи в родильном зале. Наиболее эффективное время введения первые 20 минут жизни. Недоношенным детям гестационного возраста > 30 недель, потребовавшим интубации трахеи в родильном зале при сохраняющейся зависимости от FiО2 > 0,3-04. Наиболее эффективное время введения – первые два часа жизни. Недоношенным детям на стартовой респираторной терапии методом СРАР в родильном зале при потребности в FiО2 ≥ 0,5 и более для достижения SpО2 = 85% к 10 минуте жизни и отсутствии регресса дыхательных нарушений, а так же улучшения оксигенации в последующие 10-15 минут.
В неонатологии используют сурфактант, получаемый из легких животных, свиней или коров. Вещество проходит тщательную очистку от любых инфекционных агентов (вирусов, бактерий), в также специфических животных белков, что исключает развитие аллергических реакций. Сурфактант представляет собой белый раствор, который вводится через трубочку прямо в легкие ребенка. Он быстро распространяется по всем дыхательным путям и буквально на глазах увеличивает насыщение крови кислородом. В некоторых случаях ребенок нуждается в двухкратном или даже трехкратном введении сурфактанта.
Повторное введение сурфактанта с лечебной целью рекомендовано: детям гестационного возраста ≤35 недель на СРАР, уже получившим первую дозу сурфактанта, при переводе их на искусственную вентиляцию легких в связи с нарастанием дыхательных нарушений
Недоношенным, родившимся на сроке гестации 32 недели и менее в случае отсутствия дыхания или при нерегулярном дыхании в первые 20 секунд проводится продленный вдох для наиболее эффективного расправления альвеол и формирования функциональной остаточной емкости легких. После восстановления спонтанного дыхания проводится респираторная терапия с положительным давлением в дыхательных путях методом СРАР (Сontinuous Positive Airway Pressure), что помогает поддерживать легкие в расправленном состоянии даже когда ребенок делает выдох.
Искусственная вентиляция легких у недоношенных проводится при сохраняющейся на фоне респираторной терапии нерегулярности сердцебиения иили отсутствии самостоятельного дыхания.
Потребность в дополнительной оксигенации до 45-50%, а так же в высоком давлении к концу вдоха у недоношенных новорождённых является показанием для перевода на высокочастотную осцилляторную вентиляцию легких (ВЧОВЛ).
Высокочастотная ИВЛ – это особый, высокотехнологичный метод проведения искусственной вентиляции легких. При ВЧОВЛ отсутствуют привычные дыхательные движения, так как здесь не происходит привычного вдоха и выдоха. Газообмен обеспечивается за счет высокочастотных колебаний воздушной смеси – осцилляций. При этом можно увидеть, как грудная клетки ребенка колеблется. Преимуществом такой респираторной терапии является то, что газообмен в легких происходит практически непрерывно, что необходимо в тех случаях когда легкие ребенка очень незрелые и ли в них имеется воспалительный процесс.
При ВЧО ИВЛ за счет стабилизации объема альвеол происходит уменьшение ателектазов (участков слипания легочных альвеол), увеличение площади газообмена и улучшение легочного кровотока. В результате правильно проводимой терапии достигается уменьшение вентиляционно-перфузионного соотношения, уменьшается потребность в высокой концентрации кислорода. При этом уменьшается дыхательный объем, снижается перерастяжение легких и уменьшается риск повреждения легких за счет баро - и волюмотравмы.
Синдром дыхательных расстройств - патологическое состояние новорожденных, возникающее в первые часы и сутки после рождения вследствие морфофункциональной незрелости легочной ткани и дефицита сурфактанта. Синдром дыхательных расстройств характеризуется дыхательной недостаточностью различной степени выраженности (тахипноэ, цианозом, втяжением уступчивых мест грудной клетки, участием вспомогательной мускулатуры в акте дыхания), признаками угнетения ЦНС и нарушения кровообращения. Синдром дыхательных расстройств диагностируется на основании клинических и рентгенологических данных, оценке показателей зрелости сурфактанта. Лечение синдрома дыхательных расстройств включает оксигенотерапию, инфузионную терапию, антибиотикотерапию, эндотрахеальную инстилляцию сурфактанта.
Общие сведения

Причины синдрома дыхательных расстройств
Как уже указывалось, патогенез синдрома дыхательных расстройств у новорожденных связан с незрелостью легочной ткани и обусловленной этим недостаточностью антиателектатического фактора - сурфактанта, его неполноценностью, ингибированием или повышенным разрушением.
Сурфактант представляет собой поверхностно-активный липопротеиновый слой, покрывающий альвеолярные клетки и уменьшающий поверхностное натяжение легких, т. е. предупреждающий спадение стенок альвеол. Сурфактант начинает синтезироваться альвеолоцитами с 25-26 недели внутриутробного развития плода, однако его наиболее активное образование происходит с 32-34 недели гестации. Под действием многих факторов, в числе которых гормональная регуляция глюкокортикоидами (кортизолом), катехоламинами (адреналином и норадреналином), эстрогенами, гормонами щитовидной железы, созревание системы сурфактанта завершается к 35-36-й неделе гестации.
Поэтому, чем ниже гестационный возраст новорожденного, тем меньше у него количество сурфактанта в легких. В свою очередь, это приводит к спадению стенок альвеол на выдохе, ателектазу, резкому снижению площади газообмена в легких, развитию гипоксемии, гиперкапнии и респираторного ацидоза. Нарушение альвеолокапиллярной проницаемости приводит к пропотеванию плазмы из капилляров и последующему выпадению гиалиноподобных веществ на поверхность бронхиол и альвеол, что еще в большей степени снижает синтез сурфактанта и способствует развитию ателектазов легких (болезнь гиалиновых мембран). Ацидоз и легочная гипертензия поддерживают сохранение фетальных коммуникаций (открытого овального окна и артериального протока) – это также усугубляет гипоксию, приводит к развитию ДВС-синдрома, отечно-геморрагического синдрома, дальнейшему нарушению образованию сурфактанта.
Риск развития синдрома дыхательных расстройств повышается при недоношенности, морфо-функциональной незрелости по отношению к гестационному возрасту, внутриутробных инфекциях, гипоксии плода и асфиксии новорожденного, ВПС, пороках развития легких, внутричерепных родовых травмах, многоплодии, аспирации мекония и околоплодных вод, врожденном гипотиреозе и др. Материнскими факторами риска развития синдрома дыхательных расстройств у новорожденного могут служить сахарный диабет, анемия, родовое кровотечение, родоразрешение с помощью кесарева сечения.
Классификация синдрома дыхательных расстройств
На основании этиологического принципа различают синдром дыхательных расстройств гипоксического, инфекционного, инфекционно-гипоксического, эндотоксического, генетического (при генетически обусловленной патологии сурфактанта) генеза.
На основании развивающихся патологических сдвигов выделяют 3 степени тяжести синдрома дыхательных расстройств.
- I (легкая степень) – возникает у относительно зрелых детей, имеющих при рождении состояние средней тяжести. Симптоматика развивается только при функциональных нагрузках: кормлении, пеленании, проведении манипуляций. ЧД менее 72 в мин.; газовый состав крови не изменен. Состояние новорожденного нормализуется в течение 3-4 дней.
- II (средне-тяжелая степень) – ребенок рождается в тяжелом состоянии, которое нередко требует проведения реанимационных мероприятий. Признаки синдрома дыхательных расстройств развиваются в течение 1-2 часов после рождения и сохраняются до 10 суток. Необходимость в дотации кислорода обычно отпадает на 7-8 сутки жизни. На фоне синдрома дыхательных расстройств у каждого второго ребенка возникает пневмония.
- III (тяжелая степень) – обычно возникает у незрелых и глубоко недоношенных детей. Признаки синдрома дыхательных расстройств (гипоксия, апноэ, арефлексия, цианоз, резкое угнетение ЦНС, нарушение терморегуляции) возникают с момента рождения. Со стороны сердечно-сосудистой системы отмечается тахикардия или брадикардия, артериальная гипотония, признаки гипоксии миокарда на ЭКГ. Велика вероятность летального исхода.
Симптомы синдрома дыхательных расстройств
У новорожденных с синдромом дыхательных расстройств отмечаются признаки угнетения ЦНС, обусловленные гипоксией, нарастание отека мозга, склонность к внутрижелудочковым кровоизлияниям. ДВС-синдром может проявляться кровоточивостью из мест инъекций, легочным кровотечением и т. д. При тяжелой форме синдрома дыхательных расстройств стремительно развивается острая сердечная недостаточность с гепатомегалией, периферическими отеками.
Другими осложнениями синдрома дыхательных расстройств могут являться пневмонии, пневмоторакс, эмфизема легких, отек легких, ретинопатия недоношенных, некротический энтероколит, почечная недостаточность, сепсис и др. В исходе синдрома дыхательных расстройств у ребенка может отмечаться выздоровление, гиперреактивность бронхов, перинатальная энцефалопатия, нарушения иммунитета, ХНЗЛ (буллезная болезнь, пневмосклероз и др.).
Диагностика синдрома дыхательных расстройств
В клинической практике для оценки степени тяжести синдрома дыхательных расстройств используется шкала И. Сильвермана, где в баллах (от 0 до 2-х) оцениваются следующие критерии: экскурсия грудной клетки, втяжение межреберий на вдохе, западение грудины, раздувание ноздрей, опускание подбородка на вдохе, экспираторные шумы. Суммарная оценка ниже 5 баллов свидетельствует о легкой степени синдрома дыхательных расстройств; выше 5 – средней, 6—9 баллов — о тяжелой и от 10 баллов – о крайне тяжелой степени СДР.
Состояние ребенка, обусловленное синдромом дыхательных расстройств, следует отличать от врожденной пневмонии, пороков дыхательной системы, атрезии хоан, ВПС, родовой травмы, врожденной диафрагмальной грыжи и др. В рамках дифференциальной диагностики выполняется нейросонография, рентгенография позвоночника, люмбальная пункция, ЭКГ, ЭхоКГ и пр.
Лечение синдрома дыхательных расстройств
Ведение ребенка с синдромом дыхательных расстройств осуществляется неонатологом, детским анестезиологом-реаниматологом с привлечением в случае необходимости детского невролога, детского пульмонолога, детского кардиолога и др.
Ребенок с синдромом дыхательных расстройств нуждается в непрерывном контроле ЧС, ЧД, газового состав крови, КОС; мониторинге показателей общего и биохимического анализа крови, коагулограммы, ЭКГ. Для поддержания оптимальной температуры тела ребенок помещается в кувез, где ему обеспечивается максимальный покой, ИВЛ или ингаляции увлажненного кислорода через носовой катетер, парентеральное питание. Ребенку периодически выполняется трахеальная аспирация, вибрационный и перкуторный массаж грудной клетки.
При синдроме дыхательных расстройств проводится инфузионная терапия раствором глюкозы, гидрокарбоната натрия; трансфузии альбумина и свежезамороженной плазмы; антибиотикотерапия, витаминотерапия, диуретическая терапия. Важным слагаемым профилактики и лечения синдрома дыхательных расстройств является эндотрахеальная инстилляция препаратов сурфактанта.
Прогноз и профилактика синдрома дыхательных расстройств
Последствия синдрома дыхательных расстройств определяются сроком родов, тяжестью дыхательной недостаточности, присоединившимися осложнениями, адекватностью проведения реанимационных и лечебных мероприятий.
В плане профилактики синдрома дыхательных расстройств наиболее важным представляется предупреждение преждевременных родов. В случае угрозы преждевременных родов необходимо проведение терапии, направленной на стимуляцию созревание легочной ткани у плода (дексаметазон, бетаметазон, тироксин, эуфиллин). Недоношенным детям необходимо проводить раннюю (в первые часы после рождения) заместительную терапию сурфактантом.
В дальнейшем дети, перенесшие синдром дыхательных расстройств, кроме участкового педиатра, должны наблюдаться детским неврологом, детским пульмонологом, детским офтальмологом.
Респираторный дистресс-синдром обусловлен недостаточностью легочного сурфактанта в легких новорожденных, чаще всего тех, кто родился на сроке 37 недель беременности. Риск увеличивается со степенью недоношенности. Симптомы и признаки включают затрудненное дыхание, вовлечение вспомогательных мышц и раздувание крыльев носа, появляются они вскоре после рождения. Диагноз клинический; пренатальный риск может быть оценен с помощью тестов на созревание легких плода. Лечение – терапия сурфактантом и поддерживающее лечение.
Этиология
Редкие случаи являются наследственными, вызванными мутациями генов сурфактантного белка (SP-B и SP-C) и АТФ-связывающего транспортного белка A3 (ABCA3).
Патофизиология
Легочный сурфактант – это смесь фосфолипидов и липопротеинов, выделяемых пневмоцитами типа II (см. Легочная функция новорожденных Функции легких новорожденного Переход от жизни в утробе матери к жизни вне ее включает многочисленные изменения в физиологии и функциях. Также Проблемы перинатального периода. (См. также Структура и функции печени (Liver. Прочитайте дополнительные сведения ). Он уменьшает поверхностное натяжение водной пленки, выстилающей альвеолы, тем самым уменьшая стремление альвеол к спаданию и работу, необходимую для их надувания.

При суфрактантной недостаточности для открытия альвеол необходимо большее давление. Без недостаточного давления в легких развиваются диффузные ателектазы, вызывающие воспаление и отек легких Отек легких Отек легких – острая тяжелая левожелудочковая недостаточность с легочной венозной гипертензией и альвеолярным отеком. При отеке легких появляются выраженная одышка, потливость, хрипы и иногда. Прочитайте дополнительные сведения . Поскольку кровь, проходящая через ателектатические части легких, не оксигенирована (формирование внутрилегочного шунта справа налево), у ребенка развивается гипоксемия. Комплаенс легких снижается, тем самым увеличивая работу дыхания. В тяжелых случаях развиваются слабость диафрагмы и межреберных мышц, а также гиперкапния (задержка CO2) и респираторный ацидоз Дыхательный ацидоз Дыхательным ацидозом называют первичное повышение парциального давления углекислого газа (Pco2) с компенсаторным увеличением уровня бикарбоната (HCO3−) или без него; рН обычно снижен, но может. Прочитайте дополнительные сведения .
Осложнения
Осложнения респираторного дистресс-синдрома включают внутрижелудочковые кровоизлияния Внутрижелудочковое кровотечение и/или внутрипаренхимное кровоизлияния Стимуляция сокращения матки и родов иногда приводит к нанесению физических травм ребенку. Риск неонатальных травм в результате тяжелых или травматических родов снижается за счет увеличения использования. Прочитайте дополнительные сведения , травмы перивентрикулярной белой материи, напряженный пневмоторакс Пневмоторакс (напряженный) Напряженным пневмотораксом называют скопление воздуха в плевральной полости под давлением, сдавление легких и уменьшение венозного оттока по направлению к сердцу. (См. также Обзор торакальной. Прочитайте дополнительные сведения , бронхолегочную дисплазию Бронхолегочная дисплазия (БЛД) Бронхолегочная дисплазия (БЛД) является хроническим заболеванием легких новорожденного, которое обычно вызывается длительной искусственной вентиляцией и определяется возрастом недоношенности. Прочитайте дополнительные сведения , сепсис Неонатальный сепсис Неонатальный сепсис является инвазивной инфекцией, как правило, бактериальной, развивающейся в неонатальном периоде. Симптомы сепсиса многообразны, неспецифичны и включают снижение спонтанной. Прочитайте дополнительные сведения и смерть в неонатальном периоде. Внутричерепные осложнения были связаны с гипоксемией, гиперкапнией, артериальной гипотензией, колебаниями артериального давления и слабой перфузией головного мозга ( Кровоизлияния в головной мозг Кровоизлияния в головной мозг Стимуляция сокращения матки и родов иногда приводит к нанесению физических травм ребенку. Риск неонатальных травм в результате тяжелых или травматических родов снижается за счет увеличения использования. Прочитайте дополнительные сведения ).
Клинические проявления
Симптомы РДС включают частое затрудненное кряхтящее дыхание, появляющееся немедленно или в течение нескольких часов после родов, с втяжениями грудины и раздуванием крыльев носа. Если ателектазы и дыхательная недостаточность прогрессируют, симптомы ухудшаются: появляются цианоз, вялость, нарушение дыхания и апноэ, что в конечном итоге может привести к сердечной недостаточности, если не будет произведено адекватное расширение легких, вентиляция и насыщение кислородом.
Новорожденные массой 1000 г могут иметь легкие настолько ригидные, что они не в состоянии инициировать или поддерживать дыхание в родильном зале.
При осмотре дыхательные шумы ослаблены и могут быть слышны хрипы.
Диагностика
Состав газов артериальной крови (ГАК; гипоксемия и гиперкапния)
Рентгенография грудной клетки
Посев крови, спинномозговой жидкости (СМЖ) и аспирата из трахеи
Диагноз РДС ставят на основании клинических проявлений, в т.ч. с учетом факторов риска; состава газов артериальной крови, свидетельствующего о гипоксемии и гиперкапнии; и рентгенографии грудной клетки. Рентген грудной клетки выявляет диффузные ателектазы, классически описываемые как имеющие вид матового стекла с заметными скоплениями воздуха на бронхограмме, и низкое расширение легкого; проявления слабо коррелируют с клинической тяжестью.
Дифференциальный диагноз включает:
Новорожденным обычно требуется посев крови. Культуральные исследования спинномозговой жидкости (СМЖ) не делают рутинно после рождения, из-за низкой распространенности менингита, ассоциированого с ранним неонатальным сепсисом, но они могут проводиться в отдельных случаях (например, при выявлении грамотрицательных бактерий в гемокультурах, подозрении на сепсис новорожденных с поздним началом) (1 Справочные материалы по диагностике Респираторный дистресс-синдром обусловлен недостаточностью легочного сурфактанта в легких новорожденных, чаще всего тех, кто родился на сроке 37 недель беременности. Риск увеличивается со степенью. Прочитайте дополнительные сведения ). Клинически отличить пневмонию, вызванную стрептококками группы В, от РДС чрезвычайно трудно. Таким образом, как правило, антибиотики назначаются до получения результатов посева.
Скрининг
Респираторный дистресс-синдром можно предположить пренатально с помощью тестов зрелости легких плода, которые получены из амниотической жидкости получают путем амниоцентеза или собранные из влагалища (при разрыве околоплодных оболочек) и которые могут помочь определить оптимальные сроки родов. Это показано для элективных родов до 39 недель, когда сердцебиение плода, уровень человеческого хорионического гонадотропина и УЗИ не могут подтвердить гестационный возраст, и неэлективных родов на сроках 34–36 недель.
Исследования амниотической жидкости включают в себя
Исследование индекса стабильности пенообразования (больше суфрактанта в амниотической жидкости, более высокая стабильность пены, которая формируется при встряхивании жидкости в сочетании с этанолом)
Риск респираторного дистресс-синдрома значительно ниже при соотношении лецитин/сфингомиелин > 2, наличии фосфатидил глицерина, индексе стабильности пены = 47 или соотношения сурфактант/альбумин > 55 мг/г.
Справочные материалы по диагностике
1. Srinivasan L, Harris MC, Shah SS: Lumbar puncture in the neonate: Challenges in decision making and interpretation. Semin Perinatol 36(6):445–453, 2012. doi: 10.1053/j.semperi.2012.06.007.
Прогноз
Прогноз при лечении превосходный, смертность 10%. При адекватной вспомогательной искусственной вентиляции даже в качестве единственного способа в конечном счете начинает вырабатываться сурфактант, после чего РДС разрешается в течение 4–5 дней. Однако в то же время тяжелая гипоксемия может привести к множественной органной недостаточности и смерти. Большая степень недоношенности связана с более высоким риском возникновения хронических заболеваний легких, бронхолегочной дисплазии или их комбинации.
Лечение
Сурфактант интратрахеально, если есть показания
Дополнительный кислород по мере необходимости
Механическая вентиляция по мере необходимости
Сурфактант ускоряет восстановление и снижает риск пневмоторакса Пневмоторакс Синдромы утечки воздуха в легких связаны с оттоком воздуха из нормального легочного воздушного пространства. (См. также Обзор перинатальных респираторных нарушений (Overview of Perinatal Respiratory. Прочитайте дополнительные сведения , интерстициальной эмфиземы Интерстициальная легочная эмфизема (ИЛЭ) Синдромы утечки воздуха в легких связаны с оттоком воздуха из нормального легочного воздушного пространства. (См. также Обзор перинатальных респираторных нарушений (Overview of Perinatal Respiratory. Прочитайте дополнительные сведения , внутрижелудочкового кровоизлияния Внутрижелудочковое кровотечение и/или внутрипаренхимное кровоизлияния Стимуляция сокращения матки и родов иногда приводит к нанесению физических травм ребенку. Риск неонатальных травм в результате тяжелых или травматических родов снижается за счет увеличения использования. Прочитайте дополнительные сведения , бронхолегочной дисплазии Бронхолегочная дисплазия (БЛД) Бронхолегочная дисплазия (БЛД) является хроническим заболеванием легких новорожденного, которое обычно вызывается длительной искусственной вентиляцией и определяется возрастом недоношенности. Прочитайте дополнительные сведения и смерти в больнице в течение 1 года. Дополнительные средства для замены суфрактанта включают в себя
Берактант – это липидный экстракт бычьего легкого, дополненный белками В и С, колфосцерила пальмитатом, пальмитиновой кислотой и трипальмитином; дозировка 100 мг/кг каждые 6 часов, по необходимости до 4 доз.
Порактант альфа представляет собой модифицированный экстракт, полученный из рубленого легкого свиньи, содержащий фосфолипиды, нейтральные липиды, жирные кислоты и связанные с суфрактантом белки В и С. Дозировка 200 мг/кг с последующим переходом на 2 дозы по 100 мг/кг через каждые 12 часов по необходимости.
Кальфактант – это экстракт теленка легких, содержащий фосфолипиды, нейтральные липиды, жирные кислоты и связанные с суфрактантом белки В и С. Дозировка составляет 105 мг/кг каждые 12 часов до 3 доз по необходимости.
Lucinactant is a synthetic surfactant with a pulmonary surfactant protein B analog, sinapultide (KL4) peptide, phospholipids, and fatty acids; dose is 175 mg/kg every 6 hours up to 4 doses.
Растяжимость легких может быстро улучшаться после терапии. Пиковое давление аппарата ИВЛ при вдохе, возможно, нужно будет быстро снизить для уменьшения риска легочной утечки воздуха. Другие параметры аппарата ИВЛ (например, FIO2, уровень) тоже, возможно, потребуется уменьшить.
Справочные материалы по лечению
1. Blennow M, Bohlin K: Surfactant and noninvasive ventilation. Neonatology 107(4):330–336, 2015. doi: 10.1159/000381122.
2. Bohlin K, Gudmundsdottir T, Katz-Salamon M, et al: Implementation of surfactant treatment during continuous positive airway pressure. J Perinatol 27(7):422–427, 2007. doi: 10.1038/sj.jp.7211754.
3. Aldana-Aguirre JC, Pinto M, Featherstone RM, Kumar M: Less invasive surfactant administration versus intubation for surfactant delivery in preterm infants with respiratory distress syndrome: A systematic review and meta-analysis. Arch Dis Child Fetal Neonatal Ed 102(1):F17–F23, 2017. doi: 10.1136/archdischild-2015-310299.
Профилактика
Когда плод должен родиться в период с 24-й по 34-ю недели, введение матери 2 доз бетаметазона по 12 мг внутримышечно с интервалом 24 часа или 4 доз дексаметазона по 6 мг внутривенно или внутримышечно каждые 12 часов за не менее чем 48 часов до родов вызывает образование сурфактанта у плода и снижает риск респираторного дистресс-синдрома либо уменьшает его тяжесть. ( Преждевременные роды Преждевременные роды Роды (схватки, приводящие к открытию шейки матки), начавшиеся до 37 недель, считаются преждевременными. Факторы риска включают предродовой разрыв околоплодных оболочек, аномалии матки, инфекции. Прочитайте дополнительные сведения ).
Профилактическая интратрахеальная терапия сурфактантами, назначаемая новорожденным с высоким риском развития РДС (младенцы, родившиеся 30 недель по сроку гестации, особенно в отсутствие дородового воздействия кортикостероидов), снижает риск неонатальной смертности и развития некоторых форм легочной заболеваемости (например, пневмоторакса Пневмоторакс Синдромы утечки воздуха в легких связаны с оттоком воздуха из нормального легочного воздушного пространства. (См. также Обзор перинатальных респираторных нарушений (Overview of Perinatal Respiratory. Прочитайте дополнительные сведения ).
Ключевые моменты
Респираторный дистресс-синдром (РДС) обусловлен недостаточностью легочного сурфактанта, что обычно наблюдается только у новорожденных, родившихся при 37 недель беременности. Недостаточность ухудшается с увеличением степени недоношенности.
В связи с недостаточностью сурфактанта, альвеолы закрываются или не могут раскрыться и в легких развиваются диффузные ателектазы, вызывающие воспаление и отек легких.
В дополнение к вызванной дыхательной недостаточности, РДС увеличивает риск внутрижелудочкового кровоизлияния, напряженного пневмоторакса, бронхолегочной дисплазии, сепсиса и смертельного исхода.
Диагностика клиническая и с рентгеном грудной клетки, исключение пневмонии и сепсиса проведением соответствующих посевов.
Если ожидаются преждевременные роды, то необходима оценки зрелости легких путем исследования амниотической жидкости на соотношение лецитина/сфингомиелина, стабильность пены или соотношения суфрактанта/альбумина.
При необходимости оказывают респираторную поддержку и интратрахеально вводят сурфактнант, если ребенку требуется немедленная интубация или ухудшается состояние дыхания при назальном постоянном положительном давлении в дыхательных путях.
Дайте матери несколько доз кортикостероидов парентерально (бетаметазон, дексаметазон), если время позволяет, и она должна родить на сроке от 24 недель и 34 недель беременности. Кортикостероиды вызывают продукцию суфрактанта плода и снижают риск и/или тяжесть РДС.
Читайте также:

