Способы окончательного гемостаза кратко
Обновлено: 07.07.2024
Они осуществляются механическими, физическими, химическими и биологическими методами. Механические методы:
- Лигирование сосуда в ране - выполняется лигатурой из шовного материала. Метод широко применяется во время операций, перевязываются сосуды, на которые были наложены кровоостанавливающие зажимы (способ временной остановки кровотечения). Метод минимально нарушает кровоснабжение тканей.
- Лигирование сосуда на его протяжении - применяется при очень инфицированных ранах или если трудно отыскать в ране кровоточащий сосуд. При этом перевязывают крупный кровоточащий сосуд, что существенно нарушает кровоснабжение тканей.
- Сосудистый шов - выполняется атравматической иглой с нерассасывающимся шовным материалом или сосудосшивающим аппаратом. Шов накладывают по всей окружности сосуда или ее части. При этом применяют и различные способы реконструкции сосудов. Метод является лучшим, так как не нарушает кровоснабжение тканей.
- Специальные методы - это удаление селезенки или легкого при паренхиматозных кровотечениях; это методы, применяемые в эндоваскулярной хирургии и др.
- Из временных способов становятся окончательными давящая повязка (тромбирование наступает на 2-3-й день) и тугая тампонада раны (тромбирование наступает на 4-5-й день).
- Шунтирование и сосудистое протезирование.
- Низкая температура: пузырь со льдом при капиллярных кровотечениях, носовых, маточных и др., криохирургия - замораживание, применяемое в нейрохирургии и онкологии.
- Высокая температура - электрокоагуляция, которая проводится с помощью электрокоагулятора для остановки кровотечения из небольших сосудов во время операции. Высокую температуру создает ток высокой частоты. Сосуд прижигается, и в нем образуется тромб.
В абдоминальной, торакальной и нейрохирургии используется горячий изотонический раствор поваренной соли (60-80 °С). В него погружают стерильные салфетки и прикладывают к кровоточащей поверхности органа примерно на 5 мин для гемостаза.
Лазерный луч применяется для остановки паренхиматозных кровотечений, вызывает коагуляцию тканевого белка.
- Вещества, повышающие свертываемость крови (перекись водорода, хлористый кальций, викасол, аминокапроновая кислота).
- Сосудосуживающие препараты (адреналин, спорынья, питуитрин).
- Вещества, уменьшающие проницаемость сосудистой стенки (карбазохром, рутин, аскорбиновая кислота, рутамин).
- Местное применение живой ткани - мышца, сальник (лоскут на ножке) - используются для остановки кровотечений во время операций в брюшной полости и на костях, так как они богаты тромбокиназой.
- Местное применение веществ биологического происхождения: гемостатическая губка, желатиновая губка, фибринная пленка, тромбин.
- Внутривенное применение гемостатических средств: кровь (150-200 мл), плазма, тромбоцитарная масса, фибриноген, трасилол.
В.Дмитриева, А.Кошелев, А.Теплова
"Окончательные способы остановки кровотечения" и другие статьи из раздела Общая хирургия
Попков В.М., Потапов Д.Ю., Понукалин А.Н., Дурнов Д.А.
ГБОУ ВПО Саратовский ГМУ им. В.И.Разумовского Минздрава России, НИИ фундаментальной и клинической уронефрологии
Резюме
На основе анализа данных зарубежной и отечественной литературы рассмотрены основные методы гемостаза при резекции почки. Освещены основные преимущества и недостатки каждого метода, Обоснована необходимость применения лигатурных способов гемостаза при резекциях среднего сегмента почки и всех операций со вскрытием полостной системы почки.
Ключевые слова
Обзор
Резекция почки (парциальная нефрэктомия) направлена на иссечение части паренхимы органа, содержащий патологический очаг. Первая резекция почки произведена в 1887 году Черни. Различают следующие виды резекций: клиновидная, плоскостная и фронтальная. В настоящее время парциальную нефрэктомию выполняют при травме почки и множестве её заболеваний. Среди них: опухоль почки, мочекаменная болезнь, аномалии мочевыводящих путей, эхинококкоз и кисты почек, реноваскулярная гипертензия, ксантогранулематозный пиелонефрит и нефротуберкулез. [1]
Учитывая значительное увеличение в последние годы количества резекций почки при различной патологии, особенно актуальными становятся вопросы обеспечения гемостаза во время операции и в послеоперационном периоде, так как осуществление гемостаза может занимать до 85% времени всей операции [2].
Среди множества способов окончательного гемостаза принято различать несколько групп:
Физические способы гемостаза включают в себя большую группу методик. Во время резекции почки из физических способов применяют: электрокоагуляцию, микроволновую, радиочастотную, лазерную коагуляцию, ультразвуковой и водоструйный диссекторы, а также аргоновые потоки. [3, 4, 5, 6, 7]
В литературе имеется достаточное количество публикаций, посвященных применению микроволнового коагулятора во время резекции почки [3,5,6,7,8]. Fujimoto K. (2005) сообщили о резекции почки у 121 больного с использованием микроволнового коагулятора. Отмечено отсутствие влияния данной методики гемостаза на выживаемость и частоту рецидивирования опухоли в течение 5 лет наблюдения [5]. С накоплением опыта выявились существенные недостатки методики. Hamasaki T.(2004) применили микроволновую коагуляцию вместе с наложением гемостатических швов и биологического клея у 11 пациентов с опухолью почки. Средний размер опухоли – 2,5 см, опухоль располагалась в нижнем полюсе и среднем сегменте почки. Зона коагуляции проводилась в 6-7 мм от края опухоли. Зона вторичного коагуляционного некроза составила 7-10 мм. Осложнения были в 8% - мочевой свищ [6]. Matsui Y. (2002) использовали микроволновой коагулятор у 3 групп пациентов: 12 пациентам произведена краевая резекция почки, 8 пациентам – плоскостная резекция полюса почки, 12 больным 3 группы произведена резекция почки с предварительной перевязкой сегментарной артерии. Микроволновой коагулятор показал свою эффективность у больных 1 группы. Во 2 и 3 группе были высокие показатели кровопотери. Осложнения: в 47% мочевая фистула, 5,8% - инфаркт почки у пациентов с предварительной перевязкой сегментарной артерии [3]. Nanri M. (2009) сравнивали повреждение почечной паренхимы в двух группах больных – у 11 пациентов с использованием микроволнового коагулятора и 2 группы с традиционной резекцией почки с гемостатическими швами. Выявлено достоверное отличие числа клеток почечной паренхимы, подвергшихся апоптозу у пациентов с применением микроволнового коагулятора (в среднем 421 на 1000 клеток). В случае традиционной резекции с применением холодовой ишемии среднее число таких клеток составило 286 на 1000 клеток [7]. Satoh Y. (2005) использовали микроволновой коагулятор при резекции почки по поводу опухоли средним размером 1,5 см. оценивалась величина функционирующей паренхимы через месяц после операции. Потеря функционирующей паренхимы составила от 4 до 10% [8]. Таким образом, недостатками метода являются большая зона коагуляционного некроза (до 10 мм), низкая эффективность остановки кровотечения из сосудов диаметром более 1 мм и относительно высокая частота мочевых свищей. Одним из специфических осложнений данной методики гемостаза является образование после операции стриктуры верхней трети мочеточника или лоханочно-мочеточникового сегмента. Применение микроволнового коагулятора рекомендуется при резекции краевых опухолей почки диаметром до 2 см, расположенных на возможно большем удалении от полостной системы почки. Некоторые авторы вообще не рекомендуют применение микроволнового коагулятора при резекции почки.
В последнее десятилетие в иностранной литературе появилось большое количество публикаций, посвященных применению во время парциальной нефрэктомии радиочастотной коагуляции (РЧ-коагуляции) [9,10]. Преимуществом метода является, по мнению ряда авторов, уменьшение зоны коагуляционного некроза, по сравнению с электрокоагуляционными методиками, а также высокая эффективность при коагуляции сосудов малого диаметра и уменьшение интраоперационной кровопотери [11]. Coleman J. (2007) сообщили о применении РЧА во время 20 резекций почки с хорошими непосредственными результатами, зона некроза составила 3 мм. Кроме того, авторы производили экспериментальное сравнение зоны некроза при РЧ-коагуляции и стандартной биполярной электрокоагуляции; при РЧ-коагуляции она была 4 мм, при электрокоагуляции – 7 мм [11]. Sprunger J. (2005) изучали в эксперименте эффективность и влияние на ткани РЧ-коагуляции во время резекции почки. Выявлены хорошие гемостатические характеристики метода. Ширина зоны некроза составила 2-3 мм, однако явления дистрофии были выявлены в 6-8 мм от зоны операции, что вероятнее всего объясняется воздействием высокой температуры. В случае вскрытия ЧЛС после операции в 100% случаев диагностирован мочевой затек [9]. Yao P. (2008) применяли РЧ-коагуляцию при резекции почки в эксперименте. Предварительно производилась электрокоагуляция по линии резекции полюса почки по кругу, затем выполнялась радиочастотная коагуляция и удаление при помощи холодного ножа. Отмечено малое время операции и небольшая величина кровопотери. Однако во всех случаях была необходимость в наложении дополнительных узловых швов на почку [10]. Таким образом, недостатками РЧ-коагуляции являются большая зона коагуляционного некроза, невозможность коагуляции сосудов среднего и крупного диаметра, необходимость применения дополнительных гемостатических методик [9,10]. Применение РЧ-коагуляции показано при наличии небольшой экзофитной опухоли и применения дополнительных методик гемостаза, результаты значительно лучше, если есть возможность интраоперационного УЗИ для надежной диагностики повреждения полостной системы почки [10].
Внедрение в медицинскую практику в 60-ых годах XX века газовых углекислотных лазеров, которые обладали выраженными режущими и гемостатическими свойствами, открыло новые возможности для достижения гемостаза при операциях на паренхиматозных органах. Применяемые в хирургической практике лазеры можно разделить на две группы:
- высокоэнергетические лазеры (ВЭЛ). В эту группы относятся СО2-лазер и АИГ-неодимовый лазер. Механизм их действия заключается в коагуляции тканей путем значительного их нагревания при поглощении лазерного луча[12].
Высокоинтенсивные лазеры обладают выраженным режущим эффектом. Nishiwaki Y. (1992) использовали АИГ-неодимовый лазер для резекции почки в эксперименте. Авторы отмечают возможность биполярной коагуляции данным способом артерий до 2 мм и вен до 5 мм в диаметре. После операции кровотечений из паренхимы не было. Johnson D.E. (1988) сравнивали применение неодимового лазера в различных режимах: охлажденного лазерного скальпеля, фокусированного луча и кварцевых GI-нитей. Получены следующие результаты: в режиме скальпеля отсутствует гемостатическое свойство лазера. В других режимах получены удовлетворительные результаты. Зона повреждения 1-2 мм. Однако при гистологическом исследовании через 3 недели после операции отмечено увеличение зоны некроза до 3 мм. По результатам нескольких исследований не выявлено достоверных различий в числе лигатур, необходимых для достижения окончательного гемостаза при резекции почки с использованием высокоэнергетического лазера или только шовных методов гемостаза. Также существенными недостатками применения ВЭЛ являются сильное задымление операционного поля и вскипание ткани в зоне резекции, что и может сказываться на качестве гемостаза [12].
Использование ультразвука также возможно во время резекции почки [17]. Преимущества методики – уменьшение величины кровопотери и зоны коагуляционного некроза по сравнению с электрокоагуляцией и микроволновым коагулятором. Jackman S.V. (1998) изучали применение гармонического скальпеля при резекции почки. Выполнялось 3 типа вмешательства на почке: краевая резекция, резекция полюса почки и гемирезекция или резекция среднего сегмента почки. Интраоперационный гемостаз оценивался по одному из 5 уровней: 0 – полное отсутствие гемостаза, 1- продолжающееся постоянное кровотечение, 2 – умеренное кровотечение, 3 –капиллярное кровотечение, 4 – сухое операционное поле. При использовании ультразвукового диссектора для краевой резекции почки кровотечение 0-2 уровня имелось в 9% наблюдений, при резекции полюса почки такое кровотечение было в 25% операций, при операции на среднем сегменте опасное для больного кровотечение было в 57% операций . В таких случаях использовались дополнительные гемостатические методики – коагуляция и лигатурные методы. Авторы не рекомендуют применение гармонического диссектора при геминефрэктомии и операциях на среднем сегменте почки.
В последние годы появились сведения о следующем поколении ультразвуковых диссекторов – высокоинтенсивном ультразвуковом кавитационном диссекторе [18,19]. Однако, частота кровотечения во время операции составила до 12,5%, особенно при отсутствии отжатия ножки почки. Lafon C. (2007) применяли при резекции полюса почки инструмент, который действовал на ткани высокоинтенсивным ультразвуком. Зона коагуляционного некроза была размерами 2,3 – 3,8 см [18]. Murat F.J. (2006) предложили использовать для резекции почки высокоинтенсивный ультразвуковой кавитационный диссектор. Произведено 12 резекций полюса почки по новой методике в эксперименте. Во всех случаях достигнут стабильный гемостаз. Однако в 25% случаев после операции диагностирована уринома, что свидетельствует о повреждении ЧЛС, во время операции не обнаруженном. Авторы отмечают необходимость дальнейших исследований методики [19].
Во время резекции почки для бережного препарирования тканей возможно применение водного диссектора [20]. Разделение тканей происходит струей воды диаметром до 0,3 мм под высоким давлением. Basting R.F. (2000) проводили сравнение влияния водного диссектора и электрокоагулятора на ткань паренхимы почки во время парциальной нефрэктомии. Проводилось исследование паренхимы у 24 пациентов, оперированных по поводу опухолей, кист почки и нефролитиаза. По сравнению с коагуляцией водный диссектор является гораздо более щадящим методом рассечения ткани, он практически не повреждает рассекаемую паренхиму [20]. Главный недостаток методики – отсутствие всякой возможности коагуляции сосудов, даже самых мелких, поэтому применение водного диссектора при резекции почки возможно только в сочетании с другими методами гемостаза.
Биологические методики гемостаза включают в себя использование собственных биологических тканей организма, продуктов переработки тканей животных, препаратов крови и её фракций, препаратов на основе веществ, содержащихся в растениях и комбинированных препаратов.
Механические способы являются в историческом плане наиболее ранними методами остановки кровотечения из паренхиматозных органов. Принцип их действия основан на постоянном сдавлении паренхимы органа вместе с содержащимися в ней кровеносными сосудами. До настоящего времени в литературе не имеется чёткой классификации механических способов гемостаза. Среди них различают прежде всего:
- методы, основанные на применении различных компрессионных устройств
- методы остановки кровотечения с помощью кетгутовых сеток
Принцип сдавления паренхимы почки сеткой из кетгута, предложенный Tarozzi и Albarran в 1913 году, используется в урологии до настоящего времени. Распространенным является метод гемостаза по К.Т. Овнатанян., а также некоторые его модификации. Несомненным преимуществом данного способа гемостаза является отсутствие необходимости наложения гемостатических швов и связанное с этим уменьшение зоны ишемии и последующего некроза паренхимы. Недостатками метода являются техническая сложность и длительность процедуры применения кетгутовой сетки, возможность образования гематом внутри паренхимы почки из-за довольно частого недостаточного сдавления сосудов крупного диаметра, которое может потребовать повторной органоуносящей операции[2,21,29].
Лигатурные методики гемостаза широко распространены при резекции почки, как в изолированном виде, так и в комбинации с другими способами остановки кровотечения. В литературе до настоящего времени нет четкой классификации видов гемостатических швов, применяемых при резекции почки, между тем уже достаточно давно известны требования, предъявляемые к методу во время операции на почке. Шов почки должен отвечать следующим условиям:
1) обеспечивать надежную остановку кровотечения
2) создавать наилучшие условия в зоне операционной раны для регенерации ткани путем максимального уменьшения зоны некроза
3) способствовать быстрейшему восстановлению функциональной способности органа
4) содействовать профилактике послеоперационных осложнений, наиболее грозными из которых до настоящего времени остаются вторичные кровотечения [29].
Следует отметить, что до настоящего времени в литературе нет четкой классификации гемостатических швов, применяемых при резекции почки. Целесообразна, на наш взгляд, следующая их классификация:
При выполнении резекции почки наиболее распространены узловые швы. Обязательным условием их наложения является захват в шов почечной капсулы, т.к. во всех других вариантах происходит прорезывание шва. Существует несколько вариантов узловых швов на почку: простой узловой шов [38,41,44,45,46], вертикальный и горизонтальный П-образные швы [47,48], U-образный шов, двойной узловой шов и некоторые другие [21,39].
Основное достоинство простого узлового шва с захватом капсулы и ЧЛС почки – простота наложения и уменьшение время операции. J.M.Cozar (2008) опубликовали свой опыт проведения резекций почки по поводу рака . В качестве методики гемостаза авторы использовали простые узловые швы через капсулу почки и прошивание отдельных сосудов в ране. Авторы отмечают эффективность простого узлового шва и не рекомендуют применение матрацных швов из-за большой зоны ишемии, которая возникает после их наложения [44]. Simforoosh N. (2009) у 33 пациентов с резекцией почки для гемостаза применили узловые однорядные швы, в качестве прокладки использовали гемостатические клипсы. Осложнений в ближайшем послеоперационном периоде не было, что дало авторам право рекомендовать методику для широкого применения [41]. Возможно применение узлового шва в качестве дополнительного метода гемостаза – в таком случае накладываются поверхностные швы на капсулу почки. Rubinstein M. (2005) обобщили опыт 350 резекций почки. В качестве метода гемостаза использовали комбинацию оксицеллюлозы и поверхностных узловых швов на паренхиму, в качестве дополнительного метода использовали фибриновый клей и гемостатические клипсы. Осложнений методики практически не было [45].
Основные недостатки шва: обширная зона ишемии и неравномерная компрессия в глубине паренхимы почки, что может приводить к образованию внутриорганных гематом и вторичному кровотечению. L'esperance J.O. (2009) выполнили следующий эксперимент на свиньях: выполнялась резекция почки, накладывались глубокие узловые чрезпаренхиматозные однорядные швы. На фоне этого производились интраоперационная селективная артериография почки и ретроградная пиелография. Цель исследования: выявить эффективность швов в плане гемостаза и ликвидации интраоперационного повреждения ЧЛС. Всего выполнено 8 операций. После наложения швов в 2 случаях из 8 диагностировано продолжающееся кровотечение из сегментарной артерии с образованием внутриорганной гематомы. В 3 случаях из 8 диагностировано подтекание мочи за пределы ЧЛС. В четырех случаях зафиксировано сдавление соседней сегментарной артерии, что обусловило в последующем образование зоны ишемизированной ткани почки [46]. Отличными гемостатическими свойствами обладают различные П-образные швы, к тому же, они более надежны к прорезыванию. Так, Zincke H. (1995) в качестве гемостатических рекомендуют применять горизонтальные матрацные узловые швы [47]. Оригинальная методика шва была предложена Tsivian A. (2004). Суть её заключалась в следующем: на рану почки накладывалось 4-5 П-образных швов шириной 2 см, отступя 0,5 см от края резекции. Швы не затягивались. Затем между петлей этого шва накладывался глубокий узловой шов, отступя 1 см от края резекции. Подтягивая за узловой шов, П-образные завязывались, после чего завязывался и узловой шов, прорезывания и кровотечения не наблюдали. Всего по методике прооперирован 61 пациент, в основном резецировался полюс почки, средний сегмент лишь в 5 случаях [48]. Самым существенным недостатком при применении этих швов является большая зона ишемии и вторичного некроза почечной ткани [44]. Следует отметить, что впервые подобный шов описан и применен в клинике Н.В. Петровым (1971), автор отмечал его эффективность при клиновидной резекции, однако не рекомендовал применять свой шов при плоскостной резекции почки. Близким к описываемому является U-образный шов, который имеет сходные недостатки. Методика наложения двойных лигатур при резекции почки впервые предложена при её резекции М.Н. Ефенджиевым и в последующем усовершенствован Н.М. Понукалиным [21,39]. Достоинства методики: практически отсутствуют вторичные кровотечения и мочевые затеки, очень маленькая зона вторичного некроза, возможность применения при резекции среднего сегмента почки.
Таким образом, лигатурные методики гемостаза могут применяться при любых резекциях почки. Они абсолютно показаны при наличии опухоли диаметром более 4 см c преимущественно интрапаренхиматозным ростом, операциях на среднем сегменте почки, а также в случаях, когда при операции вскрывается полостная система почки. Во всех остальных случаях применение различных методик гемостаза зависит от технических возможностей и предпочтений оперирующего хирурга.
Кровотечение в хирургии является грозным осложнением ран и оперативных вмешательств. Не случайно, знание видов и способов остановки кровотечения является фундаментальным знанием в хирургии.
Кровотечения подразделяют на виды в соответствии с поврежденным сосудом и выделяют:
· Артериальное, возникающее при повреждении артерии и характеризующееся пульсирующим и струящимся истечением крови алого цвета
· Венозное, характеризующее плавным течением крови темно-красного цвета, возникающее при глубоком повреждении тканей
· Капиллярное или кровотечение алого цвета на всем протяжении раны, которое наблюдается при повреждении мелких сосудов
· Паренхиматозное, характерное для ранения печени, селезенки или легкого. При подобном кровотечении выделяется алая и темно-красная кровь одновременно на всем протяжении раны
· Смешанное, которое характеризуется сочетанием различных видов кровотечения: капиллярное и венозное, артериальное и венозное и т.д.
В зависимости от характера повреждения выделяют так же кровотечения внешние, то есть вытекающие наружу и внутренние, когда самого кровотечения не видно, а кровь истекает в брюшную полость.
Методы остановки кровотечения
Различают основные методы временной и окончательной остановки кровотечения. Временные методы остановки кровотечения- способы остановки кровотечения, которые оказывают пациенту вне медицинского учреждения в качестве первой помощи пострадавшему:
· Наложение жгута или давящей повязки
· Зажатие поврежденной артерии
· Приподнятие поврежденной конечности
В медицинском учреждении производят окончательную остановку кровотечения.
Выделяют следующие методы окончательной остановки кровотечения:
· Механическая остановка кровотечения: зажим или перевязка сосуда, тампонада раны
· Физическая, которая заключается в прикладывании льда к ране или прижигании
· Биологический метод остановки кровотечения включает переливание крови
· Химический метод остановки кровотечения заключается в применении специальных медицинских препаратов, останавливающих кровь
Умение оперативно останавливать кровотечение – это главная и ключевая компетенция любого хирурга. Наш центр хирургии располагает исключительно компетентными специалистами, как хирургами и так и медицинским персоналом клиники, способным оперативно реагировать на экстренные ситуации пациентов.
Техника операции при ранении печени - окончательный гемостаз
Достаточно трудная задача — решиться на повторное вмешательство при медленном, но продолжающемся кровотечении, что проявляется постоянным промоканием кровью выведенных наружу концов тампонов. Как повторная тампонада, так и более активная тактика (в виде попыток резекции печени, например) — как правило, бывают неудачными и заканчиваются смертью пострадавшего [Moore E.E. et al., Beal S.L. et al., Reed R.L. et al.]. В таких случаях следует пытаться выполнить целиакографию с целью определения возможного источника кровотечения и эмболизации поврежденного сосуда.
Что касается объема вмешательств непосредственно на печени, то небольшие некровоточащие раны печени глубиной до 1 см в наложении швов не нуждаются. Паренхиматозное кровотечение останавливают электрической, лазерной, плазменной или аргоновой коагуляцией, аппликацией местных гемостатиков.
Различные виды коагуляции эффективны также при повреждениях печени I и II степени по Е. Moore. Для достижения гемостаза при более глубоких ранах требуется слишком много времени и при этом образуется большая поверхность коагуляционного некроза. За исключением аргонового коагулятора, который осушивает операционное поле и является наиболее эффективным, все остальные виды энергии в значительной мере поглощаются потоком крови, что снижает их эффективность.
Эффективность местных тромбообразующих веществ (тахокомб, серджисел, спонгостан) подтверждена лишь в случаях незначительного, паренхиматозного кровотечения, склонного к самопроизвольной остановке в условиях нормокоагуляции. Однако они незаменимы при кровоточивости, вызванной гипокоагуляцией. В последнее время внимание хирургов привлечено к фибриновому клею — биологическому веществу, эффект которого основан на усилении конечной стадии свертывания крови.
В настоящее время применяются высокотехнологичные многофункциональные местные гемостатические препараты — тиссукол (двухкомпонентный фибриповый клей) и тахокомб (коллаген, покрытый высококонцентрироваиными компонентами фибринового клея и ингибитором фибринолиза — апротинином). Хирурги, имеющие опыт использования тиссукола, подчеркивают сложность его интраоперационного применения, необходимость наличия специального оборудования (нагревателя) и дополнительно обученного персонала, что нереально в экстренных ситуациях.
В связи с этим внимание хирургов привлекает препарат тахокомб. Для гемостаза кровоточащей поверхности печени применяют большие размеры стерильных и готовых к употреблению пластин тахокомба (9,5x4,5x0,5 см), запакованных в стандартные двойные герметичные оболочки, что позволяет сохранять свойства препарата до трех лет со дня его изготовления. Пластину плотно прижимают сухой марлевой салфеткой к кровоточащей поверхности на 3-4 мин и затем осторожно удаляют салфетку, избегая резких движений, в результате которых можно оторвать пластину тахокомба от поверхности печени. При отрыве пластины последняя теряет свои свойства и ее заменяют на новую.
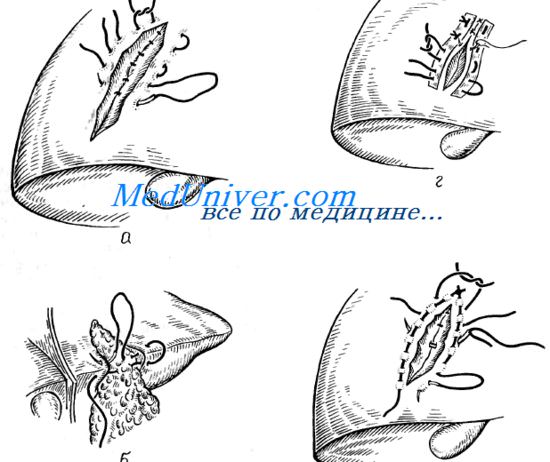
Методика ушивания раны печени
Если площадь кровоточащей поверхности больше размеров пластины тахокомба, последовательно накладывают несколько пластин в виде черепицы, перекрывая края предыдущей пластины на 2 см. Хорошие адгезивные и пластические свойства пластин тахокомба стали основанием для широкого применения этого препарата в хирургии поврежденной печени. Однако следует помнить, что возможности этого средства гемостаза ограничены паренхиматозным кровотечением.
Наложение швов на края дефекта паренхимы является самым распространеным методом гемостаза. В то же время обильное кровотечение из ран печени, с одной стороны, и рыхлость ее паренхимы, с другой, являются основными причинами неудовлетворенности хирургов результатами ушивания этих ран. Предложено множество модификаций печеночного шва. Наиболее простой заключается в наложении поверхностных узловых швов рассасывающимся материалом на большой круглой атравматический игле. Для более равномерной нагрузки на ткань печени рекомендуется предварительно обшить края дефекта непрерывным швом, а узловые швы накладывать вторым этапом, с захватом нити непрерывного шва.
Для более надежного обшивания краев можно использовать прокладки из синтетического или биологического (брюшина) материала. Затягивают швы после того, как ассистент сблизит руками края раны (разрыва) печени.
Если этого сделать не удается, необходимо использовать прядь большого сальника на сосудистой ножке. Простота методики, отсутствие побочных негативных последствий и несомненная клиническая эффективность убедительно свидетельствуют в пользу се широкого применения. Методика заключается в выкраивании пряди большого сальника на сосудистой ножке длиной не менее 20 см. Ширина определяется глубиной дефекта ткани печени и выраженностью большого сальника. Чаще всего в качестве питающей ножки используют ветви правой желудочно-сальниковой артерии.
Выкроенная прядь сальника проводится под предварительно наложенные на ткань печени узловые швы, вершина пряди фиксируется в верхнем углу раны печени, после чего швы осторожно завязывают поверх сальника, избегая чрезмерного натяжения.
Более сложные гемостатические швы в прошлом приходилось использовать при выполнении резекции поврежденного участка печени: это шов Оппеля, шов Замошина и наиболее известный шов — шов Кузнецова-Пенского. Наложение шва Кузнецова-Пенского требует специального шовного материала и специальной иглы.
В настоящее время методика гемостаза и желчестаза в таких случаях упростилась за счет изолированного лигирования сосудисто-секреторных образований и обработки паренхимы аргоновым коагулятором. Многие авторы считают, что хорошо обработанную раневую поверхность печени можно оставлять без укрытия какими-либо тканями.
Несмотря на появление новых хирургических технологий, дискуссия между сторонниками и противниками глубоких швов, захватывающих на всю глубину дефект ткани печени, не прекращается.
В. С. Дурнев и Г.А.Покровский считали достаточным наложение на глубокие раны печени поверхностных (на глубину не более 1,5-2 см) швов. В. С. Шапкин и Ж. А. Гриненко, Б. И. Альперович возражали против этого, справедливо указывая, что под швами в таких случаях образуются гематомы, склонные к нагноению. Действительно, в литературе описаны наблюдения возникновения гематом, билом с нагноением, артериовенозных и желчных фистул, гемобилии после поверхностного ушивания ран печени.
A. Robison предложил для этих целей специальный дренаж, снабженный манжетой, раздувая которую, добиваются долговременной тампонады стенок узкого раневого канала с гемостазом и желчестазом. Через две недели его легко удаляют.
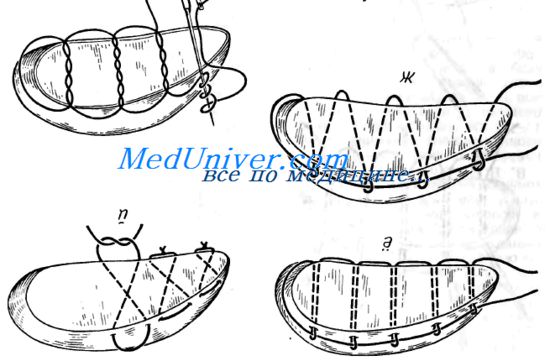
Методика ушивания раны края печени
Необходимость разработки способов хирургической обработки ран печени в значительной степени продиктована неудовлетворенностью хирургов результатами простого ушивания этих повреждений. В понятие хирургической обработки ран печени входят, по нашему мнению, не только изолированное дотирование под контролем глаза сосудисто-секреторных элементов, но и иссечение нежизнеспособных тканей, в том числе по типу атипичных резекций (debridement), а также специальные приемы для достижения поврежденных крупных сосудисто-секреторных образований (дигитоклазия).
В настоящее время изолированная обработка сосудов и желчных притоков выполняется (если состояние пострадавшего позволяет) после достижения временного гемостаза и разведения зеркалами краев. При обнаружении поврежденных портальных триад на них an mass накладывают кисетные швы из викрила на атравматической игле или металлические клипсы (скобки). Отдельные крупные структуры (сосуды, желчные протоки) перевязывают викрилом под зажимом. Оставление нежизнеспособных тканей в значительной мере ухудшает прогноз, поэтому в любом случае надо постараться их удалить.
Опыт показывает, что оценивать жизнеспособность паренхимы по внешнему виду глиссоновой капсулы весьма рискованно, и поэтому необходим визуальный контроль за состоянием паренхимы на всю глубину разрыва.
После удаления явно нежизнеспособных тканей путем их иссечения или отсечения следует приослабить турникет на печеночно-двенадцатиперстной связке и проконтролировать наличие кровоточивости оставляемой паренхимы. Отсутствие такой кровоточивости свидетельствует о грубых нарушениях кровоснабжения в этой зоне и высокой вероятности некроза. В таких случаях желательным является удаление сомнительных участков печеночной ткани, если состояние пострадавшего позволяет расширить объем вмешательства.
Опасность развития некротических и гнойно-септических осложнений при наложении или поверхностных, или глубоких швов без избирательной перевязки в глубине раны поврежденных сосудисто-секреторных образований привела к разработке методики дигитоклазии (пальцевого разделения паренхимы), у истоков которой стояли С. Chen и Т.Т. Тунг.
Суть этой методики заключается в том, что при наличии глубокой раны с массивным кровотечением ее быстро расширяют до 5-7 см при помощи электроножа или обычного скальпеля и затем, пальцами разделяя (разрывая) паренхиму по ходу раневого канала, доходят до кровоточащих сосудов и поврежденных желчных протоков. При этом возникает дополнительное кровотечение из разделенной тупым путем паренхимы, но оно несопоставимо по интенсивности с имеющимся кровотечением из крупных сосудов, поврежденных в результате ранения.
Образовавшуюся рану разводят зеркалами и под контролем зрения обрабатывают поврежденные сосудисто-секреторные образования. Применяя методику дигитоклазии, следует избирать направление разреза капсулы и направление расслоения паренхимы с таким расчетом, чтобы не лишить кровоснабжения наиболее периферийный участок паренхимы. Кроме того, при наличии раны в центральных областях печени необходимо помнить о локализации правого и левого долевых желчных протоков, чтобы не повредить их в процессе дигитоклазии.
Следует признать, что при всей эффективности этой методики, она до настоящего времени не находит широкого признания. Одним из существенных недостатков ее является усиление кровотечения в ходе выполнения дигитоклазии. Однако сторонники этого метода, обладающие большим опытом его применения, считают, что опасность такого кровотечения сильно преувеличена.
Исходя из того что традиционные методы гемостаза не приносили успеха в 100% и нередко сопровождались осложнениями, в 70-е годы XX века появились работы, в которых сообщалось о возможности резекции печени при ее повреждении [Петровский Б.В., Шапкин B.C.; Гринеко Ж.А.]. О резекциях печени сообщали М. Balasegaram и соавт., Е. Е. Moore, М. J. Hollands и соавт.. Среди сторонников этого направления наиболее последовательным был B.C. Шапкин.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

