Сплайсинг это в биологии кратко
Обновлено: 02.07.2024
Сплайсинг(от англ. splice-соединять, сращивать) - удаление из молекулы РНК нитронов (участков РНК, которые практически не несут генетической информации) и соединение оставшихся участков, несущих генетическую информацию (экзонов), в одну молекулу. Катализируется сплайсосомой – комплексом белков и РНК. (по презентации)
94% человеческих генов подвергаются альтернативному сплайсингу, причем в разных тканях производятся разные наборы белков. Благодаря этому разнообразие белков в организме млекопитающих значительно выше, чем у низших животных, хотя количество генов у тех и других примерно одинаково.
В остальных 6% генов Ч. просто нет интронов! Интроны – не просто разделители экзонов, а регуляторные участки, в которых зашифрованы инструкции по считыванию экзонов!
Если сплайсинг – еще одна возможность регуляции синтеза белков, то перетасовка экзонов при альтернативном сплайсинге (чаще добавление новых участков к старым) для выработки новых белковых продуктов – важнейшее приобретение в ходе эволюции эукариот

Сплайсинг - один из этапов образования функционально активных молекул РНК (процессинг РНК) из их предшественников[1], который осуществляется после завершения транскрипции (синтез РНК на ДНК-матрице). В результате удаления каждого интрона[2] происходит разрыв двух фосфодиэфирных связей с последующим образованием одной новой.
Механизмы сплайсинга у различных классов РНК различаются между собой. Для всех них характерна точность удаления интронов и соединения экзонов[3].
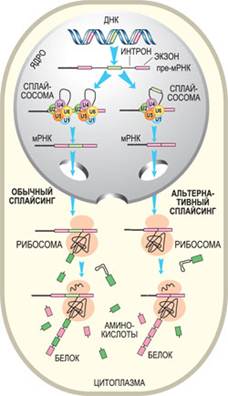
Альтернативный сплайсинг Википедия — процесс, позволяющий одному гену производить несколько мРНК и, соответственно, белков. Большинство генов в эукариотических геномах содержат экзоны и интроны. После транскрипции в процессе сплайсинга интроны удаляются из пре-мРНК. А вот экзон может включаться (или нет) в состав конечного транскрипта. Таким образом, с помощью альтернативного сплайсинга можно получить множество транскриптов, а, следовательно, и белков. Объединение различных сайтов сплайсинга позволяет индивидуальным генам экспрессировать множество мРНК, которые кодируют белки, порой, с антагонистическими функциями. Экзон одного варианта сплайсинга может оказаться интроном в альтернативном пути. Разные варианты сплайсинга могут приводить к образованию разных изоформ одного и того же белка. Например, ген тропонина состоит из 18 экзонов и кодирует многочисленные изоформы этого мышечного белка. Разные изоформы тропонина образуются в разных тканях и на определенных стадиях их развития.

Сущность альтернативного сплайсинга заключается в том, что в результате посттранскрипционного процессинга предшественника мРНК, из которого в результате сплайсинга вырезаются некодирующие последовательности нуклеотидов, соответствующие интронам транскрибированного гена, образуются зрелые мРНК, различающиеся по своей первичной структуре. В результате в разных клетках из одного и того же предшественника получаются молекулы зрелых мРНК, которые объединяют в различных комбинациях последовательности экзонов транскрибированного гена.

Историческое введение:
Сплайсинг(от англ. splice-соединять, сращивать) - удаление из молекулы РНК нитронов (участков РНК, которые практически не несут генетической информации) и соединение оставшихся участков, несущих генетическую информацию (экзонов), в одну молекулу. Катализируется сплайсосомой – комплексом белков и РНК. (по презентации)
94% человеческих генов подвергаются альтернативному сплайсингу, причем в разных тканях производятся разные наборы белков. Благодаря этому разнообразие белков в организме млекопитающих значительно выше, чем у низших животных, хотя количество генов у тех и других примерно одинаково.
В остальных 6% генов Ч. просто нет интронов! Интроны – не просто разделители экзонов, а регуляторные участки, в которых зашифрованы инструкции по считыванию экзонов!
Если сплайсинг – еще одна возможность регуляции синтеза белков, то перетасовка экзонов при альтернативном сплайсинге (чаще добавление новых участков к старым) для выработки новых белковых продуктов – важнейшее приобретение в ходе эволюции эукариот

Сплайсинг - один из этапов образования функционально активных молекул РНК (процессинг РНК) из их предшественников[1], который осуществляется после завершения транскрипции (синтез РНК на ДНК-матрице). В результате удаления каждого интрона[2] происходит разрыв двух фосфодиэфирных связей с последующим образованием одной новой.
Механизмы сплайсинга у различных классов РНК различаются между собой. Для всех них характерна точность удаления интронов и соединения экзонов[3].

Альтернативный сплайсинг Википедия — процесс, позволяющий одному гену производить несколько мРНК и, соответственно, белков. Большинство генов в эукариотических геномах содержат экзоны и интроны. После транскрипции в процессе сплайсинга интроны удаляются из пре-мРНК. А вот экзон может включаться (или нет) в состав конечного транскрипта. Таким образом, с помощью альтернативного сплайсинга можно получить множество транскриптов, а, следовательно, и белков. Объединение различных сайтов сплайсинга позволяет индивидуальным генам экспрессировать множество мРНК, которые кодируют белки, порой, с антагонистическими функциями. Экзон одного варианта сплайсинга может оказаться интроном в альтернативном пути. Разные варианты сплайсинга могут приводить к образованию разных изоформ одного и того же белка. Например, ген тропонина состоит из 18 экзонов и кодирует многочисленные изоформы этого мышечного белка. Разные изоформы тропонина образуются в разных тканях и на определенных стадиях их развития.
Сущность альтернативного сплайсинга заключается в том, что в результате посттранскрипционного процессинга предшественника мРНК, из которого в результате сплайсинга вырезаются некодирующие последовательности нуклеотидов, соответствующие интронам транскрибированного гена, образуются зрелые мРНК, различающиеся по своей первичной структуре. В результате в разных клетках из одного и того же предшественника получаются молекулы зрелых мРНК, которые объединяют в различных комбинациях последовательности экзонов транскрибированного гена.
Многие гены состоят из экзонов - кодирующие участки и интронов – некодирующие участки. При транскрипции с гена считывается РНК несущая как экзоны, так и интроны. В процессе сплайсинга интроны вырезаются, а экзоны сшиваясь образуют зрелую РНК.
Характеристика экзонов и интронов некоторых генов.
Сплайсосомы
У эукариот в большинстве кодирующих белки РНК интроны вырезаются в сплайсосомах - комплексах, состоящих из пяти малых ядерных нуклеопротеинов (snRNP, или SNURPs - снурпс). Интроны содержат последовательности, необходимые для вырезания - 3'-сайт (акцепторный), 5'-сайт (донорный) и бранч-сайт (см. рис.2). РНК в snRNA взаимодействует с этими сайтами, способствуя вырезанию интронов.
рис.2 Консервативные последовательности в экзонах и интронах необходимые для сплайсинга.
Обнаружено два типа сплайсосом - большие и малые, состоящие из разных snRNP.
Большие сплайсосомы состоят из U1, U2, U4, U5 и U6 snRNP; транскрипция U1-U5 РНК осуществляется РНК-полимеразой II, а U6 - РНК полимеразой III. Вырезают интроны имеющие GU на 5'-сайте и AG на 3'-сайте. U1 связываются с 5'-сайтом, U2 связываются с бранч-сайтом и U6. U4 ингибирует U6, инактивируя сплайсосому. U5 связывает U1 и U2 при образовании 'лассо'. При активации U6, U1 перемещается и связывает U2. U2-U6 формируют активный католитический комплекс (см. рис.3).
рис.3 Сплайсосома и взаимодействие ее компонентов с экзонами и интронами РНК.
Малые сплайсосомы. Сплайсируют РНК, содержащие AU 3'- и AC 5'-концы интронов. Cостоят из U11, U12, U4atac, U6atac и U5 - одинакового для больших и малых сплайсосом.
рис.4 Механизм удаления интронов.
Малые РНК. sРНК 103-105 копий на клетку, обогащены урацилом U1, U2. 100-300н, кодируются в ядре, но работают как в ядре (small nuclear - SN), так и в цитоплазме (small cytoplasmic - SC)
SNURPS - РНП (рибонуклеопротеидные комплексы) в ядре. snРНК входят в состав РНП, участвующих в полиаденилированиии и сплайсинге | SCURPS - РНП в цитоплазме, входят в состав информосом | U4 в комплексах, участвующих в полиаденилировании (при красной волчанке (аутоимунном заболевании) вырабатываются антитела к белкам комплекса с U4 нет полиаденилирования и сплайсинга) | Гистоновая mРНК не полиаденилируется т.к sРНКU7, комплементарная 3'-концу гистоновой mРНК, защищает ее от полиаденилирования.
Сплайсинг может иметь позитивную и негативную регуляцию. При позитивной регуляции из первичного транскрипта вырезается интрон при действии белка активатора. При негативной первичный транскрипт не подвергается сплайсингу при действии
белка репрессора.
Транс-сплайсинг
Транс-сплайсинг - форма
сплайсинга, при которой соединяются РНК разных транскриптов.
Альтернативный сплайсинг
mРНК кальцитонинового гена у млекопитающих (крыса)
Во всех клетках есть кальцитониновый ген, но в клетках щитовидной железы он экспрессируется в виде гормона кальцитонина, а в клетках гипофиза - нейропептида CGRP (пептида, имеющего отношение к гену кальцитонина). Ген один, а белки получаются разные в результате сплайсинга mРНК и процессинга полипептидов. В клетках других тканей этот ген не экспрессируется.
Сплайсинг осуществляется белковыми комплексами – сплайсосомами-ферменты, вырезающие и сшивающие участки про-mРНК, белки, придающие про-mРНК нужную конформацию, sPНК. Сплайсосома связана с ферментами полиаденилирования.
рис. Схема образования различных мРНК из
одного тропомиозинового гена в различных клетках.
Автосплайсинг
Автосплайсинг - вид сплайсинга, когда интроны кодируют рибозимы - РНК с каталитической активностью, выполняющие роль сплайсосомы. Имеются три группы интронов кодирующих рибозимы Group I, II и III. Group II и III выполняют роль сплайсосомы без привлечения
других белков.
Автосплайсинг открыт Томасом Чеком (США) в 1982 году. Он работал с инфузорией
Tetrаchymenа thermophyla
. У этой инфузории образуется 35S про-rРНК длиной 6400 нуклеотидов. Без участия дополнительных соединений белковой природы из этой про-rРНК вырезается внутренний участок длиной в 414 нуклеотида. Два экзона сшиваются с образованием 26S rРНК. Единственное требование - определенная концентрация ионов магния. Про-rРНК имеет третичную структуру и обладает каталитичекой активностью. Впервые было показано, что каталитической активностью
обладают не только белки.
Small nuclear RNAs (snRNAs), ranging in size from about 80 to 350 nucleotides, are ubiquitous components of eukaryotic cells. The U (uridine-rich) family of snRNAs are thought to be important for RNA splicing and have been highly conserved in evolution. They are associated with specific polypeptides, forming small nuclear ribonucleoprotein complexes (snRNPs). These are often targets of the autoimmune disorder systemic lupus erythematosus. The polypeptide associated with U1 snRNA appears to be unique (Wooley et al., 1983). Multigene families for human U1, U2, U3, U4 and U6 snRNAs have been demonstrated. Transcription of U1-U5 RNAs is accomplished by RNA polymerase II, whereas U6 snRNA is thought to be transcribed by RNA polymerase III. Kunkel and Pederson (1988) studied the upstream regulatory elements for the human U6 RNA gene and found a marked similarity to the proximal control elements of U1 and U2 snRNA genes, despite the transcription by different polymerases. Most of the human genes complementary to these snRNAs are pseudogenes, which are dispersed in the genome. Although most of the U1 genes are on chromosome 1, they probably are separated by intergenic spacer regions larger than 15 kb, because none of the recombinant phages isolated to date contains more than one U1 gene. By way of contrast, U2 snRNA genes are organized as a nearly perfect tandem array of 10 to 20 copies per haploid genome (Van Arsdell and Weiner, 1984). Bostock et al. (1984) concluded that the genes for human U1 snRNA are clustered on the short arm of chromosome 1. By somatic cell hybrid studies, Naylor et al. (1984) found that RNU1 segregated with PEPC (170000) and AK2 (103020), chromosome 1 markers. By in situ hybridization, they showed that most of the grains were concentrated in band 1p36.3. By in situ hybridization, Lindgren et al. (1985) found that the U1 snRNA pseudogenes (called class I) are coded in a cluster in 1q12-q22, separate from the true genes (in about 30 copies) in 1p36. Bernstein et al. (1985) presented evidence in support of the idea that the true U1 genes were derived by gene amplification and transposition from a more ancient family of U1 genes (represented now by class I U1 pseudogenes). The clustering of both U1 true genes and pseudogenes and the conservation of at least 44 kb of DNA flanking the U1 coding region in a large fraction of the 30 true U1 genes
are explained by gene amplification.
Pseudogenes for U1 snRNA outnumber the true genes by 15- to 30-fold. Some of the pseudogenes have no flanking homology to the true genes, but others, the class I pseudogenes, share several kilobases of flanking homology. Lindgren et al. (1985) noted that the site of the U1 pseudogenes corresponds to a site of chromosomal modification by adenovirus-12. They postulated that class I U2 pseudogenes may be affected by the virus because they retain flanking regulatory sequences.
СПЛА́ЙСИНГ (от англ. splicing – соединение, сращивание), образование функционально активных молекул РНК из их предшественников путём удаления отдельных фрагментов; тип процессинга . После завершения транскрипции С. подвергаются предшественники практически всех матричных РНК (пре-мРНК), а также некоторых транспортных (пре-тРНК) и рибосомных (пре-рРНК) РНК-эукариот; С. также имеет место при созревании пре-тРНК (возможно, и пре-рРНК) у архебактерий и пре-мРНК некоторых бактериофагов (напр., фага Т-4).

Обзор
Splice (англ.) — соединение двух отрезков верёвки или каната путём сплетения их концов (морской термин)
Автор
Редакторы
Введение
Сплайсинг (от англ. to splice — сшивать, соединять) — это процесс дозревания молекул, в результате которого из предшественника удаляется внутренняя часть с последующим лигированием (т. е. образованием ковалентной связи) фланкирующих последовательностей (т. е. тех частей молекулы, что примыкали к концам удалённой внутренней части).

Рисунок 1. Схематическое строение основных типов интеинов. Сверху — Классический интеин, содержащий эндонуклеазный домен. Снизу — Мини-интеин. Консервативные аминокислотные остатки, необходимые для сплайсинга, обозначены однобуквенными аббревиатурами (один остаток с N-конца интеина и триада остатков — на стыке с C-конца и C-экстеина).
Структура интеинов
Эндонуклеазный и сплайсинговый регионы образуют в молекуле интеина два пространственно разделенных домена. Сплайсинговый домен образуется N- и С-концевыми частями интеина. Он имеет характерную подковообразную форму. Концы интеина жёстко зафиксированы друг напротив друга в пространстве, и по сути формируют активный центр (АЦ), очень похожий на АЦ трипсина или любой другой сериновой протеазы. Оба конца интеина, по которым происходит разрезание, находятся около АЦ (рис. 2).

Рисунок 2. Пространственная структура интеина (мини-интеин Mxe GyrA). Сближенные концы интеина обозначены квадратом. Изображение получено из PDB-структуры 1AM2.
Современные представления о механизме белкового сплайсинга

Рисунок 3. Механизм белкового сплайсинга.
Событием, запускающим белковый сплайсинг, является автокаталитический N–O или N–S-сдвиг (первый аминокислотный остаток на N-конце интеина Ser или Cys, соответственно) на N-концевом сайте сплайсинга (шаг 1). В результате образуется высокореакционная эфирная или тиоэфирная связь.
С точки зрения химии, N–O/N–S-сдвиг не является энергетически выгодным процессом, поскольку в результате реакции происходит разрыв амидной (пептидной) связи и образуется высокоэнергетическая эфирная/тиоэфирная связь. Поэтому этот процесс должен катализироваться. Действительно, протекание реакции разрыва пептидной связи на N-конце облегчается как минимум двумя факторами. Во-первых, процесс катализируется самим сплайсинговым доменом интеина. Во-вторых, на эффективность N-концевого расщепления определенное влияние оказывают экстеины. Показано, что у некоторых интеинов пептидная связь, связывающая N-экстеин и первую аминокислоту интеина, находится в редкой и не характерной для белков цис-конформации. Поскольку такая связь энергетически невыгодна, ее наличие провоцирует протекание N–О или N–S сдвига, т. е. инициирует сплайсинг.
На втором этапе белкового сплайсинга происходит нуклеофильная атака образовавшейся эфирной связи OH- или SH-группой первого остатка С-экстеина. В результате происходит реакция трансэтерификации, т. е. перенос Ν-концевого экстеина на боковую группу первого остатка С-экстеина (шаг 2). В результате образуется разветвленное промежуточное соединение (те самые белки с двумя N-концами, с помощью изучения которых был и предложен данный механизм сплайсинга). Такая перестановка приводит к смещению зарядов, что в свою очередь, индуцирует циклизацию боковой цепи Asn на С-конце интеина (шаг 3).
Циклизация боковой группы Asn приводит к разрыву пептидной связи между интеином и С-экстеином — разветвленная структура распадается на свободный интеин и лигированные экстеины, связанные друг с другом эфирной связью (шаг 3). Последний шаг сплайсинга белка происходит спонтанно (шаги 4а и 4б).

Рисунок 4. Механизм транс-сплайсинга
Эндонуклеазная активность интеинов
Следующей удивительной особенностью интеинов (правда, не всех) является их эндонуклеазная активность. Интеин обеспечивает (с определенными ограничениями) распространение своего гена в геноме клетки. Такой процесс, как мы уже говорили, и называется хоумингом интеинов. Другими словами, интеин-белок может амплифицировать (множить) количество своих генов в клетке. Также за счет этого свойства он может обеспечивать передачу интеинового гена другим особям данного вида или передавать другим видам (т. н. горизонтальный и вертикальный перенос соответственно). Причем эволюционный анализ распространения разных интеинов (а их открыто больше 1000, причем и у прокариот, и у низших эукариот) свидетельствует, что интеины распространяются довольно активно, и притом, оказавшись в разных видах, могут мутировать и менять последовательность. В общем, интеины в данном случае ведут себя подобно транспозонам или даже примитивным вирусам (если такое в принципе можно сказать про белки). Хотя. ряд вирусов также несет в себе интеины. Например открытый недавно гигантский Мими-вирус имеет интеин (APMV Pol) в гене ДНК-полимеразы. Но об этом давайте поговорим в другой раз.
Механизм хоуминга схематически показан на рис. 5 [4]. На самом деле, хоуминг — это не такая уж экзотика. Хоуминг-эндонуклеазы были известны еще до открытия интеинов. Это большой класс сайт-специфических ДНКаз, которые часто кодируются мобильными генетическими элементами.

Использование интеинов в биотехнологии
Очистка рекомбинантных белков
После открытия феномена белкового сплайсинга внимание исследователей сразу привлек факт самодостаточности интеина и точности его самовырезания. Т. е., если пришить интеин на уровне гена к интересующему нас белку (белок-Х), то теоретически мы сможем экспрессировать слитый белок (интеин–белок-Х), который при определенных условиях разрежется (интеин + белок-Х). Если же вставить интеин между двумя белками (белок-Х–интеин–белок-Y), то в результате можно получить сшитый двойной белок (белок-Х–белок-Y). Логичным является вопрос: а можно ли использовать для этих целей искусственный интеин с аффинной меткой (*–интеин)? Это бы позволило очистить полученный продукт (*–интеин–белок-Х), а потом отделить от белка-Х его метку (*–интеин). В результате мы получили бы целевой белок без каких-либо дополнительных модификаций. В целом интеин-опосредованная очистка предлагает все преимущества аффинной хроматографии (быстрая и эффективная очистка меченного белка), позволяя обойти главный недостаток этого метода — необходимость точного и стопроцентного отщепления аффинной метки от уже чистого препарата.
Тщательное исследование показало, что это действительно возможно. Сейчас созданы несколько систем на основе разных интеинов, которые несут His-tag, хитин-связывающий домен бактерий (CBD) и другие классические аффинные метки. Ряд из них уже коммерчески доступены (например системы IMPACT, IMPACT-СΝ, TWIN-IMPACT фирмы NEB). Аналогичные системы создаются и у нас [7], [8]. Потенциал таких технологий огромен — в первую очередь потому, что позволяет упростить очистку рекомбинантного белка до одного этапа (против 4–5 этапов на ионно-обменных носителях, какие используются в многих фармацевтических производствах) и не требует изменений самого целевого белка (обязательных при использовании традиционных аффинных меток, которые внедряются в сам белок).
Использование белкового сплайсинга для создания биосенсоров
Циклизация ферментов
Экспрессия токсичных для клетки продуктов
Часто эукариотические белки, экспрессируемые в клетках прокариот, убивают организм-продуцент. Это явление называется токсичностью. Из-за неё ряд практически важных белков (например, протеазы) в достаточных количествах наработать в бактериях не удается. Использование систем экспрессии на основе интеинов может решить эту проблему. Токсичные для клетки белки можно нарабатывать в виде неактивных химерных предшественников, слитых с интеинами. Последние нарушают структуру продукта и не дают ему активироваться. После наработки такие химерные белки очищаются и активируются путем индукции самоудаления интеина из их структуры.
Заключение
Сказать по правде, об интеинах и белковом сплайсинге я могу писать много и увлеченно. И особенно это относится к возможным функциям интеинов в клетке. О том, что дают интеины клеткам, что с ними происходит после сплайсинга, как часто происходит явление сплайсинга или хоуминга — до сих пор не известно. С одной стороны, это дает широкое поле для фантазии. Но с другой, к сожалению, публиковать непроверенные фантазии для естествоиспытателя — дурной тон. Однако бесспорно одно — явление белкового сплайсинга дает еще бóльшую гибкость и приспособляемость организмам, поскольку позволяет уже пост-трансляционно изменять продукт гена (или генов). Мы видим, что к известным, и без того изощрённым и многогранным, механизмам живой клетки добавляется еще один. И по всей вероятности — далеко не последний.
Словарик
Читайте также:

