Сложные белки это кратко
Обновлено: 02.07.2024
Белки являются сложными органическими соединениями или биополимерами, содержащих в составе водород, углерод, азот и кислород, а в редких случаях — серу.
Мономерами белков являются аминокислоты.
В жизни любого организма белки играет важную роль (и в клетке тоже). При неисчерпаемом разнообразии белков, им характерна определенная специфичность.
Белки и нуклеиновые кислоты — материальная база всего существующего богатства организмов окружающей среды. От сухой массы клетки их доля может составлять от 50 до 80%.
Каково строение молекулы белка?
Молекулы белков — это длинные цепи, которые состоят из 50-1500 остатков аминокислот. Между собой они соединены прочной ковалентно-углеродной (пептидной) связью. Как результат — образование первичной структуры белка или полипептидной цепи.
Молекула белка представляет собой полипептид с молекулярной массой от 5 до 150 тысяч (в некоторых случаях даже больше).
В составе простых белков присутствуют только аминокислоты. Сложные белки помимо аминокислот могут содержать нуклеиновые кислоты (нуклеопротеиды), липиды (липопротеиды), окрашенные химические соединения (хромопротеиды), углеводы (гликопротеиды) и др.
Химические, функциональные и морфологические свойства клетки определяются специфическими белками, которые в ней присутствуют.
Набор аминокислот, их количество и последовательность расположения в полипептидной цепи — формирующие составляющие специфичность белка.
Если в составе белковой молекулы заменить одну аминокислоту, или поменять последовательность расположения аминокислот, то в результате может произойти изменение функций белка в клетке. Все это и является причиной большого разнообразия строения белка (белковой молекулы первичной структуры).
Становится понятным, почему живой организм для выполнения своих функций использует особенные виды белков. В этом отношении его возможности являются неограниченными.
Свойства белков определяются также и пространственным расположением полипептидных цепей. Полипептидные цепи в живой клетке являются скрученными или согнутыми, для них характерная вторичная или третичная структура.
Спирально закрученная белковая цепочка — это вторичная структура. Удержание витков спирали осуществляется за счет водородных связей, которые образуются между CO- и NH-группами, расположенными на соседних витках.
Дальнейшее закручивание спирали приводит к специфической конфигурации каждого белка, то есть — к третичной структуре. Ее образование происходит за счет связей между белковыми радикалами аминокислотных остатков. Это связи:
- ковалентная дисульфидная (S- S-связь) между остатками цистеина;
- водородная;
- ионная;
- гидрофобные взаимодействия.
Гидрофобные взаимодействия в количественном соотношении можно считать наиболее важными. Они появляются в результате того, что неполярные боковые цепи аминокислот пытаются объединиться друг с другом без смешения с водной средой. При этом происходит свертывание белка таким образом, что его гидрофобные боковые цепи прячутся внутрь молекулы: так они получают защиту от воды. Наружу выставлены, при этом, боковые гидрофильные цепи.
Есть определенные специфичные для любого белка моменты:
- количество молекул аминокислот с гидрофобными радикалами;
- количество молекул цистеина;
- характер их взаиморасположения в полипептидной цепи.
Сохранение определенной формы молекулы обеспечивает взаимное расположение групп атомов, необходимое для проявления активности белка в качестве катализатора, его гормональные функции и др. По этой причине стойкость макромолекул не является случайным свойством, а важный и необходимый способ стабилизации организма.
Проявление биологической активности белка характерно только при наличии третичной структуры. Замена даже одной аминокислоты в полипептидной цепи приводит к изменениям в конфигурации белка, а также к снижению его биологической активности и даже исчезновению.
В некоторых случаях возможно объединение в единый комплекс двух, трех и более белковых молекул с третичной структурой. В итоге получаем четвертичную структуру белка.
Пример четвертичной структуры белка — гемоглобин. Он состоит из четырех субъединиц и небелковой части (гема). Только в такой форме он может выполнять свои функции.
Белковые субъединицы в четвертичной структуре не имеют химической связи. Но сама структура при этом довольно крепкая за счет действия слабых межмолекулярных сил.
Третичная и четвертичная структуры могут меняться в результате разрыва водородных и ионных связей. Это происходит под влиянием различных физических и химических факторов:
- обработки щелочами, кислотами, ацетоном, спиртом;
- высокой температуры;
- давления и др.
Денатурация — это нарушение естественной или нативной белковой структуры.
Денатурация приводит к снижению растворимости белка, изменению формы и размеров молекул, утрате ферментативной активности и т.д. При этом, процесс денатурации является обратимым: при возвращении нормальных условий происходит непроизвольное обновление естественной (природной) структуры белка. Этот процесс получил название ренатурации.
Первичная белковая структура определяет особенности строения белка и функционирование белковой макромолекулы. От строения перейдем к функциям белков.
Функции белков в клетке
Выделяют как минимум 3 основных функции белка в клетке:
- Строительная функция белков или пластическая. Одна из важнейших функций, так как белки являются составными компонентами клеточных мембран и органелл. В основном из белка состоят стенки кровеносных сосудов, сухожилия, хрящи высших животных.
- Двигательная. Ее обеспечивают особенные сократительные белки, за счет которых приходят в движение жгутики и реснички, перемещение хромосом в ходе деления клеток, сокращение мускулатуры, движение органов растений, а также изменения положений разнообразных структур организма в пространстве.
- Транспортная. Эта функция обеспечивается способностью белков к связыванию и переносу с течением крови химических соединений.
Теперь пройдемся по другим функциям белков кратко.
Белок крови гемоглобин осуществляет перенос кислорода из легких в клетки других органов и тканей. В мышцах такую функцию выполняет миоглобин.
Белки сыворотки крови осуществляют перенос липидов и жирных кислот, а также различных биологически активных веществ.
Говорить о белках и их функциях невозможно, не отметив защитную функцию белков. Клетка способна вырабатывать особые белки — иммуноглобулины. Это происходит, когда в нее проникают различные чужеродные вещества вроде антигенов-белков или высокомолекулярных полисахаридов бактерий, вирусов. Иммуноглобулины или антитела устраняют чужеродные вещества и обеспечивают иммунологическую защиту организма.
Функционирование иммунной системы организма осуществляется благодаря распознаванию антигенов антигенным детерминантом (характерным участком их молекул). Таким образом чужеродные вещества связываются и обеззараживаются.
Внешняя защитная функция может выполняться также белками, которые являются токсичными для других организмов. К примеру, белок змей.
Стоит выделить и сигнальную функцию белков. Молекулы белков, способные к изменению третичной структуры в ответ на действия факторов окружающей среды, встроены в поверхность клеточной мембраны. Таким образом осуществляется восприятие сигналов из внешней среды и передача команд в клетку.
Есть еще регуляторная функция, которая присуща белкам-гормонам, влияющим на обмен веществ. Гормоны поддерживают постоянную концентрацию веществ в крови, а также принимают участие в росте, размножении и прочих жизненно важных процессов.
Инсулин — самый известный гормон, отвечающий за снижение уровня сахара в крови. При недостатке инсулина уровень сахара в крови повышается, что приводит к возникновению сахарного диабета. Разнообразные белки-ферменты также выступают в роли главных регуляторов биохимических процессов в организме (каталитическая функция).
Белки — энергетический материал. В результате расщепления 1 грамма белка до конечных продуктов происходит выделение 17,6 кДж энергии, которая используется в большинстве жизненно важных процессов в клетке.
Функции белков в таблице:

Разобравшись со строением и функциями белков, переходим к ферментам.
Ферменты и их роль в клетке
Ферменты или энзимы — это особые белки, которые присутствуют в любом организме и выполняют функцию биологических катализаторов.
Протекание химических реакций в живой клетке зависит от умеренной температуры, нормального давления и нейтральной среды. Такие условия обеспечивают довольно медленное течение реакций синтеза или распада веществ в клетке. Однако именно ферменты ускоряют реакции путем снижения энергии активации, при этом не происходит изменений их общего результата. Чтобы придать молекулам реакционную способность, в случае наличия ферментов необходимо гораздо меньше энергии.
При прямом или косвенном участии ферментов протекают все процессы в живом организме.
Составляющие компоненты пищи — белки, углеводы, липиды и др. — под влиянием ферментов расщепляются до простейших соединений. Позже из них синтезируются новые, присущие данному виду макромолекулы. В случае нарушения образования и активности ферментов возникают тяжелые заболевания.
Ферментативный катализ протекает в соответствии с теми же законами, что и неферментативный катализ в химической промышленности. Но у ферментативного катализа есть и определенные отличия. Ему характерная высокая степень специфичности — фермент катализирует только одну реакцию или действует в отношении только одного типа связи.
Все это обеспечивает регулирование жизненно важных процессов, которые происходят в клетке и организме: фотосинтеза, дыхания, пищеварения и др.
Только одно вещество катализирует расщепление фермент уреаза. Это вещество — мочевина. При этом, фермент не действует каталитически на структурно родственные соединения.
Теория активного центра — важный момент для понимания того, каков механизм действия ферментов с характерной им высокой специфичностью. Согласно этой теории, молекула фермента содержит один или несколько участков, где катализ осуществляется благодаря тесному (во множестве мест) контакту между молекулами фермента и субстрата (специфического вещества). Активным центром выступает функциональная группа (например, OH — группа аминокислоты серина) или отдельная аминокислота.
Действие катализатора нуждается в объединении нескольких аминокислотных остатков, которые располагаются в определенной последовательности. В среднем требуется от 3 до 12 остатков.
Формирование активного центра может происходить также в результате связи ферментов с ионами металлов, витаминами и прочими соединениями небелковой природы. Это коферменты или кофакторы.
Форма активного центра и его химическое строение таковы, что подразумевают связь только с определенными субстратами за счет их идеального соответствия друг другу — взаимодополняемости или комплементарности.
Другие аминокислотные остатки обеспечивают большой молекуле фермента определенную глобулярную форму — она нужна для эффективной работы самого центра.
Вокруг большой молекулы фермента образуется сильное электрическое поле. Это поле обеспечивает ориентацию молекул субстрата и их ассиметричная форма. Происходит ослабевание химических связей, и начальная затрата энергии на катализируемую реакцию сокращается. При этом, скорость реакции увеличивается.
За одну минуту одна молекула фермента каталазы расщепляет свыше 5 млн. молекул перекиси водорода, возникающая при окислении в организме различных соединений.
Наблюдается изменение конфигурации активного центра некоторых ферментов в присутствии субстрата. Чтобы обеспечить наибольшую каталитическую активность, этот фермент специально ориентирует свои функциональные группы.
При присоединении молекул субстрата к ферменту, в определенных пределах наблюдается изменение их конфигурации. Это позволяет увеличить реакционную способность функциональных групп центра. Распад комплекса фермента и субстрата происходит на заключительном этапе химической реакции — с образованием конечных продуктов и свободного фермента. Происходит освобождение активного центра, в результате чего он снова может принимать новые молекулы субстрата.
Множество факторов определяют скорость реакций с участием ферментов. К ним относятся:
- концентрация фермента;
- природа субстрата;
- давление;
- температура;
- кислотность среды;
- наличие ингибиторов и др.
Скорость биохимических реакций минимальна при температуре около 0 по Цельсию. Такое свойство широко применяется в различных отраслях, в частности — в медицине и сельском хозяйстве.
Для снижения интенсивности биохимических реакций и продления жизни, органы человека, планируемые к пересадке (почки, селезенка, печень, сердце), охлаждают. Быстрое замораживание пищевых продуктов предотвращает размножение микроорганизмов и инактивирует ферменты, в результате чего пищевые продукты не разлагаются.
Эта статья поможет вам разобраться в свойствах и функциях белков (функции белков представлены в таблице).
Сло́жные белки́ (протеиды, холопротеины) — двухкомпонентные белки, в которых помимо пептидных цепей (простого белка) содержится компонент неаминокислотной природы — простетическая группа. При гидролизе сложных белков, кроме свободных аминокислот, освобождается небелковая часть или продукты её распада.
В качестве простетической группы могут выступать различные органические (липиды, углеводы) и неорганические (металлы) вещества.
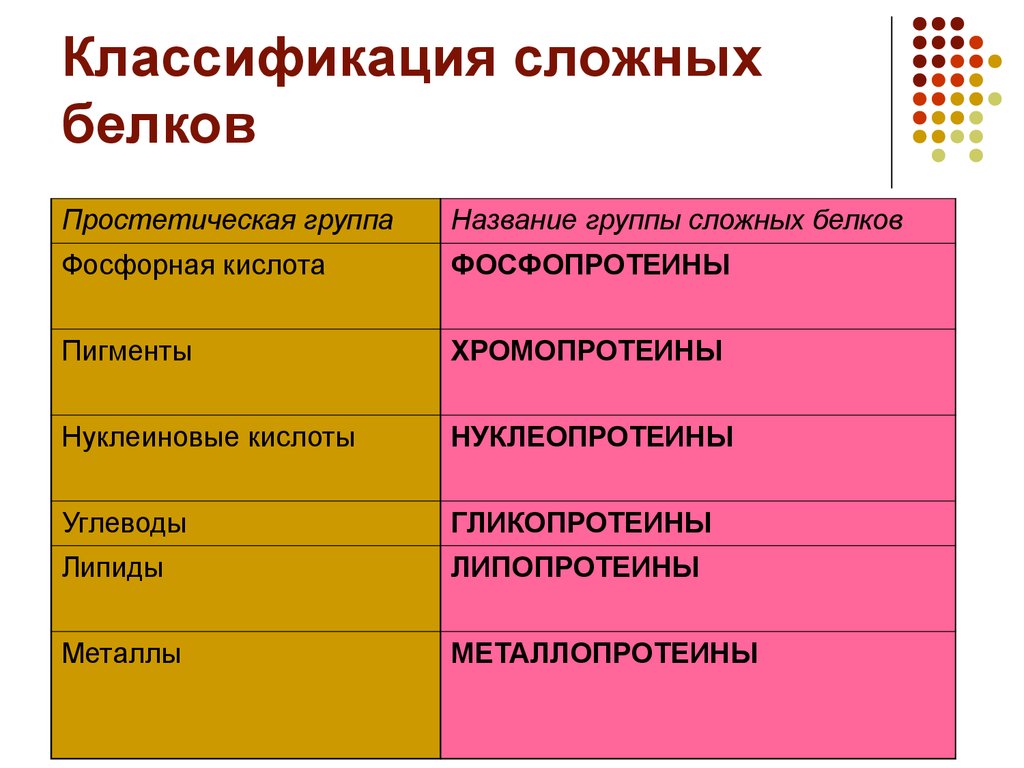
Среди сложных белков выделяют следующие основные классы: гликопротеины, липопротеины, хромопротеины, нуклеопротеины, фосфопротеины и металлопротеины.
Wikimedia Foundation . 2010 .
Смотреть что такое "Сложные белки" в других словарях:
сложные белки — (холопротеины) – белки, содержащие компонент небелковой природы – простетическую группу … Краткий словарь биохимических терминов
сложные белки — протеиды … Cловарь химических синонимов I
белки — 1. БЕЛКИ, ов; мн. (ед. белок, лка; м.). 1. Выпуклые непрозрачные оболочки глаз белого цвета. Б. у неё голубоватые. 2. Разг. сниж. О глазах. Вращать белками. ◁ Белочный, ая, ое. Б ые оболочки глаз. 2. БЕЛКИ, ов; мн. (ед. белок, лка; м.). Сложные… … Энциклопедический словарь
БЕЛКИ — природные высокомолекулярные органические соединения, построенные из остатков 20 аминокислот, которые соединены пептидными связями в длинные цепи. Молекулярная масса от нескольких тысяч до нескольких миллионов. В зависимости от формы белковой… … Большой Энциклопедический словарь
Белки — У этого термина существуют и другие значения, см. Белки (значения). Белки (протеины, полипептиды[1]) высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа аминокислот. В живых организмах… … Википедия
БЕЛКИ — (протеины), класс сложных азотсодержащих соединений, наиболее характерных и важных (наряду с нуклеиновыми кислотами) компонентов живого вещества. Белки выполняют многочисленные и разнообразные функции. Большинство белков ферменты, катализирующие… … Энциклопедия Кольера
Белки — I Белки (протеины) органические соединения, структурной основой которых служит полипептидная цепь, состоящая из аминокислотных остатков, соединенных пептидными связями ( СО NH2 ) в определенной последовательности. Белки являются главными… … Медицинская энциклопедия
БЕЛКИ (органические соединения) — БЕЛКИ, высокомолекулярные органические соединения, биополимеры, построенные из 20 видов L a аминокислотных остатков, соединенных в определенной последовательности в длинные цепи. Молекулярная масса белков варьируется от 5 тыс. до 1 млн. Название… … Энциклопедический словарь
БЕЛКИ — БЕЛКИ, или протеины, высокомолекулярные коллоидальные органические вещества, построенные из остатков аминокислот. Б. по своему количественному содержанию в организме животных занимают среди твердых составных частей его одно из первых мест, а по… … Большая медицинская энциклопедия
БЕЛКИ — (Sciurus), род беличьих. Дл. тела 20 31 см. Хорошо лазают и передвигаются по деревьям. Длинный (20 30 см) пышный хвост служит рулём при прыжках. Ок. 40 видов, в Сев. полушарии и на С. Юж. Америки, в горных и равнинных лесах, включая островные… … Биологический энциклопедический словарь
Сложный белок, кроме собственно белкового компонента, содержит дополнительную группу иной природы (простетическую). В качестве данного компонента выступают углеводы, липиды, металлы, остатки фосфорной кислоты, нуклеиновые кислоты. Чем отличаются простые белки от сложных, на какие виды подразделяют эти вещества, и каковы их особенности, расскажет эта статья. Главное отличие рассматриваемых веществ – их состав.
Сложные белки: определение
Это двухкомпонентные вещества, в состав которых входит простой белок (пептидные цепи) и небелковое вещество (простетическая группа). В процессе их гидролиза образуются аминокислоты, небелковая часть и продукты распада. Чем отличаются простые белки от сложных? Первые состоят только из аминокислот.
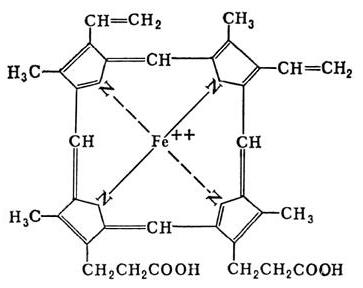
Классификация и характеристика сложных белков
Эти вещества делятся на виды в зависимости от типа дополнительной группы. К сложным белкам относятся:
- Гликопротеины – белки, молекулы которых содержат углеводный остаток. Среди них выделяют протеогликаны (компоненты межклеточного пространства), включающие в свою структуру мукополисахариды. К гликопротеидам относятся иммуноглобулины.
- Липопротеиды включают липидный компонент. К ним относятся аполипопротеины, выполняющие функцию обеспечения липидного транспорта.
- Металлопротеины содержат ионы металлов (меди, марганца, железа и др.), связанные через донорно-акцепторное взаимодействие. В эту группу не входят гемовые белки, включающие соединения профиринового кольца с железом и подобные им по структуре соединения (хлорофилл, в частности).
- Нуклеопротеиды – белки, имеющие нековалентные связи с нуклеиновыми кислотами (ДНК, РНК). К ним относится хроматин – компонент хромосом.
- 5. Фосфопротеиды, к которым относится казеин (сложный белок творога), включают ковалентно соединенные остатки фосфорной кислоты.
- Хромопротеины объединяет окрашенность простетического компонента. Данный класс включает гемовые белки, хлорофиллы и флавопротеиды.
Особенности гликопротеинов и протеогликанов
Эти белки являются сложными веществами. Протеогликаны содержат большую долю углеводов (80-85%), у обычных гликопротеидов содержание составляет 15-20%. Уроновые кислоты присутствуют только в молекуле протеогликанов, их углеводы отличаются регулярным строением с повторяющимися звеньями. Какова структура и функции сложных белков гликопротеинов? Их углеводные цепи включают только 15 звеньев и имеют нерегулярное строение. В структуре гликопротеинов связь углевода с белковым компонентом обычно осуществляется через остатки таких аминокислот, как серин или аспаргин.

К гликопротеиновым ферментам относятся холинэстераза и нуклеаза.
Подробнее о протеогликанах
Обычно сложный белок протеогликан включает в свою структуру большие углеводные цепи с повторяющимися дисахаридными остатками, состоящими из какой-либо уроновой кислоты и аминосахара. Олиго- или полисахаридные цепи называются гликанами. Первые обычно содержат 2-10 мономерных единиц.
В зависимости от структуры углеводных цепей выделяют их различные типы, например, кислые гетерополисахариды с большим количеством кислотных групп или гликозаминогликаны, включающие аминогруппы. К последним относятся:
- Гиалуроновая кислота, которую активно применяют в косметологии.
- Гепарин, препятствующий свертываемости крови.
- Кератансульфаты – компоненты хрящевой ткани и роговицы.
- Хондроитинсульфаты входят в состав хряща и синовиальной жидкости.
Данные полимеры – компоненты протеогликанов, которые заполняют межклеточное пространство, удерживают воду, смазывают подвижные части суставов, являются их структурными составляющими. Гидрофильность (хорошая растворимость в воде) протеогликанов позволяет им в межклеточном пространстве создавать преграду для крупных молекул и микроорганизмов. С их помощью создается желеобразный матрикс, в который погружены волокна других важных белков, например, коллагена. Его тяжи в среде протеогликана имеют древовидную форму.
Особенности и типы липопротеидов
Сложный белок липопротеид отличается хорошо выраженной двойственной гидрофильной и гидрофобной природой. Ядро молекулы (гидрофобную часть) образуют неполярные эфиры холестерола и триацилглицериды.
Снаружи в гидрофильной зоне располагаются белковая часть, фосфолипиды, холестерол. Выделяют несколько разновидностей белков липопротеидов в зависимости от их структуры.
Основные классы липопротеидов:
- Сложный белок высокой плотности (ЛВП, α-липопротеины). Перемещает холестерин к печени и периферическим тканям.
- Низкой плотности (ЛНП, β-липопротеины). Кроме холестерина транспортируют триацилглицериды и фосфолипиды.
- Очень низкой плотности (ЛОНП, пре-β-липопротеины). Выполняют функцию, подобную ЛНП.
- Хиломикроны (ХМ). Транспортируют жирные кислоты и холестерин из кишечника после поступления пищи.
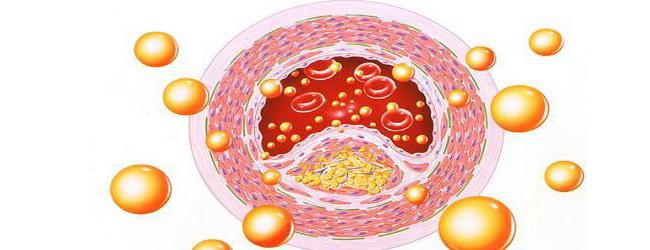
Такая сосудистая патология, как атеросклероз, возникает в результате неправильного соотношения разных типов липопротеинов в крови. По характеристике состава можно выявить несколько тенденций изменения структуры фосфолипидов (от ЛВП до хиломикронов): уменьшение доли белка (от 80 до 10%) и фосфолипидов, увеличение процента триацилглицеридов (от 20 до 90%).
Среди металлопротеинов много важных ферментов
Металлопротеин может включать в себя ионы нескольких металлов. Их наличие влияет на ориентацию субстрата в активном (каталитическом) центре фермента. Ионы металлов локализуются в активном центре и играют важную роль в проведении каталитической реакции. Часто ион выполняет функцию акцептора электронов.
Примеры металлов, содержащихся в структуре ферментных металлопротеинов:
- Медь включена в состав цитохромоксидазы, которая наряду с гемом содержит ион данного металла. Фермент участвует в процессе образования АТФ при работе дыхательной цепи.
- Железо содержат такие ферменты, как ферритин, выполняющий функцию депонирования железа в клетке; трансферрин – переносчик железа в крови; каталаза ответственна за реакцию обезвреживания перекиси водорода.
- Цинк – металл, характерный для алкогольдегидрогеназы, участвующей в окислении этилового и подобных ему спиртов; лактатдегидрогеназа – фермент в метаболизме молочной кислоты; карбоангидраза, катализирующая образование угольной кислоты из CO2 и H2O; щелочная фосфатаза, выполняющая гидролитическое расщепление эфиров фосфорной кислоты с различными соединениями; α2-макроглобулин – антипротеазный кровяной белок.
- Селен входит в состав тиреопероксидазы, участвующей в процессе образования гормонов щитовидной железы; глутатионпероксидазы, выполняющей антиоксидантную функцию.
- Кальций характерен для структуры α-амилазы – фермента гидролитического расщепления крахмала.
Фосфопротеины
Что входит в состав сложных белков фосфопротеинов? Для данной категории характерно присутствие фосфатной группы, которая связана с белковой частью через аминокислоты с гидроксилом (тирозин, серин или треонин). Какие функции выполняет фосфорная кислота, находясь в структуре белка? Она изменяет структуру молекулы, придает ей заряд, повышает растворимость, влияет на свойства белка. Примерами фосфопротеинов являются казеин молока и яичный альбумин, но в основном к данной категории сложных белков относятся ферменты.
Фосфатная группа играет важную функциональную роль, так как многие белки связаны с ней не постоянно. В клетке все время происходят процессы фосфорилирования и дефосфорилирования. В результате выполняется регуляция в работе белков. Например, если гистоны – белки, соединенные с нуклеиновыми кислотами переходят в фосфорилированное состояние, то активность генома (генетического материала) возрастает. От фосфорилирования зависит активность таких ферментов, как гликогенсинтаза и гликогенфосфорилаза.
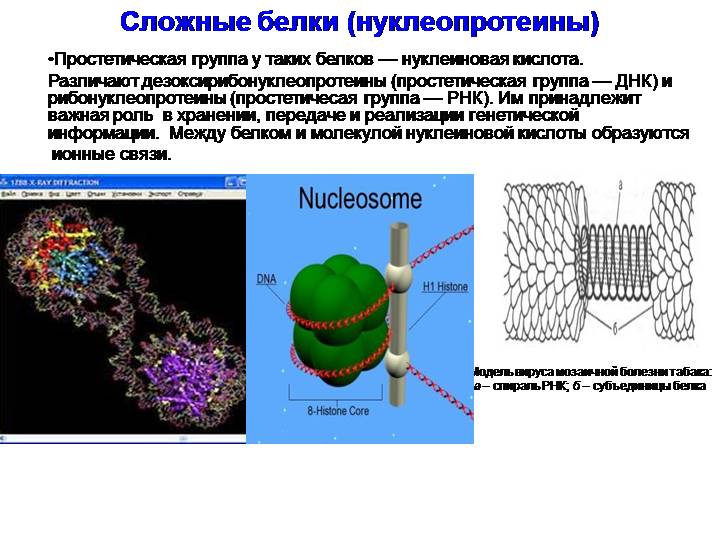
Нуклеопротеины
Нуклеопротеины – белки, соединенные с нуклеиновыми кислотами. Они – неотъемлемая часть хранения и регуляции генетического материала, работы рибосом, выполняющих функцию синтеза белка. Самые простейшие формы жизни вирусов можно назвать рибо- и дезоксирибонуклеопротеинами, так как они состоят из генетического материала и белков.
Как происходит взаимодействие дезоксирибонуклеиновой кислоты (ДНК) и гистонов? В хроматине выделяют 2 вида белков, связанных с ДНК (гистоновые и негистоновые). Первые участвуют на начальной стадии компактизации ДНК. Молекула нуклеиновой кислоты обвивается вокруг протеинов с формированием нуклеосом. Образовавшаяся нить похожа на бусины, из них формируются суперспирализованная структура (хроматиновая фибрилла) и суперспираль (хромонема интерфазы). За счет действия гистоновых белков и протеинов более высоких уровней обеспечивается сокращением размерности ДНК в тысячи раз. Достаточно сравнить размер хромосом и длину нуклеиновой кислоты, чтобы оценить важность белков (6-9 см и 10-6 мкм, соответственно).
Какие бывают хромопротеины
Хромопротеины содержат весьма разнообразные группы, которые объединяет только одно – наличие окраски в простетическом компоненте. Сложные белки данной категории подразделяются на: гемопротеины (содержат в структуре гем), ретинальпротеины (витамин А), флавопротеины (витамин В2), кобамидпротеины (витамин В12).
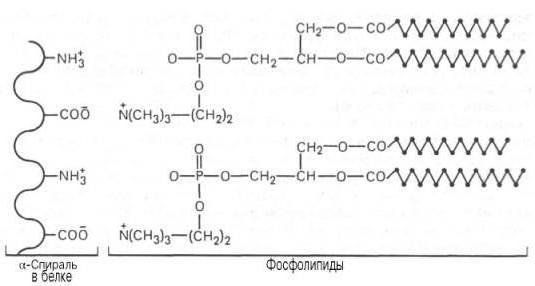
Гемопротеины классифицируются в зависимости от функций на не ферментативные (гемоглобиновый и миоглобиновый белок) и ферменты (цитохромы, каталазы, пероксидазы).
Флавопротеины содержат в качестве простетического компонента производные витамина В2 флавинмононуклеотид (ФМН) или флавинадениндинуклеотид (ФАД). Данные ферменты также участвуют в окислительно-восстановительных превращениях. К ним относятся оксидоредуктазы.
Что такое цитохромы?
Как было описано выше, гем состоит из порфирина. В его структуру входят 4 пиррольных кольца и двухвалентное железо. Особая группа гемовых ферментов – цитохромы, различающиеся составом аминокислот и числом пептидных цепей, специализированы на проведении окислительно-восстановительных реакций, за счет которых обеспечивается перенос электронов в дыхательной цепи. Данные ферменты участвуют в микросомальном окислении – начальных реакциях биотрансформации ксенобиотиков, приводящих к их обезвреживанию, и обмене многих экзогенных и экзогенных веществ, например, стероидов, насыщенных жирных кислот.
Влияние простетической группы
Простетическая группа, входящая в состав сложных белков, влияет на его свойства: изменяет его заряд, растворимость, термопластичность. Например, таким действием обладают остатки фосфорной кислоты или моносахаридов. Углеводная часть, включенная в состав сложного белка, защищает его от протеолиза (разрушения в результате процесса гидролиза), влияет на проникновение молекул через клеточную мембрану, их секрецию и сортировку. Липидный фрагмент позволяет создавать белковые каналы для транспорта плохо растворимых в воде (гидрофобных) соединений.
Строение и функции сложных белков полностью зависят от простетической группы. Например, с помощью железосодержащего гема в гемоглобине происходит связывание кислорода и углекислого газа. За счет нуклеопротеидов, формируемых в результате взаимодействия гистонов, протаминов с ДНК или РНК, происходит защита генетического материала, его компактное хранение, связывание РНК в процессе синтеза белков. Нуклеопротеидами называют устойчивые комплексы белков и нуклеиновых кислот.
Заключение
Таким образом, сложные белки выполняют большой спектр функций в организме. Поэтому потребление макро- и микроэлементов так важно для поддержания здоровья. Металлы входят в состав многих ферментов. Зная биохимию, особенности своего здоровья и экологическое состояние места проживания, можно скорректировать режим собственного питания. Например, выделяют территории, отличающиеся дефицитом какого-либо элемента. Его дополнительное внесение в рацион в виде добавок позволяет восполнить недостаток.
Сложные белки построены из двух компонентов - простой белок и небелковое вещество, называемое простетической группой. Простетические группы прочно связаны с белковой частью молекулы.
Классификация сложных белков
Классификация сложных белков зависит от строения простетической группы.
Гликопротеины (содержат углеводы).
Липопротеины (содержат липиды).
Фосфопротеины (содержат фосфорную кислоту).
Хромопротеины (содержат окрашенную простетическую группу).
Металлопротеины (содержат ионы различных металлов).
Нуклеопротеины (содержат нуклеиновые кислоты).
Муцин, биологическая роль
Муцины- сложные белки, содержащие полисахариды, они придают слюне вязкость и клейкость, способствуют смачиванию и склеиванию пищевого комка и облегчают его проглатывание
Муцины (от лат. mucus — слизь), мукопротеины — семейство высокомолекулярных гликопротеинов, содержащих кислые полисахариды. Имеют гелеобразную консистенцию, продуцируются эпителиальными клетками почти всех животных и человека. Муцины — основной компонент, входящий в состав секретов всех слизистых желёз. Некоторые муцины отвечают за регуляцию процессов минерализации у животных, например, формирования раковины у моллюсков и костной ткани у позвоночных
Казеин, биологическая роль
Казеи́н (лат. caseus — сыр) — сложный белок, образующийся из предшественника казеина — казеиногена при створаживании молока.
Казеин (казеионоген) присутствует в молоке в связанном виде как соль кальция (казеинат кальция). Свёртывание казеина в молоке происходит под действием протеолитических ферментов сычужного сока (сыр), кислот, вырабатываемых молочнокислыми бактериями (творог), либо при прямом добавлении кислот (технический казеин).
Казеин содержит все незаменимые аминокислоты, и поэтому является важным пищевым белком.
Казеин — богатый источник доступного кальция и фосфора. Препараты казеина широко применяются в медицине, особенно при парентеральном питании. Из-за сбалансированности аминокислотного состава и лёгкой усваиваемости выделенный из молока казеин часто выступает основой питания атлетов, однако из-за довольно медленного расщепления в желудке его приём целесообразен в длительные периоды покоя между тренировками, например, на ночь. Казеин входит в состав мазей, применяемых в дерматологии, и биологических клеев, используемых в хирургии. [6]
Гемопротеиды.
Гемопротеид- сложные белки, содержащие окрашенную простетическуюгруппу — Гем. Относятся к хромопротеидам (См. Хромопротеиды). Кроме дыхательных пигментов — Гемоглобина и Миоглобина, Г. включают широко распространённые дыхательные ферменты — Цитохромы, иокислительные ферменты тканей — пероксидазу, катализирующую окисление органических веществперекисью водорода, Катализу и леггемоглобин (легоглобин) — пигмент, обнаруженный в корневыхклубеньках бобовых растений.

Гликопротеины.
Гликопротеины. Простетические группы этих белков представлены углеводами и их производными.
Гликопротеины содержат от 1 до 30 % углеводов, которые прочно связаны с белковой частью молекулы. Они представлены различными моносахаридами, их ацетил-амино-производными, дезоксисахаридами, нейраминовыми и сиаловыми кислотами. Они могут быть также представлены линейными или разветвленными олигосахаридами.
большинство белков на внешней поверхности животных клеток (рецепторы);
большая часть синтезируемых клеточных белков (интерфероны);
большая часть белков плазмы крови (кроме альбуминов):
групповые вещества крови;
гормоны (гонадотропин, кортикотропин).
Связь между углеводными компонентами и белковой частью в гликопротеинах ковалентно-гликозидная, через ОН группы серина, треонина, или NH группу лизина, аспарагина, глутамина.
Сложные белки построены из двух компонентов - простой белок и небелковое вещество, называемое простетической группой. Простетические группы прочно связаны с белковой частью молекулы.
Классификация сложных белков
Классификация сложных белков зависит от строения простетической группы.

Гликопротеины (содержат углеводы).
Липопротеины (содержат липиды).
Фосфопротеины (содержат фосфорную кислоту).
Хромопротеины (содержат окрашенную простетическую группу).
Металлопротеины (содержат ионы различных металлов).
Нуклеопротеины (содержат нуклеиновые кислоты).
Муцин, биологическая роль
Муцины- сложные белки, содержащие полисахариды, они придают слюне вязкость и клейкость, способствуют смачиванию и склеиванию пищевого комка и облегчают его проглатывание
Муцины (от лат. mucus — слизь), мукопротеины — семейство высокомолекулярных гликопротеинов, содержащих кислые полисахариды. Имеют гелеобразную консистенцию, продуцируются эпителиальными клетками почти всех животных и человека. Муцины — основной компонент, входящий в состав секретов всех слизистых желёз. Некоторые муцины отвечают за регуляцию процессов минерализации у животных, например, формирования раковины у моллюсков и костной ткани у позвоночных
Казеин, биологическая роль
Казеи́н (лат. caseus — сыр) — сложный белок, образующийся из предшественника казеина — казеиногена при створаживании молока.
Казеин (казеионоген) присутствует в молоке в связанном виде как соль кальция (казеинат кальция). Свёртывание казеина в молоке происходит под действием протеолитических ферментов сычужного сока (сыр), кислот, вырабатываемых молочнокислыми бактериями (творог), либо при прямом добавлении кислот (технический казеин).
Казеин содержит все незаменимые аминокислоты, и поэтому является важным пищевым белком.
Казеин — богатый источник доступного кальция и фосфора. Препараты казеина широко применяются в медицине, особенно при парентеральном питании. Из-за сбалансированности аминокислотного состава и лёгкой усваиваемости выделенный из молока казеин часто выступает основой питания атлетов, однако из-за довольно медленного расщепления в желудке его приём целесообразен в длительные периоды покоя между тренировками, например, на ночь. Казеин входит в состав мазей, применяемых в дерматологии, и биологических клеев, используемых в хирургии. [6]
Гемопротеиды.
Гемопротеид- сложные белки, содержащие окрашенную простетическуюгруппу — Гем. Относятся к хромопротеидам (См. Хромопротеиды). Кроме дыхательных пигментов — Гемоглобина и Миоглобина, Г. включают широко распространённые дыхательные ферменты — Цитохромы, иокислительные ферменты тканей — пероксидазу, катализирующую окисление органических веществперекисью водорода, Катализу и леггемоглобин (легоглобин) — пигмент, обнаруженный в корневыхклубеньках бобовых растений.

Гликопротеины.
Гликопротеины. Простетические группы этих белков представлены углеводами и их производными.
Гликопротеины содержат от 1 до 30 % углеводов, которые прочно связаны с белковой частью молекулы. Они представлены различными моносахаридами, их ацетил-амино-производными, дезоксисахаридами, нейраминовыми и сиаловыми кислотами. Они могут быть также представлены линейными или разветвленными олигосахаридами.
большинство белков на внешней поверхности животных клеток (рецепторы);
большая часть синтезируемых клеточных белков (интерфероны);
большая часть белков плазмы крови (кроме альбуминов):
групповые вещества крови;
гормоны (гонадотропин, кортикотропин).
Связь между углеводными компонентами и белковой частью в гликопротеинах ковалентно-гликозидная, через ОН группы серина, треонина, или NH группу лизина, аспарагина, глутамина.
Белки — это незаменимые и важнейшие компоненты, которые входят в состав продуктов питания. На сегодняшний день ученые продолжают активно изучать их роль для человеческого организма, но уже установлено, что благодаря данным элементам происходит вещественный обмен. Также белки улучшают способность к росту мышц и нормализуют работу нервной системы. Они входят в структуру клеток и являются жизненно важными компонентами для организма.
Краткая история открытия сложных белков
Целенаправленно изучать функции и строение сложных белков ученые начали во второй половине 18 века, а французский химик Антуан Франсуа де Фуркруа в результате научных экспериментов получил такие макроэлементы, как глютен, альбумин и фибрин. Сложные белки были выделены учеными в отдельную молекулярную группу.
Что касается первой модели химического строения белков, то она была изобретена в 1838 году, а предложил ее Мулдер, основываясь на теории радикалов. До 1850 года данная модель считалась общепризнанной, а в 1852 г. белки стали называться протеинами. Во второй половине 19-го века специалисты приступили к изучению аминокислот, из которых состоят протеины. В 1895 г. немецким ученым Альбрехтом Косселем была выдвинута теория, в которой он утверждал, что аминокислоты — это основные структурные элементы сложных белков.
Обратите внимание! Классы сложных белков в биохимии являются высокомолекулярными органическими веществами. В состав молекулы протеина входят сотни аминокислот, которые представлены цепочкой пептидной связи.
Сложные белки: общая характеристика, классификация
Сложные белки представлены двухкомпонентными макроэлементами, которые состоят из небелковых веществ (простетической группы) и простого протеина (пептидных цепей). В процессе их гидролиза начинается активное деление продуктов распада, небелковой части и различных аминокислот. К группе сложных белков относится множество различных макроэлементов, наиболее популярными из которых являются:
- хромопротеины, объединенные простетическим компонентом и его окрашенностью. Данный класс состоит из флавопротеидов, гемовых белков и хлорофиллов;
- нуклеопротеиды, которые представлены сложными белками, характеризующимися нековалентными связями нуклеиновых кислот. Наиболее популярным является компонент хромосом — хроматин;
- фосфопротеиды, состоящие из соединенных остатков фосфорной кислоты. К ним относят казеин, являющийся сложным протеином творога;
- гликопротеины — молекулы данной группы белков отличаются наличием углеводного остатка в составе. Популярные гликопротеины представлены иммуноглобулинами, структура которых содержит полисахариды;
- липопротеиды, в составе которых содержится липидный компонент. Наибольшей популярностью пользуются аполипопротеины — макроэлементы, обеспечивающие функционирование регулярной транспортировки липидов.
Отдельная группа сложных белков представлена металлопротеинами, в состав которых входят ионы металлов. Микроэлементы марганца, железа, меди или любого другого металла связаны между собой донорно-акцепторным взаимодействием. Данная группа не имеет гемовых белков, содержащих в своем составе профириновое кольцо с железом, к примеру, хлорофилл.
Сложныке белки классификация
Обратите внимание! Гликопротеины очень важны для человеческого организма. Из данных макроэлементов построены клеточные стенки, а также хрящевая и костная соединительная ткань. Также гликопротеины обеспечивают транспортировку ионов в кровь через клеточную мембрану.
Характеристика небелковых групп, входящих в состав сложных белков
В большинстве случаев, небелковая группа протеогликанов состоит из больших углеводных цепей, в которых периодически повторяются дисахаридные остатки, представлены аминосахаром или уроновой кислотой. В зависимости от того, какую структуру имеют углеводные цепи, можно выделить их различные типы. Распространенным гликозаминогликаном является гепарин и гиалуроновая кислота, которая активно применяется в косметологических целях.
Обратите внимание! Что касается нуклеопротеинов, то они отвечают за регуляцию и хранение генетического материала, а также работу рибосом, от которых зависит процесс синтеза белка. Важной функциональной ролью отличается фосфатная группа, потому что практически все сложные протеины с ней связаны. В клетках фосфатной группы регулярно происходит дефосфорилирование и фосфорилирование, что, в свою очередь, оптимизирует работу белков.
Стоит заметить, что небелковые группы, из которых состоят сложные белки, определяют степень их термопластичности, растворимости, а также изменяют заряд. К примеру, таким эффектом отличаются моносахариды и фосфорная кислота. Сложный макроэлемент состоит из углеводной части, которая предотвращает разрушение из-за процесса гидролиза, а также влияет на сортировку и секрецию молекул, проникающих через клеточную мембрану. Белковые каналы для транспортировки гидрофобных соединений можно классифицировать с помощью липидных фрагментов.
Обратите внимание! Функции и структура небелковых элементов зависит от того, какой тип у простетической группы. К примеру, железосодержащий гем в гемоглобине способствует связыванию углекислого газа и кислорода.
Значение белков для организма человека
Из белков состоят структурные элементы клеток организма, которые способствуют обновлению любых тканей и росту. В больших объемах протеин содержится в мышцах (около 45-50%), в хрящах и костях — около 15-20%, а остальные 15-20% приходятся на кожу. Чтобы организм нормально функционировал, человеку необходимо съедать не менее 1 г чистого протеина на один кг живого веса в сутки.
Если организм будет испытывать нехватку этих веществ, человек начнет страдать от белкового голодания. С помощью различных групп сложных белков в организме происходят метаболические процессы, а дефицит таких макроэлементов равен полному голоданию. Первыми симптомами того, что человеку недостает протеинов, является:
- резкая потеря веса;
- слабость в теле, ухудшение общего состояния;
- отказ от приема пищи;
- у детей приостанавливается рост и замедляется умственное развитие;
- У взрослых людей нарушается гормональный фон.
Если показатели нехватки протеинов достигли критической отметки, это может привести к летальному исходу. Стоит заметить, что протеины животного происхождения усваиваются желудком лучше всего. К таким продуктам можно отнести рыбу и морепродукты, молоко, кефир, куриное мясо и перепелиные яйца.
С опасностью белкового голодания могут столкнуться вегетарианцы, поэтому им нужно очень внимательно следить за количеством потребляемых протеинов. Опытные диетологи утверждают, что восполнить недостаток животной пищи в ежедневном рационе можно с помощью бобовых и злаковых культур, свежих овощей и грибов.
Люди, ведущие здоровый образ жизни, используют сложные макроэлементы в целях наращивания мышечной массы, а также для повышения выносливости организма и быстрого восстановления после физических нагрузок. Приверженцами принципа протеиновых диет, в большинстве случаев, являются бодибилдеры, но белок рекомендуется употреблять в больших количествах даже при минимальных физических нагрузках.

Значение белков для организма человека
Основная особенность спортивного питания — специальные протеиновые добавки. Лучше всего организмом усваивается яичный белок, а с помощью коллагенового протеина восстанавливается мышечная ткань, сухожилия и связки. Стоит заметить, что за короткий промежуток времени способен расщепляться сывороточный протеин. Чтобы белковые добавки хорошо усвоились в желудке, их рекомендуется принимать на ночь. Категорически запрещено и неверно употреблять протеины перед физическими нагрузками.
Перед тем, как пересматривать рацион и определять норму суточного потребления макроэлементов, рекомендуется проконсультироваться с квалифицированным диетологом, который способен объяснить все нюансы. Стоит помнить, что организм нуждается в достаточном количестве протеинов, желательно, чтобы это было 50% белков животного происхождения и 50% растительного.
Читайте также:

