Регуляция митотического цикла кратко
Обновлено: 05.07.2024
Описание клеточного деления базируется на данных световой микроскопии в сочетании с микрокиносъемкой и на результатах световой и электронной микроскопии фиксированных и окрашенных клеток.
1.1. Интерфаза G0
Клетки вступают в G0-фазу с контрольной точки в G1-фазе, например, точки рестрикции у животных и стартовой точки у дрожжей. Это обычно происходит в ответ на нехватку факторов роста или питательных веществ. В течение G0-фазы аппарат клеточного цикла разобран, исчезают циклины и циклин-зависимые киназы. Клетка пребывает в G0-фазе до тех пор, пока не появится повод начать деление. Клетки некоторых типов в зрелом организме, как, например, паренхимные клетки печени и почек, вступают в G0-фазу почти навсегда, и побудить их вновь начать делиться могут лишь особые обстоятельства. Другие типы клеток, как, например, эпителиальные клетки, продолжают делиться в течение всей жизни организма и редко входят в G0-фазу.
Хотя многие клетки в G0-фазе могут умереть вместе со всем организмом, не все клетки, вступающие в G0-фазу, обречены в скором времени умереть. Это часто является результатом отсутствия стимула для клетки вновь вступить в клеточный цикл.
Старение клеток отличается от состояния покоя тем, что старение клеток — это состояние, вызванное повреждением ДНК или деградацией, делающей размножение клетки невозможным. Кроме того, старение, в отличие от покоя, часто служит биохимической альтернативой саморазрушению — апоптозу для сильно повреждённых клеток. Наконец, покой — обратимое состояние, а старение — нет
1.2. Митоз
Продолжительность митоза в среднем составляет 1—2 часа[1][4]. Митоз клеток животных, как правило, длится 30—60 минут, а растений — 2—3 часа.[5] За 70 лет в теле человека суммарно осуществляется порядка 1014 клеточных делений[6].
Аппарат клеточного деления
Деление всех эукариотических клеток сопряжено с формированием специального аппарата клеточного деления. Активная роль в митотическом делении клеток зачастую отведена цитоскелетным структурам. Универсальным как для животных, так и для растительных клеток является двухполюсное митотическое веретено, состоящее из микротрубочек и связанных с ними белков. Веретено деления обеспечивает строго одинаковое распределение хромосом между полюсами деления, в области которых в телофазе образуются ядра дочерних клеток.
Ещё одна не менее важная структура цитоскелета отвечает за разделение цитоплазмы (цитокинез) и, как следствие, за распределение клеточных органелл. В животных клетках за цитокинез отвечает сократимое кольцо из актиновых и миозиновых филаментов. В большинстве клеток высших растений из-за наличия жёсткой клеточной стенки цитокинез протекает с образованием клеточной пластинки в плоскости между двумя дочерними клетками. При этом область образования новой клеточной перегородки определяется заранее предпрофазным пояском из актиновых микрофиламентов, а поскольку актин участвует также в формировании клеточных септ у грибов, возможно, что он направляет цитокинез у всех эукариот [19] .
Веретено деления
Поздняя метафаза митоза в клетке лёгкого тритона (использованы иммунофлуоресцентные красители). Четко просматривается веретено деления, образованное микротрубочками (зелёные), и хромосомы (синие)
По морфологии различают два типа митотического веретена: астральный (или конвергентный) и анастральный (дивергентный) [~ 1][24] .
Астральный тип митотической фигуры, характерный для животных клеток, отличают благодаря небольшим зонам, на полюсах веретена, в которых сходятся (конвергируют) микротрубочки. Зачастую центросомы, располагающиеся в области полюсов астрального веретена, содержат центриоли. От полюсов деления также расходятся во всех направлениях радиальные микротрубочки, не входящие в состав веретена, а образующие звездчатые зоны — цитастеры.
Анастральный тип митотической фигуры отличается широкими полярными областями веретена, так называемыми полярными шапочками, в их состав не входят центриоли. Микротрубочки при этом расходятся широким фронтом (дивергируют) от всей зоны полярных шапочек. Этот тип митотической фигуры также отличает отсутствие цитастеров. Анастральный тип митотического веретена наиболее характерен для делящихся клеток высших растений, хотя иногда наблюдается и в некоторых клетках животных.
Микротрубочки
Микротрубочки — динамичные структуры, принимающие активное участие в построении веретена деления во время митоза. Химически они представляют собой биополимеры, состоящие из субъединиц белка тубулина. Количество микротрубочек в клетках различных организмов может значительно отличаться. В метафазе веретено деления в клетках высших животных и растений может содержать до нескольких тысяч микротрубочек, тогда как у некоторых грибов их всего около 40 [22] .
Центромеры и кинетохоры
Основные статьи: Центромера, Кинетохор
Центромеры — специализированные последовательности ДНК, необходимые для связывания с микротрубочками веретена деления и для последующего расхождения хромосом. В зависимости от локализации различают несколько типов центромер. Для голоцентрических центромер характерно образование связей с микротрубочками веретена по всей длине хромосомы (некоторые насекомые, нематоды, некоторые растения). В противоположность голоцентрическим моноцентрические центромеры служат для связи с микротрубочками в единственной области хромосомы [24] .
В центромерной области обычно располагаются кинетохоры хромосом — сложные белковые комплексы, морфологически очень сходные по своей структуре для различных групп эукариот, как, например, для диатомовых водорослей, так и для человека [25] . Обычно на каждую хроматиду (хромосому) приходится по одному кинетохору. На электронных микрофотографиях кинетохор обычно выглядит как пластинчатая трёхслойная структура [26] . Порядок слоев следующий: внутренний плотный слой, примыкающий к телу хромосомы; средний рыхлый слой; внешний плотный слой, от которого отходит множество фибрилл, образуя т.н. фиброзную корону кинетохора.
К основным функциям кинетохора относят: закрепление микротрубочек веретена деления, обеспечение движения хромосом во время митоза при участии микротрубочек, связывание между собой сестринских хроматид и регуляцию их последующего разделения в анафазе митоза [27] . Минимально достаточно одной микротрубочки (например, для дрожжей) ассоциированной с кинетохором, чтобы обеспечить движение хромосомы. Однако с одним кинетохором могут быть связаны целые пучки, состоящие из 20—40 микротрубочек (например, у высших растений или человека), чтобы обеспечить расхождение хромосом к полюсам клетки [26][27] .
1.3. Циклины и циклин-зависимые киназы
Циклины — семейство белков-активаторов циклин-зависимых протеинкиназ (CDK) (англ. CDK, cyclin-dependent kinases) — ключевых ферментов, участвующих в регуляции клеточного цикла эукариот. Циклины получили своё название в связи с тем, что их внутриклеточная концентрация периодически изменяется по мере прохождения клеток через клеточный цикл, достигая максимума на его определенных стадиях.
Каталитическая субъединица циклин-зависимой протеинкиназы частично активируется в результате взаимодействия с молекулой циклина, которая образует регуляторную субъединицу фермента. Образование этого гетеродимера становится возможным после достижения циклином критической концентрации. В ответ на уменьшение концентрации циклина происходит инактивация фермента. Для полной активации циклин-зависимой протеинкиназы должно произойти специфическое фосфорилирование и дефосфорилирование определенных аминокислотных остатков в полипептидных цепях этого комплекса. Одним из ферментов, осуществляющих подобные реакции, является киназа CAK (CAK — CDK activating kinase).
Рис. Концентрация циклинов в клеточном цикле
| циклин | Cdk | фаза клеточного цикла |
|---|---|---|
| циклин Е | Cdk2 | вход в S-фазу |
| циклин A | Cdk2 | вход в G2-фазу |
| циклин B | Cdk1 | вход в M-фазу |
2. Регуляция клеточного цикла
Закономерная последовательность смены периодов клеточного цикла осуществляется при взаимодействии таких белков, как циклин-зависимые киназы и циклины. Клетки, находящиеся в G0 фазе, могут вступать в клеточный цикл при действии на них факторов роста. Разные факторы роста, такие как тромбоцитарный, эпидермальный, фактор роста нервов, связываясь со своими рецепторами, запускают внутриклеточный сигнальный каскад, приводящий в итоге к транскрипции генов циклинов и циклин-зависимых киназ. Циклин-зависимые киназы становятся активными лишь при взаимодействии с соответствующими циклинами. Содержание различных циклинов в клетке меняется на протяжении всего клеточного цикла. Циклин является регуляторной компонентой комплекса циклин-циклин-зависимая киназа. Киназа же является каталитическим компонентом этого комплекса. Киназы не активны без циклинов. На разных стадиях клеточного цикла синтезируются разные циклины. Так, содержание циклина B в ооцитах лягушки достигает максимума к моменту митоза, когда запускается весь каскад реакций фосфорилирования, катализируемых комплексом циклин-В/циклин-зависимая киназа. К окончанию митоза циклин быстро разрушается протеиназами.

2.1. Контрольные точки клеточного цикла
3. Ингибиторы циклин-зависимой киназы
Ингиби́тор цикли́н-зави́симой кина́зы (англ. Cdk inhibitor protein, CKI, CDI, CDKI) — белок, блокирующий активность циклин-зависимой киназы отдельно или циклин-зависимой киназы в комплексе с циклином. Обычно сдерживающая активность CKI приурочена к фазе G1 клеточного цикла. К тому же, активация CKI может происходить в ответ на провреждения ДНК или может быть вызвана внеклеточными ингибирующими сигналами[2].
Большинство эукариотических организмов обладают ингибиторами циклин-зависимых киназ. В животных клетках выделяют два семейства CKI: Cip/Kip и INK4.
Ингибиторы семейства Cip/Kip блокируют циклин-зависимую киназу в комплексе с циклином, а ингибиторы семейства INK4 блокируют отдельные циклин-зависимые киназы Cdk4 и Cdk6. В животных клетках ингибиторы циклин-зависимых киназ разделяются на два основных семейства: Cip/Kip и INK4. Семейство Cip/Kip включает ингибиторы CDK белки p21, p27, p57. К основным субстратам Cip/Kip-ингибиторов относятся циклин-киназные комплексы G1/S-Cdk и S-Cdk, отвечающие, соответственно, за G1/S-переход и вступление в S-фазу. Ингибиторы семейства INK4 блокируют циклин-зависимые киназы Cdk4 и Cdk6 регулирующие G1-фазу клеточного цикла.
| Рис. Схема ингибирования Cdk6 с участием INK4. Белок INK4 соединяется с циклин-зависимой киназой Cdk6 и смещает аминоконцевую долю киназы примерно на 15° относительно оси вращения. В итоге, деформируется каталитическая область Cdk6, а также снижается способность циклин-зависимой киназы к связыванию циклина. |
На протяжении фазы G1 в растущей клетке блокируется активность циклин-зависимых киназ (англ. Cdk) до момента вступления клетки в очередной клеточный цикл. Сдерживание активности Cdk обеспечивается тремя контрольными механизмами. Во-первых, снижением экспрессии генов циклинов. Во-вторых, увеличением степени деградации циклинов. Наконец, к третьему типу сдерживания активности Cdk относятся ингибиторы CKI. Помимо обеспечения стабильного роста клетки в фазе G1 ингибиторы циклин-зависимых киназ участвуют в аресте клеточного цикла на стадии G1 в ответ на неблагоприятные внешние условия. К тому же события клеточного цикла могут блокироваться с участием CKI при повреждениях ДНК[2].
Ингибиторы циклин-зависимых киназ: Sic1 у почкующихся дрожжей, Rum1 у делящихся дрожжей и Rux у Drosophila — несмотря на структурные различия обладают как минимум тремя сходными функциональными особенностями. Во-первых, основными мишенями данных CKI являются митотические циклин-киназы (англ. M-Cdk) и циклин-киназы синтетической фазы клеточного цикла (англ. S-Cdk). В то же время указанные ингибиторы CKI не могут блокировать циклин-зависимые киназы, обеспечивающие переход клетки из фазы G1 в S-фазу (англ. G1/S-Cdk). Наконец, третьей характерной особенностью всех перечисленных ингибиторов CKI является способ их деактивации. Все они разрушаются после фосфорилирования со стороны активных циклин-зависимых киназ[2].
Семейство Cip / Kip (p21, p27, p57) регулирует динамику актина посредством ингибирования пути Rho-ROCK-LIMK [2]

3.1. CDKN1A или P21
CDKN1A (англ. cyclin-dependent kinase inhibitor 1A, p21, Cip1) — внутриклеточный белок-ингибитор циклин-зависимой киназы 1A, играет критическую роль в клеточном ответе на повреждение ДНК. Уровень белка повышен в клетках, находящихся в стадии покоя, таких как дифференцированные клетки организма. Один из 9 известных белковых ингибиторов циклин-зависимой киназы.
p21 обеспечивает устойчивость гематопоэтических клеток к инфицированию ВИЧ за счёт связывания с вирусной интегразой, предотвращая таким образом встраивание провируса в хромосомный аппарат клетки.

Ген CDKN1A как правило не инактивируется полностью в злокачественных опухолях. Точная роль p21 в канцерогенезе до конца пока не установлена. Исследования показывают, что при некоторых типах опухолей потеря p21 является признаком плохих шансов на выживание. Однако известны ситуации, когда повышенная концентрация этого белка в клетках положительно коррелирует с агрессивностью опухоли и её способностью к метастазированию. Это особенно относится к тем случаям, когда p21 накапливается в цитоплазме, а не в ядре клетки
Ген р21 и регенерация.
Исследовательская группа профессора Эллен Хэбер-Катц (Ellen Heber-Katz) выяснила, что выключение гена р21 активирует у мышей способность к восстановлению тканей.
В природе регенеративные способности (восстановление тканей, органов и конечностей) наиболее выражены у амфибий, полипов, иглокожих, губок, гидр, дождевых червей, саламандр и нек. др., в то время как у млекопитающих они существенно ограничены.
В лаборатории молекулярного биолога Хэбер-Катц регенерацией у млекопитающих заинтересовались в 1996 году, когда во время изучения одного из аутоиммунных заболеваний зафиксировали у лабораторных мышей линииMurphy Roths Large (MRL) восстановление хрящевой ткани ушей после пожизненной маркировки (перфорации). У животных других линий такой регенерации не происходило. Ученые исследовали восстановленные участки и зафиксировали в них синтез ДНК, пролиферацию клеток и появление новых волосяных фолликулов.
Последующие эксперименты на мышах MRL показали, что после нанесенных им повреждений в области сердечной мышцы и спинного мозга, эти ткани так же успешно регенеририруют без образования рубцов.
Чтобы с наибольшей вероятностью вычислить гены, ответственные за процессы регенерации у мышей MRL, было решено картировать их геном. Так же под прицел ученых попал феномен влияния изменений в ДНК на цикл деления клеток.
Исследования показали, что у животных MRL линии неактивен ген р21, играющий важную роль в регуляции клеточного деления и в торможении процесса деления клеток при повреждении ДНК.
В новой работе ученые показали, что мыши без гена p21 демонстрируют регенеративные характеристики, наблюдаемые у мышей MRL линии. У генноинженерных мышей фиксировалось быстрое деление клеток, восстанавливающее ткани и быстрый апоптоз - механизм клеточного самоуничтожения, включающийся, если ДНК повреждена. Сочетание этих процессов свойственно видам, обладающим регенеративными способностями. Ученые считают, что такое совокупное воздействие позволяет клеткам данных видов делиться быстро, не выходя из-под антиракового контроля.
В научной публикации, опубликованной в Трудах Национальной академии наук, коллектив Эллен Хэбер-Катц предоставляет веские доказательства, что тканевая регенерация связана с контролем клеточного деления.
Клеточный цикл (или митотический цикл) — согласованная однонаправленная последовательность событий, в ходе которой клетка последовательно проходит его разные периоды без их пропуска или возврата к предыдущим стадиям. Клеточный цикл заканчивается делением исходной клетки на две дочерние клетки.
Содержание
Длительность клеточного цикла эукариот
Длительность клеточного цикла у разных клеток варьирует. У быстро размножающихся клеток взрослых организмов таких как кроветворные или базальные клетки эпидермиса и тонкой кишки могут входить в клеточный цикл каждые 12-36 ч. Короткие клеточные циклы около 30 мин наблюдаются при быстром дроблении яиц иглокожих и земноводных. В экспериментальных условиях короткий клеточный цикл 20ч имеют многие линии клеточных культур. У большинства клеток длительность периода между митозами составляет примерно 10-24 ч.
Фазы клеточного цикла эукариот
Клеточный цикл эукариот состоит из интерфазы, во время которой идет синтез ДНК и белков и осуществляется подготовка к делению клетки и собственно само деление клетки, митоз. Интерфаза состоит из нескольких периодов: G1-фазы начального роста, во время которой идет синтез мРНК, белков, других клеточных компонентов, S-фазы (синтетической фазы), во время которой идет удвоение † ДНК и G2-фазы во время которой идет подготовка к митозу. У дифференцировавшихся клеток, которые более не делятся в жизненном цикле может отсутствовать G1 фаза. Такие клетки находятся в фазе покоя G0.
Регуляция клеточного цикла
Закономерная последовательность смены периодов клеточного цикла осуществляется при взаимодействии таких белков, как циклин-зависимые киназы и циклины. Клетки, находящиеся в G0 фазе могут вступать в клеточный цикл при действии на них гормонов роста. Разные факторы роста, такие как тромбоцитарный, эпидермальный, фактор роста нервов связываясь со своими рецепторами запускают внутриклеточный сигнальный каскад, приводящий в итоге к транскрипции генов циклинов и циклин-зависимых киназ. Циклин-зависимые киназы становятся активными лишь при взаимодействии с соответствующими циклинами. Содержание различных циклинов в клетке меняется на протяжении всего клеточного цикла. Циклин является регуляторной компонентой комплекса циклин-циклин-зависимая киназа. Киназа же является каталитическим компонентом этого комплекса. Киназы не активны без циклинов. На разных стадиях клеточного цикла синтезируются разные циклины. Так содержание циклина B в ооцитах лягушки достигает максимума к моменту митоза, когда запускается весь каскад реакций фосфорилирования запускаемый комплексом циклин-В/циклин-зависимая киназа. К окончанию митоза циклин быстро разрушается протеиназами.
Контрольные точки клеточного цикла
Нарушения клеточного цикла и образование опухолей

Нарушение нормальной регуляции клеточного цикла является причиной появления большинства солидных опухолей. В клеточном цикле, как уже говорилось, прохождение контрольных пунктов его возможно только в случае нормального завершения предыдущих этапов и отсутствия поломок. Для опухолевых клеток характерны изменения компонентов сверочных точек клеточного цикла. При инактивации сверочных точек клеточного цикла наблюдается дисфункция некоторых опухолевых супрессоров и протоонкогенов, в частности p53, pRb, Myc и Ras. Белок p53 является одним из факторов транскрипции, который инициирует синтез белка p21, являющегося ингибитором комплекса CDK-циклин что приводит к остановке клеточного цикла в G1 и G2 периоде. Таким образом клетка у которой повреждено ДНК не вступает в S-фазу. При мутациях, приводящих к потере генов белка p53, или при их изменениях, блокады клеточного цикла не происходит, клетки вступают в митоз, что приводит к появлению мутантных клеток, большая часть из которых нежизнеспособна, другая — дает начало злокачественным клеткам.
• Во многих эукариотических клетках основной контрольной точкой служит переход от G2 в М-период цикла
• С переходом G2-M связана активация нескольких протеинкиназ
G2-фаза клеточного цикла связана с подготовкой клетки к митозу. В течение этой фазы большинство клеток растет, и, таким образом, после деления у них сохраняется постоянное ядерно-цитоплазматическое отношение. Во время этой фазы, т. е. до момента вступления клетки в митоз и начала сегрегации хромосом, также узнаются и корректируются ошибки репликации ДНК. Как клетки начинают митоз, когда завершились все процессы? В настоящем разделе мы рассмотрим роль протеинкиназ во вступлении клетки в митоз.
Основной киназой митоза, способствующей переходу G2-M, является комплекс Cdk1-циклин В. По мере накопления митотических циклинов, они связываются с Cdk1. Комплекс накапливается, однако он находится в неактивном состоянии, поскольку белок фосфорилирован при участии представителя семейства киназ Weel. Если в клетках отсутствует активность Weel, то Cdk1 не подавляется. При этом вступающие в митоз клетки достигают небольшой величины, т. е. являются wee. Киназа Mik1 является гомологом Weel и участвует в фосфорилировании и ингибировании активности Cdk1 при пролонгировании S-фазы. Гомолог Weel, Myt1, локализован исключительно в эндоплазматическом ретикулуме (ЭР), в то время как другие представители этого семейства находятся в клеточном ядре. Эти киназы фосфорилируют тирозиновый (Tyr15) или расположенный рядом треони-новый остаток (Thrl4), что приводит к ингибированию активности фермента.
Дефосфорилирование остатков Tyr15 или Thr14 контролирует активацию Cdk1 и вход в митоз. Этот процесс осуществляется Cdc25 фосфатазой. У делящихся дрожжей ген cdc25, в отличие от weel, является необходимым. Если фосфатные группы не удаляются, то митоз не наступает Для гарантии в клетках млекопитающих присутствуют три разных изоформы Cdc25, которые обеспечивают наступление этого ключевого процесса.
В клетках высших эукариот наиболее подробно исследован один из этапов активации Cdk1, протекающий с участием Cdc25. В этих клетках активация Cdc25 происходит с участием Polo-киназ (PLKs), представителей семейства, отличающегося от CDK. После активации Cdc25 с участием PLK и последующего увеличения активности Cdk1 дальнейшая активация Cdc25 происходит под действием самой Cdk1. Такая форма положительной обратной связи при активации Cdk1 приводит к сильному увеличению активности киназы, что приводит клетку к вступлению в митоз. Активность Weel также отрицательно регулируется за счет фосфорилирования Cdk1 с тем чтобы обеспечить резкую активацию Cdk1, необходимую для вступления клетки в митоз. На рисунке ниже схематически представлены процессы активации Cdk1.
У многоклеточных эукариот вхождение клетки в митоз и сам митоз находятся под контролем двух различных CDK-циклиновых комплексов. Например, в клетках млекопитающих Cdk1-циклин А регулирует некоторые процессы в митозе, включающие конденсацию хромосом и их выстраивание у митотического веретена. Варианты циклина В, обладающие разной локализацией и периодически меняющие активность в цикле, вероятно, регулируют другие процессы митоза за счет фосфорилирования различных субстратов. В результате многолетних исследований было найдено много субстратов Cdk1, некоторые из них являются реальными кандидатами на роль эффекторов Cdk1 в митозе.
Хотя Cdk1 считается основным регулятором митоза, другие представители семейства киназ также играют важную роль в различных митотических процессах, и в настоящем разделе мы рассмотрим три группы таких киназ. К их числу относится уже упомянутое выше семейство PLK. Впервые эти киназы были обнаружены в мутантах Drosophila, у которых были нарушены некоторые процессы митоза, а в дальнейшем PLK были найдены в клетках многих эукариот, где они выполняют роль пускового фактора митоза, участвуют в созревании центросом, образовании веретена, сегрегации хромосом и в цитокинезе. В то время как геном Drosophila и дрожжей кодирует только одну киназу, в клетках позвоночных образуется до четырех разных представителей семейства PLK. При этом наиболее функционально близким к ферменту дрожжей и Drosophila является Plk 1. Все ферменты содержат N-концевой киназный домен и С-концевой участок, включающий одну или несколько консервативных последовательностей, которые называются доменами Polo (или Polo boxes). Строение концевых участков и активация PLK показаны на рисунке ниже.
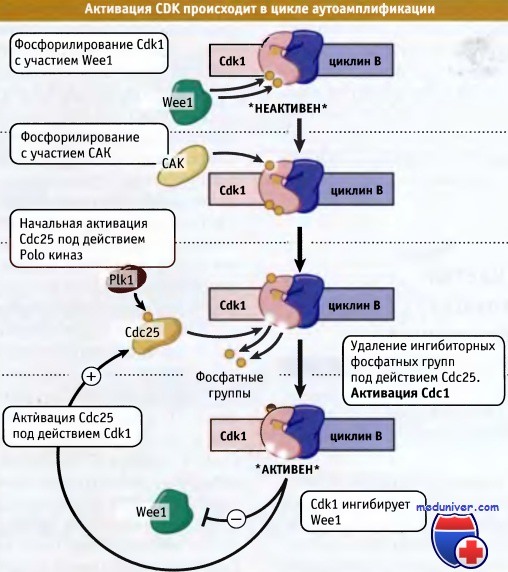
Фосфорилирование Cdk1 подготавливает фермент к активации, однако он поддерживается в неактивном состоянии.
Polo- киназы (Plks) активируют фосфатазу Cdc25, которая затем активирует небольшое количество Cdk1, удаляя фосфатные группы.
После активации эта киназа фосфорилирует Cdc25, что приводит к увеличению уровня активного фермента.
Наряду с этим, при активации некоторого количества Cdc1 она фосфорилирует и инактивирует Weel.
Этот цикл аутоамплификации приводит к резкой активации Cdc1.
Домены Polo выполняют роль внутриклеточных функциональных доменов и участвуют в позиционировании киназ на многочисленных сайтах причаливания, расположенных на центросомах, кинетохорах (белковые структуры, связывающие хромосомы с концами микротрубочек), митотическом веретене и цитокинетическом кольце. Эти домены связываются с мотивом фосфо-Сер/Трео-Про, который представляет собой фосфорилированную консенсусную последовательность в Cdk1 и в других киназах, обладающих сродством к пролин-содержащим сайтам, таких как МАР киназы. Эти данные позволяют предполагать, что PLK присоединяются к белкам, которые предварительно были фосфорилированы Cdk1 или другими киназами, хотя возможно, что in vivo сайты причаливания PLK получают дополнительную информацию от присоединяемых компонентов. Такой механизм мог бы обеспечить координацию активности различных митотических киназ, а также совместную регуляцию Plk1 и других протеинкиназ. Он также помог бы объяснить, почему в митозе PLK активируются параллельно или вслед за Cdkl и другими киназами. По-видимому, в различных сайтах для PLK существует множество субстратов. Все известные субстраты принимают участие в формировании веретена и в цитокинезе.
Еще одна группа киназ , участвующих в митозе, представлена семейством NimA-подобных киназ (NEK). Эти ферменты были обнаружены у A. nidulans. История открытия NEK хорошо иллюстрирует тезис о том, насколько важно использовать различные организмы для исследования процессов, контролирующих клеточный цикл. Каждый из объектов исследования обладает своими особенностями, а в совокупности они обеспечивают получение разнообразной ценной информации. Мутанты nimA организма A nidulans заблокированы в С2-периоде, хотя активность Cdk1 в клетках высока. Это говорит о том, что самой по себе активации Cdk1 еще недостаточно для наступления всех событий митоза. Действительно, оказалось, что активность NIMA в митозе меняется параллельно с изменением активности Cdk1. После секвенирования первой обнаруженной киназы гомологичные NEK были найдены в клетках многих эукариот, и было продеменстрировано их участие в нескольких событиях митоза, включая конденсацию хромосом и расхождение центросом.
Третья группа киназ, которая привлекла внимание исследователей в связи с участием в процессах митоза, представлена семейством Aurora. Так же как Cdkl и PLK, киназы Aurora участвуют во многих процессах, включая конденсацию и сегрегацию хромосом, функционирование кинетохора, созревание центросом, образование веретена и цитокинез. Киназы Aurora впервые были обнаружены в почкующихся дрожжах, где они представлены одной киназой. Однако впоследствии было показано их присутствие в клетках многоклеточных эукариот и человека, где они принадлежат к одной из трех следующих групп: Aurora А, В, или С.
Все ферменты семейства Aurora имеют общую структуру: киназному домену предшествует N-концевой домен, а после киназного домена расположен небольшой С-концевой участок. Уровень Aurora А увеличивается на ранней стадии митоза, а при наступлении анафазы он понижается. Снижение содержания фермента, так же как и в случае циклинов, обусловлено его протеолизом с участием убиквитина. Активность Aurora А также регулируется за счет ее фосфорилирования по сайту, расположенному в Т-петле. Как и для Cdk1, это фосфорилирование играет существенную роль в активации Aurora А, и процесс находится под контролем нескольких, пока неполностью охарактеризованных белков. В регуляции активности киназы Aurora А, и, вероятно, Aurora В также участвует протеинфосфатаза 1 (РР1).
Хотя очевидно, что киназы Aurora необходимы для процессов митоза, предстоит еще многое выяснить об их регуляции и о деталях механизма действия. Также неясно, каким образом активность киназ Aurora связана с активностью других киназ, принимающих участие в митозе. Например, неизвестно, функционируют ли они в митозе параллельно, по отдельности или в сочетании с другими киназами.
К числу важнейших выводов, полученных в результате исследований киназ Aurora, относится признание того, что эти ферменты, вероятно, участвуют в генезе опухолей. Опухоли многих типов содержат повышенный уровень киназ Aurora, и гиперэкспрессия Aurora А может приводить к злокачественной трансформации клеток грызунов. Хотя механизм этого явления неизвестен, гиперэкспрессия фермента, вероятно, вызывает амплификацию центросом и дефекты сегрегации хромосом. Более того, считается, что ген, кодирующий Aurora А, обусловливает предрасположенность к развитию рака.
Обобщая все изложенное выше, отметим, что инициация митоза и прохождение клетки через эту стадию цикла требуют функционирования CDK, Plk, NEK и протеинкиназ семейства Aurora. Поскольку активность этих киназ играет критическую роль в поддержании целостности генома, активность каждой киназы регулируется тщательным образом с тем, чтобы избежать несвоевременной активации и обеспечить своевременную ее инактивацию. Накапливаются данные, свидетельствующие о зависимости активности Plk от присутствия других киназ, особенно CDK.
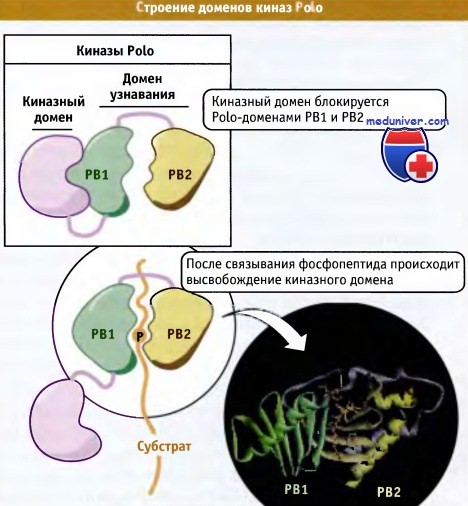
Киназы семейства Polo обладают N-концевым киназным доменом и С-концевым участком,
содержащим два консервативных домена, называемых Polo-домены (РВ1 и РВ2).
Эти домены участвуют в узнавании киназой своих внутриклеточных партнеров.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Найди готовую курсовую работу выполненное домашнее задание решённую задачу готовую лабораторную работу написанный реферат подготовленный доклад готовую ВКР готовую диссертацию готовую НИР готовый отчёт по практике готовые ответы полные лекции полные семинары заполненную рабочую тетрадь подготовленную презентацию переведённый текст написанное изложение написанное сочинение готовую статью
Частица массой движется в потенциальном поле, в котором её потенциальная энергия равна (гармонический осциллятор). Оцените с помощью соотношения неопределённостей минимально возможную энергию частицы в этом поле
Используя соотношение неопределённостей энергии и времени, определите естественную ширину спектральной линии излучения атома при переходе его из возбуждённого состояния в основное. Среднее время жизни атома в возбуждённом состоянии , а длина волны
Свободно движущаяся нерелятивистская частица имеет относительную неопределённость кинетической энергии порядка . Оцените, во сколько раз неопределённость координаты такой частицы больше её дебройлевской длины волны.
Покажите, что соотношения неопределённостей позволяют сделать вывод об устойчивости атома, то есть о том, что электрон при движении по круговой орбите не может упасть на ядро.
Покажите, используя соотношение неопределённостей, что электроны не могут входить в состав атомного ядра. Линейные размеры ядра считать равными , а энергию связи нуклонов в ядре равной 10МэВ.
Кинетическая энергия электрона в атоме водорода составляет величину порядка 10эВ. Используя соотношение неопределённостей, оцените минимальные линейные размеры атома.
Считая, что минимальная энергия нуклона (протона или нейтрона) в ядре равна 10МэВ, оцените, исходя из соотношения неопределённостей, линейные размеры ядра.
Митотический цикл. Регуляция митотического цикла
РУДН. Кафедра биологии и общей генетики
Азова Мадина Мухамедовна
Период между двумя митотическими делениями ранее назывался интерфазой и рассматривался как пассивное состояние клетки. В 1953 г. А. Говард и С. Пелк опровергли представление об инертности клетки в интерфазе и предложили разбить митотический цикл на 4 периода (фазы):
· Собственно деление клетки (митоз)
· Пресинтетический период G1 ( от англ. gap - интервал)
· Синтетический период S
Рекомендуемые материалы
· Премитотический период G2
В пресинтетическом (постмитотическом) периоде завершается формирование ядрышка, осуществляется активный синтез РНК и белков, масса клетки и количество органоидов увеличивается. В этом периоде каждая хромосома соматической клетки состоит из одной хроматиды, т.е. содержит одну молекулу ДНК.
В синтетическом периоде происходит синтез ДНК (репликация) и гистоновых белков, в результате чего каждая хромосома удваивается и состоит из двух сестринских хроматид, соединенных в области центромеры.
Премитотический (постсинтетический) период характеризуется синтезом белков, необходимых для формирования нитей веретена деления, и накоплением АТФ. Хромосомы остаются двухроматидными.
Митоз разделяют на четыре последовательные фазы: профазу, метафазу, анафазу и телофазу.
В профазе хромосомы спирализуются и становятся видимыми в световой микроскоп. Ядрышко и ядерная мембрана разрушаются. Центриоли расходятся к полюсам клетки, и формируются нити веретена деления. Веретено деления представляет собой двухполюсную структуру, состоящую из микротрубочек и связанных с ними белков.
В метафазе двухроматидные хромосомы выстраиваются в экваториальной плоскости клетки, нити веретена деления прикрепляются к центромерам. В результате образуется метафазная пластинка, в которой хромосомы удерживаются натяжением микротрубочек, отходящих от них к противоположным полюсам веретена деления.
В анафазе центромеры разделяются, и, как следствие, каждая сестринская хроматида становится самостоятельной хромосомой и перемещается к соответствующему полюсу клетки со скоростью около 1 мкм/мин. В конце анафазы, которая обычно длится всего лишь несколько минут, на полюсах клетки собираются два равноценных полных набора хромосом.
Телофаза характеризуется формированием ядерной мембраны вокруг каждого набора хромосом. Конденсированный хроматин начинает деспирализоваться, исчезнувшие в профазе ядрышки вновь появляются. Веретено деления разрушается.
Клеточное деление заканчивается цитокинезом и появлением двух дочерних клеток, каждая из которых идентична материнской клетке.
Митоз обеспечивает поддержание постоянства генетического материала в ряду поколений клеток и лежит в основе процессов роста и развития организмов, а также регенерации и бесполого размножения.
Стимулами, обеспечивающими переход клетки из одного периода клеточного цикла в другой, служат активности последовательно сменяющих друг друга циклинзависимых киназ. Каждая циклинзависимая киназа (cdk) представляет собой каталитическую субъединицу холоферментного комплекса, для активности которой требуется присутствие активаторной субъединицы – циклина. В активной форме комплексы циклин–cdk фосфорилируют регуляторные белки, контролирующие протекание данной фазы:
· Комплексы циклинов D1-D3 с cdk4 или cdk6 (в зависимости от типа клеток) отвечают за начальные этапы фазы G1;
· Комплекс циклин E-cdk2 обеспечивает переход из G1 в S-фазу;
· Циклин A – cdk2 контролирует репликацию ДНК;
· Циклин B – cdk1 отвечает за переход из G2 в митоз.

Сверочная точка в G1 (R1). Остановка в G1 наблюдается после ДНК-повреждающих воздействий, нерасхождении хромосом в предыдущем делении, разрушении микротрубочек и др. Остановка может быть необратимой (например, при g-облучении) или обратимой, прекращающейся с окончанием действия фактора, ее вызвавшего (например, при восстановлении нормального пула нуклеотидов или реставрации системы микротрубочек).
Сверочная точка в G2 (R2). Выявляются повреждения, пропущенные при прохождении предыдущих сверочных точек, либо полученные на последующих стадиях клеточного цикла. Кроме того, детектируется полнота репликации ДНК, и клетки, в которых ДНК недореплицирована, не входят в митоз.
Сверочная точка сборки веретена деления. Во избежание неправильного распределения хромосом, клетки задерживаются в метафазе до тех пор, пока все кинетохоры (центромеры) не будут прикреплены к микротрубочкам.
Вещества, стимулирующие вступление клеток в митотический цикл и его прохождение, получили название факторов роста. Каждый из них взаимодействует с чувствительными по отношению к нему специфическими рецепторами, расположенными на поверхности клетки, вследствие чего на внутренней поверхности мембраны возникают новые регуляторные сигналы, в передаче которых участвуют вторичные посредники и группа специфических протеинкиназ. В результате происходит активация факторов транскрипции и экспрессия генов пролиферативного ответа, что в конечном итоге инициирует репликацию ДНК и вступление клетки в митоз.
К наиболее изученным факторам роста относятся:
· PDGF (тромбоцитарный фактор роста) стимулирует деление соединительнотканных клеток;
· EGF (эпидермальный фактор роста) стимулирует деление эпидермальных и многих других клеток;
· FGF (фактор роста фибробластов) вызывает деление клеток многих типов, включая фибробласты и эндотелиальные клетки;
· IL-(1, 2, 3 …) (интерлейкины 1, 2, 3 и др.) стимулируют пролиферацию лейкоцитов;
· CSF (факторы, стимулирующие рост клеточных колоний) являются факторами роста клеток системы кроветворения.
Нарушения в регуляции клеточного цикла приводят к неопластической трансформации клеток. Для понимания механизмов этого процесса важным событием оказалось открытие онкогенов, протоонкогенов и опухолевых супрессоров.
Онкогены – это клеточные или вирусные гены, экспрессия которых может привести к развитию новообразования.
Вместе с этой лекцией читают "Лекция 7".
Протоонкогены – это нормальные клеточные гены, усиление или модификация функции которых превращает их в онкогены.
Опухолевые супрессоры – это клеточные гены, инактивация которых резко увеличивает вероятность возникновения новообразований.
К настоящему времени обнаружено около ста онкогенов (клеточных и вирусных) и около двадцати опухолевых супрессоров. Некоторые из них приведены в таблицах 1 и 2.
Оказалось, что большинство известных протоонкогенов и опухолевых супрессоров являются компонентами нескольких общих сигнальных путей, контролирующих клеточный цикл, апоптоз, целостность генома, дифференцировку клеток.
В заключение можно сказать, что изучение процессов, протекающих в ходе митотического цикла, а также их регуляции позволит решить одну из наиболее актуальных проблем современной медицины – выявление причин и способов лечения опухолевых заболеваний человека.
Изучение механизмов регуляции митозов является одной из важнейших проблем современной биологии, поскольку митозы лежат в основе роста организмов, регенерации тканей, нарушение митотической активности – основной механизм возникновения опухолей.
В регуляции митотического цикла участвуют различные факторы, их сбалансированное взаимодействие приводит к нормальному протеканию клеточного цикла. При этом следует различать факторы, регулирующие митотический цикл, и факторы, влияющие на митотическую активность. К последним следует отнести экзогенные факторы, которые могут стимулировать или тормозит митозы. Например, колхицин (алкалоид безвремянника осеннего) – соединяется с субъединицами белка тубулина, тем самым препятствует их присоединению к центриолям. Винкристин и винбластин – препараты, используемые при лечении опухолей. Фитогемагглютинин (выделен из фасоли обыкновенной) – стимулирует митозы в культуре клеток, облепиховое масло успешно используется при лечении ожогов.
В регуляции периодов интерфазы принимают участие ранее упомянутые факторы: активаторы S-периода, М-стимулирующий и М-задерживающий факторы, циклины. Вместе с тем, следует выделить ряд особых факторов, осуществляющих общий контроль за делениями клеток. Это – протоонкогены и антионкогены, а также кейлоны.
Протоонкогены – группа генов, контролирующих нормальное клеточное деление и дифференцировку. Эти гены проявляют свою большую активность в эмбриональном периоде, в дальнейшем их активность снижается. Изменение структуры генов в результате мутаций и усиление их активности вызывает развитие опухолей. Измененные мутацией, но активные формы протоонкогенов получили название онкогенов.
Антионкогены – гены, продукты деятельности которых, угнетают митотическую активность. В настоящее время изучены различные антионкогены (RB, DCC, APC, WTI и др.) и, особенно ген р53. Последний обеспечивает поддержание стабильности генетического аппарата клетки (останавливает клеточный цикл для репарации ДНК), а при значительных нарушениях наследственного аппарата запускает механизм апоптоза.
Кейлоны – группа гормоноподобных соединений, угнетающих клеточные деления. Кейлоны образуются всеми дифференцированными клетками и воздействуют на незрелые клетки этой же ткани, тем самым поддерживая клеточный гомеостаз. Образование кейлонов контролируется механизмом отрицательной обратной связи.
Старение и гибель клеток. После определенного периода нормального функционирования у клетки начинается период старения, который морфологически проявляется:
- уменьшением объема клетки
- увеличением содержания крупных лизосом
- накоплением пигментных и жировых включений
- появлением вакуолей в цитоплазме и ядре
клеток ограничено. У опухолевых клеток функция гена нарушена, и они могут делиться неограниченное число раз.
При гибели клетки можно выделить два различных механизма ее развития: некроз и апоптоз.
Апоптоз – активный генетически контролируемый процесс гибели клетки. Апоптоз энерноемкий процесс и регулируется различными внутренними факторами клетки. Он обычно происходит в отдельных клетках и имеет место в норме у человека как в эмбриональной периоде так и у взрослого. Особенно значима роль апоптоза в следующих процессах:
- формировании органов в ходе эмбрионального развития
- удаление стареющих клеток в зрелых тканях
- реакциях тканей на действие повреждающих факторов
- в развитии инфекционных заболеваний
Сигналы, запускающие генетическую программу апоптоза:
1. Нарушение регуляторных механизмов, поддерживающих нормальную дифференцировку и функциональную активность клеток (см. регуляцию роста клеток), потеря контакта с другими клетками, изменения морфологии и функций органоидов при старении клеток.
2. Возникновение неустранимых повреждений ДНК.
3. Инфекционные заболевания (вирусные).
- утрата клеткой контакта с соседними клетками
- сжатие цитоплазмы и ядра клетки, образование вздутий и выпячиваний мембраны,
Читайте также:

