Реакция разложения это кратко
Обновлено: 05.07.2024
Реакции разложения — химические реакции, в которых из одного, более сложного вещества образуются два или более других, более простых веществ [1] .
Фактором, вызывающим разложение, могут являться различные физические воздействия. Соответственно, выделяют различные виды реакций разложения:
-
(биологический распад, биоразложение) — разложение в результате деятельности живых организмов; — реакция обменного разложения между растворенным веществом и растворителем:
- и т. д.
- Неорганическая химия
- Органическая химия
- Химические реакции
- При разложении оксида ртути(\(II\)) образуются два простых вещества — ртуть и кислород:
- При разложении воды под действием электрического тока образуются водород и кислород:
- При разложении гидроксида меди(\(II\)) образуются оксид металла и вода:
- При разложении карбоната кальция образуются оксид кальция и углекислый газ:
- Образуются малодиссоциирующие вещества (например - вода, однако есть исключения - реакция этерификации)
- Реакция сопровождается выделение большого количества тепла
- В ходе реакции образуется газ или выпадает осадок
-
— растворителем выступает какой-либо спирт; — растворителем выступает вода;
-
— термическое разложение органических соединений без доступа воздуха.
См. также
Примечания
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Реакции разложения" в других словарях:
Энергия активации реакции разложения H2O2 — Условия реакции Энергия активации, кДж/моль некаталитическая 76 катализатор Pt 57 катализатор каталаза 29 … Химический справочник
РАЗЛОЖЕНИЯ РЕАКЦИИ — РАЗЛОЖЕНИЯ РЕАКЦИИ, химические реакции, при которых из одного сложного вещества (см. СЛОЖНОЕ ВЕЩЕСТВО) образуется несколько более простых веществ (см. ПРОСТОЕ ВЕЩЕСТВО). Реакции разложения, являясь эндотермическим процессом, часто сопровождаются… … Энциклопедический словарь
РЕАКЦИИ — (1) связей силы воздействия тел на точки механической системы, в которых стесняется свобода её движения. Р. связей возникают (согласно закону Ньютона) как пассивные силы противодействия при наличии активных сил, действующих на механические связи… … Большая политехническая энциклопедия
Разложения реакции — Реакции химические, в которых из одного вещества образуются два или более веществ. Например, окись ртути при нагревании разлагается на ртуть и кислород: 2HgO = 2Hg + O2; хлористое серебро при действии света разлагается на серебро и хлор:… … Большая советская энциклопедия
Реакции химические — Химическая реакция превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются … Википедия
Реакции химические — превращения одних веществ в другие, отличные от исходных по химическому составу или строению. Общее число атомов каждого данного элемента, а также сами химические элементы, составляющие вещества, остаются в Р. х. неизмененными; этим Р. х … Большая советская энциклопедия
Химические реакции — Этим термином называется тот процесс, во время которого взятые тела превращаются в новые, ранее не существовавшие. В русском языке мы имеем два слова для выражения этого понятия: X. взаимодействие и X. превращение. Из них нужно отдать… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ЦЕПНЫЕ РЕАКЦИИ — ЦЕПНЫЕ РЕАКЦИИ, хим. реакции, каждый элементарный акт к рых с определенной, отличной от нуля вероятностью влечет за собой еще один элементарный акт. Этот второй акт с той же вероятностью повлечет за собой третий и т. д. Средняя длина (число… … Большая медицинская энциклопедия
МОНОМОЛЕКУЛЯРНЫЕ РЕАКЦИИ — (от моно . и молекула), химические реакции, в которых изменяется состав или строение только одной частицы (молекулы (см. МОЛЕКУЛА), радикала (см. РАДИКАЛЫ СВОБОДНЫЕ), иона (см. ИОНЫ)). Мономолекулярные реакции эндотермичны и для их начала… … Энциклопедический словарь
Топохимические реакции — Реакции химические, происходящие на границе раздела твёрдых фаз. Примеры Т. р.: дегидратация кристаллогидратов, восстановление окислов, термический распад азидов тяжёлых металлов и т.д. Особенности Т. р.: 1) они начинаются не во всём… … Большая советская энциклопедия
Понятие реакции разложения противоположно понятию реакции соединения. Реакции разложения характерны для сложных веществ.
В рассмотренных реакциях из одного сложного вещества в результате реакций образовалось два простых вещества .
В этих двух реакциях из одного сложного вещества образовалось два других сложных вещества .
В результате реакции разложения также может образоваться несколько веществ.
Продукты реакции могут являться как сложными, так и простыми веществами.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Реакции разложения"
В настоящее время реакции разложения широко распространены. Например, разложение воды происходят в специальном устройстве – электролизёре. При электролизе воды получают чистый кислород.
Однако, для получения кислорода в лаборатории, используют пероксид водорода (Н2О2). Если подогреть небольшое количество пероксида водорода, не доводя его до кипения, кислород выделяется очень медленно. Об этом можно судить, если поднести к пробирке, где собирался кислород, тлеющую лучинку.
Для того чтобы она вспыхнула, кислорода в данном случае недостаточно, т.е. реакция идет с небольшой скоростью. Но если, в пероксид водорода добавить порошка оксида марганца (IV), то реакция пойдет очень быстро, кислород интенсивно выделяется в виде газа, и если поднести тлеющую лучинку, то она вспыхнет из-за большого количества кислорода. В данном случае, можно говорить о большой скорости реакции. Т.е. скорость реакции – это быстрота ее протекания или быстрота превращения одних веществ в другие. Вторая реакция пошла гораздо быстрее первой. В первом случае мы нагревали пероксид водорода, а во втором – использовали вещество – оксид марганца (IV), именно оно ускорило химическую реакцию. Его называют катализатором.
Катализатор – это вещество, ускоряющее химическую реакцию, но само при этом остается неизмененным.
Доказать, что оксид марганца (IV) не расходуется в реакции очень просто. В результате разложения пероксида водорода образуется вода, если к ней долить еще некоторую порцию пероксида водорода, то реакция опять протекает так же бурно, т.е. оксид марганца (IV) остался в результате реакции неизменным.
В жизни мы тоже используем перекись водорода, обрабатывая раны. При этом происходит тоже бурное выделение кислорода. А сам процесс идет с помощью биологического катализатора – фермента каталазы. Т.е. ферменты – биологические катализаторы белковой природы. Большинство процессов в живых организмах протекает благодаря ферментам. Ферменты используются в стиральных порошках для удаления крови, белков, чая; с помощью ферментов варят пиво, изготавливают сыры, лекарственные средства.
Рассмотрим еще несколько примеров реакций разложения. Если в пробирке на пламени спиртовки подогреть студенистый осадок гидроксида меди (II), то он начинает чернеть из-за образовавшегося оксида меди (II).
Cu(OH)2 = CuO + H2O
Это тоже реакция разложения: из одного сложного вещества – гидроксида меди (II) образовалось два новых – оксид меди (II) и вода.
В промышленности для получения негашеной извести – СаО – и углекислого газа используют реакцию разложения известняка, основу которого составляет карбонат кальция.
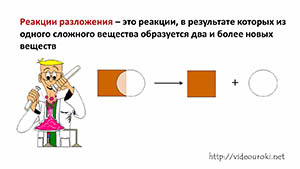
В данной реакции из одного сложного вещества образовалось два сложных и одно простое. Из этого можно сделать вывод, что реакции разложения – это реакции, в результате которых из одного сложного вещества образуется два и более новых веществ.
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF

Окислительно-восстановительные реакции (ОВР)
-
Межмолекулярные - атомы окислителя и восстановителя входят в состав разных молекул. Примеры:

Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
От обилия информации можно запутаться. Я рекомендую сформулировать четко: "Окислитель - понижает СО, восстановитель - повышает СО". Запомнив эту информацию таким образом, вы не будете путаться.

ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе "Решения задач".
Обратимые и необратимые реакции
Обратимые реакции - такие химические реакции, которые протекают одновременно в двух противоположных направлениях: прямом и обратном. При записи реакции в таких случаях вместо знака "=" ставят знак обратимости "⇆".
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)

Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
Все реакции можно разделить на гетеро- и гомогенные. Гетерогенные реакции (греч. heterogenes - разнородный) - реакции, протекающие на границе раздела фаз, в неоднородной среде. Скорость таких реакций зависит от площади соприкосновения реагирующих веществ.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:

Гомогенные реакции (греч. homogenes - однородный) - реакции, протекающие между веществами, находящимися в одной фазе.
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.

Реакции и их тепловой эффект
Все реакции можно разделить на те, в ходе которых тепло поглощается, или, наоборот, тепло выделяется. Представьте пробирку, охлаждающуюся или нагревающуюся в вашей руке - это и есть тот самый тепловой эффект. Иногда тепла выделяется так много, что реакции сопровождаются воспламенением или взрывом (натрий с водой).
Экзотермические реакции (греч. exo - вне) - химические реакции, сопровождающиеся потерей энергии системой и выделением тепла (той самой энергии) во внешнюю среду. При написании химических реакций в конце экзотермических ставят "+ Q" (Q - тепло), иногда бывает указано точное количество выделяющегося тепла. Например:
2Mg + O2 = 2MgO + Q
NaOH + HCl = NaCl + H2O + 56 кДж

К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью "запутывания" в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)

Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония ("вулканчик") является примером экзотермического разложения, при котором тепло выделяется.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Классификация реакций
Эндотермической, обратимой Эндотермической, необратимой Экзотермической, обратимой Экзотермической, необратимой
Реакция углерода с кислородом является необратимой, сопровождается выделением тепла (процесс горения) - экзотермическая.
Горение азота в кислороде, как это ни удивительно, относится к реакции эндотермической. Это связано с наличием в азоте очень прочной тройной связи, для разрыва которой нужно приложить много усилий.
Цинк вытесняет атомы водорода из кислоты, такая реакция относится к реакциям замещения.
Обратимой, экзотермической Обратимой, эндотермической Необратимой, экзотермической Необратимой, эндотермической
Читайте также:

