Реакция нейтрализации кратко микробиология
Обновлено: 05.07.2024
В основе этой реакции лежит способность специфической антитоксической сыворотки нейтрализовать экзотоксин.
Антитела иммунной сыворотки способны нейтрализовать повреждающее действие микробов или их токсинов на чувствительные клетки и ткани, что связано с блокадой микробных антигенов антителами, т. е. их нейтрализацией.
Реакцию нейтрализации (РН) проводят путем введения смеси антиген—антитело животным или в чувствительные тест-объекты (культуру клеток, эмбрионы). При отсутствии у животных и тест-объектов повреждающего действия микроорганизмов или их антигенов, токсинов говорят о нейтрализующем действии иммунной сыворотки и, следовательно, о специфичности взаимодействия комплекса антиген—антитело.
Для проведения реакции исследуемый материал, в котором предполагается наличие экзотоксина, смешивают с антитоксической сывороткой, выдерживают в термостате и вводят животным (морским свинкам, мышам). Контрольным животным вводят фильтрат исследуемого материала, не обработанный сывороткой. В том случае, если произойдет нейтрализация экзотоксина антитоксической сывороткой, животные опытной группы останутся живыми. Контрольные животные погибнут в результате действия экзотоксина.
55. Реакция иммунофлюоресценции. Механизм. Компоненты. Применение.
Иммунофлюоресцентный метод (РИФ, реакция иммунофлюоресценции, реакция Кунса) - метод выявления специфических Аг с помощью Ат, конъюгированных с флюорохромом. Обладает высокой чувствительностью и специфичностью.
Применяется для экспресс-диагностики инфекционных заболеваний (идентификация возбудителя в исследуемом материале), а также для определения Ат и поверхностных рецепторов и маркеров лейкоцитов (иммунофенотипирование) и др. клеток.
Обнаружение бактериальных и вирусных антигенов в инфекционных материалах, тканях животных и культурах клеток при помощи флюоресцирующих антител (сывороток) получило широкое применение в диагностической практике. Приготовление флюоресцирующих сывороток основано на способности некоторых флюорохромов (например, изотиоцианата флюоресцеина) вступать в химическую связь с сывороточными белками, не нарушая их иммунологической специфичности.
Различают три разновидности метода: прямой, непрямой, с комплементом. Прямой метод РИФ основан на том, что антигены тканей или микробы, обработанные иммунными сыворотками с антителами, меченными флюорохромами, способны светиться в УФ-лучах люминесцентного микроскопа. Бактерии в мазке, обработанные такой люминесцирующей сывороткой, светятся по периферии клетки в виде каймы зеленого цвета. Непрямой метод РИФ заключается в выявлении комплекса антиген - антитело с помощью антиглобулиновой (против антитела) сыворотки, меченной флюорохромом. Для этого мазки из взвеси микробов обрабатывают антителами антимикробной кроличьей диагностической сыворотки. Затем антитела, не связавшиеся антигенами микробов, отмывают, а оставшиеся на микробах антитела выявляют, обрабатывая мазок антиглобулиновой (антикроличьей) сывороткой, меченной флюорохромами. В результате образуется комплекс микроб + антимикробные кроличьи антитела + антикроличьи антитела, меченные флюорохромом. Этот комплекс наблюдают в люминесцентном микроскопе, как и при прямом методе.
Механизм. На предметном стекле готовят мазок из исследуемого материала, фиксируют на пламени и обрабатывают иммунной кроличьей сывороткой, содержащей антитела против антигенов возбудителя. Для образования комплекса антиген — антитело препарат помещают во влажную камеру и инкубируют при 37 °С в течение 15 мин, после чего тщательно промывают изотоническим раствором хлорида натрия для удаления не связавшихся с антигеном антител. Затем на препарат наносят флюоресцирующую антиглобулиновую сыворотку против глобулинов кролика, выдерживают в течение 15 мин при 37 °С, а затем препарат тщательно промывают изотоническим раствором хлорида натрия. В результате связывания флюоресцирующей антиглобулиновой сыворотки с фиксированными на антигене специфическими анти телами образуются светящиеся комплексы антиген — антитело, которые обнаруживаются при люминесцентной микроскопии.
61. Реакции нейтрализации. Механизм, компоненты, способы постановки, применение. Реакция нейтрализации токсина антитоксином.
Реакция нейтрализации
Антитела иммунной сыворотки способны нейтрализовать повреждающее действие микробов или их токсинов на чувствительные клетки и ткани, что связано с блокадой микробных антигенов антителами, т. е. их нейтрализацией. Реакцию нейтрализации (РН) проводят путем введения смеси антиген—антитело животным или в чувствительные тест-объекты (культуру клеток, эмбрионы). При отсутствии у животных и тест-объектов повреждающего действия микроорганизмов или их антигенов, токсинов говорят о нейтрализующем действии иммунной сыворотки и, следовательно, о специфичности взаимодействия комплекса антиген—антитело
Реакция нейтрализации основана на способности специфических вируснейтрализующих антител блокировать инфекционные, гемагглютинирующие, гемадсорбирующие, цитопатические, бляшкообразующие и др. свойства вирусов.
Реакции нейтрализации т У!УО ставят в культурах клеток, куриных эмбрионах и на лабораторных животных.
Принцип . Смесью вирус (исследуемый или известный) + сыворотка (диагностическая или исследуемая), выдержанной в течение определенного времени, заражают культуру клеток, куриный эмбрион или лабораторное животное. При (+> реакции, т.е. при нейтрализации вируса антителами индикаторные объекты продолжают нормально существовать, а в контроле — гибель или характерные изменения.
Реакция нейтрализации — реакция торможения гемагглютинации (РТГА).
РТГА применяется:
-для серотипирования вирусов;
-для серодиагностики инфекций.
Выделяют два способа постановки:
- капельный способ на стекле (ориентировочная реакция), применяется для серо копирования вирусов;
- развернутый в пробирках.
Механизм . У некоторых вирусов (например, гриппа) есть гемагглютинин, вызывающий агглютинацию эритроцитов различных животных, в зависимости от вида вируса. При наличии в сыворотке антител — антигемагглютининов наблюдаются инги-бирования активности вирусов.
РТГА.
Цель: серотипирование вируса гриппа А
Компоненты:
1. Исследуемый материал — аллантоисная жидкость куриного эмбриона,
2. Диагностические противогриппозные типоспецифиче-ские сыворотки,
3. 5 % взвесь куриных эритроцитов.
4. Физиологический раствор.
Реакция ставится на стекле капельным способом. На стекло наносят по 1 капле диагностических сывороток и исследуемого материала, перемешивают, затем добавляют 1 каплю взвеси эритроцитов. При положительной реакции наблюдается гомогенное покраснение, а при отрицательной выпадение хлопьев красного
Реакция нейтрализации токсин а взаимодействие токсина со специфическим антитоксином, приводящее к образованию комплекса, не обладающего токсичностью.
еакция нейтрализации на животных применяется:
- для определения специфической активности анатоксинов (дифтерийный, столбнячный и др.) по стандартной антитоксической сыворотке и по опытной дозе токсина. Активность анатоксинов выражается в единицах связывания (ЕС), ЕС -количество анатоксина, которое целиком связывается с ШЕ/мл антитоксической сыворотки;
- для идентификации бактерий (возбудители газовой анаэробной инфекции, столбняка, ботулизма и др.) по стандартной антитоксической сыворотке;
- для титрования антитоксических сывороток (противодифтерийная, противостолбнячная и др.) по стандартному токсину. Титрование — это определение количества антитоксинов в 1 мл сыворотки. Специфическая активность сывороток выражается в международных антитоксических единицах (МЕ). 1МЕ —минимальное количество сыворотки, которое способно нейтрализовать определенную дозу токсина, выражающуюся в стандартных единицах: смертельных, некротических или реактивных дозах, в зависимости от вида токсина и способа титрования.
Титрование антитоксических сывороток может производиться следующими методами:
Метод Эрлиха. Титрование антитоксических сывороток по известной смертельной (опытной) дозе токсина.
Проводится в 2 этапа:
1) определение опытной дозы токсина. Смертельная доза — это количество токсина, которое в смеси с 1МЕ стандартной сыворотки вызывает гибель 50 % взятых в опыт животных;
2) к различным разведениям испытуемой сыворотки добавляют опытную дозу токсина, инкубируют 45 минут и вводят животным. По результатам производят расчет
титра сыворотки.
Метод Ремера. Титрование антитоксических сывороток по известной некротической дозе токсина. Проводится в 2 этапа:
1) определение опытной некротической дозы токсина путём внутрикожного введения морской свинке различного количества токсина со стандартной сывороткой. Некротическая доза токсина — это его минимальное количество, которое в смеси с 1/50МЕ стандартной сыворотки вызывает на месте внутрикожного введения некроз на 4-5-и день;
2) к различным разведениям испытуемой сыворотки добавляют опытную дозу токсина и вводят внутрикожно морской свинке.
По результатам производят расчёт титра сыворотки. Так титруется противодифтерийная сыворотка.
Реакции нейтрализации ( РН ). Схема реакции нейтрализации ( РН ). Реакции нейтрализации вирусов. Реакции нейтрализации токсинов.
Реакции нейтрализации (РН) основаны на способности AT связывать различные возбудители или их метаболиты, лишая тем самым их возможности реализовать свои биологические свойства (иными словами, AT нейтрализуют возбудителей). На практике РН применяют для выявления вирусов и различных токсинов. В определённой степени к ним же относят реакции торможения вирусиндуцированной гемагглютинации и иммобилизации.
Реакции нейтрализации вирусов
В сыворотке крови переболевших лиц циркулируют AT, нейтрализующие вирусы. Их наличие выявляют смешиванием культуры возбудителя с сывороткой с последующим введением лабораторному животному или заражением культуры клеток. На эффективность нейтрализации указывает выживание животного либо отсутствие гибели клеток в культурах.
Реакции нейтрализации токсинов
Реакции нейтрализации токсинов применяется для идентификации бактериальных экзотоксинов по видовой и типовой их принадлежности, а также для определения содержания антитоксинов в исследуемой сыворотке. Принцип основан на способности антитоксинов связывать токсин и блокировать его действие. Для идентификации токсина и определения титра антитоксических AT их смесь вводят лабораторным животным. При соответствии типа токсина и антисыворотки гибели животных не наблюдают. Нейтрализацию токсинов in vitro определяют в реакции флоккуляции. Для определения антитоксического иммунитета у человека часто применяют кожные пробы (например, пробу Шика).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Реакция нейтрализации (РН)
Антитела иммунной сыворотки способны нейтрализовать повреждающее действие микробов или их токсинов на чувствительные кшетки и ткани, что связано с блокадой микробных антигенов антителами, т.е. их нейтрализацией.
Реакцию нейтрализации (РН) проводят путем введения смеси антиген - антитело животным или в чувствительные тест-объекты (культуру клеток, эмбрионы). При отсутствии у животных и тест-объектов повреждающего действия микроорганизмов или их антигенов, токсинов говорят о нейтрализующем действии иммунной сыворотки и, следовательно, о специфичности взаимодействия комплекса антиген - антитело. См. также: реакция флоккуляции.
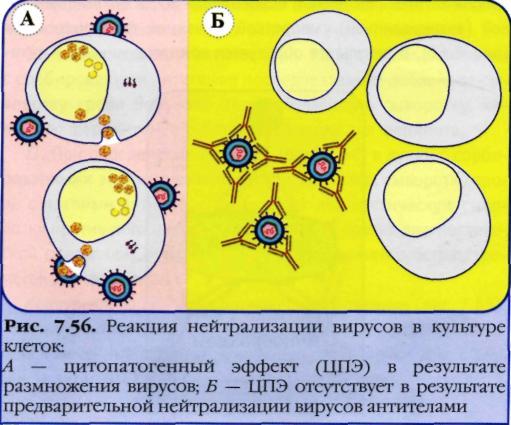
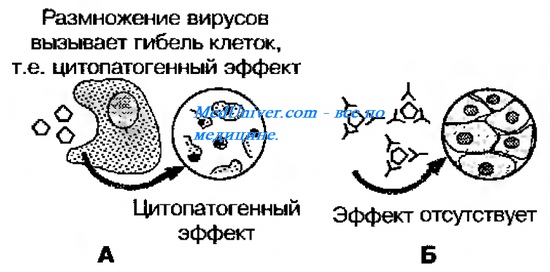
Реакция нейтрализации вирусов в культуре клеток:
А - цитопатогенный эффект (ЦПЭ) в результате размножения вирусов;
Б - ЦПЭ отсутствует в результате нейтрализации вирусов антителами.
Читайте также:

