Реакция нейтрализации это кратко
Обновлено: 07.07.2024
Нейтрализа́ция (от лат. neuter — ни тот, ни другой) — взаимодействие кислот с основаниями, в результате которого образуются соли и вода, например:
НСl + NaOH = NaCl + Н2О
В ионном виде уравнение записывают так:
Раствор становится нейтральным, если были взяты сильные кислоты и основания.
Примеры
Применение
Нейтрализация лежит в основе ряда важнейших методов титриметрического анализа.
Wikimedia Foundation . 2010 .
Смотреть что такое "Реакция нейтрализации" в других словарях:
реакция нейтрализации — – реакция между кислотой и основанием, при которой компоненты реагируют друг с другом в эквивалентных стехиометрических количествах, а продуктами являются соль и вода. Общая химия : учебник / А. В. Жолнин [1] Реакция нейтрализации – реакция, в… … Химические термины
реакция нейтрализации — РН — [Англо русский глоссарий основных терминов по вакцинологии и иммунизации. Всемирная организация здравоохранения, 2009 г.] Тематики вакцинология, иммунизация Синонимы РН EN neutralization testNT … Справочник технического переводчика
реакция нейтрализации (РН) вируса — Лабораторный метод. [Англо русский глоссарий основных терминов по вакцинологии и иммунизации. Всемирная организация здравоохранения, 2009 г.] Тематики вакцинология, иммунизация EN viral neutralization testNT … Справочник технического переводчика
реакция нейтрализации токсина — (син. реакция токсин антитоксин ) взаимодействие токсина со специфическим антитоксином, приводящее к образованию комплекса, не обладающего токсичностью … Большой медицинский словарь
реакция нейтрализации в вирусологии — метод идентификации вируса, основанный на феномене потери им инфекционности в результате взаимодействия со специфическими антителами … Большой медицинский словарь
реакция — – процесс взаимодействия. Словарь по аналитической химии [3] • реакция нейтрализации реакция обмена окислительно восстановительные реакции … Химические термины
реакция "токсин-антитоксин" — см. Реакция нейтрализации токсина … Большой медицинский словарь
Нейтрализации реакция — (РН) лабораторный тест, в к ром Ат иммунной с ки нейтрализуют, обезвреживают, тормозят биол. активность (летальную, инфекц., токсическую, ферментативную и др.) микроорганизмов, их токсинов и ферментов. РН применяют: 1) для качественного и… … Словарь микробиологии
Реакция Соногашира — Реакция Соногашира именная реакция в органической химии, присоединение галогеналканов к терминальным алкинам. Данная реакция была впервые проведена Кенкичи Соногашира и Нобуе Хогихара в 1975 году. Катализаторы Для проведения реакции… … Википедия
РЕАКЦИЯ СРЕДЫ — РЕАКЦИЯ СРЕДЫ, термин, употребляемый в химии и характеризующийся соотношением водородных и гидроксильных ионов. Р. с. является кислой, если в растворе преобладают водородные ионы; раствор обнаруживает в атом случае свойства к^гы. В случае… … Большая медицинская энциклопедия

Взаимодействие кислоты и основания с образованием соли и воды называется реакцией нейтрализации. Обычно подобные реакции протекают с выделением тепла.
Общее описание
Суть нейтрализации состоит в том, что кислота и основание, обмениваясь активными частями, нейтрализуют друг друга. В результате образуется новое вещество (соль) и нейтральная среда (вода).
Простым и наглядным примером реакции нейтрализации является взаимодействие соляной кислоты и гидроксида натрия:
Если опустить лакмусовую бумажку в раствор соляной кислоты и гидроксида натрия, то она окрасится в фиолетовый цвет, т.е. покажет нейтральную реакцию (красный – кислая среда, синий – щелочная среда).
Раствор двух активных соединений превратился в воду за счёт обмена натрием и хлором, поэтому ионное уравнение данной реакции выглядит следующим образом:
После нагревания получившегося раствора вода испарится, а в пробирке останется поваренная соль – NaCl.
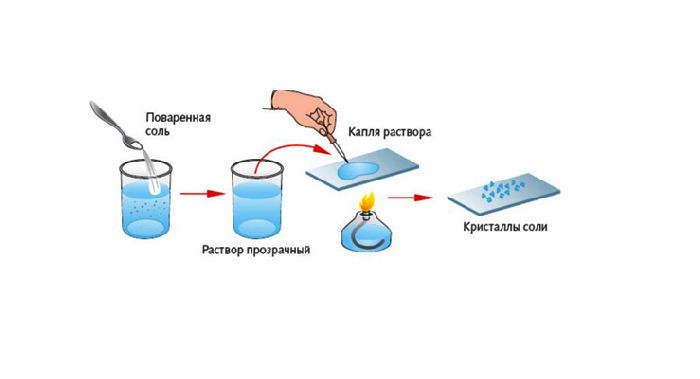
Рис. 1. Образование соли после выпаривания.
В подобных реакциях вода – обязательный продукт.
Примеры
Реакция нейтрализации может происходить между сильными и слабыми кислотами и щелочами. Рассмотрим два типа реакций:
- необратимые реакции – образованная соль не распадается на составляющие вещества – кислоту и щёлочь (протекают в одну сторону);
- обратимые реакции – образованные соединения способны распадаться на изначальные вещества и вновь взаимодействовать (протекают в обе стороны).
Примером первого вида реакций является взаимодействие сильной кислоты с сильным основанием:
Обратимые реакции протекают при нейтрализации слабой кислоты сильным основанием, а также слабого основания слабой кислотой:
Слабые нерастворимые или слаборастворимые основания (Fe(OH)3, Fe(OH)2, Mg(OH)2, Zn(OH)2) также нейтрализуются сильной кислотой. Например, гидроокись меди не растворяется в воде, но при взаимодействии с азотной кислотой образует соль (нитрат меди) и воду:

Рис. 2. Взаимодействие гидроокиси меди с кислотой.
Реакции нейтрализации экзотермичные, они протекают с выделением тепла.
Использование
Реакции нейтрализации – основа титриметрического анализа или титрования. Это метод количественного анализа концентрации веществ. Метод используется в медицине, например, для определения кислотности желудочного сока, а также в фармакологии.

Рис. 3. Титрование.
Кроме того, важно практическое применение нейтрализации в лаборатории: при проливе кислоты её можно нейтрализовать щёлочью.
Что мы узнали?
Реакция, при которой кислота и основание образуют соль и воду, называется нейтрализацией. Эта реакция возможна между любыми кислотами и основаниями: сильной кислотой и сильной щёлочью, слабой кислотой и слабым основанием, сильным основанием и слабой кислотой, слабым основанием и сильной кислотой. Реакция протекает с выделением тепла. Нейтрализация применяется в медицине и фармакологии.
Химический процесс, при котором кислота и щёлочь образуют воду и соль, называется реакцией нейтрализации. Реагировать между собой могут сильные и слабые вещества. При этом выделяется тепловая энергия. Эти свойства химических веществ нашли практическое применение в фармакологии, медицине и промышленности.

Общие принципы

Сущность реакции нейтрализации заключается в том, что кислота и основание вступают во взаимодействие. Они обмениваются активными компонентами. Происходит нейтрализация обоих составляющих. В итоге получается вода и соль, имеющие нейтральную реакцию среды.
Общий принцип взаимодействия выглядит следующим образом: кислота соединяется со щёлочью, обменивается активными компонентами, в результате чего получается нейтральная соль и вода.
Наиболее простым примером реакции нейтрализации может стать взаимодействие гидроксида натрия с соляной кислотой. Формула представлена так:
NaOH + HCl → NaCl + H2O.
Перед соединением этих веществ можно проверить их реакцию с помощью лакмусовой бумаги:
- В присутствие соляной кислоте лакмус окрасится в красный цвет.
- В щелочном растворе гидроксида натрия — в синий.
- После смешивания растворов бумажка покажет нейтральную реакцию, то есть будет фиолетовой.
Ионное уравнение нейтрализации выглядит так: H + + OH - → H2O.

Если получившийся раствор нагреть, вода постепенно испарится. В колбе останется осадок — поваренная соль (хлорид натрия).
Чтобы лучше понять, что такое реакция нейтрализации в химии, важно помнить, что 2 сложных вещества обмениваются между собой частями. В итоге получается 2 новых сложных компонента. Таким образом, нейтрализация — это частный случай большой группы реакций обмена.
Некоторые основания не растворяются в воде, но хорошо растворяются в кислотах. В результате взаимодействия тоже образуется вода и соль. Примером может быть реакция между нерастворимым гидроксидом меди и серной кислотой. В итоге получается медный купорос и вода.
Виды реакции
Процесс химической нейтрализации может происходить между веществами с разной активностью: сильной кислотой и таким же основанием или между слабой кислотой и сильной щёлочью. В химии выделяют 2 типа реакции:

- Необратимые — получившиеся вещества не распадаются, то есть реакция протекает в 1 сторону. Обычно так протекает реакция сильной кислоты и сильного основания.
- Обратимые — протекают в обе стороны. То есть соль может распадаться и снова получается кислота и основание. Встречаются, если слабый компонент встречается с сильным.
Реакции нейтрализации относятся к разряду экзотермичных. При взаимодействии выделяется много энергии в виде тепла. Количество выделенной энергии — относительный показатель, который получил название теплового эффекта химической реакции.
Мера энергии, накопленной веществом при образовании, называется энтальпией. В экзотермических реакциях значение энтальпии всегда бывает отрицательным.
Названия солей
Все международные химические названия солей, полученных в результате нейтрализации, строятся по единому принципу и состоят из двух слов. Первое слово — это наименование кислотного остатка. Оно является производным от латинского названия кислоты:

- серной — сульфат;
- азотной — нитрат;
- соляной — хлорид;
- фосфорной — фосфат и пр.
Второе слово в названии соли — это наименование металла. У некоторых элементов периодической таблицы валентность изменяется. В этом случае она указывается в скобках.
В качестве примера можно привести названия солей:
- фосфат калия — K3PO4;
- сульфат меди — CuSO4;
- нитрат натрия — NaNO3.
Это утверждение верно и для обратной ситуации — по названию соли можно определить её химическую формулу. Вначале записывается символ, которым металл обозначается в периодической таблице. Затем добавляется формула кислотного остатка.
Следующий шаг — определение валентности обеих частей. Теперь нужно найти для них наименьшее общее кратное и разделить его на валентность каждой части соли. Значит, в результате получается количество атомов металла в формуле и количество кислотных остатков.
Кислотный остаток может иметь сложную структуру и содержать в себе несколько разных атомов (азотная, серная, фосфорная кислоты и пр.). При составлении формулы соли кислотный остаток вписывается в скобки. За ними цифровым индексом обозначается количество остатков.
Титрование и химический эквивалент
Реакция нейтрализации связана с процедурой титрования. В химии так принято называть определение количества щёлочи или кислоты в растворе. Для этого берётся реагент с заданной заранее молярной концентрацией. Вычисляется, сколько его нужно для осаждения искомого вещества. При титровании используется понятие химической эквивалентности:

- Для кислоты химический эквивалент — это количество кислоты, которое в реакции со щёлочью выделяет 1 моль ионов водорода.
- Для основания это показатель количества, которое выделяет 1 моль ионов OH - .
Если реагируют одинаковые химические эквиваленты, нейтрализация называется полной. В этом случае в растворе не останется кислоты или щёлочи, не вступившей в реакцию. Масса эквивалента кислоты или основания в граммах называется грамм-эквивалентом.
Все кислоты, которые выделяют из 1 молекулы 1 ион водорода, подчиняются следующей закономерности: их химический эквивалент равняется 1 молю вещества. Молекулярная масса таких соединений равна 1 грамм-эквиваленту.
Если вещество выделяет из 1 молекулы 2 иона водорода, его грамм-эквивалент равен половине молекулярной массы, а 1 моль соответствует 2 химическим эквивалентам.
С этим химическим процессом связано ещё одно понятие — нормальность или нормальная концентрация вещества. Этот фактор отражает, сколько эквивалентов содержит 1 литр раствора.
Применение на практике
Методы нейтрализации положены в основу титриметрического анализа. Титрование используется во многих сферах:
- В диагностике заболеваний пищеварительной системы титрование применяют для определения количества соляной кислоты в желудочном соке.
- В лабораторной диагностике применяется реакция нейтрализации для определения буферной ёмкости плазмы крови.
- Многие тяжёлые заболевания и угрожающие жизни состояния сопровождаются сдвигом рН биологических жидкостей. Сдвиг может произойти в кислую сторону (ацидоз) или в щелочную (алкалоз). Чтобы скорректировать кислотно-основное равновесие, необходимо определить рН.
- Чтобы сократить содержание в крови щелочных компонентов, при метаболическом ацидозе в качестве экстренной меры используют внутривенное вливание щелочного раствора (бикарбоната натрия, лактата натрия, Трисамина). В результате происходит выравнивание баланса в организме.
- Для коррекции алкалоза вводят раствор аскорбиновой кислоты. Она нейтрализует избыток щелочных оснований.
- Наиболее широко используются реакции нейтрализации при лечении болезней желудка. При повышенной кислотности назначают антацидные средства — оксид магния, карбонат кальция и пр.
- В фармакологии и аналитической химии титрование применяют для определения количества органических и неорганических кислот в составе вещества. Кроме того, метод позволяет определить, проходят ли лекарственные средства через клеточные мембраны и с какой скоростью.
- Метод нейтрализации используется в пищевой и химической промышленности. С его помощью определяют количество кислоты или щёлочи в том или ином веществе, продукте или жидкости.
Нередко эта химическая реакция используется в быту. При проливе уксусной или другой кислоты на кожу может возникнуть ожог. В качестве первой помощи необходимо тщательно промыть место чистой водой, после чего обработать содовым раствором. Той же тактики придерживаются при ожоге едкой щёлочью. В качестве нейтрализатора используется лимонная или уксусная кислота в слабом разведении.
реакция нейтрализации это то, что происходит между кислотой и основным видом в количественном отношении. В общем, вода и соль образуются в реакциях этого типа в водной среде (ионные частицы, состоящие из катиона, отличного от Н). + и анион, отличный от ОН - ты O 2- ) согласно следующему уравнению: кислота + основание → соль + вода.
В реакции нейтрализации участвуют электролиты, которые представляют собой вещества, которые при растворении в воде образуют раствор, который обеспечивает электропроводность. Кислоты, основания и соли считаются электролитами.

Таким образом, сильные электролиты - это те частицы, которые полностью диссоциируют в составляющих их ионах, когда они находятся в растворе, в то время как слабые электролиты только частично ионизируются (они имеют меньшую способность проводить электрический ток, то есть они не являются хорошими проводники любят сильные электролиты).
- 1 Характеристики
- 1.1 Кислотно-щелочное титрование
- 2.1 Сильная кислота + сильное основание
- 2.2 Сильная кислота + слабое основание
- 2.3 Слабая кислота + сильное основание
- 2.4 Слабая кислота + слабое основание
черты
Во-первых, следует подчеркнуть, что если реакция нейтрализации инициируется равными количествами кислоты и основания (в молях), когда реакция заканчивается, получается только одна соль; то есть нет остаточных количеств кислоты или основания.
Кроме того, очень важным свойством кислотно-основных реакций является рН, который указывает, насколько кислым или щелочным является раствор. Это определяется количеством ионов H + найдено в измеренных растворах.
С другой стороны, существует несколько концепций кислотности и основности в зависимости от параметров, которые принимаются во внимание. Выделяется концепция Бренстеда и Лоури, которая рассматривает кислоту как разновидность, способную жертвовать протоны (H + ) и база как вид, способный их принять.
Кислотно-основное титрование
Чтобы правильно и количественно изучить реакцию нейтрализации между кислотой и основанием, применяется метод, называемый кислотно-щелочным титрованием (или титрованием)..
Кислотно-основное титрование состоит из определения концентрации кислоты или основания, необходимой для нейтрализации определенного количества основания или кислоты известной концентрации..
На практике стандартный раствор (концентрация которого точно известна) должен постепенно добавляться к раствору, концентрация которого неизвестна, пока не будет достигнута точка эквивалентности, когда один из видов полностью нейтрализует другой.
Точка эквивалентности обнаруживается насильственным изменением цвета индикатора, который был добавлен к раствору неизвестной концентрации, когда химическая реакция между обоими растворами была завершена.
Например, в случае нейтрализации фосфорной кислоты (Н3ПО4) будет точка эквивалентности для каждого протона, который отделяется от кислоты; то есть будет три точки эквивалентности и будут наблюдаться три изменения цвета.
Продукты реакции нейтрализации
В реакциях сильной кислоты с сильным основанием проводят полную нейтрализацию частиц, как в реакции между соляной кислотой и гидроксидом бария:
Таким образом, ионы H не генерируются + или ОН - в избытке, что означает, что pH растворов сильных электролитов, которые были нейтрализованы, неразрывно связаны с кислотным характером их реагентов.
Напротив, в случае нейтрализации между слабым электролитом и сильным электролитом (сильная кислота + слабое основание или слабая кислота + сильное основание) получается частичная диссоциация слабого электролита и появляется константа диссоциации кислоты (Kв) или основание (Kб) слабый, для определения кислотного или основного характера чистой реакции путем расчета pH.
Например, у вас есть реакция между синильной кислотой и гидроксидом натрия:
HCN (ac) + NaOH (ac) → NaCN (ac) + H2O (l)
В этой реакции слабый электролит существенно не ионизируется в растворе, поэтому суммарное ионное уравнение представляется следующим образом:
HCN (ac) + OH - (ac) → CN - (ac) + H2O (l)
Это получается после записи реакции с сильными электролитами в их диссоциированной форме (Na + (ac) + OH - (ac) на стороне реагентов и Na + (ac) + CN - (ac) на стороне продуктов), где только ион натрия является зрителем.
Наконец, в случае реакции между слабой кислотой и слабым основанием указанная нейтрализация не происходит. Это потому, что оба электролита диссоциируют частично, не приводя к ожидаемой воде и соли.
примеров
Сильная кислота + сильное основание
Данная реакция между серной кислотой и гидроксидом калия в водной среде взята в качестве примера согласно следующему уравнению:
Можно видеть, что и кислота, и гидроксид являются сильными электролитами; следовательно, они полностью ионизированы в растворе. PH этого раствора будет зависеть от сильного электролита, который находится в большей пропорции.
![]()
Сильная кислота + слабое основание
Нейтрализация азотной кислоты аммиаком приводит к соединению нитрата аммония, как показано ниже:
В этом случае вода, добываемая вместе с солью, не наблюдается, поскольку она должна быть представлена в виде:
Таким образом, вода может рассматриваться как продукт реакции. В этом случае раствор будет иметь практически кислый рН.
Слабая кислота + сильное основание
Далее показана реакция между уксусной кислотой и гидроксидом натрия:
Поскольку уксусная кислота является слабым электролитом, она частично диссоциирует, что приводит к получению ацетата натрия и воды, чей раствор будет иметь основной pH.
Слабая кислота + слабое основание
Наконец, как указано выше, слабое основание не может нейтрализовать слабую кислоту; Не происходит и обратное. Оба вида гидролизуются в водном растворе, и рН раствора будет зависеть от "силы" кислоты и основания.
Читайте также:


