Расскажите о нахождении железа в природе химия 9 класс кратко
Обновлено: 05.07.2024
Одним из самых известных металлов является железо. Часто металлические изделия называют железными, но это лишь один химический элемент – металл из многих. Причем химические свойства этого элемента не так просты, как кажется. В этой статье рассмотрим физические и химические особенности железа.
План урока:
Положение в таблице Менделеева и строение атома
Железо расположено в 8 группе побочной подгруппе. У этого элемента 26 электронов, распределенных по 4 уровням. Электронная конфигурация: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 . Для его атома характерно предзаполнение s-подуровня, поэтому в действительности формула следующая: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 . Железо является d-элементом. Благодаря этому, основные степени окисления железа: 0, +2, +3.
Физические свойства
Железо обладает всеми свойствами металлов:
- высокая температура плавления (1539 0 С).
Многие свойства находятся в оптимальных границах, поэтому железо часто используют при изготовлении различных изделий из металла. Для изменения определенных характеристик изготавливаются сплавы.
Основные сплавы железа
Металлы отличаются некоторыми параметрами. Например, одни обладают меньшей температурой плавления, другие большей прочностью, третьи – наиболее электропроводны. Иногда, для изменения свойств металла, его сплавляют с неметаллами (чаще всего, углерод). Самый распространенный сплав – сталь. Основу сплава составляет железо и углерод, кроме них могут добавляться различные металлы (легирующие компоненты), меняющие свойства сплава.
Таблица. Сплавы железа и их свойства
В качестве легирующих металлов стали могут использовать:
- Cr – хром
- Mo – молибден
- Ni – никель
- Si – кремний
- Cu – медь
- W – вольфрам
- Al – алюминий
- Mn – марганец
- Ti – титан
- Nb – ниобий
- Co — кобальт
Легирующими компонентами чугуна являются неметаллы: марганец, кремний, сера, фосфор и некоторые металлы (алюминий, хром).
Нахождение железа в природе
В природе железо содержится в рудах. Они могут отличаться по содержанию железа и других примесей. К основным железным рудам относятся: магнетит, гематит, пирит.
Магнетит (магнитный железняк)
Химическая формула – FeO·Fe2O3. К основному оксиду могут примешиваться различные металлы и их оксиды. Зоны залежей магнетита проводят к формированию магнитных аномалий – участков Земли, на которых магнитные приборы указывают не на полюса, а на эту залежь. По этой причине использовать компасы и электронные приборы в этих зонах бесполезно.
Магнетит добывается в Челябинской области, на Кольском полуострове, Южном Урале, на Украине (гора Кривой рог).
Кратер добычи железной руды в Курской Магнитной Аномалии. Источник
Эта руда является основной для получения железа, так как его содержание в ней – 72,4%. В форме минерала используется в качестве утяжелителя глинистых растворов при бурении.
Пирит
Химическая формула - FeS2 (серный или железный колчедан). Может содержать примеси Mn, Ni, Co. Это минерал желтого цвета. Из-за внешнего сходства его часто путали с золотом, поэтому этот минерал часто называют золотом дураков. Хотя, самородное золото часто содержится в пирите в виде примесей и даже встраивается в го кристаллическую решетку.
Считается одним из самых распространенных сульфидов. Залежи пирита расположена во всех геотермальноактивных зонах, а также, в донных отложениях Черного моря.
При контакте с воздухом окисляется до лимонита (FeOOH·(Fe2O3·nH2O).
Пирит используется для получения серной кислоты, сероводорода или в строительном деле в качестве добавки в цемент.
Гематит
Химическая формула - Fe2O3. С давних времен минерал использовался для изготовления красок, ритуальных украшений и лекарственных препаратов. В настоящее время является основным источником получения чугуна.
- Украинское (Кривбасс);
- Михайловское (КМА);
- Колатсельгские штольни;
- Байкальское месторождение;
- Альпийское;
- Кутим.
Кроме минералов существует еще метеоритное железо. Это форма металла, попавшего на Землю из космоса. Во время прохождения через плотные слои атмосферы все примеси метеорита сгорают. Такое железо считается самым чистым. Оно практически не подвергается коррозии.
Способы получения
Основным способом получения железа является выделение из минеральных руд. Основным считается доменный процесс. Выделение железа производится в несколько стадий.
Доменная печь
Таблица. Стадии доменного процесса
Мартеновская печь
Для снижения содержания примесей в чугуне, полученный материал отправляют в Мартеновскую печь. Это плавильная установка. Процесс увеличения доли железа происходит в три этапа:
- Плавление. Здесь образуется большое количество FeO.
- Окисление. С+ FeO = Fe+CO. в результате реакции доля углерода снижается.
- Раскисление. Окисление оставшегося FeO алюминием, ферромарганцем или ферросилицием.
Электрическая печь
Установка предназначена для получения легированной стали. Установка разогревается до высоких температур (цифра зависит от итогового сплава) и добавляется окислительный материал (нихром, фехраль и т.д.).
Химические свойства железа
Железо – элемент средней активности. Без нагревания многие реакции даже с сильными окислителями идут крайне медленно. При повышении температуры скорость взаимодействия увеличивается.
Взаимодействие с неметаллами
С неметаллами железо образует бинарные соединения – соли или оксиды.
Важная особенность: при взаимодействии с простыми веществами (кроме кислорода), железо проявляет степень окисления +3.
С кислородом образуется сразу два оксида со степенями окисления +2 и +3:
Взаимодействие с водой
Железо реагирует с парами воды в раскалённом состоянии:
Отношение железа к кислотам
С концентрированными кислотами железо не реагирует (пассивирует).
С растворами реакция идет также как и у других металлов – с образованием соли и водорода. Важно: при реакции со сложными соединениями железо проявляет степень окисления +2.
Реакция с солями
Железо реагирует с солями, металл которых пассивнее железа. Это значит, он должен располагаться левее в ряду активности металлов.
Смешанный оксид Fe3O4
Интересным соединение железа является смешанный оксид. Его особенность в том, что в одной кристаллической решетке есть сразу два иона железа - +2 и +3. Так как они образуют единый комплекс, часто их записывают как один оксид. На самом деле это кристаллогидрат двух оксидов: FeO⋅Fe2O3. Для него характерны следующие реакции:
Гидроксиды железа 2 и 3
Гидроксиды железа являются амфотерными соединениями, но с разной степенью основности.
Fe(OH)2
Гидроксид железа (II) – соединение коричневого или буро-оранжевого цвета.
Природный минерал с этой формулой называется амакинит.
Проявляет все химические свойства основных гидроксидов (реакции замещения с солями, кислотами).
Как амфотерное соединение способен реагировать со щелочами с образованием комплексных солей:
Гидроксид железа (II) является компонентом железо-никелевых аккумуляторов.
Fe(OH)3
Соединение красно-коричневого цвета.
Проявляет амфотерные свойства.
В природе встречается в составе минерала лимонита.
Проявляет химические свойства как и Fe(OH)2.
Применение железа
Железо является основным элементом черной металлургии, где используются сплавы этого вещества. Железные изделия необходимы в строительном, отделочном, электронном ремесле. В чистом виде оно применяется в химической промышленности, для изготовления аккумуляторов, для очистки сточных вод.
FOR-DLE.ru - Всё для твоего DLE ;)
Привет, я Стас ! Я занимаюсь так называемой "вёрсткой" шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и "статейки" для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Упражнение 3. Перечислите химические свойства железа. Подчеркните особенности его взаимодействия с растворами кислот и солей, а также с неметаллами.
Взаимодействие железа с неметаллами (в зависимости от природы окислителя в продуктах реакции железо может иметь степень окисления +2 или +3):
Fe + S = FeS
Схема окислительно-восстановительной реакции.
F 0 + S 0 → F +2 S -2
Восстановитель Fe 0 - 2e → Fe +2 |2|2|1 ― процесс окисления
Окислитель S 0 + 2e → S -2 |2| |1 ― процесс восстановления
2Fe + 3Cl2 = 2Fe2Cl3
Схема окислительно-восстановительной реакции.
Fe 0 + Cl2 0 → Fe +3 Cl3 -1
Восстановитель Fe 0 - 3e → Fe +3 |3|6|2 ― процесс окисления
Окислитель Cl2 0 + 2e → 2Сl -1 |2| |3 ― процесс восстановления
3Fe + 2O2 = Fe3O4 (при высокой t 0 C)
Химическое название железной окалины Fe3O4 — оксид железа (II,III). Подобные оксиды называют смешанными. Формулу оксида железа (II, III) можно записать по-другому: FeO • Fe2O3
Схема окислительно-восстановительной реакции.
Fe 0 + O2 0 → Fe +2 O • Fe2 +3 O3 -2
Восстановитель Fe 0 -2e → Fe +2
Восстановитель 2Fe 0 -6e → 2Fe +3
---------------------------------
Восстановитель 3Fe 0 -8e → Fe 2+ + 2Fe +3 |8|8|х1 ― процесс окисления
Окислитель O2 0 +4e → 2O -2 |4| |х2 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы железа и кислорода. Находим наименьшее общее кратное для чисел 8 и 4 (количество отданных электронов 8 и присоединенных электронов 4). Это число 8, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 8 и 4, записываем результат за третьей чертой в строках, касающихся элементов железа и кислорода. Числа в последнем столбце ― 1 и 2 ― это дополнительные множители в схемах соответствующих процессов:
3Fe 0 -8e → Fe 2+ + 2Fe +3
2O2 0 +8e → 4O -2
Добавим почленно эти уравнения, получим суммарную схему:
3Fe 0 + 2O2 0 → Fe +2 + 2Fe +3 + 4O -2
Эти коэффициенты переносим в уравнение реакции (обратите внимание: два атома Fe +3 и 4 атома O -2 уже есть в составе Fe +2 O -2 • Fe2 +3 O3 -2 , поэтому перед FeO • Fe2O3 , ставим коэффициент 1).
Взаимодействие железа с водой (раскалённое железо с перегретым водяным паром):
3Fe + 4H2O = Fe3O4 + 4H2↑
Взаимодействие железа с кислотами:
Fe + 2HCl = FeCl2 + H2↑
Fe + 2H + + 2Cl - → Fe 2+ + 2Cl - + H2↑
Fe + 2H + → Fe 2+ + H2↑
Схема окислительно-восстановительной реакции.
Fe 0 + H +1 Cl → Fe +2 Cl2 + H2 0
Fe 0 - 2e → Fe +2 |2|2|1 ― процесс окисления
2H +1 + 2e → H2 0 |2| |1 ― процесс восстановления
В приведённой реакции железо — восстановитель, соляная кислота (за счёт атомов водорода в степени окисления +1) — окислитель.
Fe + H2SO4 = FeSO4 + H2↑
Fe + 2H + + SO4 2- → Fe 2+ + SO4 2- + H2↑
Fe + 2H + → Fe 2+ + H2↑
Схема окислительно-восстановительной реакции.
Fe 0 + H2 +1 SO4 → Fe +2 SO4 + H2 0
Fe 0 - 2e → Fe +2 |2|2|1 ― процесс окисления
2H +1 + 2e → H2 0 |2| |1 ― процесс восстановления
В приведённой реакции железо — восстановитель, серная кислота (за счёт атомов водорода в степени окисления +1) — окислитель.
Взаимодействие железа с растворами солей менее активных металлов:
Fe + CuCl2 = FeCl2 + Cu
Fe + Cu 2+ + 2Cl - → Fe 2+ + 2Cl - + Cu
Fe + Cu 2+ → Fe 2+ + Cu
Схема окислительно-восстановительной реакции.
Fe 0 + Cu +2 Cl → Fe +2 Cl2 + Cu 0
Fe 0 - 2e → Fe +2 |2|2|1 ― процесс окисления
Cu +2 + 2e → Cu 0 |2| |1 ― процесс восстановления
В приведённой реакции железо — восстановитель, хлорид меди (за счёт атомов меди в степени окисления +2) — окислитель.
ПРИМЕНИТЕ СВОИ ЗНАНИЯ
Упражнение 1. Составьте уравнения химических реакций, с помощью которых можно осуществить следующие превращения, для реакций, протекающих в растворах, запишите ионные уравнения, а для двух уравнений окислительно-восстановительных реакций в каждой схеме расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель:
а) FeO → Fe → FeCl3 → Fe(OH)3 → Fe2O3 → Fe2(SO4)3 → FeCl3;
FeO + CO = Fe + CO2
Схема окислительно-восстановительной реакции.
Fe +2 O + C +2 O → Fe 0 + C +4 O2
C +2 -2ē → C +4 |2|2|1 ― процесс окисления
Fe +2 +2ē → Fe 0 |2| |1 ― процесс восстановления
Проводим вертикальную черту и выписываем за ней число электронов, которые отдали и присоединили атомы углерода и железа. Находим наименьшее общее кратное для чисел 2 и 2. Это число 2, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 2, записываем результат за третьей чертой в строках, касающихся элементов углерода и железа. Множители 1 и 1 являются искомыми коэффициентами. Поскольку элементы изменили степень окисления полностью (в правой части схемы эти элементы ни в одном веществе не проявляют такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы этих элементов в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1 (который обычно не пишем) перед формулой всех соединений (FeO, CO, Fe, CO2).
FeO + CO = Fe + CO2
В приведённой реакции оксид углерода (II) — восстановитель (за счёт атомов углерода в степени окисления +2) , а оксид железа (II) — окислитель (за счёт атомов железа в степени окисления +2).
2Fe + 3Cl2 = 2FeCl3
Схема окислительно-восстановительной реакции.
Fe 0 + Cl2 0 → Fe +3 Cl3 -1
Восстановитель Fe 0 -3ē → Fe +3 |3|6|2 ― процесс окисления
Окислитель Cl2 0 +2ē → 2Cl -1 |2| |3 ― процесс восстановления
Проводим вертикальную черту и выписываем за ней число электронов, которые отдали и присоединили атомы железа и хлора. Находим наименьшее общее кратное для чисел 3 и 2. Это число 6, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 3 и 2, записываем результат за третьей чертой в строках, касающихся элементов железа и меди. Множители 2 и 3 являются искомыми коэффициентами. Поскольку элементы изменили степень окисления полностью (в правой части схемы эти элементы ни в одном веществе не проявляют такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы элемента железа в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 2 перед формулой двух соединений железа (Fe, FeCl3), а поскольку различным является индекс элемента хлора ― ставим коэффициент 3, так как относится к двум атомам хлора, перед формулой Cl2 .
2Fe + 3Cl2 = 2FeCl3
FeCl3 + 3NaOH = 3NaCl + Fe(OH) 3 ↓
Fe 3+ + 3Cl - + 3Na + + 3OH - → 3Na + + 3Cl - + Fe(OH)3↓
Fe 3+ + 3OH - → Fe(OH)3↓
2Fe(OH)3 = Fe2O3 + 3H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
Fe2O3 + 6H + + 3SO4 2- → 2Fe 3+ + 3SO4 2- + 3H2O
Fe2O3 + 6H + → 2Fe 3+ + 3H2O
Fe2(SO4)3 + 3BaCl2 = 2FeCl3 + 3BaSO4↓
2Fe 3+ + 3SO4 2- + 3Ba 2+ + 6Cl - → 2Fe 3+ + 6Cl - + 3BaSO4↓
3Ba 2+ + 3SO4 2- → 3BaSO4↓ :3
Ba 2+ + SO4 2- → BaSO4↓
Упражнение 2. Используя метод электронного баланса, составьте уравнения окислительно-восстановительных реакций, протекающих по схемам:
а) Fe(OH)2 + O2 + H2O → Fe(OH)3;
Схема окислительно-восстановительной реакции.
Fe +2 (OH)2 + O2 0 + H2O → Fe +3 (O -2 H)3
Fe +2 -1e → Fe +3 |1|4|4 ― процесс окисления
O2 0 +4e → 2O -2 |4| |1 ― процесс восстановления
Проводим вертикальную черту и выписываем за ней число электронов, которые отдали и присоединили атомы железа и кислорода. Находим наименьшее общее кратное для чисел 1 и 4. Это число 4, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 1 и 4, записываем результат за третьей чертой в строках, касающихся элементов кремния и водорода. Множители 4 и 1 являются искомыми коэффициентами. Поскольку железо изменил степень окисления полностью (в правой части схемы этот элемент ни в одном веществе не проявляет такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы этого элемента в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 4 перед формулой двух соединений железа (Fe(OH)2, Fe(OH)3). Поскольку элемент кислород изменил степень окисления не полностью, поэтому ставим коэффициент 1, который обычно не пишем, только перед перед формулой кислорода:
4Fe(OH)2 + O2 + H2O → 4Fe(OH)3
Уравниваем остальные соединения. Получим уравнение:
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
В приведённой реакции гидроксид железа (III) (за счёт атомов железа в степени окисления +2) — восстановитель, кислород — окислитель.
б) Fe + Br2 → FeBr3;
Схема окислительно-восстановительной реакции.
Fe 0 + Br2 0 → Fe +3 Br3 -1
Восстановитель Fe 0 - 3e → Fe +3 |3|6|2 — процесс окисления
Окислитель Br2 0 +2e → 2Br -1 |2| |3 — процесс восстановления
Проводим вертикальную черту и выписываем за ней число электронов, которые отдали и присоединили атомы железа и брома. Находим наименьшее общее кратное для чисел 3 и 2. Это число 6, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 3 и 2, записываем результат за третьей чертой в строках, касающихся элементов натрия и серы. Множители 2 и 3 являются искомыми коэффициентами. Поскольку эти элементы изменили степень окисления полностью (в правой части схемы эти элементы ни в одном веществе не проявляют такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы железа в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 2 перед формулой двух соединений железа (Fe2, FeBr3), а поскольку различным является индекс элемента брома― ставим коэффициент 3, перед формулой брома :
2Fe + 3Br2 = 2FeBr3
Упражнение 3. Напишите по два молекулярных уравнения, соответствующих каждому ионному уравнению:
а) Fе 2+ + 2OH - = Fe(ОН)2↓;
В левой части уравнения записаны только формулы ионов, поэтому взаимодействующие вещества должны быть сильными и растворимыми электролитами. По таблице растворимости определяем в каких веществах (берем во внимание только сильные электролиты) могут содержаться ионы Fe 2+ (FeCl2, FeBr2, FeI2, FeSO4, Fe(NO3)2) и OH - (NaOH, KOH, Ba(OH)2).
1) FeCl2 + 2NaOH = Fe(OH)2↓ + 2NaCl
2) FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4
3) FeBr2 + 2NaOH = Fe(OH)2↓ + 2NaBr
4) FeI2 + 2NaOH = Fe(OH)2↓ + 2NaI
5) Fe(NO3)2 + 2NaOH = Fe(OH)2↓ + 2NaNO3
б) Fe2O3 + 6Н + = 2Fe 3+ + 6H2O;
В левой части уравнения записана только формулы иона Н + , поэтому взаимодействущее вещество должно быть сильным и растворимым электролитом. По таблице растворимости определяем в каких веществах могут содержаться ионы Н + (HCl, HBr, HI, HNO3).
1) Fe2O3 + 6HCl = 2FeCl3 + 3H2O
2) Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
3) Fe2O3 + 6HBr = 2FeBr3 + 3H2O
4) Fe2O3 + 6HI = 2FeI3 + 3H2O
в) 2Fe 3+ + 2I - = 2Fe 2+ + I2.
В левой части уравнения записаны только формулы ионов, поэтому взаимодействующие вещества должны быть сильными и растворимыми электролитами. По таблице растворимости определяем в каких веществах (берем во внимание только сильные электролиты) могут содержаться ионы Fe 3 + (FeCl3, FeBr3, Fe(NO3)3) и I - (NaI, KI).
1) 2FeCl3 + 2NaI = 2FeCl2 + I2 + 2NaCl
2) 2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
3) 2FeBr3 + 2NaI = 2FeBr2 + I2 + 2NaBr
4) 2FeBr3 + 2KI = 2FeBr2 + I2 + 2KBr
5) 2Fe(NO3)3 + 2NaI = 2Fe(NO3)2 + I2 + 2NaNO3
6) 2Fe(NO3)3 + 2KI = 2Fe(NO3)2 + I2 + 2KNO3
Упражнение 5. Один из учащихся написал формулу двойной соли железа и аммония NH4Fe(SO4)2•12Н2O, а другой — (NH4)2Fe(SO4)2•6Н2O. Кто из них прав? Тот, кто написал формулу NH4Fe(SO4)2•12Н2O.
Докажите ваше утверждение.
Двойные соли состоят с двух катионов и аниона одного кислотного остатка, следовательно формула будет иметь вид NH4Fe(SO4)2•12Н2O.
NH4Fe(SO4)2 → NH4 + + Fe 2+ + 2SO4 2-
Формула (NH4)2Fe(SO4)2•6H2O является комбинацией двух солей (NH4)2SO4•FeSO4•6H2O.
В периодической системе Менделеева железо входит в группу VIIIВ. В четвертом периоде, к которому принадлежит и железо, в эту группу входят также кобальт и никель. Эти три элемента образуют триаду и обладают сходными свойствами.
Радиус нейтрального атома железа 0, 126 нм, радиус иона Fe 2+ — 0, 080 нм, иона Fe 3+ — 0, 067 нм. Энергии последовательной ионизации атома железа 7, 893, 16, 18, 30, 65, 57, 79 эВ. Сродство к электрону 0, 58 эв. По шкале Полинга электроотрицательность железа около 1, 8.
Железо высокой чистоты — это блестящий серебристо-серый, пластичный металл, хорошо поддающийся различным способам механической обработки.
Нахождение в природе
В земной коре железо распространено достаточно широко — на его долю приходится около 4, 1% массы земной коры (4-е место среди всех элементов, 2-е среди металлов). Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красные железняки (руда гематит, Fe2O3; содержит до 70% Fe), магнитные железняки (руда магнетит, Fe3О4; содержит 72, 4% Fe), бурые железняки (руда гидрогетит НFeO2·nH2O), а также шпатовые железняки (руда сидерит, карбонат железа, FeСО3; содержит около 48% Fe). В природе встречаются также большие месторождения пирита FeS2 (другие названия — серный колчедан, железный колчедан, дисульфид железа и другие), но руды с высоким содержанием серы пока практического значения не имеют. По запасам железных руд Россия занимает первое место в мире. В морской воде 1·10 -5 —1·10 -8 % железа.
История получения железа
Железо играло и играет исключительную роль в материальной истории человечества. Первое металлическое железо, попавшее в руки человека, имело, вероятно, метеоритное происхождение. Руды железа широко распространены и часто встречаются даже на поверхности Земли, но самородное железо на поверхности крайне редко. Вероятно, еще несколько тысяч лет назад человек заметил, что после горения костра в некоторых случаях наблюдается образование железа из тех кусков руды, которые случайно оказались в костре. При горении костра восстановление железа из руды происходит за счет реакции руды как непосредственно с углем, так и с образующимся при горении оксидом углерода (II) СО. Возможность получения железа из руд существенно облегчило обнаружение того факта, что при нагревании руды с углем возникает металл, который далее можно дополнительно очистить при ковке. Получение железа из руды с помощью сыродутного процесса было изобретено в Западной Азии во 2-м тыс. до н. э. Период с 9 по 7 в. до н. э., когда у многих племен Европы и Азии развилась металлургия железа, получил название железного века, пришедшего на смену бронзовому веку. Усовершенствование способов дутья (естественную тягу сменили меха) и увеличение высоты горна (появились низкошахтные печи — домницы) привело к получению чугуна, который стали широко выплавлять в Западной Европе с 14 века. Полученный чугун переделывали в сталь. С середины 18 века в доменном процессе вместо древесного угля начали использовать каменно-угольный кокс. В дальнейшем способы получения железа из руд были значительно усовершенствованы, и в настоящее время для этого используют специальные устройства — домны, кислородные конвертеры, электродуговые печи.
Физические и химические свойства
При температурах от комнатной и до 917 °C, а также в интервале температур 1394-1535 °C существует α-Fe с кубической объемно центрированной решеткой, при комнатной температуре параметр решетки а = 0, 286645 нм. При температурах 917-1394 °C устойчиво β-Fe с кубической гранецентрированной решеткой Т (а = 0, 36468 нм). При температурах от комнатной до 769 °C (так называемая точка Кюри) железо обладает сильными магнитными свойствами (оно, как говорят, ферромагнитно), при более высоких температурах железо ведет себя как парамагнетик. Иногда парамагнитное α-Fe с кубической объемно центрированной решеткой, устойчивое при температурах от 769 до 917 °C, рассматривают как γ-модификацию железа, а β-Fe, устойчивое при высоких температурах (1394-1535 °C), называют по традиции δ-Fe (представления о существовании четырех модификаций железа — α, β, γи δ— возникли тогда, когда еще не существовал рентгеноструктурный анализ и не было объективной информации о внутреннем строении железа). Температура плавления 1535 °C, температура кипения 2750 °C, плотность 7, 87 г/см 3 . Стандартный потенциал пары Fe 2+ /Fe 0 –0, 447В, пары Fe 3+ /Fe 2+ +0, 771В.
При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной пленкой оксида, препятствующего дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближенно ее химическую формулу можно записать как Fe2О3·хН2О.
С кислородом железо реагирует при нагревании. При сгорании железа на воздухе образуется оксид Fe2О3, при сгорании в чистом кислороде — оксид Fe3О4. Если кислород или воздух пропускать через расплавленное железо, то образуется оксид FeО. При нагревании порошка серы и железа образуется сульфид, приближенную формулу которого можно записать как FeS.
Железо при нагревании реагирует с галогенами. Так как FeF3 нелетуч, железо устойчиво к действию фтора до температуры 200-300°C. При хлорировании железа (при температуре около 200°C) образуется летучий FeСl3. Если взаимодействие железа и брома протекает при комнатной температуре или при нагревании и повышенном давлении паров брома, то образуется FeBr3. При нагревании FeСl3 и, особенно, FeBr3 отщепляют галоген и превращаются в галогениды железа (II). При взаимодействии железа и иода образуется иодид Fe3I8.
При нагревании железо реагирует с азотом, образуя нитрид железа Fe3N, с фосфором, образуя фосфиды FeP, Fe2P и Fe3P, с углеродом, образуя карбид Fe3C, с кремнием, образуя несколько силицидов, например, FeSi.
При повышенном давлении металлическое железо реагирует с монооксидом углерода СО, причем образуется жидкий, при обычных условиях легко летучий пентакарбонил железа Fe(CO)5. Известны также карбонилы железа составов Fe2(CO)9 и Fe3(CO)12. Карбонилы железа служат исходными веществами при синтезе железоорганических соединений, в том числе и ферроцена состава [Fe(-C5H5)2].
Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. В концентрированной серной и азотной кислотах железо не растворяется, так как прочная оксидная пленка пассивирует его поверхность.
С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа (II):
При взаимодействии железа с приблизительно 70%-й серной кислотой реакция протекает с образованием сульфата железа (III):
Оксид железа (II) FeО обладает основными свойствами, ему отвечает основание Fe(ОН)2. Оксид железа (III) Fe2O3 слабо амфотерен, ему отвечает еще более слабое, чем Fe(ОН)2, основание Fe(ОН)3, которое реагирует с кислотами:
Гидроксид железа (III) Fe(ОН)3 проявляет слабо амфотерные свойства; он способен реагировать только с концентрированными растворами щелочей:
Образующиеся при этом гидроксокомплексы железа (III) устойчивы в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причем в осадок выпадает гидроксид железа (III) Fe(OH)3.
4FeCl2 + O2 + 2H2O = 4Fe(OH)Cl2Из солей железа (II) в водных растворах устойчива соль Мора — двойной сульфат аммония и железа (II) (NH4)2Fe(SO4)2·6Н2О.
Железо (III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов, например, KFe(SO4)2 — железокалиевые квасцы, (NH4)Fe(SO4)2 — железоаммонийные квасцы и т. д.
Для обнаружения в растворе соединений железа (III) используют качественную реакцию ионов Fe 3+ с тиоцианат-ионами CNS - . При взаимодействии ионов Fe 3+ с анионами CNS - образуется ярко-красный роданид железа Fe(CNS)3. Другим реактивом на ионы Fe 3+ служит гексацианоферрат (II) калия K4[Fe(CN)6] (ранее это вещество называли желтой кровяной солью). При взаимодействии ионов Fe 3+ и [Fe(CN)6] 4- выпадает ярко-синий осадок.
Реактивом на ионы Fe 2+ в растворе может служить раствор гексацианоферрат (III) калия K3[Fe(CN)6], ранее называвшийся красной кровяной солью. При взаимодействии ионов Fe 3+ и [Fe(CN)6] 3- выпадает ярко-синий осадок такого же состава, как и в случае взаимодействия ионов Fe 3+ и [Fe(CN)6] 4- .
Сплавы железа с углеродом
Чугун получают в домнах. Домна представляет собой гигантский (высотой до 30-40 м) усеченный конус, полый внутри. Стенки домны изнутри выложены огнеупорным кирпичом, толщина кладки составляет несколько метров. Сверху в домну вагонетками загружают обогащенную (освобожденную от пустой породы) железную руду, восстановитель кокс (каменный уголь специальных сортов, подвергнутый коксованию — нагреванию при температуре около 1000 °C без доступа воздуха), а также плавильные материалы (известняк и другие), способствующие отделению от выплавляемого металла примесей — шлака. Снизу в домну подают дутье (чистый кислород или воздух, обогащенный кислородом). По мере того, как загруженные в домну материалы опускаются, их температура поднимается до 1200-1300 °C. В результате реакций восстановления, протекающих главным образом с участием кокса С и СО:
Этот расплав периодически выпускают из домны через специальное отверстие — летку — и дают расплаву застыть в специальных формах. Чугун бывает белый, так называемый передельный (его используют для получения стали) и серый, или литьевой. Белый чугун — это твердый раствор углерода в железе. В микроструктуре серого чугуна можно различить микрокристаллики графита. Из-за наличия графита серый чугун оставляет след на белой бумаге.
Чугун хрупок, при ударе он колется, поэтому из него нельзя изготавливать пружины, рессоры, любые изделия, которые должны работать на изгиб.
Твердый чугун легче расплавленного, так что при его затвердевании происходит не сжатие (как обычно при затвердевании металлов и сплавов), а расширение. Эта особенность позволяет изготавливать из чугуна различные отливки, в том числе использовать его как материал для художественного литья.
Если содержание углерода в чугуне снизить до 1, 0-1, 5%, то образуется сталь. Стали бывают углеродистыми (в таких сталях нет других компонентов, кроме Fe и C) и легированными (такие стали содержат добавки хрома, никеля, молибдена, кобальта и других металлов, улучшающие механические и иные свойства стали).
Стали получают, перерабатывая чугун и металлический лом в кислородном конвертере, в электродуговой или мартеновской печах. При такой переработке снижается содержание углерода в сплаве до требуемого уровня, как говорят, избыточный углерод выгорает.
Физические свойства стали существенно отличаются от свойств чугуна: сталь упруга, ее можно ковать, прокатывать. Так как сталь, в отличие от чугуна, при затвердевании сжимается, то полученные стальные отливки подвергают обжатию на прокатных станах. После прокатки в объеме металла исчезают пустоты и раковины, появившиеся при затвердевании расплавов.
Производство сталей имеет в России давние глубокие традиции, и полученные нашими металлургами стали отличаются высоким качеством.
Применение железа, его сплавов и соединений
Чистое железо имеет довольно ограниченное применение. Его используют при изготовлении сердечников электромагнитов, как катализатор химических процессов, для некоторых других целей. Но сплавы железа — чугун и сталь — составляют основу современной техники. Находят широкое применение и многие соединения железа. Так, сульфат железа (III) используют при водоподготовке, оксиды и цианид железа служат пигментами при изготовлении красителей и так далее.
Железо в организме
Железо присутствует в организмах всех растений и животных как микроэлемент, то есть в очень малых количествах (в среднем около 0, 02%). Однако железобактерии, использующие энергию окисления железа (II) в железо (III) для хемосинтеза, могут накапливать в своих клетках до 17-20% железа. Основная биологическая функция железа — участие в транспорте кислорода и окислительных процессах. Эту функцию железо выполняет в составе сложных белков — гемопротеидов, простетической группой которых является железопорфириновый комплекс — гем. Среди важнейших гемопротеидов дыхательные пигменты гемоглобин и миоглобин, универсальные переносчики электронов в реакциях клеточного дыхания, окисления и фотосинеза цитохромы, ферменты каталоза и пероксида, и других. У некоторых беспозвоночных железосодержащие дыхательные пигменты гелоэритрин и хлорокруорин имеют отличное от гемоглобинов строение. При биосинтезе гемопротеидов железо переходит к ним от белка ферритина, осуществляющего запасание и транспорт железа. Этот белок, одна молекула которого включает около 4 500 атомов железа, концентрируется в печени, селезенке, костном мозге и слизистой кишечника млекопитающих и человека. Суточная потребность человека в железе (6-20 мг) с избытком покрывается пищей (железом богаты мясо, печень, яйца, хлеб, шпинат, свекла и другие). В организме среднего человека (масса тела 70 кг) содержится 4, 2 г железа, в 1 л крови — около 450 мг. При недостатке железа в организме развивается железистая анемия, которую лечат с помощью препаратов, содержащих железо. Препараты железа применяются и как общеукрепляющие средства. Избыточная доза железа (200 мг и выше) может оказывать токсичное действие. Железо также необходимо для нормального развития растений, поэтому существуют микроудобрения на основе препаратов железа.

Железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
Смотрите так же:
СТРУКТУРА
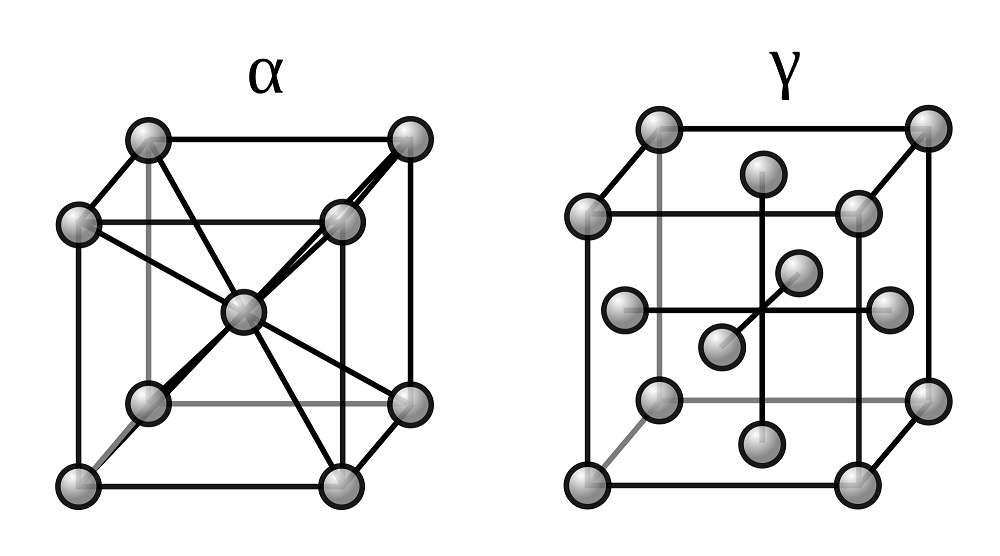
Две модификации кристаллической решетки железа
Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация – γ-Fe(выше 906°) образует решетку гранецентрированного куба типа Сu (а0 = 3,63), а низкотемпературная – α-Fe-решетку центрированного куба типа α-Fe (a0 = 2,86).
В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
- В интервале температур от самых низких до 910°С —а-феррит (альфа-феррит), имеющий строение кристаллической решетки в виде центрированного куба;
- В интервале температур от 910 до 1390°С — аустенит, кристаллическая решетка которого имеет строение гранецентрированного куба;
- В интервале температур от 1390 до 1535°С (температура плавления) — д-феррит (дельта-феррит). Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла.
В результате получается зернистое строение металла. Каждое зерно имеет кристаллическую решетку с определенным направлением его осей.
При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна
СВОЙСТВА

В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все. Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, – единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля. А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
ЗАПАСЫ И ДОБЫЧА
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %.

ПРОИСХОЖДЕНИЕ

ПРИМЕНЕНИЕ

Кольцо из железа
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Читайте также:

