Применение алкенов в медицине кратко
Обновлено: 02.07.2024
Этиленовые углеводороды, алкены, олефины (от французского слова - Gas olefant - маслообразующий газ) - это углеводороды алифатического ряда, содержащие одну двойную связь.
Общая формула этиленовых углеводородов СnH2n. Они составляют гомологический ряд, первым представителем которого является этилен СН2 = СН2.
Классификация и номенклатура
Названия этиленовые углеводороды по заместительной номенклатуре IUPAC образуют путем замещения суффикса -ан в названии соответствующего насыщенного углеводорода на -ен; положения двойной связи обозначают цифрой, при этом нумерация начинается с того конца цепи, к которому ближе расположен двойная связь:
- первые четыре представителя алкенов - газы
- соединения С5-С17 - бесцветные жидкости
- далее следуют твердые вещества
Физические свойства
Есть углеводороды практически нерастворимые в воде, ограниченно растворимые в спиртах и хорошо - в углеводородах, их галогенпроизводных, эфире.
Химические свойства
Реакционную способность этиленовых углеводородов определяет наличие в их молекуле двойной С = С связи. Атомы углерода, соединенные двойной связью, находятся в sp2-гибридизованому состоянии и образуют δ- и π-связи, из которых π-связь менее прочный. Он состоит из двух базисных орбиталей - связующего и разрыхлительно, образованных за счет π-орбиталей атомов С.
Энергия связи - ~ 615 кДж / моль, длина - 0,134 нм, для этилена валентные углы равны 120 °. Вследствие высокой поляризуемости и низкой энергии образования π-связи алкены достаточно легко вступают в реакции электрофильного присоединения по двойной связи. Есть углеводороды, которые взаимодействуют с галогенами с образованием вицинальных дигалогенопохидних; условия протекания реакции зависят от природы галогена (реакцию с F2 проводят при температуре -78 ° С, константа равновесия реакции йодирования очень мала). Известны методы замещения атомов водорода галогеном с сохранением двойной связи. Так, при взаимодействии олефинов с N-бромсукцинимид в CCl4 в присутствии пероксидов (реакция Воля - Циглера) или солями хлорноватистой кислоты образуются α-галогенопроизводные.
Прямое галогенирование этиленовых углеводородов при температуре 400-600 ° С также приводит к замещению атомов Н, например, хлорированием пропилена получают хлористый аллил CH2ClCH = CH2, который является исходным продуктом в синтезе синтетического глицерина.
Эти реакции осуществляются по радикальному механизму. Подобно галогенам присоединяются к этиленовых углеводородов с образованием галогеногидринов и гипогалогенновые кислоты (HOCl, HOBr, HOI).
Гидратация этиленовых углеводородов возможна только в присутствии кислотных катализаторов, например, H2SO4, H3PO4, HClO4 и др. Таким образом, в промышленности из этилена и пропилена получают этиловый и изопропиловый спирты. Реакцию гидратации можно осуществить и в газовой фазе - при повышении температуры и давления, Kt - Al2O3, ZnCl2 и тому подобное. В присутствии кобальтовых катализаторов этиленовые углеводороды реагируют с СО и Н2 с образованием, в зависимости от условий, альдегидов или спиртов (так называемый оксосинтез). Присоединение Н2 к этиленовым углеводородам на гетерогенных катализаторах (металлические мелкодисперсные Ni, Pt, Pd), гомогенное каталитическое гидрирование (Kt - [(C6H5) 3P] 3RhCl или [(C6H5) 3P] 3RuClH), восстановление с помощью диимида приводят к образованию соответствующих алканов. Есть углеводороды, которые вступают в реакцию гидроборирования. Триалкилбор можно легко окислять в щелочной среде до соответствующего спирта.
В полярных средах этиленовые углеводороды реагируют с галогеноводородами с образованием алкилгалогенидов, присоединение электрофилов происходит по правилу Марковникова. В реакции с НBr или аминами порядок присоединения зависит от наличия или отсутствия примесей пероксидных соединений, поскольку в их присутствии отмечается противоположный правила Марковникова эффект.
Алкены вступают в реакции АЕ со спиртами, кислотами, галогенангидридами и ангидридами карбоновых кислот (реакция Дарзана).
Присоединяются к солям переходных и платиновых металлов (Ag +, Ru +, Hg2 +, Pb4 +, Cu2 +), образуя при этом р-комплексы, например.
FeCl2 • C2H4 • H2O реагируют с N2O3, N2O4, NOCl, IN3 с образованием, как правило, кристаллических аддуктов.
Есть углеводороды, которые проявляют высокую алкилирующюю способность - в присутствии кислот Льюиса (AlCl3, BF3, HF и др.) они реагируют с насыщенными углеводородами. Разветвленные алканы, которые образуются при этом, применяют как высокооктановые добавки к моторному топливу. В условиях реакции Фриделя - Крафтса бензол алкилируется этиленом в этилбензол (полупродукта в синтезе стиренов), пропиленом - до Кумены (изопропилбензену), который используют для получения ацетона и фенола. При повышенной температуре в присутствии катализаторов (кислоты, ZnCl2 и т.д.).
Этиленовых углеводородов подвержены изомеризации: при этом происходит миграция двойной связи α-олефинов в β-положение, а также возможна изомеризация углеродного скелета. Большое практическое значение имеют процессы полимеризации этиленовых углеводородов.
Кислотные катализаторы вызывают катионную полимеризацию алкенов. Этилен при этих условиях полимеризуется достаточно трудно, пропилен и изобутилен в безводных средах образуют полимеры с очень длинными цепями. В присутствии 60% H2SO4 изобутилен димеризуется, гидрированием димера приводит к образованию изооктана. В присутствии свободных радикалов этиленовых углеводородов полимеризуются по цепному механизму. Свободнорадикальная полимеризация этилена в промышленности проводится под давлением 100 МПа и выше и при температуре 100 ° С, процесс инициируется пероксидами или О2 (следы). Пропилен и изобутилен по радикальному механизму полимеризуются плохо. Реакции нуклеофильного присоединения для этиленовых углеводородов менее характерны и ход их возможен только в условиях взаимодействия с сильными нуклеофилами, например, с металлоорганическими соединениями типа С4Н9Li. К реакциям AN принадлежат анионная полимеризация этиленовых углеводородов (С применением катализатора Циглера - Натти).
Получение и применение в промышленности
В промышленности так получают высокомолекулярный полиэтилен, стереорегулярный изотактический полипропилен, этилен - пропиленовый каучук. Реакционные карбены присоединяются к двойной связи с образованием циклопропанового фрагмента - циклопропанирования. Известны реакции 1,3-диполярного циклоприсоединения и диеновый синтез. Есть углеводороды, которые легко окисляются и в зависимости от условий реакции окисления образуются различные вещества. Например, при действии KMnO4 (в кислой среде) - смесь карбоновых кислот и кетонов, при действии KMnO4 (слабощелочной раствор) - гликоли (реакция Вагнера), так же действует OsO4 в органических растворителях; HIO4 в присутствии OsO4 расщепляет молекулы этиленовых углеводородов по двойной связи с образованием смеси карбонильных соединений. То же происходит при озонолиза и разложении озонидов. Реакцию Вагнера и озонирование используют для определения строения этиленовых углеводородов. Действие молекулярного кислорода на этиленовые углеводороды в газовой фазе (150-300 ° С) в присутствии катализатора (Ag) приводит к образованию эпоксисоединений. Таким образом в промышленности синтезируют этилен- и пропиленоксид.
Эпоксиды образуются количественно при воздействии на этиленовых углеводородов надкислот или Н2О2 в ацетонитриле.
При окислении этилена и пропилена кислородом воздуха (CuCl2 и PdCl2) получают соответственно ацетальдегид и ацетон. Известны также методы окисления этиленовых углеводородов, при которых привлекаются двойные связи; например в промышленности газофазным окислением пропилена получают акролеин, в результате окислительного аммонолиза образуется акрилонитрил. Основным способом добывания этиленовых углеводородов является использование нефтепродуктов и природного газа. Из газов жидкофазного и парофазного крекинга комбинацией методов розничной адсорбции, глубокого охлаждения и ректификации под давлением можно выделить индивидуальные этиленовые углеводороды. В лабораторных условиях и в небольшом количестве в промышленности этиленовых углеводородов получают дегидратацией спиртов над Al2O3 или ThO2 при температуре 400-420 ° С или с помощью кислотных дегидратных агентов (H2SO4, ZnCl2, P2O5 и др.).
Метод удобен в случае получения низших олефинов, так как в случае более сложных этиленовых углеводородов реакция часто сопровождается изомеризации. Есть углеводороды (Главным образом цис-изомеры) с заданным положением двойной связи можно получить пиролизом эфиров карбоновых кислот: разложением четвертичных аммониевых оснований (реакция Гофмана) гидрированием ацетиленовых углеводородов или дегидрированием алканов; действием алкилиденфосфоренив на карбонильные соединения (реакция Виттига), восстановительным сочетанием альдегидов и кетонов при обработке LiAlH4 и др. Этиленовые углеводороды - основные исходные реагенты в химической промышленности. Из этилена и пропилена получают различные полимеры и эластомеры, эпоксисоединения, дихлорэтан, этанол, стирен и др.
Применение в медицине и фармации
Полиэтилен по-разному используется в фармации, во-первых, для изготовления упаковочных изделий (флаконов, шприцев, капельниц, пробок и др.) во-вторых, как скелетоутворювальний материал для матрицы в производстве таблеток.
Распространение в природе
Молекулы с двойной связью очень распространены в природе и играют важную биологическую роль. Например, в состав растительных жиров входят ненасыщенные и полиненасыщенные кислоты, многие растения содержат маслообразная смеси веществ, известные как терпены; в организме животных содержится витамин А (ретинол), некоторые алкены имеют свойства, характерные для феромонов. Так, один из высших гомологов этилена цис-9-трикозен (мускалур) СН 3 (СН 2) 12СН = СН (СН 2) 7СН3 является половым атроктантом самки домашней мухи. Самый алкен этилен - гормон роста растений, который контролирует созревания фруктов и появление в них окраску.
При воздействии на организм он вызывает общий наркоз. Введение двойной связи в молекулы может усилить или существенно изменить физиологическое действие вещества. Трихлорэтилен (Cl2C = CHCl) имеет значительно большую наркотическое действие по сравнению с хлороформом или этилхлоридом, а при введении в морфин алильного группы вместо метильной получают его антагонист.
Литература
- Жогло Ф., Возняк В., Попович В., Богдан Я. Вспомогательные вещества и их применение в технологии лекарственных форм. - Львов, 1996;
- Общая органическая химия. В 12 т. / Под общ. ред. Д. Бартона и У.Д. Оллис. - Т. 1. стереохимии, углеводороды, галогеносодержащие соединения. - М., 1981;
- Терней А. Современная органическая химия. В 2 т. - М., 1981;
- Черных В.П., Зименковский Б.С., Гриценко И.С. Органическая химия / Под общ. ред. В.П. Черных. - второй изд. - Х., 2007.
Полезно знать
© VetConsult+, 2015. Все права защищены. Использование любых материалов, размещённых на сайте, разрешается при условии ссылки на ресурс. При копировании либо частичном использовании материалов со страниц сайта обязательно размещать прямую открытую для поисковых систем гиперссылку, расположенную в подзаголовке или в первом абзаце статьи.
В органической химии можно встретить углеводородные вещества с разным количеством углерода в цепи и C=C-связью. Они являются гомологами и называются алкенами. Из-за своего строения они химически более активны, чем алканы. Но какие именно реакции для них характерны? Рассмотрим их распространение в природе, разные способы получения и применение.
Что из себя представляют?
Алкены, которые также называются олефинами (маслянистые) получили свое название от этен-хлорида, производного первого представителя этой группы. У всех алкенов есть хотя бы одна двойная C=C-связь. CnH2n - формула всех олефинов, а название образовывается от алкана с таким же количеством углеродов в молекуле, только суффикс -ан меняется на -ен. Арабской цифрой в конце названия через дефис обозначают номер углерода, от которого начинается двойная связь. Рассмотрим основные алкены, таблица поможет вам запомнить их:
Если молекулы имеют простое неразветвленное строение, то добавляют суффикс -илен, это также отражено в таблице.
Где их можно встретить?
Так как реакционная способность алкенов весьма высока, их представители в природе встречаются крайне редко. Принцип жизни молекулы олефинов — "давай дружить". Нет вокруг других веществ — не беда, будем дружить между собой, образуя полимеры.
Но они есть, и небольшое количество представителей входит в состав сопутствующего нефтяного газа, а высших — в нефти, добываемой на территории Канады.
Самый первый представитель алкенов этен — это гормон, стимулирующий созревание плодов, поэтому его в небольших количествах синтезируют представители флоры. Есть алкен цис-9-трикозен, который у самок мухи домашней играет роль полового аттрактанта. Еще его называют мускалур. (Аттрактант — вещества природного или синтетического происхождения, которое вызывает влечение к источнику запаха у другого организма). С точки зрения химии, алкен этот выглядит так:
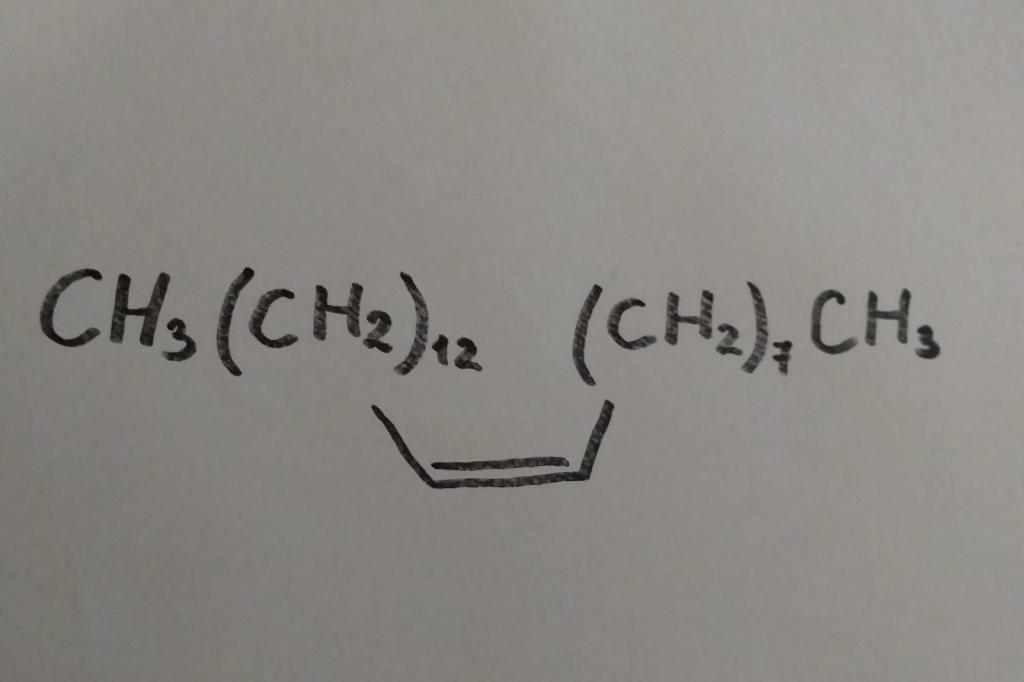
Так как весьма ценным сырьем являются все алкены, способы получения их искусственным путем весьма разнообразны. Рассмотрим наиболее распространенные.
А если нужно много?
В промышленности класс алкенов, в основном, получается при крекинге, т.е. расщеплении молекулы под воздействием высоких температур, высших алканов. Для реакции необходим нагрев в диапазоне от 400 до 700 °C. Расщепляется алкан так, как ему захочется, образуя алкены, способы получения которых мы рассматриваем, с большим количеством вариантов строения молекул:
Еще один распространенный способ называется дегидрирование, при котором от представителя ряда алкана в присутствии катализатора отделяют молекулу водорода.
В лабораторных условиях алкены и способы получения отличаются, они основаны на реакциях элиминирования (отщепления группы атомов без их замещения). Чаще всего элиминируются атомы воды из спиртов, галогены, водород или галогенводород. Наиболее распространенный способ получения алкенов — из спиртов в присутствии кислоты, как катализатора. Возможно использование и других катализаторов
Все реакции элиминирования подчинены правилу Зайцева, гласящему:
Атом водорода отщепляется от того углерода, соседствующего с углеродом, несущим группу -OH, у которого меньше водородов.
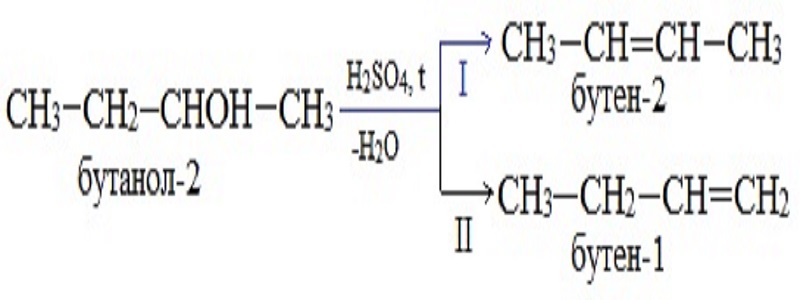
Применив правило, ответьте, какой продукт реакции будет преобладать? Позже вы узнаете, правильно ли ответили.
Химические свойства
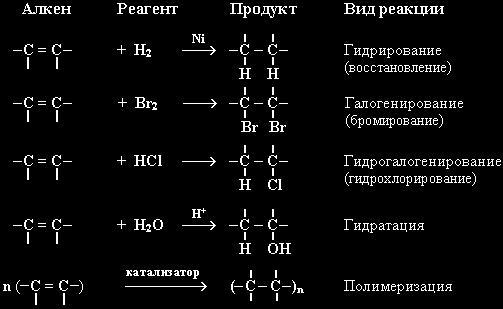
Алкены активно реагируют с веществами, разрывая свою пи-связь (еще одно название связи C=C). Ведь она не такая прочная, как одинарная (сигма-связь). Углеводород из ненасыщенного превращается в насыщенный, не образуя других веществ после реакции (присоединение).
Далее перечислены самые распространенные реакции алкенов, которые проводятся в разных видах деятельности человека:
- присоединение водорода (гидрирование). Присутствие катализатора и нагревания нужна для ее прохождения;
- присоединение молекул галогенов (галогенирование). Является одной из качественных реакций на пи-связь. Ведь при реакции алкенов с бромной водой, она из бурой становится прозрачной;
- реакция с галогенводородами (гидрогалогенирование);
- присоединение воды (гидратация). Условиями прохождения реакции является нагревание и присутствие катализатора (кислоты);
Реакции несимметричных олефинов с галогенводородами и водой подчиняются правилу Марковникова. А значит, водород присоединится к тому углероду из двойной углерод-углеродной связи, у которого уже больше атомов водорода.
- горение;
- неполное окисление каталитическое. Продуктом являются циклические оксиды;
- реакция Вагнера (окисление перманганатом в нейтральной среде). Эта реакция алкенов — еще одна качественная C=C-связь. При протекании розовый раствор марганцовки обесцвечивается. Если ту же реакцию провести в соединенной кислой среде, продукты будут уже другими (карбоновые кислоты, кетоны, углекислый газ);
- изомеризация. Характерны все виды: цис- и транс-, перемещение двойной связи, циклизация, скелетная изомеризация;
- полимеризация — главное свойство олефинов для промышленности.
Применение в медицине
Большое практическое значение имеют продукты реакции алкенов. Многие из них используются в медицине. Из пропена получают глицерин. Этот многоатомный спирт является прекрасным растворителем, причем, если его использовать вместо воды, растворы будут более концентрированными. В медицинских целях в нем растворяют алкалоиды, тимол, йод, бром и др. Также глицерин применяют при приготовлении мазей, паст и кремов. Он предотвращает их высыхание. Сам по себе глицерин является антисептиком.
При реакции с хлороводородом получаются производные, которые применяются как местная анестезия при нанесении на кожу, а также для кратковременного наркоза при незначительных хирургических вмешательствах, при помощи ингаляций.
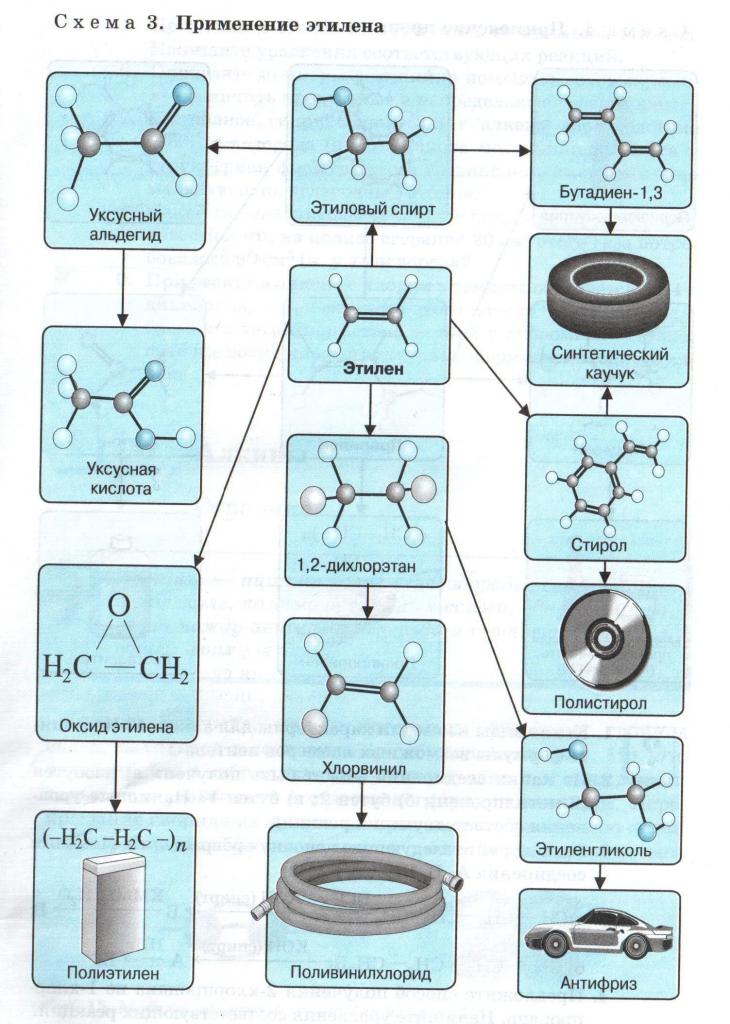
Алкадиены — это алкены с двумя двойными связями в одной молекуле. Основное их применение — производство синтетического каучука, из которого потом изготавливают различные грелки и спринцовки, зонды и катетеры, перчатки, соски и многое другое, что просто незаменимо при уходе за больными.
Применение в промышленности
производство тефлона, этилового спирт, уксусная кислота
Более широкое применение нашли алкены и их производные в промышленности. (Где и как используются алкены, таблица выше).

Это лишь малая часть использования алкенов и их производных. С каждым годом потребность в олефинах только возрастает, а значит, возрастает потребность и в их производстве.
Читайте также:

