Постоянная больцмана это в физике кратко
Обновлено: 30.06.2024
Постоянная Больцмана, представляющая собой коэффициент, равный k = 1 , 38 · 10 - 23 Д ж К , является частью значительного числа формул в физике. Она получила свое название по имени австрийского физика – одного из основоположников молекулярно-кинетической теории. Сформулируем определение постоянной Больцмана:
Постоянной Больцмана называется физическая постоянная, с помощью которой определяется связь между энергией и температурой.
Не следует путать ее с постоянной Стефана-Больцмана, связанной с излучением энергии абсолютно твердого тела.
Существуют различные методы вычисления данного коэффициента. В рамках этой статьи мы рассмотрим два их них.
Нахождение постоянной Больцмана через уравнение идеального газа
Данная постоянная может быть найдена с помощью уравнения, описывающего состояние идеального газа. Опытным путем можно определить, что нагревание любого газа от T 0 = 273 К до T 1 = 373 К приводит к изменению его давления от p 0 = 1 , 013 · 10 5 П а до p 0 = 1 , 38 · 10 5 П а . Это достаточно простой эксперимент, который может быть проведен даже просто с воздухом. Для измерения температуры при этом нужно использовать термометр, а давления – манометр. При этом важно помнить, что количество молекул в моле любого газа примерно равно 6 · 10 23 , а объем при давлении в 1 а т м равен V = 22 , 4 л . С учетом всех названных параметров можно перейти к вычислению постоянной Больцмана k :
Для этого запишем уравнение дважды, подставив в него параметры состояний.
Зная результат, можем найти значение параметра k :
Нахождение постоянной Больцмана через формулу броуновского движения
Для второго способа вычисления нам также потребуется провести эксперимент. Для него нужно взять небольшое зеркало и подвесить в воздухе с помощью упругой нитки. Допустим, что система зеркало-воздух находится в стабильном состоянии (статическом равновесии). Молекулы воздуха ударяют в зеркало, которое, по сути, ведет себя как броуновская частица. Однако с учетом его подвешенного состояния мы можем наблюдать вращательные колебания вокруг определенной оси, совпадающей с подвесом (вертикально направленной нитью). Теперь направим на поверхность зеркала луч света. Даже при незначительных движениях и поворотах зеркала отражающийся в нем луч будет заметно смещаться. Это дает нам возможность измерить вращательные колебания объекта.
Обозначив модуль кручения как L , момент инерции зеркала по отношению к оси вращения как J , а угол поворота зеркала как φ , можем записать уравнение колебаний следующего вида:
Минус в уравнении связан с направлением момента сил упругости, который стремится вернуть зеркало в равновесное положение. Теперь произведем умножение обеих частей на φ , проинтегрируем результат и получим:
Следующее уравнение является законом сохранения энергии, который будет выполняться для данных колебаний (то есть потенциальная энергия будет переходить в кинетическую и обратно). Мы можем считать эти колебания гармоническими, следовательно:
При выведении одной из формул ранее мы использовали закон равномерного распределения энергии по степеням свободы. Значит, можем записать так:
Как мы уже говорили, угол поворота можно измерить. Так, если температура будет равна приблизительно 290 К , а модуль кручения L ≈ 10 - 15 Н · м ; φ ≈ 4 · 10 - 6 , то рассчитать значение нужного нам коэффициента можно так:
Следовательно, зная основы броуновского движения, мы можем найти постоянную Больцмана с помощью измерения макропараметров.
Значение постоянной Больцмана
Значение изучаемого коэффициента состоит в том, что с его помощью можно связать параметры микромира с теми параметрами, что описывают макромир, например, термодинамическую температуру с энергией поступательного движения молекул:
Этот коэффициент входит в уравнения средней энергии молекулы, состояния идеального газа, кинетической теории газа, распределение Больцмана-Максвелла и многие другие. Также постоянная Больцмана необходима для того, чтобы определить энтропию. Она играет важную роль при изучении полупроводников, например, в уравнении, описывающем зависимость электропроводности от температуры.
Условие: вычислите среднюю энергию молекулы газа, состоящего из N -атомных молекул при температуре T , зная, что у молекул возбуждены все степени свободы – вращательные, поступательные, колебательные. Все молекулы считать объемными.
Решение
Энергия равномерно распределяется по степеням свободы на каждую ее степень, значит, на эти степени будет приходиться одинаковая кинетическая энергия. Она будет равна ε i = 1 2 k T . Тогда для вычисления средней энергии мы можем использовать формулу:
ε = i 2 k T , где i = m p o s t + m υ r + 2 m k o l представляет собой сумму поступательных вращательных степеней свободы. Буквой k обозначена постоянная Больцмана.
Переходим к определению количества степеней свободы молекулы:
m p o s t = 3 , m υ r = 3 , значит, m k o l = 3 N - 6 .
i = 6 + 6 N - 12 = 6 N - 6 ; ε = 6 N - 6 2 k T = 3 N - 3 k T .
Ответ: при данных условиях средняя энергия молекулы будет равна ε = 3 N - 3 k T .
Условие: есть смесь двух идеальных газов, плотность которых в нормальных условиях равна p. Определите, какова будет концентрация одного газа в смеси при условии, что мы знаем молярные массы обоих газов μ 1 , μ 2 .
Решение
Сначала вычислим общую массу смеси.
m = ρ V = N 1 m 01 + N 2 m 02 = n 1 V m 01 + n 2 V m 02 → ρ = n 1 m 01 + n 2 m 02 .
Параметр m 01 обозначает массу молекулы одного газа, m 02 – массу молекулы другого, n 2 – концентрацию молекул одного газа, n 2 – концентрацию второго. Плотность смеси равна ρ .
Теперь из данного уравнения выразим концентрацию первого газа:
n 1 = ρ - n 2 m 02 m 01 ; n 2 = n - n 1 → n 1 = ρ - ( n - n 1 ) m 02 m 01 → n 1 = ρ - n m 02 + n 1 m 02 m 01 → n 1 m 01 - n 1 m 02 = ρ - n m 02 → n 1 ( m 01 - m 02 ) = ρ - n m 02 .
Далее нам потребуется уравнение, описывающее состояние идеального газа:
p = n k T → n = p k T .
Подставим полученное равнее значение:
n 1 ( m 01 - m 02 ) = ρ - p k T m 02 → n 1 = ρ - p k T m 02 ( m 01 - m 02 ) .
Поскольку молярные массы газов нам известны, мы можем найти массы молекул первого и второго газа:
m 01 = μ 1 N A , m 02 = μ 2 N A .
Также мы знаем, что смесь газов находится в нормальных условиях, т.е. давление равно 1 а т м , а температура 290 К . Значит, мы можем считать задачу решенной.
Ответ: в данных условиях рассчитать концентрацию одного из газов можно как n 1 = ρ - p k T m 02 ( m 01 - m 02 ) , где m 01 = μ 1 N A , m 02 = μ 2 N A .
Постоянная Больцмана перекидывает мост из макромира в микромир, связывая температуру с кинетической энергией молекул.
Людвиг Больцман — один из создателей молекулярно-кинетической теории газов, на которой зиждется современная картина взаимосвязи между движением атомов и молекул с одной стороны и макроскопическими свойствами материи, такими как температура и давление, с другой. В рамках такой картины давление газа обусловлено упругими ударами молекул газа о стенки сосуда, а температура — скоростью движения молекул (а точнее, их кинетической энергией).Чем быстрее движутся молекулы, тем выше температура.
Постоянная Больцмана дает возможность напрямую связать характеристики микромира с характеристиками макромира — в частности, с показаниями термометра. Вот ключевая формула, устанавливающая это соотношение:
1/2 mv 2 = kT
где m и v — соответственно масса и средняя скорость движения молекул газа, Т — температура газа (по абсолютной шкале Кельвина), а k — постоянная Больцмана. Это уравнение прокладывает мостик между двумя мирами, связывая характеристики атомного уровня (в левой части) с объемными свойствами (в правой части), которые можно измерить при помощи человеческих приборов, в данном случае термометров. Эту связь обеспечивает постоянная Больцмана k, равная .
Раздел физики, изучающий связи между явлениями микромира и макромира, называется статистическая механика. В этом разделе едва ли найдется уравнение или формула, в которых не фигурировала бы постоянная Больцмана. Одно из таких соотношений было выведено самим австрийцем, и называется оно просто уравнение Больцмана:
S = k log p + b
где S — энтропия системы (см. Второе начало термодинамики), p — так называемый статистический вес (очень важный элемент статистического подхода), а b — еще одна константа.
Всю жизнь Людвиг Больцман в буквальном смысле опережал свое время, разрабатывая основы современной атомной теории строения материи, вступая в яростные споры с подавляющим консервативным большинством современного ему научного сообщества, считавшего атомы лишь условностью, удобной для расчетов, но не объектами реального мира. Когда его статистический подход не встретил ни малейшего понимания даже после появления специальной теории относительности, Больцман в минуту глубокой депрессии покончил с собой. Уравнение Больцмана высечено на его надгробном памятнике.

Австрийский физик. Родился в Вене в семье госслужащего. Учился в Венском университете на одном курсе с Йозефом Стефаном (см. Закон Стефана—Больцмана). Защитившись в 1866 году, продолжил научную карьеру, занимая в разное время профессорские должности на кафедрах физики и математики университетов Граца, Вены, Мюнхена и Лейпцига. Будучи одним из главных сторонников реальности существования атомов, сделал ряд выдающихся теоретических открытий, проливающих свет на то, каким образом явления на атомном уровне сказываются на физических свойствах и поведении материи.
Постоянная Больцмана (ПБ) связывает температуру с энергией. Это незаменимый инструмент в термодинамике, изучении тепла и его связи. Постоянная названа по имени австрийского физика, одного из основателей теории статистической механики, она расширяет классическую ньютоновскую модель, чтобы описать, как групповое поведение больших объектов возникает из микроскопических свойств каждого отдельного.
- Исторические данные
- Молекулы и тепловые вещества
- Особенности энергии
- Статистическое рассредотачивание
- Безграничная материя
- Изменения в фиксации постоянной

Исторические данные
Как точная наука, физика не считается абсолютной без набора довольно весомых констант, которые интегрируются как универсальные коэффициенты в уравнения, устанавливающие связь между какими-либо величинами. Это фундаментальные элементы, благодаря которым многие вещи приобретают неизменность.

Между этими характеристиками, присущими материи Вселенной, существует постоянная Больцмана, значение которой входит в ряд весомых уравнений. Стоить сказать об определённом количестве решений с помощью неизменной.
Законы Ньютона управляют силами, массами и движениями объектов или систем и считаются детерминированными: то есть тот, кто полностью знает начальные условия в системе, может точно предсказать будущее. Именно так космические миссии размещают посадочные модули роботов в определённых желаемых местах в сотнях миллионов километров от Земли.
Для огромного комплекса объектов, таких как миллиарды триллионов горячих молекул, движущихся в паровом двигателе, доминирующей единицей расчёта является постоянная Больцмана, но невозможно определить состояние каждой независимой частицы: они движутся с разными скоростями и энергетическими диапазонами.
Например, молекулы воздуха при комнатной температуре 25 градусов по Цельсию (300 Кельвинов, или 77 гр. по Фаренгейту) движутся со средней скоростью около 500 метров в секунду (1100 миль в час). Но некоторые движутся 223 м/с и 717 м/с и так далее, и все они идут в разных направлениях. Каждое их свойство не может быть известно.
Однако понимание физики тепловых явлений требует некоторого способа сделать математически полезные утверждения о коллекциях огромного числа объектов. Больцман и другие учёные показали, что это можно вычислить с точки зрения статистики и вероятностей механики. Коллективные термодинамические свойства комбинаций вытекают из суммы энергий каждого отдельного объекта. Интересно, что разные значения энергии имеют иные вероятности возникновения. Для вычислений нужно знать, чему равно значение постоянной Больцмана. Вот уравнение: E=32kT
Молекулы и тепловые вещества

Физический смысл постоянной Больцмана и температуры применяется к свойству степени нагрева тела. В физике используется безусловная шкала, основанная на выводе молекулярно-кинетической доктрины в качестве меры, показывающей количество энергии теплового движения частиц.
Данные для вычислений, используемые в системе СГС, считаются очень большими единицами, чтобы выразить энергию молекул, и, таким образом, довольно сложно измерить температуру этим способом. Удобной единицей снятия данных считается градус, и данные фиксируются косвенно, путём регистрации изменяющихся макроскопических показаний вещества.
В однородном безупречном газе при определённой температуре энергия на любом поступательном уровне свободы равна, как следует из определения Максвелла. При комнатной температуре эта энергия равна j или 0,013 эВ. В одноатомном безупречном газе любой атом содержит 3 степени свободы, это соответствует 3 пространственным осям, что фактически означает, что любой атом содержит энергию B. С учётом тепловой энергии можно определить среднее значение квадрата скорости атомов, которое обратно пропорционально корню массы.
Особенности энергии

Для расчёта веществ при температурах и давлениях, ближайших к обычным, применяется совершенная газовая модель, то есть та, величина молекулы которой гораздо меньше занята конкретной численностью веществ, а расстояние между частичками гораздо больше радиуса их взаимодействия. Основываясь на уравнениях кинетической доктрины, средняя энергия этих частиц нацелена как ECP = 3/2 ∙ kT, где E-кинетическая энергия, T-температура, а 3/2 — коэффициент пропорциональности K, введённый Больцманом.
Численность здесь характеризует:
- количество степеней свободы поступательного движения молекулы;
- пространственные измерения.
Смысл k, который позднее был назван в честь Больцмана, демонстрирует, сколько Джоулей на уровне 1. В иных доктринах его смысл определяет, как статистически, в среднем, энергия термического неселективного перемещения 1-го моноатомного безупречного газа возрастает с температурой на 1 градус.
Статистическое рассредотачивание
Так как макроскопические состояния материи считаются итогом поведения большого числа частиц, они описываются статистическими способами. Последнее подразумевает выяснение того, как распределяются энергосвойства молекул газа.
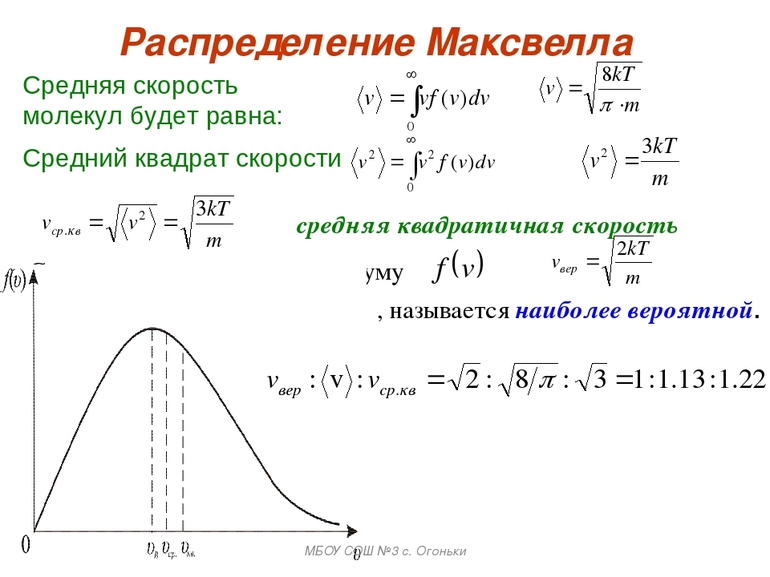
Рассредотачивание кинетических скоростей по Максвеллу происходит по-разному. Практически он показывает, что в равновесном газе главное множество молекул содержит части, более близкие к вероятным v = √ (2kT / m0), где m0-масса молекулы.
Определение Больцманом возможных энергий для газов будет пребывать на фоне всякой силы, к примеру, гравитации. Это зависит от пропорции 2-х вещей:
- притяжения к Земле;
- хаотического термического перемещения частиц газа.
В итоге чем меньше возможность энергии молекул (ближе к плоскости планеты), тем выше их сосредоточение.
Оба статистических способа связаны с рассредотачиванием Максвелла-Больцмана, содержащим экспоненциальный коэффициент eE / kT, где E — сумма кинетической и возможной энергий, а kT — средняя сила термического смещения, обусловленная ПБ. Формула постоянной Больцмана — коэффициент, равный k=1,38·10−23 ДжК.
Константа пропорциональности неизменна по Больцману. Это выражение, которое определяет связь между микроскопическим и макроскопическим состояниями, выражает центральную идею статистической механики. Планковское число измерений температуры составляет 1 416 785 (71) • 1032 К, что фактически соответствует энергии массового спокойствия.
Безграничная материя
С точки зрения теории неограниченного погружения материи, ПБ является величиной только 1-го атомного смысла. Как показывает идеальный тест физических единиц измерения значений, при использовании шкалы температуры и тепловой энергии, содержащиеся в единице количества вещества, они считаются неизменными. Отсюда выделяют данные, практически используя температуру как физическое определение на одном уровне. Вещества могут быть пересчитаны по значению неизменной со вступлением надлежащих коэффициентов схожести. Теоретическим критерием этой процедуры считается SPF-симметрия.
Можно получить определение звёздного неба и по теории Планка оно будет простым минусом импульса объектов. Его данные также равны понятию Kps = K ∙ f = 9,187 ∙ 1032 Дж / К, где f — коэффициент однородности массы.
ПБ определяет ассоциация между действенной температурой большого количества обычных звёздных объектов как меру термической энергии и средней кинетической при смещении. Не считая того, что она связывает внутреннюю температуру объектов с имеющейся энергией. Такие константы могут быть рассчитанными для любого значения материи.
В результате ПБ:
- позволяет оценивать кинетическую температуру частиц;
- подчёркивает вероятность нахождения и распределения температуры изнутри самих частиц.

Измерение постоянной Больцмана является одной из ведущих констант. Это не только разрешает установить ассоциацию между линиями микроскопичных явлений молекулярного значения с параметрами процессов, наблюдаемых в макромире. И дело не только в том, что эта величина включена в ряд значимых уравнений.
В настоящем времени непонятно, есть ли какой-нибудь вещественный принцип произведения, на базе которого он имел бы возможность получить вывод на теоретическом уровне. В иных доктринах ничего не рассказывается об этом. На самом деле смысл этой константы может быть практически схожим с другими величинами.
Изменения в фиксации постоянной
В 2017 году мировое сообщество измерений выполнило требования, чтобы дать точное толкование ПБ и переопределить Кельвин. Акустическая термометрия измерялась различными исследовательскими группами, и она использовалась в окончательном определении ПБ для системы СИ, которая была утверждена в ноябре 2018 года. На основании этих данных значение концентрации зависимости KB составляет 1,380649 x 10 -23 Дж к-1.
Хотя Кельвин не был основан на физическом артефакте, его изменение также важно. Более раннее определение размерности было основано на специфических свойствах универсальной постоянной природы. Основываясь на постоянной Стефана Больцмана, Кельвин также используют учёные, применя букву K в вычислениях. Это позволяет измерениям температуры быть действительно универсальными.
Постоянная Больцмана ( k или kb ) — физическая постоянная, определяющая связь между температурой и энергией. Названа в честь австрийского физика Людвига Больцмана, сделавшего большой вклад в статистическую физику, в которой эта постоянная играет ключевую роль. Её экспериментальное значение в системе СИ равно

Дж/К.
Числа в круглых скобках указывают стандартную погрешность в последних цифрах значения величины. В принципе, постоянная Больцмана может быть получена из определения абсолютной температуры и других физических постоянных. Однако, вычисление постоянной Больцмана с помощью основных принципов слишком сложно и невыполнимо при современном уровне знаний. В естественной системе единиц Планка естественная единица температуры задаётся так, что постоянная Больцмана равна единице.
Универсальная газовая постоянная определяется как произведение постоянной Больцмана на число Авогадро, R = kNA . Газовая постоянная более удобна, когда число частиц задано в молях.
Связь между температурой и энергией

Дж, или 0,013 эВ. В одноатомном идеальном газе каждый атом обладает тремя степенями свободы, соответствующими трём пространственным осям, что означает, что на каждый атом приходится энергия в 3 / 2(kT) .
Зная тепловую энергию, можно вычислить среднеквадратичную скорость атомов, которая обратно пропорциональна квадратному корню атомной массы. Среднеквадратичная скорость при комнатной температуре изменяется от 1370 м/с для гелия до 240 м/с для ксенона. В случае молекулярного газа ситуация усложняется, например двухатомный газ уже имеет приблизительно пять степеней свободы.
Определение энтропии
Энтропия термодинамической системы определяется как натуральный логарифм от числа различных микросостояний Z , соответствующих данному макроскопическому состоянию (например, состоянию с заданной полной энергией).
S = klnZ.
Коэффициент пропорциональности k и есть постоянная Больцмана. Это выражение, определяющее связь между микроскопическими ( Z ) и макроскопическими состояниями ( S ), выражает центральную идею статистической механики.
См. также
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Постоянная больцмана" в других словарях:
ПОСТОЯННАЯ БОЛЬЦМАНА — (обозначение k), отношение универсальной ГАЗОВОЙ постоянной к ЧИСЛУ АВОГАДРО, равное 1,381.10 23 джоулей на градус Кельвина. Оно указывает на взаимосвязь между кинетической энергией частицы газа (атома или молекулы) и ее абсолютной температурой.… … Научно-технический энциклопедический словарь
постоянная Больцмана — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN Boltzmann constant … Справочник технического переводчика
Постоянная Больцмана — Boltzmann Constant Постоянная Больцмана Физическая постоянная, определяющая связь между температурой и энергией. Названа в честь австрийского физика Людвига Больцмана, сделавшего большой вклад в статистическую физику, в которой эта постоянная … Толковый англо-русский словарь по нанотехнологии. - М.
постоянная Больцмана — Bolcmano konstanta statusas T sritis fizika atitikmenys: angl. Boltzmann constant vok. Boltzmann Konstante, f; Boltzmannsche Konstante, f rus. постоянная Больцмана, f pranc. constante de Boltzmann, f … Fizikos terminų žodynas
БОЛЬЦМАНА ПРИНЦИП — соотношение S k lnW между энтропией S и термодинамической вероятностью W (k постоянная Больцмана). На Больцмана принципе основано статистическое истолкование второго начала термодинамики: природные процессы стремятся перевести термодинамическую… … Большой Энциклопедический словарь
БОЛЬЦМАНА РАСПРЕДЕЛЕНИЕ — (Максвелла Больцмана распределение) равновесное распределение частиц идеального газа по энергиям (E) во внешнем силовом поле (напр., в поле тяготения); определяется функцией распределения f e E/kT, где E сумма кинетической и потенциальной энергий … Большой Энциклопедический словарь
Постоянная Стефана — Не следует путать с постоянной Больцмана. Постоянная Стефана Больцмана (также постоянная Стефана), физическая постоянная, являющаяся постоянной пропорциональности в законе Стефана Больцмана: полная энергия, излучаемая единицей площади … Википедия
Больцмана постоянная — Значение постоянной Размерность 1,380 6504(24)×10−23 Дж·К−1 8,617 343(15)×10−5 эВ·К−1 1,3807×10−16 эрг·К−1 Постоянная Больцмана (k или kb) физическая постоянная, определяющая связь между температурой и энергией. Названа в честь австрийского… … Википедия
БОЛЬЦМАНА РАСПРЕДЕЛЕНИЕ — статистически равновесная функция распределения по импульсам и координатам частиц идеального газа, молекулы к рого подчиняются классич. механике, во внешнем потенциальном поле: Здесь постоянная Больцмана (универсальная постоянная ), абсолютная… … Математическая энциклопедия
Читайте также:

