Полярография в химии кратко
Обновлено: 30.06.2024
Полярография представляет собой разновидность вольтамперомет-рии – группы электрохимических методов, в которых регистрируют силу тока в зависимости от потенциала рабочего (индикаторного) электрода.
В зависимости от вида развертки потенциала и механизма массопереноса различают вольтамперометрию с линейной разверткой потенциала (вольтамперометрию при постоянном токе), методы со ступенчатым изменением потенциала, гидродинамические методы и инверсионную вольтамперометрию.
Вольтамперометрические методы представляют собой точные методы определения многих органических и неорганических веществ (в основном, ионов металлов), которые можно электрохимически окислить или восстановить (электроактивные вещества) в следовых количествах. С помощью вольтамперометрии возможно одновременное определение нескольких веществ. Если рабочий электрод является микроэлектродом, объем анализируемого раствора сравнительно велик, а время анализа мало, концентрация определяемого вещества в объеме раствора во время анализа изменяется незначительно. Вольтамперометрические методы умеренно селективны, но селективность можно значительно повысить, например, сочетанием жидкостной хроматографии с электрохимическим детектированием.
Термин полярография относится только к вольтамперометрии с использованием ртутного капающего электрода.
Рис. 2.19. Принципиальная схема полярографа: а – ртутный капающий электрод (РКЭ); б – двухэлектродная полярографическая ячейка; в – трехэлектродная полярографическая ячейка (РКЭ – ртутный капающий электрод, ВЭ – вспомогательный электрод, ЭС – электрод сравнения)
Индикаторный электрод – идеально поляризуемый электрод, т.е. электрод, характеризующийся большим сдвигом потенциала при протекании бесконечно малого тока. Поляризация электрода отвечает горизонтальному участку на кривой i – E электрода и определяет диапазон потенциалов, пригодный для аналитических целей, поскольку в нем можно изучать процессы электрохимического окисления или восстановления определяемого вещества. Напротив, идеально неполяризуемый электрод – это электрод с фиксированным потенциалом, не изменяющимся при протекании относительно небольших токов. Неполяризуемые электроды, такие как электроды второго рода или электрод из донной ртути с большой поверхностью, используют в вольтамперометрии в качестве электродов сравнения. Вспомогательным электродом (токопроводящим противоэлек-тродом) может служить, например, платиновая проволока.
В вольтамперометрии используют различные индикаторные электроды; наиболее часто применяемые электроды обсуждаются ниже.
Ртутный капающий электрод. В классической полярографии инди-каторным электродом является ртутный капающий микроэлектрод. Ртут-ная капля образуется на конце стеклянного капилляра (длиной 10 – 20 см, внутренним диаметром 0,05 мм), соединенного гибкой трубкой с резер-вуаром со ртутью (рис. 2.19а). Ртутные капли имеют воспроизводимый диаметр и время жизни от 2 до 6 с. Время жизни капли зависит от высоты столба ртути над капилляром, т.е. гидростатического давления ртути. Иногда используют механический молоточек, контролирующий время жизни капель.

Ртутный капающий электрод обладает следующими преимущества-ми: 1) постоянное обновление поверхности электрода предотвращает ее загрязнение, что выражается в высокой воспроизводимости зависимостей ток – потенциал; 2) перенапряжение водорода на ртути в водных растворах велико, поэтому можно изучать процессы восстановления электроактив-ных веществ с более отрицательными потенциалами, чем обратимый потенциал разряда ионов водорода. В кислом растворе, например в 0,1 М НС1, выделение газообразного водорода наблюдается при потенциалах отрицательнее –1,2 В; 3) ртуть образует амальгамы со многими металлами, понижая их потенциал восстановления.
Интервал поляризации ртутного электрода в водном растворе при от-сутствии кислорода составляет (относительно насыщенного каломельного электрода) от +0,3 примерно до –2,7 В. В катодной области он ограничен потенциалами восстановления катионов фонового электролита, который добавляют для обеспечения диффузионного массопереноса. Наиболее отрицательных потенциалов можно достичь, применяя соли тетраалкил-аммония. Окисление ртути
ограничивает интервал поляризации в анодной области потенциалов. На ртутном микроэлектроде в основном можно определять восстанав-ливающиеся электроактивные вещества.
Твердые электроды. Для определения окисляющихся веществ обычно используют твердые электроды. Из твердых электродов, используемых при электролизе (платиновых, золотых, графитовых), в аналитической вольтамперометрии наибольшее применение нашли различного вида графитовые электроды. Это обусловлено широким диапазоном анодных потенциалов, низким электрическим сопротивлением и легкостью обновления поверхности электрода. В анодной области интервал поляризации графитовых электродов ограничен потенциалом выделения кислорода (+1,5В).
Полярография представляет собой разновидность вольтамперомет-рии – группы электрохимических методов, в которых регистрируют силу тока в зависимости от потенциала рабочего (индикаторного) электрода.
В зависимости от вида развертки потенциала и механизма массопереноса различают вольтамперометрию с линейной разверткой потенциала (вольтамперометрию при постоянном токе), методы со ступенчатым изменением потенциала, гидродинамические методы и инверсионную вольтамперометрию.
Вольтамперометрические методы представляют собой точные методы определения многих органических и неорганических веществ (в основном, ионов металлов), которые можно электрохимически окислить или восстановить (электроактивные вещества) в следовых количествах. С помощью вольтамперометрии возможно одновременное определение нескольких веществ. Если рабочий электрод является микроэлектродом, объем анализируемого раствора сравнительно велик, а время анализа мало, концентрация определяемого вещества в объеме раствора во время анализа изменяется незначительно. Вольтамперометрические методы умеренно селективны, но селективность можно значительно повысить, например, сочетанием жидкостной хроматографии с электрохимическим детектированием.
Термин полярография относится только к вольтамперометрии с использованием ртутного капающего электрода.
Рис. 2.19. Принципиальная схема полярографа: а – ртутный капающий электрод (РКЭ); б – двухэлектродная полярографическая ячейка; в – трехэлектродная полярографическая ячейка (РКЭ – ртутный капающий электрод, ВЭ – вспомогательный электрод, ЭС – электрод сравнения)
Индикаторный электрод – идеально поляризуемый электрод, т.е. электрод, характеризующийся большим сдвигом потенциала при протекании бесконечно малого тока. Поляризация электрода отвечает горизонтальному участку на кривой i – E электрода и определяет диапазон потенциалов, пригодный для аналитических целей, поскольку в нем можно изучать процессы электрохимического окисления или восстановления определяемого вещества. Напротив, идеально неполяризуемый электрод – это электрод с фиксированным потенциалом, не изменяющимся при протекании относительно небольших токов. Неполяризуемые электроды, такие как электроды второго рода или электрод из донной ртути с большой поверхностью, используют в вольтамперометрии в качестве электродов сравнения. Вспомогательным электродом (токопроводящим противоэлек-тродом) может служить, например, платиновая проволока.
В вольтамперометрии используют различные индикаторные электроды; наиболее часто применяемые электроды обсуждаются ниже.
Ртутный капающий электрод. В классической полярографии инди-каторным электродом является ртутный капающий микроэлектрод. Ртут-ная капля образуется на конце стеклянного капилляра (длиной 10 – 20 см, внутренним диаметром 0,05 мм), соединенного гибкой трубкой с резер-вуаром со ртутью (рис. 2.19а). Ртутные капли имеют воспроизводимый диаметр и время жизни от 2 до 6 с. Время жизни капли зависит от высоты столба ртути над капилляром, т.е. гидростатического давления ртути. Иногда используют механический молоточек, контролирующий время жизни капель.
Ртутный капающий электрод обладает следующими преимущества-ми: 1) постоянное обновление поверхности электрода предотвращает ее загрязнение, что выражается в высокой воспроизводимости зависимостей ток – потенциал; 2) перенапряжение водорода на ртути в водных растворах велико, поэтому можно изучать процессы восстановления электроактив-ных веществ с более отрицательными потенциалами, чем обратимый потенциал разряда ионов водорода. В кислом растворе, например в 0,1 М НС1, выделение газообразного водорода наблюдается при потенциалах отрицательнее –1,2 В; 3) ртуть образует амальгамы со многими металлами, понижая их потенциал восстановления.
Интервал поляризации ртутного электрода в водном растворе при от-сутствии кислорода составляет (относительно насыщенного каломельного электрода) от +0,3 примерно до –2,7 В. В катодной области он ограничен потенциалами восстановления катионов фонового электролита, который добавляют для обеспечения диффузионного массопереноса. Наиболее отрицательных потенциалов можно достичь, применяя соли тетраалкил-аммония. Окисление ртути
ограничивает интервал поляризации в анодной области потенциалов. На ртутном микроэлектроде в основном можно определять восстанав-ливающиеся электроактивные вещества.
Твердые электроды. Для определения окисляющихся веществ обычно используют твердые электроды. Из твердых электродов, используемых при электролизе (платиновых, золотых, графитовых), в аналитической вольтамперометрии наибольшее применение нашли различного вида графитовые электроды. Это обусловлено широким диапазоном анодных потенциалов, низким электрическим сопротивлением и легкостью обновления поверхности электрода. В анодной области интервал поляризации графитовых электродов ограничен потенциалом выделения кислорода (+1,5В).
К электрохимическим методам анализа относится также полярографический анализ, основанный на измерении силы тока, возникающего при электровосстановлении или электроокислении анализируемого вещества на микроэлектроде.
Полярографический метод анализа обладает высокой чувствительностью, что позволяет проводить определение очень малых количеств исследуемого вещества. Рекомендуемый интервал определяемой концентрации составляет 10-3-10-4 моль/л, минимально допустимая определяемая концентрация может достигать 10~6 моль/л. Полярография дает возможность одновременно вести определение нескольких веществ, не прибегая к предварительному их разделению. Время определения обычно не превышает нескольких минут.
Если к электродам, опущенным в раствор электролита, приложить разность потенциалов и постепенно ее увеличивать, то при слишком малой разности потенциалов ток практически не будет протекать через раствор. При достижении разности потенциалов определенной величины (потенциал разложения) сила тока резко возрастает.
При полярографических определениях о ходе электролиза исследуемого вещества судят одновременно по силе тока в цепи и по приложенному напряжению. Полученная вольт-амперная характеристика (рис. 19) используется как для идентификации вещества, так и для определения его концентрации.
Если взять один из электродов с малой поверхностью (обычно применяют капельный ртутный катод), а другой - с большой поверхностью, то при пропускании через раствор постоянного тока основное изменение концентрации будет наблюдаться у электрода с малой поверхностью. Это объясняется большой плотностью тока на микроэлектроде. Для правильной интерпретации вольт-амперной кривой необходимо, чтобы процессом, лимитирующим скорость электролиза, была диффузия анализируемого электроактивного вещества к электроду. В полярографии движение определяемых ионов сводится к минимуму за счет добавления большого избытка (50-100-кратного) индифферентного электролита, называемого фоном. Поскольку концентрация определяемого электроактивного вещества мала по сравнению с концентрацией фона, то практически весь ток определяется движением ионов фона.
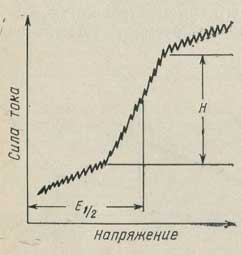
Рис. 19. Полярографическая (вольт-амперная) кривая.
E1/2 - потенциал полуволны; H - высота полярографической волны.
Постепенное повышение напряжения приводит к возрастанию плотности тока на микроэлектроде. При этом концентрация электроактивного вещества в приэлектродном пространстве становится меньше его концентрации в основной массе раствора, так как скорость его восстановления (или окисления) на микроэлектроде становится больше скорости диффузии его из раствора. В этом случае дальнейшее повышение разности потенциалов не вызывает заметного возрастания силы тока, протекающего через раствор (предельный ток). Если скорость процесса в электролитической ячейке контролируется диффузией, то сила тока пропорциональна концентрации электроактивного вещества. Таким образом, при потенциале разложения только часть ионов, достигающих электрода, разряжается на его поверхности. При потенциале полуволны на электроде разряжается половина ионов, достигающих его поверхности. И, наконец, предельный ток пропорционален концентрации определяемых ионов в массе раствора.
Диффузионный ток равен разности между предельным током и остаточным током. Он прямо пропорционален концентрации вещества в растворе. Таким образом, высота волны Н характеризует диффузионный ток и дает возможность определить концентрацию анализируемого вещества.
Потенциал, соответствующий току, который равен половине диффузионного тока, называется потенциалом полуволны. Он зависит не от концентрации вещества, а от природы восстанавливаемого (или окисляемого) иона. Потенциал полуволны является важной характеристикой вещества и может служить для его идентификации.
Электрод, на котором происходит аналитическая электрохимическая реакция, должен быть поляризован. Чтобы добиться поляризации, необходимо использовать электрод с малой поверхностью. Применение металлического, неподвижно закрепленного электрода не приводит к хорошим результатам, так как толщина диффузионного слоя у электрода будет меняться (увеличиваться), а это приведет в свою очередь к уменьшению предельного тока. Чтобы избежать этого явления, можно использовать быстро вращающийся платиновый микроэлектрод. В этом случае диффузионные слои на поверхности раздела фаз сохраняют постоянную малую толщину. Но образующийся на поверхности электрода осадок металла быстро меняет природу электрода. Поэтому платиновый вращающийся электрод чаще используют не при восстановительной, а при окислительной полярографии.
При обычной восстановительной полярографии чаще всего используется капающий ртутный электрод, состоящий из тонкого капилляра, через который медленно (1 капля в 3-5 с) капает ртуть из расположенного выше резервуара. Период образования капли можно менять, изменяя высоту расположения резервуара с ртутью над капилляром. Таким образом, электрод обновляется каждые 3-5 с и процесс переноса электронов на каждой следующей капле начинается в условиях, когда ртуть имеет чистую поверхность. Поскольку размер ртутной капли меняется за время ее жизни от нуля до максимального в момент отрыва, то и сила тока будет колебаться от минимального до максимального значения и вольт-амперная кривая будет иметь вид, изображенный на рис. 18. Степень осцилляции силы тока в цепи уменьшают введением емкостей и демпфированных гальванометров; измеряемая средняя сила тока (усредненная по времени жизни капли) равна 6h от максимальной силы тока в момент перед падением капли.
Серьезным недостатком капающего ртутного электрода является его сравнительно легкая окисляемость. Поэтому его не рекомендуется использовать в качестве анода. В этом случае предпочтительнее микродисковый платиновый вращающийся электрод.
В качестве второго электрода (с большой поверхностью) используют стандартный насыщенный каломельный электрод или ртуть, налитую на дно электролитической ячейки.
Приборы для полярографического анализа называются полярографами. Современные полярографы - сложные регистрирующие приборы, обеспечивающие высокую точность определений (погрешность 1-2%). График зависимости силы тока от потенциала капающего электрода называется полярограммой. Если в растворе присутствует несколько восстанавливаемых соединений, то полярограмма имеет вид многоступенчатой кривой. В этом случае положение потенциалов полуволн и значения силы тока соответствует величинам, полученным для растворов индивидуальных соединений с той же концентрацией определяемого вещества.
Для удаления кислорода из анализируемого раствора рекомендуется перед снятием полярограммы продуть его азотом или другим инертным газом. Легкость полярографического восстановления во многих случаях зависит от величины рН раствора, поэтому для получения сравнимых результатов следует проводить измерения при определенной и одинаковой во всех анализах кислотности раствора.
Ход определения и методика работы на приборе подробно излагаются в инструкции к нему, однако суть их заключается в следующем. Анализируемый раствор помещают в электролизер. Температура полярографической ячейки должна быть постоянной, в пределах +-0,5 С. Для удаления кислорода в испытуемом растворе пропускают через него в течение 10-15 мин азот или водород. Активный кислород можно связать и химическими реактивами - сульфитом натрия и др.
Ртутный капельный электрод помещают в раствор. При этом регулируют скорость падения капель ртути и снимают полярограмму в области указанного потенциала. Затем в тех же условиях получают полярографическую волну стандартного образца. Высоту волны находят графически и измеряют в миллиметрах. Концентрацию испытуемого раствора можно найти методом калибровочных кривых или методом стандартных растворов, или методом добавок.
При использовании метода калибровочных кривых готовят ряд растворов с различной концентрацией стандартного образца, снимают их полярограммы и определяют высоту волн. По полученным данным строят калибровочный график высота волны - концентрация. Затем снимают полярограмму исследуемого раствора, находят высоту волны и, пользуясь калибровочным графиком, определяют искомую концентрацию. Метод калибровочных кривых наиболее целесообразно применять при проведении большого числа однотипных, серийных анализов.
Метод стандартных растворов используют в тех случаях, когда известна приблизительная концентрация испытуемого вещества. Вместо серии растворов применяют раствор стандартного образца, концентрация которого достаточно близка к концентрации исследуемого раствора.
Концентрацию вещества (Сх) вычисляют по формуле:
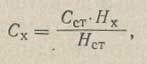
где Сст - концентрация раствора стандартного образца, мг/мл; Hх - высота волны анализируемого раствора, мм; Hст - высота волны раствора стандартного образца, мм.
Метод добавок заключается в том, что объем испытуемого раствора Vx полярографируют и измеряют высоту волны Hх, соответствующую концентрации Сх. Затем приливают к анализируемому раствору отмеренный объем Vст стандартного раствора определяемого вещества. Снова полярографируют и измеряют суммарную высоту волны HE = Нх + Нст. Отсюда легко вычислить высоту волны, соответствующую добавленному количеству определяемого вещества: Hст = HE - Hх. Если учесть, что добавленный стандартный раствор разбавился при смешении с анализируемым в
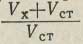
раз, то концентрацию вещества в основном анализируемом растворе следует вычислять по формуле:
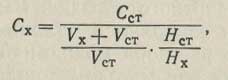
Полярографически определяются многие неорганические катионы (например, металлов), анионы (йодат-, бромат-, нитрат-, перманганат-ионы) и молекулы (кислород, двуокись серы, окись азота, перекись водорода и т. п.). К органическим веществам, которые восстанавливаются на капающем ртутном электроде, относятся соединения, содержащие карбонильные группы, двойные углерод-углеродные связи, связи углерод - галоген, азот - кислород, сера - сера и др. В качестве растворителей часто используют органические жидкости, так как многие из анализируемых этим методом веществ нерастворимы в воде. Многие органические вещества легко окисляются на аноде и дают анодные волны, что также используется для их полярографического определения.
ПОЛЯРОГРАФИЯ , разновидность волътамперометрии с использованием индикаторного микроэлектрода из жидкого металла, пов-сть к-рого периодически или непрерывно обновляется. При этом не происходит длительного накопления продуктов электролиза на пов-сти раздела электрод-раствор в электролитич. ячейке. Индикаторным электродом в полярографии служит чаще всего ртутный капающий электрод. Исполь-зуют также капающие электроды из жидких амальгам и расплавов, струйчатые электроды из жидких металлов, многокапельные электроды, в к-рых жидкий металл или расплав продавливают через диски из пористого стекла, и др.
В соответствии с рекомендациями ИЮПАК различают неск. вариантов полярографии: постояннотоковая полярография (исследует зависимость тока I от потенциала Е индикаторного микроэлектрода), осциллополярография (зависимость dE/dt от t при заданном I(t), где t -время), полярография с разверткой I (зависимость Е от I), разностная полярография (зависимость разности токов в двух ячейках от Е), полярография с однократной или многократной разверткой Е за время жизни каждой капли, циклическая полярография с треугольной разверткой Е, полярография со ступенчатой разверткой Е, разл. виды переменнотоковой и импульсной полярографии и др.
На полярограммах, регистрируемых в полярографии при использовании капающих индикаторных электродов, наблюдаются осцилляции I, пропорциональные величине I. Эти осцилляции связаны с постепенным увеличением пов-сти капли и ее периодич. обрывами. Для сглаживания осцилляции используют регистрирующие приборы (гальванометры) с большой константой времени, демпфирование, напр., с помощью RC-цепочек (электрич. цепей, состоящих из резисторов и конденсаторов), или стробирование, т. е. запись тока в течение непродолжит. интервала жизни каждой капли, причем ток поддерживают неизменным до аналогичных измерений на следующей капле. Постояннотоковую полярографию со стробирова-нием называют таст-полярографией. Среднее значение I зависит от периода капания, к-рый меняется с изменением Е. Чтобы период капания в р-ре данного состава поддерживать постоянным, каплю обрывают, напр. припаянной к концу капилляра лопаточкой или ударами электромагн. молоточка. Такой принудит. обрыв капли часто сочетают со строби-рованием. При малых периодах капания (менее 0,5 с) в случае электродов с принудит. обрывом капель очень велика емкостная составляющая тока, обусловленная заряжением двойного электрич. слоя у пов-сти свежезародившейся капли; это позволяет изучать адсорбцию орг. в-в на капающем электроде. Области применения полярографии и используемая в этом методе аппаратура такие же, как в волътамперометрии. Особая область использования полярографии-исследование и анализ металлич. расплавов и амальгам (в т. наз. амальгамной полярографии, т.е. в полярографии с капающими амальгамными индикаторными электродами).
Широко используется полярография в орг. химии для анализа и изучения реакц. способности индивидуальных в-в, а также для установления механизма электродных процессов, выявления возможности осуществления электросинтеза и нахождения оптим. условий его проведения. Потенциал полуволны Е 1/2 в случае обратимых электрохим. процессов близок к термо-динамич. окислит.-восстановит. потенциалу системы; для необратимых процессов, когда скорость электрохим. стадии мала, Е 1/2 определяется величиной стандартной константы скорости переноса электрона, к-рая в определенных условиях хорошо коррелируется с константами скорости хим. р-ций этих в-в и с их термодинамич. характеристиками (см. Корреляционные соотношения). На значения Е 1/2 необратимых электродных процессов существ. влияние оказывает строение двойного электрич. слоя.
Предельный (или максимальный) ток в полярографии может определяться не только диффузией в-в к электроду, но и скоростью образования электрохимически активного в-ва в результате хим. р-ции. Такой ток называют кинетическим. Он м. б. объемным, если р-ция протекает в приэлектродном пространстве, или поверхностным, если в р-ции участвует хотя бы одно в-во, адсорбированное на пов-сти электрода. Если электрохимически активная форма регенерируется в результате хим. превращений из продукта электродной р-ции, то такие процессы называют каталитическими. Изучение кине-тич. и каталитич. волн в полярографии позволяет определять константы скорости быстрых хим. р-ций, напр. взаимод. анионов к-т с ионами Н 3 О + , комплексообразования, окисления.
Лит.: Майрановский С. Г., Каталитические и кинетические волны в полярографии, М., 1965; его же, Двойной слой и его эффекты в полярографии, М., 1971; Майрановский С. Г., Страдынь Я.П., Безуглый В. Д., Полярография в органической химии, Л., 1975; Турьян Я.И., Химические реакции в полярографии, М., 1980; Салихджанова Р. М.-Ф., Гинзбург Г. И., Поля-рографы и их эксплуатация в практическом анализе и исследованиях, М., 1988; Безуглый В. Д., Полярография в химии и технологии полимеров, 3 изд., М., 1989 Б. Я. Каплан. С. Г. Майрановский.
Электролиз — химическая реакция окисления или восстановления на электроде под действием электрического тока. Для измерения количества, прошедшего через ячейку заряда, применяются кулонометры или электронные интеграторы. В кулонометре протекает известная реакция с 100%-ным выходом по току. Измерение массы образовавшегося в кулонометре вещества позволяет рассчитать прошедший заряд. Если будем проводить расчеты по массе выделившегося вещества, то это будет метод электрогравиметрии.
Кулонометрический метод анализа базируется на законах электролиза Фарадея:
1. Количество восстановленного или окисленного в результате электролиза вещества прямо пропорционально количеству прошедшего электричества.
2. Массы различных веществ, выделенных на электроде при прохождении 96500 Кл электричества, равны их электрохимическим эквивалентам:

Если раствор содержит несколько компонентов, имеющих различные потенциалы разложения, можно выделять их из смеси в определенной последовательности, регулируя напряжение. При увеличении напряжения сначала выделяются на катоде металлы, имеющие меньший потенциал разложения. Например, из раствора ионов Pb+2 и Cd+2 (с единичными активностями) сначала будут восстанавливаться на катоде ионы свинца (E 0 Pb = –0,126 В, Е 0 Сd = –0,402 В). Если потенциал катода сделать равным –0,35 В, то будут восстанавливаться только ионы свинца, а ионы кадмия останутся в растворе.
Кулонометрия — высокочувствительный и точный метод анализа, позволяющий определить до 10 –9 г вещества. Однако необходимо правильно подобрать напряжение (потенциал) электролиза, для того чтобы исключить протекание побочных реакций. 7.5.
Вольтамперометрия
Это электрохимический метод анализа, основанный на использовании вольтамперных зависимостей I = f(E), которые получают в процессе электролиза на поляризуемом электроде. Метод основан на расшифровке кривых зависимости тока от потенциала (поляризационных кривых), измеренных в ячейке с поляризующимся индикаторным электродом и неполяризующимся электродом сравнения.
Если к системе электродов, погруженных в раствор, приложить напряжение, то по цепи будет проходить электрический ток. На электродах будут протекать электрохимические реакции окисления на аноде и восстановления на катоде. Ион может вступать в электрохимическую реакцию, только если достигается соответствующий окислительно-восстановительный потенциал. Нередко электрохимическая реакция все равно не протекает.
Причина этого в сложном механизме электрохимического процесса, который включает:
1) перенос вещества к поверхности электрода;
2) передачу электрона (данная стадия может быть обратимой и необратимой)
— реакция Fe3+ + е – = Fe2+ обратима;
— реакция MnO4 – + 8H+ + 5 е – = Mn2+ + 4H2O необратима);
3) отвод продуктов реакции
— перенос вещества от поверхности обратно в раствор;
— растворение вещества в материале электрода (в случае ртутного электрода);
— электрокристаллизация на поверхности электрода;
— выделение газа.
Скорость электрохимического процесса определяется самой медленной его стадией. Если скорость какой-либо из стадий равна нулю, процесс вообще не протекает. Графит, платина, свинец, цинк и ртуть обладают наибольшей поляризацией, а хлоридсеребряный, каломельный и медный электроды не поляризуются. Поляризация определяется рядом параметров, ее невозможно рассчитать, необходимо установить опытным путем.
Поляризация существенно влияет на ток, протекающий через электрохимическую ячейку. Рассмотрим две электродные системы, помещенные в раствор инертного фонового электролита. Система из медного рабочего электрода и неполяризованного электрода сравнения зависит от напряжения и описывается законом Ома. Такая электродная система не представляет интереса для электрохимического анализа.
Во второй электродной системе в качестве рабочего используется поляризуемый ртутный электрод. В области потенциалов от +0,2 до –2,0 В ток через электроды практически не протекает. За пределами этого диапазона ток резко увеличивается. (Катодный ток в области отрицательных потенциалов обусловлен восстановлением ионов водорода. В положительной области потенциалов анодный ток вызван растворением ртути в результате электрохимической реакции.)
В вольтамперометрии используются ячейки, состоящие из поляризуемого рабочего и неполяризуемого электрода сравнения. Требования к рабочему электроду:
- ● площадь рабочего электрода должна быть небольшой;
- ● электрод должен быть поляризован как можно в более широкой области потенциалов;
- ● желательно, чтобы поверхность электрода постоянно обновлялась.
Если первое требование легко выполняется за счет конструкции электрода, то второе целиком зависит от материала. Электроды из благородных металлов (платины, золота) и графита поляризованы в области потенциалов от +1,3 до –1,0 В. Катодный ток связан с восстановлением ионов водорода, а анодный — с выделением кислорода. Эти электроды имеют преимущество в анодной области потенциалов. В катодной области их использование ограничено.
Анализ проводится следующим образом. На электролитическую ячейку подают плавно возрастающее напряжение от внешнего источника и регистрируют протекающий в ней ток. Если в растворе отсутствуют электрохимически активные ионы, то получается зависимость I = f(Е).
Если в растворе присутствует электрохимически активные ионы, то наблюдается волна. Если потенциал рабочего электрода меньше потенциала выделения электрохимически активного компонента, то электрохимическая реакция на нем не протекает. Незначительный ток, протекающий через ячейку, связан с образованием на поверхности электрода двойного электрического слоя (ДЭС), который можно уподобить конденсатору. Чем больше ток ДЭС, тем ниже чувствительность метода.
Когда потенциал электрода достигает величины, равной потенциалу выделения электрохимически активного компонента, происходит деполяризация рабочего электрода. Ионы начинают разряжаться на рабочем электроде с образованием амальгам на ртутном электроде:

Через электрод протекает ток электролиза (фарадеев ток), который пропорционален напряжению. Концентрация ионов в приэлектродном слое уменьшается. Происходит перенос вещества из объема раствора к поверхности электрода. При этом ток достаточно мал (порядка 10 –5 А) и не влияет на концентрацию ионов в глубине раствора. Перенос вещества протекает исключительно за счет диффузии. На электроде разряжаются все поступающие из глубины раствора ионы. Протекающий через электрод ток зависит только от скорости диффузии, которая зависит не от напряжения электрода, а от концентрации раствора, коэффициента диффузии, формы и размера электрода.
Полярография.
В 1922 г. чешским ученым Я. Гейровским был разработан полярографический метод анализа. Он использовал ртутный капающий электрод. Вольтамперометрия, использующая ртутный капающий электрод, стала называться полярографией. За открытие и развитие полярографического метода анализа в 1959 г. Я. Гейровскому была присуждена Нобелевская премия. Зависимость между приложенным напряжением и силой тока в любой точке волны описывается уравнением Гейровского — Ильковича:

Потенциал полуволны не зависит от величины диффузионного тока и является качественной характеристикой иона. Если в растворе присутствует несколько ионов, потенциалы полуволн которых различаются более чем на 100 мВ, то на полярограмме наблюдается несколько волн. Величина потенциала полуволны обычно отличается от нормального окислительно-восстановительного потенциала вследствие:
● кинетической поляризации электрода;
● влияния адсорбционных явлений;
● влияния реакций комплексообразования и осаждения.
Величины полуволн различных ионов в различных фоновых растворах при использовании различных электродов приведены в справочной литературе. Таким образом можно провести качественный анализ состава раствора по величине Е 12 . Количественной характеристикой полярограммы является величина предельного диффузионного тока, которая зависит не только от концентрации иона, но и от конструкции рабочего электрода. Для ртутного капающего электрода величина диффузионного тока связана с концентрацией уравнением Ильковича:

Большинство параметров уравнения зависят от свойств рабочего электрода и в процессе работы не изменяются. Поэтому их объединяют в константу k. В этом случае уравнение преобразуется к виду I = kс. Среди величин, включаемых в k, труднее всего экспериментально определить коэффициент диффузии. Поэтому коэффициент пропорциональности между концентрацией вещества и силой диффузионного тока обычно устанавливают с помощью стандартных растворов.
На твердотельных электродах наблюдаются максимумы, возникающие из-за высокой скорости наложения потенциала. Они подавляются подбором оптимальных условий записи полярограмм. Максимумы, связанные с осаждением вещества на электроде, не устраняются. Твердые электроды после записи каждой волны необходимо чистить.
Полярография применима не только для определения катионов, но и для органических веществ, способных восстанавливаться, например альдегидов, кетонов, перекисей, молекул с группами C=N–, –NO 2 , –NHOH, –S–S–. Это высокочувствительный и быстрый метод определения неорганических и органических веществ, один из универсальных методов определения следовых количеств веществ, позволяющий одновременно определять несколько компонентов в смеси. На рис. 7.5 приведен внешний вид одного из наиболее часто используемых полярографов.

Рис. 7.5. Полярограф АВС 1.1
По разнообразию решаемых задач вольтамперометрические методы являются наиболее универсальными среди методов электрохимического анализа. Они позволяют одновременно получать качественную и количественную информацию о находящихся в растворе электроактивных веществах, т. е. способных вступать в химические реакции под действием электрического тока.
Подбором соответствующих условий (растворителя, материала электродов, реагентов) самые различные вещества могут быть переведены в электроактивное состояние. Поэтому на сегодняшний день разработаны способы вольтамперометрического определения большинства элементов и весьма широкого круга неорганических и органических соединений в диапазоне концентраций от 10 –3 до 10 –11 мольл.
Инверсионная вольтамперометрия позволяет существенно увеличить чувствительность метода. Метод инверсионной полярографии заключается в выделении определяемого элемента из очень разбавленного раствора на ртутной капле, тонкой пленке ртути на графитовом электроде или просто на графитовом электроде электролизом с последующим анодным растворением полученного продукта. Процесс накопления определяемого компонента проходит при потенциале φ (рис. 7.6), соответствующем предельному току I /L.

Рис. 7.6. Принцип электрохомического инверсионного определения 1 — стадия накопления; 2 — стадия растворения
Зависимость силы тока I от потенциала φ при анодном растворении имеет максимум пика Ip , высота которого пропорциональна концентрации определяемого иона, а потенциал максимума φр определяется природой иона. Чем больше продолжительность накопительного электролиза, тем большее количество ионов металла переходит из раствора на электрод и тем больше возрастает чувствительность метода.
В настоящее время инверсионная вольтамперометрия является одним из важнейших методов определения следовых содержаний органических и неорганических соединений в растворах, а также анализа твердых материалов. Ее достоинства по сравнению с другими методами:
- ● возможность определения значительного числа (более 40) химических элементов и многих органических веществ;
- ● возможность одновременного определения нескольких ионов металлов (рис. 7.7);
- ● низкие пределы обнаружения, достигающие для некоторых элементов (например, Cd, Bi, Tl, Pb, Sb) и органических веществ (10 –9 –10 –10 мольл);
- ● достаточно высокая селективность и хорошие метрологические характеристики;
- ● легкость компьютеризации и автоматизации аналитических определений;
- ● сравнительно невысокая стоимость приборов для инверсионной вольтамперометрии и относительная простота работы на них.
Амперометрическое титрование (потециостатическое поляризационное титрование) — это разновидность вольтамперометрического метода (наряду с полярографией). Метод основан на измерении величины тока между электродами электрохимической ячейки, к которым приложено некоторое постоянное напряжение, как функции прибавленного титранта. Определяемое вещество должно быть электрохимически активным.
При прибавлении титранта в анализируемый раствор концентрация этого вещества уменьшается или увеличивается, соответственно падает или возрастает диффузионный ток. Точку эквивалентности фиксируют по резкому изменению падения или роста диффузионного тока, что отвечает окончанию реакции титруемого вещества с титрантом. Вид кривой титрования зависит от того, какое вещество вступает в электрохимическую реакцию (рис. 7.8).

Рис. 7.7. Одновременное определение нескольких ионов металлов методом инверсионной вольтамперометрии

Рис. 7.8. Кривые амперометрического титрования а — активно титруемое вещество; б — активен титрант; в — активны титруемое вещество и титрант; г — активен продукт реакции
При амперометрическом титровании используются реакции осаждения, комплексообразования и окислительно-восстановительные. Если ни титрант, ни продукт реакции, ни определяемое вещество не являются электрохимически активными, то используют амперометрический индикатор. Это вещества, которые восстанавливаются или окисляются на электроде и взаимодействуют с титрантом после того, как определяемое вещество количественно вступит в реакцию. Поэтому диффузионный ток при титровании определяемого вещества постоянен, а после точки эквавалентности уменьшается.
Читайте также:

