Особенности характеризующие органические соединения кратко
Обновлено: 05.07.2024
Органические вещества — класс соединений, в состав которых входит углерод (за исключением карбидов, карбонатов, оксидов углерода и цианидов).
Соединения углерода с другими элементами составляют особый класс органических соединений — элементоорганические соединения. Металлоорганические соединения содержат связь металл-углерод и составляют обширный подкласс элементоорганических соединений.
Количество известных органических соединений давно перевалило за 10 млн; таким образом, органические соединения — самый обширный класс химических соединений. Многообразие органических соединений связано с уникальным свойством углерода образовывать цепочки из атомов углерода, что в свою очередь обусловлено высокой стабильностью (то есть энергией) углерод-углеродной связи. Связь углерод-углерод может быть как одинарной, так и кратной: двойной, тройной. При увеличении кратности углерод-углеродной связи возрастает её энергия, т. е. стабильность, а длина уменьшается. Высокая валентность углерода — 4, а также возможность образовывать кратные связи, позволяет образовывать структуры различной размерности (линейные, плоские, объёмные).
Существует несколько важных свойств, которые выделяют органические соединения в отдельный ни на что не похожий класс химических соединений.
- Различная топология образования связей между атомами, образующими органические соединения (прежде всего атомами углерода), приводит к появлению соединений, имеющих один и тот же состав и молекулярную массу, но обладающих различными физико-химическими свойствами — изомеров. Данное явление носит название изомерии.
- Явление гомологии — существования рядов органических соединений, в которых формула любых двух соседей ряда (гомологов) отличается на одну и ту же группу (чаще всего CH2). Целый ряд физико-химических свойств в первом приближении изменяется симбатно по ходу гомологического ряда. Это важное свойство используется в материаловедении при поиске веществ с заранее заданными свойствами.
Содержание
Органическая номенклатура
Органическая номенклатура —это система классификации и наименований органических веществ.
Классификация
Классификация органических соединений построена на важном принципе, согласно которому физические и химические свойства органического соединения в первом приближении определяются двумя основными критериями — строением углеродного скелета соединения и его функциональными группами. В соответствии с этими критериями построена классификация органических соединений.
Классификация органических веществ.
- Органические вещества
-
(алканы) (диеновые углеводороды)
- Производные углеводородов
- , Кетоны
Алифатические соединения
Алифатические соединения — органические вещества, не содержащие в структуре ароматических систем.
Ароматические соединения
Ароматические соединения или арены — органические вещества, в структуру которых входит одна (или более) ароматическая циклическая система (см. Ароматизация)
Гетероциклические соединения
Гетероциклические соединения — вещества, в молекулярной структуре которых присутствует хотя бы один цикл с одним (или несколькими) гетероатомом
Полимеры
Полимеры представляют собой особый вид веществ, также известный как высокомолекулярные соединения. В их структуру обычно входят многочисленные сегменты меньшего размера. Эти сегменты могут быть идентичны, тогда речь идет о гомополимере. Полимеры относятся к макромолекулам, классу веществ, состоящих из молекул очень большого размера. Полимеры могут быть органическими (полиэтилен, полипропилен, плексиглас и т. д.) или неорганическими (силикон); синтетическими (поливинилхлорид), или природными (целлюлоза, крахмал).
Структурный анализ органических веществ
В настоящее время существует несколько методов характеристики органических соединений. Кристаллография (рентгеноструктурный анализ) — наиболее точный метод, требующий, однако, наличия высококачественного кристалла достаточного размера для получения высокого разрешения. Поэтому пока этот метод не используется слишком часто.
Элементный анализ — деструктивный метод, использующийся для количественного определения содержания элементов в молекуле вещества.
Инфракрасная спектроскопия (ИК): используется главным образом для доказательства наличия (или отсутствия) определенных функциональных групп.
Масс-спектрометрия: используется для определения молекулярных масс веществ и способов их фрагментации.
Спектроскопия ядерного магнитного резонанса ЯМР.
Ультрафиолетовая спектроскопия (УФ): используется для определения степени сопряжения в системе
Подобно тому, как для неорганической химии основой развития являются Периодический закон и Периодическая система химических элементов Д. И. Менделеева, для органической химии основополагающей стала теория строения органических соединений А. М. Бутлерова.
Основным постулатом теории Бутлерова является положение о химическом строении вещества, под которым понимается порядок, последовательность взаимного соединения атомов в молекулы, т.е. химическая связь.
Под химическим строением понимают порядок соединения атомов химических элементов в молекуле согласно их валентности.
Этот порядок может быть отображен при помощи структурных формул, в которых валентности атомов обозначаются черточками: одна черточка соответствует единице валентности атома химического элемента. Например, для органического вещества метана, имеющего молекулярную формулу $СН_4$, структурная формула выглядит так:
![]()
Основные положения теории А. М. Бутлерова
- Атомы в молекулах органических веществ связаны друг с другом согласно их валентности. Углерод в органических соединениях всегда четырехвалентен, а его атомы способны соединяться друг с другом, образуя различные цепи.
- Свойства веществ определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т. е. химическим строением вещества.
- Свойства органических соединений зависят не только от состава вещества и порядка соединения атомов в его молекуле, но и от взаимного влияния атомов и групп атомов друг на друга.
Теория строения органических соединений является динамичным и развивающимся учением. По мере развития знаний о природе химической связи, о влиянии электронного строения молекул органических веществ стали пользоваться, кроме эмпирических и структурных, электронными формулами. В таких формулах указывают направление смещения электронных пар в молекуле.
Квантовая химия и химия строения органических соединений подтвердили учение о пространственном направлении химических связей (цис- и трансизомерия), изучили энергетические характеристики взаимных переходов у изомеров, позволили судить о взаимном влиянии атомов в молекулах различных веществ, создали предпосылки для прогнозирования видов изомерии и направления и механизма протекания химических реакций.
Органические вещества имеют ряд особенностей:
- В состав всех органических веществ входят углерод и водород, поэтому при горении они образуют углекислый газ и воду.
- Органические вещества построены сложно и могут иметь огромную молекулярную массу (белки, жиры, углеводы).
- Органические вещества можно расположить в ряды сходных по составу, строению и свойствам гомологов.
- Для органических веществ характерной является изомерия.
Изомерия и гомология органических веществ
Свойства органических веществ зависят не только от их состава, но и от порядка соединения атомов в молекуле.
![]()
Изомерия — это явление существования разных веществ — изомеров с одинаковым качественным и количественным составом, т.е. с одинаковой молекулярной формулой.
Различают два вида изомерии: структурную и пространственную (стереоизомерию). Структурные изомеры отличаются друг от друга порядком связи атомов в молекуле; стереоизомеры — расположением атомов в пространстве при одинаковом порядке связей между ними.
Выделяют следующие разновидности структурной изомерии: изомерию углеродного скелета, изомерию положения, изомерию различных классов органических соединений (межклассовую изомерию).
Структурная изомерия
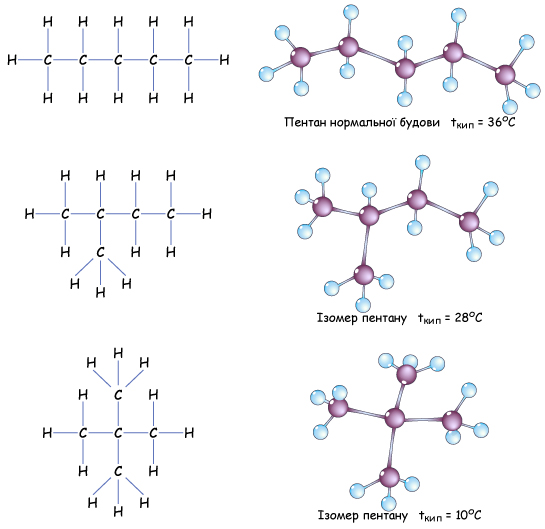
Изомерия углеродного скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы. Как уже было показано, молекулярной формуле $С_4Н_$ соответствуют два углеводорода: н-бутан и изобутан. Для углеводорода $С_5Н_$ возможны три изомера: пентан, изопентан и неопентан:
![]()
С увеличением числа атомов углерода в молекуле число изомеров быстро растет. Для углеводорода $С_Н_$ их уже $75$, а для углеводорода $С_Н_$ — $366 319$.
Изомерия положения обусловлена различным положением кратной связи, заместителя, функциональной группы при одинаковом углеродном скелете молекулы:
![]()
Изомерия различных классов органических соединений (межклассовая изомерия) обусловлена различным положением и сочетанием атомов в молекулах веществ, имеющих одинаковую молекулярную формулу, но принадлежащих к разным классам. Так, молекулярной формуле $С_6Н_$ соответствует ненасыщенный углеводород гексен-1 и циклический углеводород циклогексан:
![]()
Изомерами являются углеводород, относящийся к алкинам, — бутин-1 и углеводород с двумя двойными связями в цепи бутадиен-1,3:
Диэтиловый эфир и бутиловый спирт имеют одинаковую молекулярную формулу $С_4Н_О$:
Структурными изомерами являются аминоуксусная кислота и нитроэтан, отвечающие молекулярной формуле $С_2Н_5NO_2$:
![]()
Изомеры этого типа содержат различные функциональные группы и относятся к разным классам веществ. Поэтому они отличаются по физическим и химическим свойствам значительно больше, чем изомеры углеродного скелета или изомеры положения.
Пространственная изомерия
Пространственная изомерия подразделяется на два вида: геометрическую и оптическую. Геометрическая изомерия характерна для соединений, содержащих двойные связи, и циклических соединений. Так как свободное вращение атомов вокруг двойной связи или в цикле невозможно, заместители могут располагаться либо по одну сторону плоскости двойной связи или цикла (цис-положение), либо по разные стороны (транс-положение). Обозначения цис- и транс- обычно относят к паре одинаковых заместителей:
![]()
Геометрические изомеры различаются по физическим и химическим свойствам.
Оптическая изомерия возникает, если молекула несовместима со своим изображением в зеркале. Это возможно, когда у атома углерода в молекуле четыре различных заместителя. Этот атом называют асимметрическим. Примером такой молекулы является молекула $α$-аминопропионовой кислоты ($α$-аланина) $СН_3СН(NH_2)COOH$.
Молекула $α$-аланина ни при каком перемещении не может совпасть со своим зеркальным отражением. Такие пространственные изомеры называются зеркальными, оптическими антиподами, или энантиомерами. Все физические и практически все химические свойства таких изомеров идентичны.
Изучение оптической изомерии необходимо при рассмотрении многих реакций, протекающих в организме. Большинство этих реакций идет под действием ферментов — биологических катализаторов. Молекулы этих веществ должны подходить к молекулам соединений, на которые они действуют, как ключ к замку, следовательно, пространственное строение, взаимное расположение участков молекул и другие пространственные факторы имеют для течения этих реакций большое значение. Такие реакции называются стереоселективными.
Большинство природных соединений являются индивидуальными энантиомерами, и их биологическое действие резко отличается от свойств их оптических антиподов, полученных в лаборатории. Подобное различие в биологической активности имеет огромное значение, так как лежит в основе важнейшего свойства всех живых организмов — обмена веществ.
Гомологическим рядом называется ряд веществ, расположенных в порядке возрастания их относительных молекулярных масс, сходных по строению и химическим свойствам, где каждый член отличается от предыдущего на гомологическую разность $CH_2$. Например: $CH_4$ — метан, $C_2H_6$ — этан, $C_3H_8$ — пропан, $C_4H_$ — бутан и т. д.
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ.
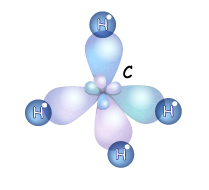
В органических соединениях углерод всегда четырехвалентен. В возбужденном состоянии в его атоме происходит разрыв пары $2s^3$-электронов и переход одного из них на р-орбиталь:
![]()
Такой атом имеет четыре неспаренных электрона и может принимать участие в образовании четырех ковалентных связей.
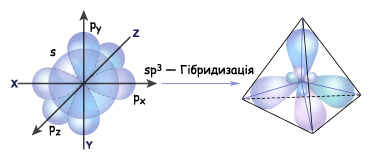
На основании приведенной электронной формулы валентного уровня атома углерода можно было бы ожидать, что на нем находится один $s$-электрон (сферическая симметричная орбиталь) и три $р$-электрона, имеющих взаимно перпендикулярные орбитали ($2р_х, 2р_у, 2p_z$-орбиталь). В действительности же все четыре валентных электрона атома углерода полностью эквивалентны и углы между их орбиталями равны $109°28'$. Кроме того, расчеты показывают, что каждая из четырех химических связей углерода в молекуле метана ($СН_4$) на $25%$ является $s-$ и на $75%$ — $p$-связью, т.е. происходит смешивание $s-$ и $р-$состояний электронов. Это явление называют гибридизацией, а смешанные орбитали — гибридными.
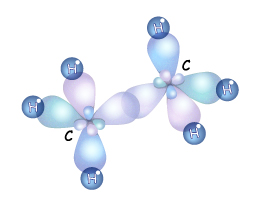
Атом углерода в $sp^3$-валентном состоянии имеет четыре орбитали, на каждой из которых находится по одному электрону. В соответствии с теорией ковалентной связи он имеет возможность образовывать четыре ковалентные связи с атомами любых одновалентных элементов ($СН_4, CHCl_3, CCl_4$) или с другими атомами углерода. Такие связи называются $σ$-связями. Если атом углерода имеет одну $С—С$ связь, то он называется первичным ($Н_3С—СН_3$), если две — вторичным ($Н_3С—СН_2—СН_3$), если три — третичным (), а если четыре — четвертичным ().
Одной из характерных особенностей атомов углерода является их способность образовывать химические связи за счет обобщения только $р$-электронов. Такие связи называются $π$-связями. $π$-связи в молекулах органических соединений образуются только в присутствии $σ$-связей между атомами. Так, в молекуле этилена $Н_2С=СН_2$ атомы углерода связаны $σ-$ и одной $π$-связью, в молекуле ацетилена $НС=СН$ — одной $σ-$ и двумя $π$-связями. Химические связи, образовавшиеся с участием $π$-связей, называются кратными (в молекуле этилена — двойная, в молекуле ацетилена — тройная), а соединения с кратными связями — ненасыщенными.
Явление $sp^3$-, $sp^2$- и $sp$ - гибридизации атома углерода.
При образовании $π$-связей изменяется гибридное состояние атомных орбиталей атома углерода. Так как образование $π$-связей происходит за счет р-электронов, то в молекулах с двойной связью электроны будут иметь $sp^2$-гибридизацию (была $sp^3$, но один р-электрон отходит на $π$-орбиталь), а с тройной — $sp$-гибридизацию (два р-электрона отошли на $π$-орбиталь). Характер гибридизации изменяет направленность $σ$-связей. Если при $sp^3$-гибридизации они образовывают пространственно разветвленные структуры ($а$), то при $sp^2$-гибридизации все атомы лежат в одной плоскости и углы между $σ$-связями равны $120°$(б), а при $sp$-гибридизации молекула линейна (в):
![]()
При этом оси $π$-орбиталей перпендикулярны оси $σ$-связи.
![]()
Как $σ$-, так и $π$-связи являются ковалентными, значит, должны характеризоваться длиной, энергией, пространственной направленностью и полярностью.
Характеристики одинарных и кратных связей между атомами С.
Молекула Тип гибридизации Валентный угол Длина связи, нм Энергия связи, кДж/моль $CH_3-CH_3$ $sp^3$ $109°5'$ $0.154$ $369$ $CH_2=CH_2$ $sp^2$ $120°$ $0.134$ $712$ $CH≡CH$ $sp^3$ $180°$ $0.120$ $962$ Радикал. Функциональная группа.
![]()
Одной из особенностей органических соединений является то, что в химических реакциях их молекулы обмениваются не отдельными атомами, а группами атомов. Если эта группа атомов состоит только из атомов углерода и водорода, то она называется углеводородным радикалом, если же она имеет атомы других элементов, то она называется функциональной группой. Так, например, метил ($СН_3$—) и этил ($С_2Н_5$—) являются углеводородными радикалами, а оксигруппа (—$ОН$), альдегидная группа (), нитрогруппа (—$NO_2$) и т. д. являются функциональными группами спиртов, альдегидов и азотсодержащих соединений соответственно.
Как правило, функциональная группа определяет химические свойства органического соединения и поэтому является основой их классификации.
Не затруднит! Лови:
Резкой грани между органическими и неорганическими веществами не существует. Оксиды углерода, угольная кислота, ее соли и некоторые другие вещества по наличию в них углерода должны считаться органическими, но по свойствам они близки к неорганическим соединениям подобного типа и изучаются обычно в неорганической химии. В отличие от неорганических веществ органические вещества имеют ряд характерных особенностей: 1) атомы углерода способны соединяться друг с другом; 2) образуют цепи и кольца, что не так типично для неорганических соединений. Это одна из причин многообразия органических соединений; 3) одной из важных особенностей органических соединений, которая накладывает отпечаток на все их химические свойства, является характер связей между атомами в их молекулах. Эти связи имеют ярко выраженный ковалентный характер. Органические вещества в большинстве неэлектролиты, не диссоциируют в растворах на ионы и сравнительно медленно взаимодействуют друг с другом. 4) важной особенностью органических соединений является и то, что среди них широко распространено явление изомерии; 5) имеется множество соединений углерода, которые обладают одинаковым качественным и количественным составом и одинаковой молекулярной массой, но совершенно различными физическими и даже химическими свойствами; 6) многие органические соединения являются непосредственными носителями, участниками или продуктами процессов, которые протекают в живых организмах, – ферменты, гормоны, витаминыКак уже было сказано выше, наиболее характерной для органических соединений является ковалентная связь. Она образуется за счет общих электронных пар. Образование ковалентной связи выгодно обоим атомам (они приобретают завершенный электронный слой), поэтому ковалентная связь прочная. Органические соединения обычно имеют молекулярное строение.Ковалентная связь обычно образуется за счет неспаренных электронов двух атомов. Углерод использует все свои валентные электроны и образует четыре связи. Но некоторые атомы (азот, кислород, сера) для образования связей в молекуле могут используют не все свои валентные электроны, а только неспаренные. Неподеленные пары электронов таких атомов могут участвовать в образовании дополнительных связей по донорно-акцепторному механизму.Кроме того, такой атом с неподеленной парой электронов, может взаимодействовать с атомом с пониженной электронной плотностью ( δ+) из другой молекулы или другой части большой органической молекулы. Чаще всего таким атомом является водород. В результате такого взаимодействия возникает водородная связь, которую графически обозначают обычно тремя точками. Энергия водородной связи невелика (1—40 кДж/моль) и в основном определяется электростатическим взаимодействием. Водородные связи способствует стабилизации пространственной формы сложных органических молекул (белки) или ассоциации небольших молекул в димеры (спирты и карбоновые кислоты) и повышению их температуры кипения.
Рассмотрим первую из них - sp 3 – гибридизацию.
![]()
![]()
![]()
![]()
![]()
Итак, если гибридизации подвергаются четыре разных орбитали, то и образуется четыре орбитали. Но это уже одинаковые гибридные орбитали. Форма гибридной орбитали – неправильная объемная восьмерка. Орбитали максимально удалены друг от друга (электронные облака заряжены отрицательно и отталкиваются друг от друга), и поэтому их вершины направлены к вершинам тетраэдра. Угол между связями примерно 109 0 . Если атом углерода находится в состоянии sp 3 – гибридизации, то все четыре гибридные орбитали перекрываются с гибридными или негибридными орбиталями других атомов на прямых, которые связывают центры этих атомов и углерода. Эти четыре гибридные орбитали образуют четыре прочные -связи (сигма-связи). Значит, если атом углерода образует четыре связи с четырьмя разными атомами, то он находится в состоянии sp 3 -гибридизации, и угол между ними 109 0 .
![]()
Этот тип гибридизации является самым распространенным в органических соединениях. Это означает что молекулы органических соединений не имеют линейного строения, а зигзагообразно изогнуты в пространстве. А так как вокруг одинарных связей возможно свободное вращение без разрыва этой связи, то форма органической молекулы в пространстве может меняться.
![]()
Если атом углерода находится в состоянии sp 2 -гибридизации, значит смешиваются одна s-орбиталь и две р-орбитали и образуются три гибридные sp 2 -орбитали. Они по форме очень похожи на sp 3 -орбитали, но немного короче (меньше вклад р-орбиталей). Все три гибридные орбитали лежат в одной плоскости и максимально удалены друг от друга (т.е. находятся под углом 120 0 ). Одна из р-орбиталей сохраняет форму правильной объемной восьмерки и располагается перпендикулярно плоскости, в которой лежат эти три гибридные орбитали. При сближении двух атомов, которые находятся в sp 2 гибридном состоянии, перекрываются их гибридные орбитали на прямой, которая соединяет центры этих атомов. Т.е. образуется -связь.
![]()
Но при сближении атомов происходит перекрывание и двух негибридных р-орбиталей, расположенных
параллельно друг другу. Область перекрывания лежит над и под плоскостью, в которой находятся -связи этих атомов. Так между двумяsp 2 –гибридными атомами образуется дополнительная связь, которую называют -связью.Такое боковое перекрывание оказывается менее эффективно, чем осевое, и значит связь менее прочной.Итак, -связь образована за счет перекрывания негибридных р-орбиталей вне прямой соединяющей центры атомов, перпендикулярно плоскости в которой лежат связи. Комбинацию из одной -связи и одной -связи называют двойной связью и обозначают двумя черточками.
Например, -связь в молекуле этена образована за счет перекрывания гибридных электронных орбиталей на прямой соединяющей центры атомов (С-С и С-Н).А -связь образуется между атомами углерода за счет негибридных р-орбиталей. Таким образом между атомами углерода в этене образуется двойная связь. Структурную формулу этена записывают обычно СН2=СН2. Но мы должны помнить, что связи в молекуле расположены по углом в 120 о и лежат все в одной плоскости.
![]()
![]()
![]()
![]()
Надо помнить, что несмотря на то что в структурной формуле мы рисует одинаковые черточки, это связи разные, одна прочная -связь и две -связи, которые легко разрываются. Четыре атома в молекуле с тройной связью лежат на одной прямой.
Итак: Химическая связь в молекулах характеризуется длиной, энергией и полярностью. Длина связи зависит от размера атомов, между которыми возникает, но дополнительное связывание приводит к уменьшению расстояния между ядрами, поэтому тройная связь короче двойной, а двойная короче одинарной. Энергия связи – это энергия, которая выделяется при ее образовании или необходима для ее разрыва. Энергия двойной связи (620 кДж/моль) меньше удвоенного значения энергии одинарной связи (350 кДж/моль). А это значит, что энергия -связи меньше, чем у -связи. Полярность связи характеризует неравномерность распределения электронной плотности между атомами с различной ЭО. Появление зарядов на атомах (даже частичных!) очень сильно изменяет реакционную способность вещества.
Как уже было сказано выше, наиболее характерной для органических соединений является ковалентная связь. Она образуется за счет общих электронных пар. Образование ковалентной связи выгодно обоим атомам (они приобретают завершенный электронный слой), поэтому ковалентная связь прочная. Органические соединения обычно имеют молекулярное строение.Ковалентная связь обычно образуется за счет неспаренных электронов двух атомов. Углерод использует все свои валентные электроны и образует четыре связи. Но некоторые атомы (азот, кислород, сера) для образования связей в молекуле могут используют не все свои валентные электроны, а только неспаренные. Неподеленные пары электронов таких атомов могут участвовать в образовании дополнительных связей по донорно-акцепторному механизму.Кроме того, такой атом с неподеленной парой электронов, может взаимодействовать с атомом с пониженной электронной плотностью ( δ+) из другой молекулы или другой части большой органической молекулы. Чаще всего таким атомом является водород. В результате такого взаимодействия возникает водородная связь, которую графически обозначают обычно тремя точками. Энергия водородной связи невелика (1—40 кДж/моль) и в основном определяется электростатическим взаимодействием. Водородные связи способствует стабилизации пространственной формы сложных органических молекул (белки) или ассоциации небольших молекул в димеры (спирты и карбоновые кислоты) и повышению их температуры кипения.
Рассмотрим первую из них - sp 3 – гибридизацию.
![]()
![]()
![]()
![]()
![]()
Итак, если гибридизации подвергаются четыре разных орбитали, то и образуется четыре орбитали. Но это уже одинаковые гибридные орбитали. Форма гибридной орбитали – неправильная объемная восьмерка. Орбитали максимально удалены друг от друга (электронные облака заряжены отрицательно и отталкиваются друг от друга), и поэтому их вершины направлены к вершинам тетраэдра. Угол между связями примерно 109 0 . Если атом углерода находится в состоянии sp 3 – гибридизации, то все четыре гибридные орбитали перекрываются с гибридными или негибридными орбиталями других атомов на прямых, которые связывают центры этих атомов и углерода. Эти четыре гибридные орбитали образуют четыре прочные -связи (сигма-связи). Значит, если атом углерода образует четыре связи с четырьмя разными атомами, то он находится в состоянии sp 3 -гибридизации, и угол между ними 109 0 .
![]()
Этот тип гибридизации является самым распространенным в органических соединениях. Это означает что молекулы органических соединений не имеют линейного строения, а зигзагообразно изогнуты в пространстве. А так как вокруг одинарных связей возможно свободное вращение без разрыва этой связи, то форма органической молекулы в пространстве может меняться.
![]()
Если атом углерода находится в состоянии sp 2 -гибридизации, значит смешиваются одна s-орбиталь и две р-орбитали и образуются три гибридные sp 2 -орбитали. Они по форме очень похожи на sp 3 -орбитали, но немного короче (меньше вклад р-орбиталей). Все три гибридные орбитали лежат в одной плоскости и максимально удалены друг от друга (т.е. находятся под углом 120 0 ). Одна из р-орбиталей сохраняет форму правильной объемной восьмерки и располагается перпендикулярно плоскости, в которой лежат эти три гибридные орбитали. При сближении двух атомов, которые находятся в sp 2 гибридном состоянии, перекрываются их гибридные орбитали на прямой, которая соединяет центры этих атомов. Т.е. образуется -связь.
Но при сближении атомов происходит перекрывание и двух негибридных р-орбиталей, расположенных
параллельно друг другу. Область перекрывания лежит над и под плоскостью, в которой находятся -связи этих атомов. Так между двумяsp 2 –гибридными атомами образуется дополнительная связь, которую называют -связью.Такое боковое перекрывание оказывается менее эффективно, чем осевое, и значит связь менее прочной.Итак, -связь образована за счет перекрывания негибридных р-орбиталей вне прямой соединяющей центры атомов, перпендикулярно плоскости в которой лежат связи. Комбинацию из одной -связи и одной -связи называют двойной связью и обозначают двумя черточками.
Например, -связь в молекуле этена образована за счет перекрывания гибридных электронных орбиталей на прямой соединяющей центры атомов (С-С и С-Н).А -связь образуется между атомами углерода за счет негибридных р-орбиталей. Таким образом между атомами углерода в этене образуется двойная связь. Структурную формулу этена записывают обычно СН2=СН2. Но мы должны помнить, что связи в молекуле расположены по углом в 120 о и лежат все в одной плоскости.
![]()
![]()
![]()
![]()
Надо помнить, что несмотря на то что в структурной формуле мы рисует одинаковые черточки, это связи разные, одна прочная -связь и две -связи, которые легко разрываются. Четыре атома в молекуле с тройной связью лежат на одной прямой.
Итак: Химическая связь в молекулах характеризуется длиной, энергией и полярностью. Длина связи зависит от размера атомов, между которыми возникает, но дополнительное связывание приводит к уменьшению расстояния между ядрами, поэтому тройная связь короче двойной, а двойная короче одинарной. Энергия связи – это энергия, которая выделяется при ее образовании или необходима для ее разрыва. Энергия двойной связи (620 кДж/моль) меньше удвоенного значения энергии одинарной связи (350 кДж/моль). А это значит, что энергия -связи меньше, чем у -связи. Полярность связи характеризует неравномерность распределения электронной плотности между атомами с различной ЭО. Появление зарядов на атомах (даже частичных!) очень сильно изменяет реакционную способность вещества.
Органические вещества обладают рядом характерных особенностей, среди которых наиболее важные:
- атомы углерода в молекулах органических соединений способны соединяться друг с другом;
- атомы углерода в молекулах органических соединений образуют цепи и кольца, что является одной из причин многообразия органических соединений;
- связи между атомами в молекулах органических соединений ковалентные. В своем большинстве органические вещества являются неэлектролитами, т.е. не диссоциируют на ионы в растворах, а также сравнительно медленно взаимодействуют друг с другом.
- для органических соединений характерно явление изомерии, в связи с чем имеется множество соединений углерода, которые обладают одинаковым качественным и количественным составом, одинаковой молекулярной массой, но совершенно различными физическими и даже химическими свойствами;
- многие органические соединения являются непосредственными носителями, участниками или продуктами процессов, которые протекают в живых организмах, – ферменты, гормоны, витамины.
Физические свойства органических соединений
Чаще всего органические соединения представляют собой газы, жидкости или низкоплавкие твердые вещества. Большое число твердых органических веществ плавится в интервале сравнительно невысоких температур (от комнатной до 400 °С).
Взаимное влияние атомов в молекулах органических соединений
Взаимное влияние атомов в молекуле передается через систему ковалентных связей с помощью электронных эффектов. Электронным эффектом называют смещение электронной плотности в молекуле под влиянием заместителей.
Индуктивный эффект (I) – смещение электронной плотности по цепи σ-связей.
Мезомерный эффект (M) — смещение электронной плотности по цепи π-связей.
-I (отрицательный индуктивный эффект): -Cl, -Br, -OH, -NH2;
-M (отрицательный мезомерный эффект): -CH=O, -COOH, -NO2;
+M (положительный мезомерный эффект):-OH, -NH2;
Химические свойства органических соединений
Реакции органических веществ классифицируют по типу разрыва связей на:
— радикальные реакции, протекающие с гомолитическим разрывом ковалентной связи
— ионные реакции, протекающие с гетеролитическим разрывом ковалентной связи
По типу реакции:
RCH2X + Y → RCHY + X
Окисление и восстановление в органической химии связывают с потерей и приобретением водорода и кислорода. Вещество окисляется, если оно теряет атомы Н и приобретает атомы О. Окислитель в общем виде обозначают [O].
Вещество восстанавливается, если оно приобретает атом Н и (или) теряет атомы О. Восстановитель в общем виде обозначается [H].
Генетическая связь между классами органических соединений
Генетические ряды органических соединений выглядит следующим образом:
![Генетические ряды органических соединений]()
Рассмотрим на примере ряда этана:
CH2=CH2 + H2O → C2H5OH (получение из алкенов предельных одноатомных спиртов)
C2H5OH + [O] → CH3CHO + H2O (получение из предельных одноатомных спиртов альдегидов)
CH3CHO + [O] → CH3COOH (получение из альдегидов предельных одноосновных карбоновых кислот)
CH3COOH + Cl2 → CH2Cl-COOH (получение из предельных одноосновных карбоновых кислот хлорзамещенных карбоновых кислот)
CH2Cl-COOH + NH3→ NH2-CH2– COOH + HCl (получение хлорзамещенных карбоновых кислот аминокислот)
![получение из аминокислот пептидов]()
(получение из аминокислот пептидов)
Примеры решения задач
Читайте также: