Окислительное хлорирование углеводородов кратко
Обновлено: 02.07.2024
Получение хлоруглеводородов методом прямого хлорирования приводит к образованию хлорида водорода, в связи с чем возникают проблемы его утили-зации. Процессы окислительного хлорирования насыщенных углеводородов и олефинов позволяют использовать абгазный НСl и тем самым уменьшить поте-ри хлора и стоимость производства.
В промышленности хлорид водорода образуется в результате замести-тельного хлорирования углеводородов и пиролиза промежуточных хлоруглево-дородов:
СН4 + 4Сl2 ССl4 + 4НСl
С2Н4Сl2 С2Н3Сl + НСl
Наибольший интерес представляют три процесса утилизации абгазного НСl:
- электролиз образовавшейся соляной кислоты с получением хлора;
- использование НСl для получения органических хлорированных про-
- окисление НСl до хлора по методу Дикона.
Процесс Дикона основан на окислении НСl воздухом или кислородом в присутствии катализатора (например, хлорида меди, нанесенного на инертный носитель) при 670-770 К:
4 НСl + О2 2Сl2 + 2Н20 + Н
С понижением температуры равновесная степень превращения НСl воз-растает: например, при 823 К она составляет 58%, а при 573 К- 85%. Катализа-тором реакции Дикона являются системы на основе хлоридов меди и щелочных металлов. Наиболее активная добавка к хлориду меди - хлорид калия. Актив-ный компонент CuCl KCl может быть нанесен методом пропитки на носители
или использоваться в виде расплава солей. На селективность процесса окисли-тельного хлорирования сильное влияние оказывает химическая природа и фи-зико-химические свойства носителя.
Основным достоинством процесса окислительного хлорирования являет-ся возможность создания на его основе сбалансированных по хлору процессов, что в настоящее время приобретает первостепенное значение в связи с ужесто-чением требований к охране окружающей среды. Совмещение реакций окисле-ния HCl и хлорирования углеводородов приводит к сдвигу равновесия реакции Дикона вследствие расходования хлора. Реакция присоединения экзотермична, а элиминирования HCl - эндотермична, причем суммарный процесс оксихлори-рования протекает с выделением тепла.
Наиболее перспективной является комбинация процессов получения од-ного и того же продукта двумя путями: по одному из них (хлорирование) полу-чается хлорид водорода, по другому (гидрохлорирование) - он используется как реагент. Пример удачного сочетания реакций - получение винилхлорида из этилена и ацетилена:
СН2=СН2 + Сl2 С2Н4Сl2 (CH2Cl—CH2Cl)
С2Н4Сl2 СН2=СНСl + НСl
СНСН + НСl СН2=СНСl
СН2=СН2 + СНСН + С12 2СН2=СНСl
Разработано несколько схем переноса хлора в реакциях окислительного хло-
- сопряжение реакции окисления НСl с реакцией заместительного хлори-рования насыщенных углеводородов
4НСl + О2 2Сl2 + 2Н2О
НR RH + Cl2 HR R˝Cl + HCl
HR RCl + Cl2 ClR RCl + HCl
- реакции аддитивного оксихлорирования ненасыщенных углеводородов
R=R + 2HCl + 0,5O2 ClR RCl + H2O
- реакции заместительного оксихлорирования ненасыщенных углеводо-родов
R=RН + HCl + 0,5O2 R RCl + H2O
Важную роль в процессах оксихлорирования имеет выбор окислителя - воз-
духа или чистого кислорода. Несмотря на более высокую стоимость и взры-
воопасность в связи с жесткими требованиями к охране окружающей среды,
целесообразно в процессах окислительного хлорирования использовать чис-
При совмещении дегидрохлорирования и окислительного хлорирования
окислению подвергается хлорид водорода, образовавшийся в результате за-
местительного хлорирования или отщепления. Поэтому получение хлороле-
фина с тем же числом атомов хлора, что и в исходном хлорсодержащем уг-
леводороде, формально можно записать без участия хлорида водорода:
С2Н5Сl + Сl2 С2Н4Сl2 + НСl
С2Н4Сl2 СН2=СНСl + НСl
2НСl + 0,5О2 Н2О + Сl2
С2Н5Сl + 0,5О2 СН2=СНСl + Н2О
Процессы заместительного оксихлорирования метана схематически можно представить в виде ряда последовательных реакций:
СН4 + НСl + 0,5О2 СН3Сl + Н2О
СН3Сl + НСl + 0,5О2 СН2Сl2 + Н2О
СН2Сl2 + НСl + 0,5О2 СНСl3 + Н2О
СНСl3 + НСl + 0,5О2 ССl4 + Н2О
Реакция оксихлорирования метана
СН4 + nHCl + 0,5nO2 CH4-nCln + nH2O
представляет собой совокупность двух последовательных, независимо про-текающих реакций окисления хлорида водорода до молекулярного хлора (а) и заместительного хлорирования метана с образованием хлорметанов (б):
4HCl + O2 2Cl2 + 2H2O (а)
CH4 + nCl2 CH4-n + nHCl (б)
По механизму протекания процесса все реакции окислительного хлорирова-ния можно подразделить на две большие группы. К первой группе относят реакции, протекающие через промежуточную стадию окисления хлорида водорода кислородом с образованием хлора, который хлорирует органиче-ский субстрат. Ко второй группе относятся реакции, не требующие предва-рительного окисления хлоридом водорода до хлора. Примерами реакции первой группы являются в основном реакции заместительного оксихлориро-вания алканов (и хлоралканов), а второй – аддитивное оксихлорирование ал-кенов (и хлоралкенов):
2HCl + 0,5O2 Cl2 + H2O,
RH + Cl2 RCl + HCl,
C═C + 2HCl + O2 C=C + 2H2O.
Заместительное хлорирование алкенов выделяется в отдельную группу. Окислительное хлорирование этана протекает через ряд параллельно-последовательных стадий хлорирования и дегидрохлорирования, сопровож-дается окислением продуктов до оксидов углерода.
Окислительное хлорирование хлорпроизводшх углеводородов Со, согласно стехиометрическому уравнению реакции, должно сопровождаться образованием эквимольной смеси четыреххлористого углерода и тетрахлорэтилена. Перераспределение продуктов реакции, отличное от ожидаемого эквимольного, может быть объяснено вторичными превращениями самого четыреххлористог. [1]
Реакции окислительного хлорирования углеводородов ценны тем, что позволяют утилизировать хлороводород, полученный в процессах хлорирования. [2]
Невидимому, окислительное хлорирование углеводородов С3 - С6 ( и выше) сопряжено со значительными затруднениями вследствие их более легкой окисляемости в условиях окислительного хлорирования по сравнению с метаном. Это интересное в теоретическом и практическом отношениях направление исследований в области хлорирования низших парафиновых углеводородов заслуживает серьезного систематического изучения. [3]
Поскольку при окислительном хлорировании углеводородов в контактной зоне присутствует образующаяся вода, происхождение некоторых кислородсодержащих веществ можно объяснить Гидролизом хлорпроизводных. При этой температуре допускается возможность промежуточного образования бензилхлорида или других соединений, содержащих хлор в боковой группе, а ниже 300 С вероятно хлорирование толуола в кольцо. [4]
В целом процесс окислительного хлорирования углеводородов или их хлорпроизводных представляет собой сложную систему последовательно-параллельных реакций дегидрохлори-рования, хлорирования, хлоролиза, дехлорирования, окисления и ряда других. [5]
С появлением процессов окислительного хлорирования углеводородов был открыт новый путь утилизации хлористого водорода, образующегося при синтезе хлорорганических соединений из насыщенных веществ под действием молекулярного хлора. [6]
При совмещении реакции окислительного хлорирования углеводородов и расщепления хлорпроизводных образование хлороводорода не происходит. [7]
Большое значение для осуществления процесса окислительного хлорирования углеводородов имеет подбор катализаторов, позволяющих проводить реакцию 1 ( реакцию Дикона) с достаточно высокой скоростью при сравнительно низкой температуре. [8]
Значительно более рациональным является утилизация НС1 в процессе окислительного хлорирования углеводородов или хлорорганических отходов, что еще более экономически выгодно. [9]
Рассмотрены теоретические аспекты реакций, лежащих в основе производства хлорорганических соединений, в том числе прямого хлорирования, гидрохлорирования, окислительного хлорирования углеводородов ; пиролиза, хлоролиза и дегидрохлорирования хлорсодержащих соединений, специальные методы хлорирования. Приведены высокоэффективные каталитические системы для реализации указанных процессов. [10]
Химический способ получения хлора окислением хлористого водорода в настоящее время используют только при производстве винилхлорида и перхлоруглеродов по сбалансированным схемам прямого и окислительного хлорирования углеводородов . [11]
Рассмотренные в этой главе экспериментальные исследования убедительно доказывают отсутствие ингибирующей роли кислорода при сравнительно высоких температурах и возможность при этом успешного осуществления окислительного хлорирования углеводородов , в первую очередь метана, с преимущественным образованием четыреххлористого углерода. [12]
В бдной из более поздних патентных публикации [197] был предложен двухступенчатый процесс хлорирования метана. Вначале ведется обычное взаимодействие метана с хлором, а затем, после конденсации уже образовавшихся продуктов хлорирования, добавляется воздух для осуществления реакции окислительного хлорирования избыточного углеводорода хлористым водородом. [13]
Активность катализаторов увеличивается от первого реактора к третьему [26]. Типичные варианты технологических схем процессов оксихлорирования этилена в псевдоожиженном и неподвижном слое катализатора представлены на рис.2 и 3.
Процесс оксихлорирования этилена с неподвижным слоем катализатора несколько более селективен по сравнению с псевдоожиженным слоем, однако, более сложен в эксплуатации и менее технологичен. Поэтому выбор метода оксихлорирования определяется часто субъективными обстоятельствами. По состоянии на 2003г. порядка 70% всех известных промышленных процессов осуществлены в псевдоожиженном слое катализатора.
Окислительное хлорирование пропилена представляет промышленный интерес с точки зрения непосредственного получения аллилхлорида одностадийным замещением водорода на хлор. При использовании традиционных катализаторов, например, CuCl2-MgCl2 – LiCl/ пемза необходимы высокие температуры (450-500 0 С). селективность образования аллилхлорида достигает 90%, активность катализатора составляет 2,33.10-3 моль/(кг.с) [28]. Металлы платиновой группы более активны в этом процессе: температура может быть снижена до 240-260 0 С [29]. Предполагается, что аллилхлорид образуется в присутствии палладия через стадию p -аллильного комплекса; палладий при этом хлорируется:
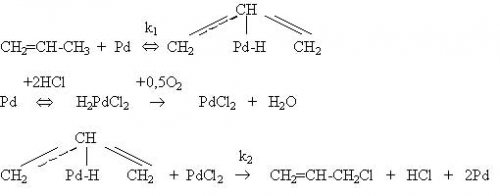
Скорость образования аллилхлорида можно представить уравнением:
Катализаторы также играют важную роль в реализации принципа сбалансированности процессов по углеводородному сырью. Наиболее перспективным является создание промышленных процессов оксихлорирования хлоруглеводородов С2 - С3 с получением три- и перхлорэтилена, а также их селективного гидрирования с получением соответственно этилена и пропилена и возвратом их в технологический цикл.
Оксихлорирование хлорпроизводных С2 - С3 проводят в присутствии смеси хлоридов меди и калия, нанесенных на пористый носитель. Предпочтительно использование носителей с низкой удельной поверхностью (10-15 м2/г) с целью снижения образования побочных продуктов глубокого окисления [30,31]. Установлено, что при температурах, превышающих 350 0С, на медьсодержащих носителях протекает реакция окисления хлористого водорода до хлора и участие последнего в дальнейших превращениях. Скорость оксихлорирования 1,2-дихлорэтана описывается уравнением (аналогичным принятому для оксихлорирования алкенов [32]):
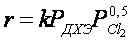
:
C 2 H 4 Cl 2 + Н2 ® C 2 H 4 + 2 HCl C 2 H 3 Cl 3 + 2Н2 ® C 2 H 4 + 3 HCl
Тем самым достигается сбалансированность процессов по углеводородному сырью.
Метод гидрирования может быть также использован при переработке четыреххлористого углерода, выпуск которого запрещен Монреальским протоколом 1987г., в хлороформ: CCl 4 + Н2 ® CHCl 3 + HCl
Установлено [34,35], что гидродехлорирование хлорпроизводных этан-этиленового ряда целесообразно проводить в присутствии никельсодержащих катализаторов. Выход этилена в этом случае достигает 80% (рис.4).
Палладиевые катализаторы более активны, но менее селективны по сравнению с никелевыми: основным продуктом в этом случае является этан, выход которого достигает 70%, а выход этилена не превышает 10-15%.
Как нами показано [34], гидродехлорирование идет преимущественно по механизму, предполагающему мультиплетный отрыв атомов хлора от молекулы исходного соединения. Скорость реакции гидродехлорирования выражается следующим уравнением:
r = kH PH 2
Реакционная способность хлоролефинов при этом ниже по сравнению с хлоралканами [35].
В промышленных условиях процесс следует проводить в стационарном слое катализатора с использованием трубчатого реактора. Температура 320-370 0С, время контакта 5-10 с, мольное соотношение водорода на один атом хлора равно 0,5:1.
Катализатор, разработанный для данного процесса, отличается высокой стабильностью.
Для переработки вторичных отходов, таких как гексахлорбензол, гексахлорэтан и др. целесообразно использовать палладиевые катализаторы. Обесхлоренные органические продукты направляются далее на сжигание, а хлористый водород может быть утилизирован в технологическом процессе.
Заключение.
Промышленное значение процессов хлорорганического синтеза в перспективе будет возрастать. Это связано с необходимостью все более широкого, комплексного использования минерального и органического сырья, к которым, в данном случае, относятся поваренная соль и продукты вторичной переработки нефти и природного газа. Необходимым условием этого является минимальное воздействие на окружающую среду. Реализация этого принципа должна осуществляться, по крайней мере, в двух направлениях:
1. Создание процессов, полностью сбалансированных по хлору и углеводородному сырью;
2. Наличие квалифицированной, экологически безопасной технологии переработки отходов производства и потребления хлорорганических продуктов.
Рис.1. Зависимость lg константы скорости реакции от величины Н связи M-Cl.
_____ экспериментальные данные
------- расчетные данные
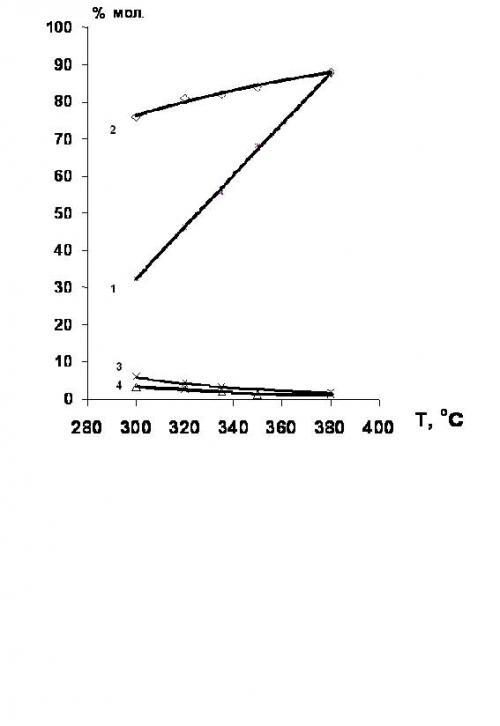
Рис.2. Технологическая схема процесса оксихлорирования этилена в псевдоожиженном слое катализатора
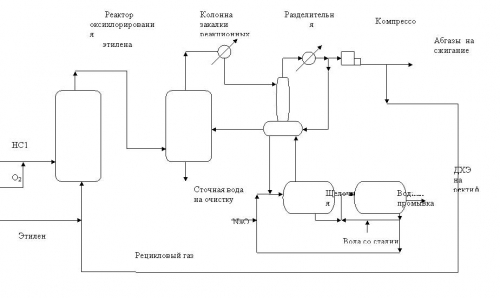
Рис.3. Технологическая схема процесса оксихлорирования этилена в неподвижном слое катализатора.
Рис.4. Температурные зависимости конверсии 1,2-дихлорэтана и селективности образования продуктов гидрохлорирования в присутствии Ni-содержащих катализаторов.
1 – конверсия 1,2-дихлорэтана;
селективности образования: 2 – этилена; 3 – этана; 4- этилхлорида
6. Галогенирование углеводородов
Среди процессов галогенирования широкое распространение получили процессы хлорирования углеводородов. Их ценные свойства и доступность элементарного хлора, необходимого для их получения, способствовали развитию производства хлорорганических соединений-
Хлор в углеводородах может замещать водородные атомы или присоединяться по месту ненасыщенных связей между атомами углерода:
Для хлорирования могут использоваться не только хлор, но и хлорсодержащие соединения: хлористый сульфурил SO 2 Cl 2 , фосген COCI 2 , четыреххлористый углерод CCl 4 и др.
Большой практический интерес представляет процесс хлорирования углеводородов хлористым водородом, так называемое гидрохлорирование, например
или окислительным хлорированием, например
Хлорирование углеводородов проводится в паровой и в жидкой фазах различными способами: при нагревании (термическое хлорирование). в присутствии катализаторов (каталитическое хлорирование), при специальном освещении реагирующих компонентов (фотохимическое хлорирование).
Термическое хлорирование обычно применяется для получения хлоридов низших углеводородов. Например, метан реагирует с хлором трудно, поэтому его хлорируют при высокой температуре. Гомологи метана хлорируются легче, чем метан, и при более низких температурах. Каталитическое хлорирование углеводородов проводится чаще всего в жидкой фазе, причем газообразные углеводороды предварительно растворяют в хлорорганических растворителях. Поскольку катализатор снижает энергию активации, в его присутствии хлорирование протекает при более низких температурах, чем при термическом хлорировании. Например, в присутствии катализатора четырех хлористой углерод образуется при 250-300° С ; без катализатора в процессе термического хлорирования - при 460° С. Катализаторами служат хлориды металлов (Сu, Sb, Sn, Si ) и металлоидов ( I, S ), нанесенные на высокопористые материалы (пемзу, активированный уголь, силикагель), а также органические соединения - перекись бензоила и некоторые нитрилы. Наиболее активным катализатором является хлорид меди С u С1 2 , нанесенный на пористый носитель (пемзу, силикагель, активированный уголь).
Фотохимическое хлорирование - процесс хлорирования, ускоряемый действием света. Элементарный механизм этого процесса заключается в активации молекул реагирующих веществ при поглощении фотонов. Под действием лучистой энергии хлор диссоциирует на атомы:
которые затем взаимодействуют с углеводородом ( RH ). При этом образуется свободный углеводородный радикал R - и отщепляется хлористый водород:
Углеводородный радикал реагирует с другой молекулой хлора и образует хлорпроизводные углеводорода и один атом хлора и т. д.
Таким образом, хлорирование углеводородов принадлежит к цепным реакциям.
Хлорпроизводные углеводороды: четыреххлористый углерод СО 4 , метиленхлорид CH 2 Cl 2 , трихлорэтилен CHCl=CCl 2 , дихлорэтан CH 2 Cl -СН 2 С l и др. применяются в качестве растворителей.
При переработке ряда хлорпроизводных получают спирты (аллиловый, амиловые), каучукоподобные материалы (тиокол, полихлоропрен), синтетические полимеры (поливинилхлорид, энант), антидетонаторы (тетраэтилсвинец) и др.
В промышленных масштабах производятся хлорфтор- и фторпроизводные углеводородов, используемые в качестве хладагентов, высокотемпературных теплоносителей, смазочных и трансформаторных масел.
Перфторуглероды - производные углеводородов, у которых все атомы водорода замещены фтором: С n F 2n , С n F 2n+2 и др. - химически стойкие вещества, применяемые в качестве инертных растворителей, неокисляющихся высокотемпературных смазок, теплоносителей, диэлектриков для токов высокой и сверхвысокой частоты и исходных веществ в производстве химически и термически стойких полимеров - фторопластов.
Хлорирование парафиновых углеводородов заключается в замещении атома водорода хлором с образованием хлористого водорода. При этом получаются моно-, ди-, три- и полихлориды. Практически в процессе хлорирования образуется смесь хлоридов:
В зависимости от условий процесса в смеси преобладает какой-либо один из хлоридов.
При хлорировании олефинов может происходить замещение атомов водорода, как в случае хлорирования парафиновых углеводородов, а также присоединение атомов хлора по двойной связи с образованием насыщенных соединений, например
Скорость хлорирования возрастает с увеличением молекулярного веса олефина, повышением температуры и введением избытка галогена.
Гидрохлорирование олефинов - взаимодействие олефинов с хлористым водородом протекает с образованием монохлорпроизводных, например
По правилу В. В. Марковникова, атом галогена присоединяется к наименее гидрогенизированному атому углерода, поэтому при гидрогалогенировании олефинов образуются только вторичные и третичные галогенпроизводные. Одновременное присоединение галогенов и замещение атомов водорода галогенами приводят к образованию полигалогенных соединений.
Производство хлористого винила. Хлористый винил получается при гидрохлорировании ацетилена:
или при дегидрохлорировании дихлорэтана:
В промышленности гидрохлорирование ацетилена проводится в жидкой или газовой фазе. Последний способ более перспективен, так как для его осуществления требуется аппаратура меньшего объема и процесс может быть легко автоматизирован.
Гидрохлорирование ацетилена в газовой фазе производится при 170° С. Смесь хлористого водорода и ацетилена из смесителя 1 поступает в трубчатый контактный аппарат 2 (рис. 8), трубки которого заполнены катализатором хлорной ртутью, нанесенной на активированный уголь (10% HgCI 2 от массы угля). Тепло реакции отводится холодным минеральным маслом, циркулирующим в межтрубном пространстве реактора. Контактные газы, содержащие 93% хлористого винила и 5% хлористого водорода, поступают в скрубберы 3, где они сначала промываются водой для удаления хлористого водорода, а затем нейтрализуются щелочью. В аппарате 4 хлористый винил осушается твердой щелочью. Далее винил-хлорид конденсируется в конденсаторе 5, охлаждаемом рассолом, после чего направляется на ректификацию для отделения примесей: ацетальдегида, 1,1-дихлорэтана и др. После ректификации из хлористого винила производится отгонка ацетилена.
Винилхлорид - важнейшее сырье для получения полимеров, необходимых в производстве пластических масс и синтетических волокон.
При хлорировании полимера винилхлорида - поливинилхлорида - получается перхлорвнниловая смола, содержащая 64-65% хлора (поливинилхлорид содержит 55-56% хлора). Хлорирование поливинилхлорида проводится в хлорорганическом растворителе (хлорбензоле, дихлорэтане и др.) при 110-115° С. При употреблении низкокипящего растворителя процесс проводится под давлением. Перхлорвиниловая смола применяется в производстве лаков, эмалей и синтетического волокна - хлорина.
Хлорирование ароматических углеводородов может протекать несколькими путями. В зависимости от условий процесса атомы хлора могут присоединяться или замещать атомы водорода в ядре и в боковой цепи.
При фотохимическом хлорировании в отсутствии катализатора происходит присоединение хлора и образуются хлорпроизводные циклических углеводородов, например при хлорировании бензола образуется гексахлорциклогексан:
Водород бензольного ядра замещается на атомы хлора при сравнительно невысоких температурах в присутствии катализаторов железа или его солей. Сначала образуется монохлорбензол, затем дихлорбензол, трихлорбензол и т. п. Хлор замещает атомы водорода в боковой цепи ароматических углеводородов при более высоких температурах в отсутствии катализатора.
Получение хлорбензола. Процесс осуществляется по реакции
в присутствии катализатора хлорного железа .
Бензол и хлор непрерывно поступают в нижнюю часть реактора, в котором происходит образование хлорбензола и небольших количеств полихлоридов. Выделяющееся реакционное тепло отводится охлаждающей водой или расходуется на испарение избытка бензола, вводимого в хлоратор, и частичное испарение образующегося хлорбензола.
Парогазовая смесь, содержащая выделяющийся при хлорировании хлористый водород, пары бензола, остатки влаги и некоторые газообразные примеси, выводится в верхней части хлоратора, охлаждается в графитовом холодильнике до -2° С, где конденсируются пары бензола. Жидкие продукты реакции, выводимые из средней части хлоратора: хлорбензол, полихлориды и непрореагировавший бензол, поступают на ректификацию для выделения из них хлорбензола.
Хлорбензол применяется как полупродукт в производстве синтетических красителей, фенола, инсектицида ДДТ, он является хорошим растворителем некоторых эфиров целлюлозы и других полимеров.
Фторхлорзамещенные углеводородов предельного и непредельного ряда используются для получения пластических масс - фторопластов.
При взаимодействии хлороформа с фтористым водородом образуется дифторхлорметан:
При пиролизе дифторхлорметана при 650° С в отсутствии катализатора образуется тетрафторэтилен - мономер, при полимеризации которого получается фторопласт-4 (тефлон):
При полимеризации трифторхлорэтилена CF 2 =CFCl получается фторопласт-3.
Важнейший фреон - дихлордифторметан (фреон-12) получается при взаимодействии фтористого водорода с четыреххлористым углеродом в присутствии катализатора небольших количеств пятихлористой сурьмы:
Получение хлоруглеводородов методом прямого хлорирования приводит к образованию хлорида водорода, в связи с чем возникают проблемы его утили-зации. Процессы окислительного хлорирования насыщенных углеводородов и олефинов позволяют использовать абгазный НСl и тем самым уменьшить поте-ри хлора и стоимость производства.
В промышленности хлорид водорода образуется в результате замести-тельного хлорирования углеводородов и пиролиза промежуточных хлоруглево-дородов:
СН4 + 4Сl2 ССl4 + 4НСl
С2Н4Сl2 С2Н3Сl + НСl
Наибольший интерес представляют три процесса утилизации абгазного НСl:
- электролиз образовавшейся соляной кислоты с получением хлора;
- использование НСl для получения органических хлорированных про-
- окисление НСl до хлора по методу Дикона.
Процесс Дикона основан на окислении НСl воздухом или кислородом в присутствии катализатора (например, хлорида меди, нанесенного на инертный носитель) при 670-770 К:
4 НСl + О2 2Сl2 + 2Н20 + DН
С понижением температуры равновесная степень превращения НСl воз-растает: например, при 823 К она составляет 58%, а при 573 К- 85%. Катализа-тором реакции Дикона являются системы на основе хлоридов меди и щелочных металлов. Наиболее активная добавка к хлориду меди - хлорид калия. Актив-ный компонент CuCl× KCl может быть нанесен методом пропитки на носители
или использоваться в виде расплава солей. На селективность процесса окисли-тельного хлорирования сильное влияние оказывает химическая природа и фи-зико-химические свойства носителя.
Основным достоинством процесса окислительного хлорирования являет-ся возможность создания на его основе сбалансированных по хлору процессов, что в настоящее время приобретает первостепенное значение в связи с ужесто-чением требований к охране окружающей среды. Совмещение реакций окисле-ния HCl и хлорирования углеводородов приводит к сдвигу равновесия реакции Дикона вследствие расходования хлора. Реакция присоединения экзотермична, а элиминирования HCl - эндотермична, причем суммарный процесс оксихлори-рования протекает с выделением тепла.
Наиболее перспективной является комбинация процессов получения од-ного и того же продукта двумя путями: по одному из них (хлорирование) полу-чается хлорид водорода, по другому (гидрохлорирование) - он используется как реагент. Пример удачного сочетания реакций - получение винилхлорида из этилена и ацетилена:
СН2=СН2 + Сl2 С2Н4Сl2 (CH2Cl—CH2Cl)
С2Н4Сl2 СН2=СНСl + НСl
СНºСН + НСl СН2=СНСl
СН2=СН2 + СНºСН + С12 2СН2=СНСl
Разработано несколько схем переноса хлора в реакциях окислительного хло-
- сопряжение реакции окисления НСl с реакцией заместительного хлори-рования насыщенных углеводородов
4НСl + О2 2Сl2 + 2Н2О
НR¢ R¢¢H + Cl2 HR¢ R˝Cl + HCl
HR¢ R¢¢Cl + Cl2 ClR¢ R¢¢Cl + HCl
- реакции аддитивного оксихлорирования ненасыщенных углеводородов
R¢=R¢¢ + 2HCl + 0,5O2 ClR¢ R¢¢Cl + H2O
- реакции заместительного оксихлорирования ненасыщенных углеводо-родов
R¢=R¢¢Н + HCl + 0,5O2 R¢ R¢¢Cl + H2O
Важную роль в процессах оксихлорирования имеет выбор окислителя - воз-
духа или чистого кислорода. Несмотря на более высокую стоимость и взры-
воопасность в связи с жесткими требованиями к охране окружающей среды,
целесообразно в процессах окислительного хлорирования использовать чис-
При совмещении дегидрохлорирования и окислительного хлорирования
окислению подвергается хлорид водорода, образовавшийся в результате за-
местительного хлорирования или отщепления. Поэтому получение хлороле-
фина с тем же числом атомов хлора, что и в исходном хлорсодержащем уг-
леводороде, формально можно записать без участия хлорида водорода:
С2Н5Сl + Сl2 С2Н4Сl2 + НСl
С2Н4Сl2 СН2=СНСl + НСl
2НСl + 0,5О2 Н2О + Сl2
С2Н5Сl + 0,5О2 СН2=СНСl + Н2О
Процессы заместительного оксихлорирования метана схематически можно представить в виде ряда последовательных реакций:
СН4 + НСl + 0,5О2 СН3Сl + Н2О
СН3Сl + НСl + 0,5О2 СН2Сl2 + Н2О
СН2Сl2 + НСl + 0,5О2 СНСl3 + Н2О
СНСl3 + НСl + 0,5О2 ССl4 + Н2О
Реакция оксихлорирования метана
СН4 + nHCl + 0,5nO2 CH4-nCln + nH2O
представляет собой совокупность двух последовательных, независимо про-текающих реакций окисления хлорида водорода до молекулярного хлора (а) и заместительного хлорирования метана с образованием хлорметанов (б):
4HCl + O2 2Cl2 + 2H2O (а)
CH4 + nCl2 CH4-n + nHCl (б)
По механизму протекания процесса все реакции окислительного хлорирова-ния можно подразделить на две большие группы. К первой группе относят реакции, протекающие через промежуточную стадию окисления хлорида водорода кислородом с образованием хлора, который хлорирует органиче-ский субстрат. Ко второй группе относятся реакции, не требующие предва-рительного окисления хлоридом водорода до хлора. Примерами реакции первой группы являются в основном реакции заместительного оксихлориро-вания алканов (и хлоралканов), а второй – аддитивное оксихлорирование ал-кенов (и хлоралкенов):
2HCl + 0,5O2 Cl2 + H2O,
RH + Cl2 RCl + HCl,
C═C + 2HCl + O2 C=C + 2H2O.
Заместительное хлорирование алкенов выделяется в отдельную группу. Окислительное хлорирование этана протекает через ряд параллельно-последовательных стадий хлорирования и дегидрохлорирования, сопровож-дается окислением продуктов до оксидов углерода.
Гидрохлорирование
Реакция гидрохлорирования может протекать по правилу Марковнико-ва (а) или против него (б):
В связи с бурным развитием производства винилхлорида на базе эти-лена по сбалансированной схеме процесс гидрохлорирования ацетилена в настоящее время утратил свое промышленное значение и в ряде стран суще-ствует только как одна из стадий в комбинированных схемах. Например, при термическом пиролизе легкой бензиновой фракции (нафта) образуется при-мерно стехиометрическая смесь ацетилена и этилена. Эту смесь без концен-трирования и разделения подвергают сначала гидрохлорированию, а далее этилен хлорируют до дихлорэтана, после дегидрохлорирования которого об-разовавшийся хлорид водорода возвращается на гидрохлорирование ацети-лена. Этот способ получения винилхлорида интенсивно развивается в Гер-мании и России. При наличии этилена возможна комбинированная схема, сочетающая производство дихлорэтана и его пиролиза с процессом гидро-хлорирования. В России на долю производств винилхлорида, получаемого гидрохлорированием ацетилена и комбинированными методами, в настоя-щее время приходится ~40% от его общего выпуска.
Дегидрохлорирование
Реакция дегидрохлорирования протекает, в основном, по радикально-цепному механизму и в связи с этим скорость ее увеличивается в присутст-вии веществ, генерирующих свободные радикалы. Применение инициаторов позволяет снизить температуру на 100ои более и уменьшить выход
соединений глубокого дегидрохлорирования, загрязняющих целевые про-дукты и приводящих к образованию смол и кокса. Инициирующее действие объясняется более низкой энергией разрыва связи, приводящей к образова-
нию радикалов, по сравнению с термическим процессом, в котором разрыв связи С—Сl является достаточно энергоемким.
В качестве инициаторов применяют соединения, не образующие в ходе процесса вещества, которые нельзя использовать в хлорорганическом синте-зе, а также трудноотделяемые от целевых продуктов. Поэтому наиболее це-лесообразно применение в качестве инициатора хлора. Энергия разрыва Сl—Сl-связи в большинстве хлорэтанов примерно на 84 кДж/моль меньше энергии разрыва С—Сl-связи , что существенно облегчает протекание реак-ции инициирования.
При использовании различных инициаторов, образующих при распаде свободные радикалы
кинетику процесса можно описать уравнением:
где r – скорость реакции; kи, k1, k2, kо - константы инициирования, продол-жения и обрыва цепи, соответственно.
Это уравнение можно рассматривать как обобщенное для термического и инициированного процессов.
При термическом процессе инициирование цепи происходит за счет разложения исходного хлоралкана, и это уравнение преобразуется к виду:
r = kнабл.[RCl][RCl] = kнабл.[RCl]
хорошо описывающему реальный процесс.
При использовании хлора в качестве инициатора значение энергии ак-тивации снижается по сравнению с термическим процессом примерно до 50 кДж, а при использовании тетрахлорметана – до 113 кДж.
Читайте также:

